Pramipexol
Parkinsonova nemoc (PN) je chronicko-progresivní onemocnění nervové soustavy na podkladě neuronální degenerace substantia nigra a nedostatku dopaminu v bazálních gangliích mozku. Prevalence Parkinsonovy nemoci se odhaduje na 100–150 případů na 100 000 obyvatel, ve věkové skupině nad 60 let až na 1 %. Ročně přibývá kolem 20 nových případů na 100 000 obyvatel. V ČR touto nemocí trpí asi 10 000 pacientů [1]. U pacientů s PN byla pozorována 2–5krát vyšší mortalita ve srovnání s kontrolním souborem podobného věku [2]. PN je choroba spojená se sníženou kvalitou života jedince a představuje významný socioekonomický problém stárnoucí populace. Například v USA jsou náklady na léčbu PN odhadovány na 6 miliard dolarů [3].
Hlavním patofyziologickým podkladem vzniku a rozvoje PN je úbytek buněk v pars compacta substantiae nigrae s následným snížením tvorby dopaminu. Nedostatek dopaminu na synapsích nigrostriatálního okruhu zapříčiní dysregulaci striata a dalších struktur. Tato dysregulace je zodpovědná za většinu symptomů PN. Postižena je presynaptická část nigrostriatální synapse, postsynaptický systém striata zůstává relativně funkční.
PN se projevuje charakteristickou poruchou hybnosti (hypokineze, klidový třes, svalová rigidita). Dále bývají přítomny posturální poruchy (změny držení těla, stoje a chůze), častá je deprese, úzkost, poruchy spánku, v pokročilejších stadiích onemocnění se mohou rozvinout poruchy kognitivních funkcí až případně demence a autonomní dysfunkce (poruchy gastrointestinální činnosti, inkontinence moči, ortostatická hypotenze aj.) [4].
Základním farmakoterapeutickým přístupem v léčbě PN je levodopa. V současné době je v ČR pouze v kombinaci s inhibitory dekarboxylázy (benserazid, carbidopa), které neprocházejí hematoencefalickou bariérou. Zabraňují periferní degradaci levodopy, a zvyšují tím její dostupnost v mozku. Levodopa je v mozku dekar- boxylázami metabolizována na dopamin. Inhibitory monoaminoxidázy typu B (selegilin, rasagilin) zabraňují odbourávání dopaminu v synaptické štěrbině. Prodlužují tak působení dopaminu, především na postsynaptických receptorech. Inhibitory katechol-O-methyltransferázy (COMT – entacapon, tolcapon) brání metabolismu levodopy v periferních tkáních, ale i v mozku. Při kombinační terapii levodopa + inhibitor dekarboxylázy je zvýrazněna degradace levodopy cestou COMT. Proto se jeví výhodným terapeutickým přístupem léčby PN kombinace levodopy s inhibitory karboxylázy i COMT v jedné tabletě. Amantadin byl původně objeven jako antivirotikum, teprve náhodné použití u pacientů s PN odhalilo jeho příznivý vliv především na rigiditu a akinezi. Perorální forma může být užita v monoterapii v časných fázích PN. Podání infuzního amantadinu se ukázalo jako účinné v pozdních fázích nemoci, kdy vyrovnává hlavně kolísající hybnost. Význam léčiv s anticholinergním účinkem (benzatropin, biperiden, procyclidin) je v poslední době omezen na použití u mladých pacientů v časné fázi PN s převažujícím třesem bez kognitivní dysfunkce a u parkinsonského syndromu navozeného léky. Jejich použití limitují též relativně časté nežádoucí účinky (sucho v ústech, žízeň, obstipace, poruchy mikce, halucinace apod.).
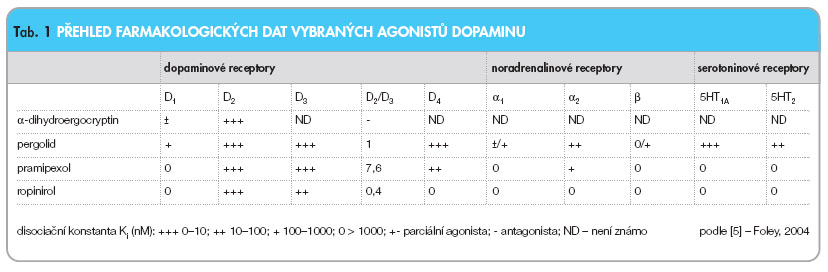
Dopaminoví agonisté (DA) jsou skupinou léčiv, která prošla především v 90. letech výrazným rozvojem. Starší látky mají strukturu podobnou námelovým alkaloidům (ergolinové deriváty), v ČR jsou zastoupeny pergolidem a dihydroergocryptinem. Novější léčiva již nejsou odvozena od ergolinové struktury, v ČR jsou zastoupena pramipexolem a ropinirolem. Původní indikací DA bylo jejich společné podávání s levodopou v pozdních stadiích PN s cílem snížit výskyt motorických fluktuací. Důkazy posledních let favorizují DA jako monoterapii v časných stadiích PN. Monoterapie agonisty v začátku onemocnění potlačuje symptomy onemocnění. Jejich účinnost však postupně klesá a je nutno indikovat terapii levodopou. Oddálení terapie levodopou, či alespoň snížení jejího dávkování pomocí DA je vhodné např. kvůli neurotoxickému působení levodopy či snížení intenzity a frekvence dyskinezí zmiňovaných některými autory. Důkazy srovnávající klinickou účinnost jednotlivých DA zatím nejsou dostatečné, volba DA tedy závisí spíše na zkušenosti lékaře s konkrétní látkou, profilu nežádoucích účinků a v neposlední řadě i na ekonomických faktorech. Alomorphin má specifické postavení mezi DA, je podáván s.c. autoinjektorem nebo pumpou v pozdních fázích PN ke zmírnění těžkých fluktuací nebo dyskinezí [5, 6].
Farmakodynamika
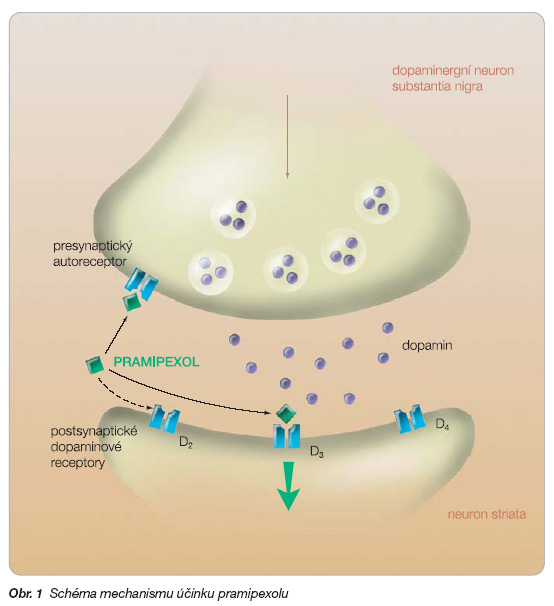
Pramipexol je perorálně účinný non-ergolinový agonista dopaminu. Studie uskutečněné in vitro i in vivo potvrdily, že pramipexol je pre- i postsynaptický agonista D2-podskupiny dopaminových receptorů (patří sem receptorové subtypy D2, D3, D4). Receptory D1-podskupiny (D1, D5) neovlivňuje stejně tak jako mnoho dalších receptorů v centrálním nervovém systému. Unikátní vlastností je jeho 7–10násobně větší afinita k receptorům D3 než k receptorům D2 (tab. 1).
Vzhledem k progredující degeneraci presynaptických dopaminergních neuronů se předpokládá, že za účinek je zodpovědná především vazba na postsynaptické receptory D2 a D3 (obr. 1).
Neuroprotektivní účinky
Četné experimentální studie hodnotily neuroprotektivní vlastnosti pramipexolu. Ling a kol. pozorovali schopnost pramipexolu bránit odumření embryonálních mezencefalických buněk způsobenému toxicitou levodopy. V tomto systému pramipexol indukoval expresi autotrofního proteinu, který bránil oxidačnímu stresu buňky [7]. Kitamura a kol. simulovali neuronální degeneraci jako u Parkinsonovy nemoci pomocí působení N-methyl-4-fenyl-pyridinia na buňky neuroblastomu SH-SY5Y. Preinkubace buněk pramipexolem bránila jejich buněčné smrti [8]. Podobné výsledky byly zjištěny i na zvířecím modelu. Protektivní účinky byly sledovány, jen pokud byl opicím podán pramipexol před působením toxinu [9].
Ověřit neuroprotektivní působení pramipexolu v klinické praxi měla za cíl studie CALM-PD-CIT [10]. V této randomizované dvojitě slepé studii bylo rozděleno 82 pacientů v časné fázi PN do skupiny léčené levodopou (n = 40) a pramipexolem (n = 42). Rozsah degenerace dopaminových neuronů byl monitorován pomocí jednofotonové emisní počítačové tomografie (SPECT). Jako marker funkce striatálních neuronů byla použita látka 123I b-CIT. Po 46 měsících bylo pozorováno snížení uptake 123I b-CIT o 16 % ve skupině pramipexolu vs 25,5% snížení ve skupině léčené levodopou. Studie vyvolala četné diskuse o jejích limitech. Diskutovalo se např. o tom, zda rozdíl ve výsledcích na konci studie nezapříčinilo spíše neurotoxické působení levodopy než neuroprotektivní působení pramipexolu, zda počítačová tomografie je vhodnou metodou pro sledování degenerace neuronů (dle definice sleduje biochemické markery, ne přímo degeneraci neuronu) apod. [5, 11]. Proto není teorie neuroprotektivního působení dopaminových agonistů dosud obecně přijata [12, 13].
Farmakokinetické vlastnosti
Pramipexol vykazuje v terapeutických dávkách lineární farmakokinetiku. Po perorálním užití je rychle absorbován, maximálních koncentrací v plazmě dosahuje již po 2 hodinách od podání (tab. 2).
Zlepšení symptomů PN však nastává po pravidelném podávání za 1–4 týdny. Biologická dostupnost přesahuje 90 %. Současný příjem potravy může prodloužit délku vstřebávání, avšak nikoli rozsah. Pramipexol se jen z malé části váže na plazmatické bílkoviny, má velký distribuční objem (500 l). V organismu dochází k minimálnímu metabolismu, z 90 % je vylučován ledvinami, a proto je při snížené funkci ledvin nutno přiměřeně redukovat dávku. Biologický poločas eliminace se pohybuje v rozmezí 8–14 hodin [14].
Klinické zkušenosti
Účinnost v klinických studiích byla nejčastěji hodnocena pomocí stupnice UPDRS (The Unified Parkinson´s Disease Rating Scale), která má čtyři části.
I. ‑duševní činnost, chování, nálada
II. ‑aktivity denního života (ADL) – řeč, polykání, hygiena, oblékání apod.
III. ‑motorické funkce – rychlost řeči, mimika obličeje, klidový třes, držení těla apod.
IV. ‑komplikace terapie – přítomnost a rozsah dyskinezí, fluktuací a dalších komplikací.
Studie, které by srovnávaly účinnost jednotlivých dopaminových agonistů navzájem, dosud chybí [5].
Časná fáze Parkinsonovy choroby
Agonisté dopaminu byli uvedeni na trh jako adjuvantní terapie levodopy u pacientů v pozdní fázi PN. Novější klinické studie hodnotily schopnost agonistů dopaminu bránit příznakům nemoci, oddálit tím nutnost prvního podání levodopy, a tím oddálit pozdní motorické komplikace léčby levodopou.
Hubbleová a kol. provedli 9týdenní randomizovanou studii na 55 nově diagnostikovaných pacientech trpících PN (průměrný věk 63 let). Dávka pramipexolu byla postupně titrována maximálně do 4,5 mg/den. Účinnost byla hodnocena pomocí UPDRS II a III. Výsledky ukázaly větší benefit léčby pramipexolem oproti placebové větvi (změna UPDRS II 5,19 vs 2,16 placebo, p < 0,002; UPDRS III 11,97 vs 8,31, avšak statisticky nevýznamně) [15].
Lékaři neurologických center v USA a Kanadě sdružení v organizaci Parkinson Study Group zkoumali účinnost pramipexolu v randomizované dvojitě slepé studii, do níž bylo zařazeno 264 pacientů s nově diagnostikovanou PN. Pacienti byli randomizováni celkem do 5 skupin (4 dle dávkování pramipexolu, 1 placebo). Cílem studie bylo sledovat změny v UPDRS skóre po 10 týdnech podávání pramipexolu (dávkování bylo titrováno max. 6 týdnů). Na konci studie pacienti léčení pramipexolem vykazovali zlepšení skóre UPDRS o 20 %. Průměrné změny skóre ve skupině pramipexolu se pohybovaly v rozmezí 5,9–7 jednotek vs 0,9 jednotek v placebové skupině [16].
Shannon a kol. uspořádali randomizovanou placebem kontrolovanou studii s 355 pacienty v časné fázi PN. Pramipexol byl titrován 7 týdnů, po kterých následovalo dalších 24 týdnů terapie. Primárním cílem studie bylo zjistit rozdíly ve skóre UPDRS II a III mezi léčebnými skupinami. Pramipexol (střední dávka 3,8 mg/den) redukoval závažnost příznaků PN ve všech sledovaných parametrech. UPDRS ADL pokleslo z 8,2 na začátku studie na 6,4 jednotek na konci studie. V placebové skupině došlo k růstu skóre z 8,3 na 8,7 jednotek (rozdíl účinnosti pramipexol vs placebo p < 0,0001). UPDRS III pokleslo podobně po léčbě pramipexolem z 18,8 na začátku studie na 14,1 jednotek, zatímco ve skupině placeba skóre vzrostlo (p < 0,0001).
Po potvrzení krátkodobé účinnosti pramipexolu byl výzkum zaměřen na ověření jeho dlouhodobé účinnosti u pacintů v časné fázi PN. Hlavním sledovaným parametrem bylo prodloužení doby do vzniku motorických komplikací spojených s dopaminergní léčbou, jako je „wearing off", dyskineze, „on-off" fluktuace, ve srovnání s terapií levodopou.
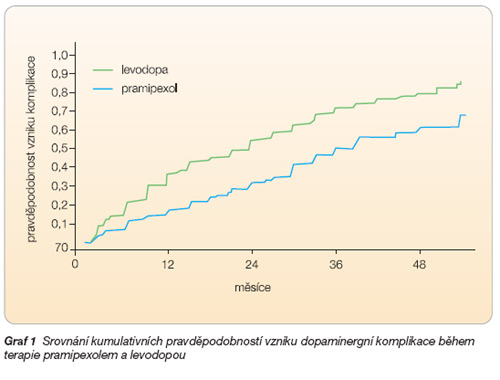
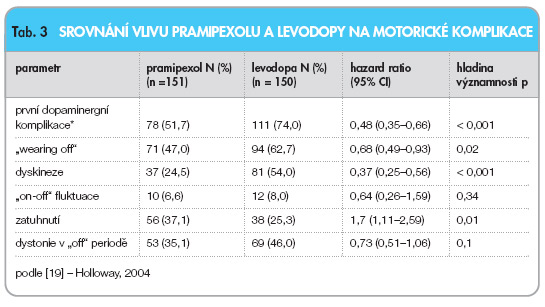
Největší studie byla provedena opět pod záštitou Parkinson Study Group [18, 19]. Pacienti byli randomizováni do skupiny léčené pramipexolem (0,5 mg 3x denně, n = 151) a levodopou/carbidopou (25/100 mg 3x denně, n = 150). Dávkování mohlo být v případě přetrvávajících obtíží zvýšeno. Od 11. týdne studie mohla být ve skupině pramipexolu přidána „nezaslepeně" levodopa. Primárním cílem bylo sledovat procento pacientů s motorickými komplikacemi, sekundárními cíli zůstalo skóre UPDRS, dále bylo analyzováno: ovlivnění kvality života (škála Parkinson´s Disease Quality-of-Life PDQUALIF a EuroQal Visual Analog Scale, VAS), nežádoucí účinky léčby a u podskupiny pacientů utilizace dopaminu v mozku metodou SPECT. Po 23,5 měsících studie došlo ve skupině pramipexolu k motorickým komplikacím u 28 % pacientů oproti 51 % léčených levodopou (hazard ratio 0,45; 95% CI 0,3–0,66). UPDRS skóre však bylo výrazněji zlepšeno ve skupině léčené levodopou (9,2 vs 4,5 jednotek). Po čtyřech letech PN progredovala, počet komplikací se zvýšil, nicméně relativní rozdíly ve sledovaných parametrech zůstaly zachovány. Dopaminergní komplikaci (primární cíl studie) prožilo 51,7 % pacientů ve skupině pramipexolu a 74 % pacientů ve skupině levodopy (HR: 0,48; 95% CI: 0,35–0,66). Kumulativní pravděpodobnost dopaminergních komplikací během studie viz graf 1.
Zajímavým nálezem je zvýšený počet zatuhnutí („freezing") ve skupině pramipexolu (tab. 3). Celkové UPDRS skóre se oproti počátečním hodnotám ve skupině pramipexolu zhoršilo (-3,2 jednotek), ve skupině levodopy přetrvávalo mírné zlepšení (2,0).
Pozdní fáze Parkinsonovy choroby
V pozdní fázi Parkinsonovy choroby se projevují nežádoucí účinky léčby levodopou – abnormální mimovolné pohyby (dyskineze), bolestivé křeče v končetinách (dystonie), zkrácené odpovědi na léčbu ("wearing-off" fenomén), "on-off" fluktuace. Právě snaha o ovlivnění těchto projevů vedla k vývoji dopaminových agonistů.
O odpověď na otázku, zda je pramipexol účinnější než placebo u pacientů dlouhodobě léčených levodopou s projevujícími se komplikacemi léčby, se pokusil Clarke a kol. ve svém systematickém review [20]. Stanovená kritéria splnily 4 studie zahrnující celkem 669 pacientů. Během terapie pramipexolem došlo ke zkrácení „off" stavu oproti placebu průměrně o 1,8 hodin (95% CI: 1,2–2,3 hod./den). Významný rozdíl v UPDRS ADL skóre ve prospěch pramipexolu byl potvrzen ve všech studiích. Zlepšení motorických funkcí (UPDRS III) bylo pozorováno ve třech studiích. Podání pramipexolu umožnilo snížit dávku levodopy v průměru o 115 mg (95% CI: 87–143 mg/den). Doba trvání studií nepřesáhla 24 týdnů. K podobným výsledkům dospěla i randomizovaná dvojitě slepá studie Mollera a kol. s 354 pacienty (174 dostávalo pramipexol) trvající 32 týdnů. Léčba pramipexolem zlepšila skóre UPDRS II a III o 30 %, zkrátila „off" stav o 2,5 hod/den, pozitivně ovlivněna byla i duševní činnost (UPDRS I). Studie dále pokračovala v otevřené fázi. I po třech letech od začátku celé studie dokázala terapie pramipexolem snížit celkové skóre UPDRS II–IV o 11 % oproti počátečním hodnotám [21].
Indikace
Pramipexol je určen k léčbě projevů a příznaků idiopatické Parkinsonovy nemoci. V časné fázi PN může být podáván v monoterapii. Jeho užívání redukuje symptomy nemoci a oddaluje nutnost zahájení léčby levodopou. V pozdní fázi PN je vhodné přidání pramipexolu ke stávající léčbě levodopou, pokud účinek levodopy slábne nebo se objevuje kolísání léčebného efektu („on-off" fluktuace).
Indikace pramipexolu k léčbě deprese, panické poruchy, syndromu neklidných nohou a schizofrenie jsou zatím pouze předmětem výzkumu.
Nežádoucí účinky
Analýza nežádoucích účinků pramipexolu byla provedena na základě klinických studií, které zahrnovaly 782 pacientů léčených pramipexolem a 633 pacientů užívajících placebo. Počet úmrtí během léčby pramipexolem byl srovnatelný s placebem. Abnormality vidění hlásilo 3 % pacientů léčených pramipexolem oproti 0,4 % u kontrolního souboru. Zvýšený počet dyskinezí na začátkou konkomitantní terapie s levodopou může být vysvětlen pramipexolem indukovanou absorpcí levodopy.
Nejčastějšími důvody ukončení terapie pramipexolem v klinických studiích byly halucinace (2,7 % vs 0,4 % placebo), nauzea (1,4 % vs 0,7 %), hypotenze (1 % vs 0,5 %) a somnolence (1,3 % vs 0,2 %). V placebové větvi byly nejčastějším důvodem ukončení terapie extrapyramidové symptomy (5,5 % vs 1,4 % pramipexol) a „nulový efekt léčiva" (1,3 % vs 0,1 % pramipexol).
Většina nežádoucích účinků se vyskytovala v podobné míře v léčené i placebové větvi. U pacientů léčených pramipexolem se častěji vyskytly halucinace (13 % vs 5 % placebo), somnolence (15 % vs 6 %) a gastrointestinální obtíže (nauzea, zácpa). V postmarketingových sledováních se objevily případy náhlého upadnutí do spánku [22].
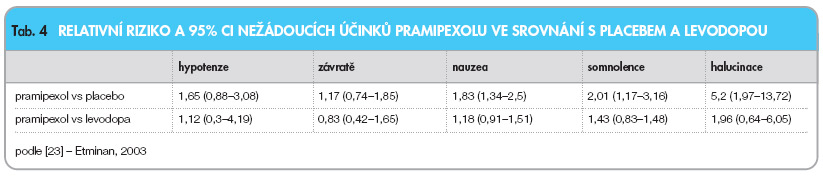
Metaanalýza nežádoucích účinků v klinických studiích s pramipexolem odhalila především zvýšené relativní riziko vzniku halucinací (tab. 4) [23].
Interakce
Díky minimálnímu metabolismu a vazbě na plazmatické bílkoviny má pramipexol velmi nízký potenciál k lékovým interakcím. Popsáno bylo zvýšení maximální koncentrace (cmax) levodopy v plazmě v průměru o 71 % u žen a 13 % u mužů, ovlivněn byl čas dosažení cmax, avšak biologická dostupnost a eliminace levodopy nebyly ovlivněny. Amantadin, cimetidin a některé další léky jsou stejně jako pramipexol eliminovány vazebnými místy kationtového sekrečního systému v renálních tubulech, což může vést ke snížení clearance jednoho nebo obou léků.
Dávkování
Dávkování pramipexolu je individuální. Podává se ve třech dílčích dávkách. Dávky jsou uvedeny v množství pramipexolu (baze). Při zahájení léčby by se dávka měla postupně každých 5–7 dní zvyšovat z počáteční dávky 0,264 mg/den (3 x 0,088 mg) v prvním týdnu, 0,546 mg/den (3 x 0,18 mg) v 2. týdnu na 1,05 mg/den (3 x 0,35 mg) v týdnu třetím. Pokud je nutno dále zvýšit dávku, měla by se zvyšovat v týdenních intervalech o 0,54 mg/den do maximální denní dávky 3,3 mg. V případě nutnosti přerušení léčby by se dávka měla obdobným způsobem snižovat z důvodu možného výskytu neuroleptického maligního syndromu po náhlém přerušení léčby. U pacientů s ledvinovým selháním (clearance kreatininu < 50 ml/den) by mělo být dávkování redukováno.
Závěr
Pramipexol je účinným antiparkinsonikem jak v kombinaci s levodopou v pokročilém stadiu Parkinsonovy nemoci, tak také v monoterapii v časných stadiích nemoci. Oproti dopaminergním agonistům ze skupiny derivátů námelových alkaloidů má pramipexol nižší toxicitu a nižší výskyt vážných komplikací (vazospasmy, refrakterní edémy, plicní a retroperitoneální fibróza). V současnosti je zjišťován přínos pramipexolu v léčbě deprese, schizofrenie, syndromu neklidných nohou a panických poruch.
Seznam použité literatury
- [1] Roth J, Růžička E. Parkinsonova nemoc – přehled současných terapeutických přístupů. Remedia 1999; 9: 145–156.
- [2] Morens DAM, Davis JW, Grandinetti A, et al. Epidemiologic observations on Parkinson´s disease: incidence and mortality in a prospective study of middle-aged men. Neurology 1996; 46: 1044–1050.
- [3] National Institutes of Health. Parkinson´s Disease: Challenges, Progress, and Promise. 2004. http: //www.ninds.nih.gov/disorders/parkinsons_disease/parkinsons_research.htm
- [4] Roth J, Sekyrová M, Růžička E. Parkinsonova nemoc. Praha, Maxdorf Medica, 1999.
- [5] Foley P, Gerlach M, Double KL, et al. Dopamine receptor agonists in the therapy of Parkinson´s disease. J Neural Transm 2004; 111: 1375–1446.
- [6] Rektorová I. Parkinsonova nemoc, antiparkinsonika a kognitivní funkce. Remedia 2005; 15: 528–533.
- [7] Ling ZD, Robie HC, Tong CW, et al. Both the antioxidant and D3 agonist actions of pramipexole mediate its neuroprotective actions in mesencephalic cultures. J Pharmacol Exp Ther 1999; 289: 202–210.
- [8] Kitamura Y, Kosaka T, Kakimura JI, et al. Protective effects of the antiparkinsonian drugs talipexole and pramipexole against 1-methyl-4-phenylpyridinium-induced apoptotic death in human neuroblastoma SH-SY5Y cells. Mol Pharmacol 1998; 54: 1046–1054.
- [9] Jenner P, Iravani MM, Haddon CO, et al. Pramipexole protects against MPTP-induced nigral dopaminergic cell loss in primates. Neurology 2002; 58 (suppl. 3): A494.
- [10] Parkinson Study Group. Dopamine transporter brain imaging to assess the effects of pramipexole vs levodopa on Parkinson disease progression. JAMA 2002; 287: 1653–1661.
- [11] Morrish PK. How valid is dopamine transporter imaging as a surrogate marker in research trials in Parkinson´s disease? Mov Disord. 2003; 18 (Suppl 7): S63–S70.
- [12] Schapira AH, Olanow CW. Rationale for the use of dopamine agonists as neuroprotective agents in Parkinson´s disease. Ann Neurol 2003; 53 (Suppl 3): S149–S159.
- [13] NICE Guidelines. Parkinson´s disease. http:// www.nice.org.uk/page.aspx?o=33924 (on-line, 13. 2. 2006).
- [14] Dooley M, Markham A. Pramipexole. A Review of its Use in the Management of Early and Advanced Parkinson´s Disease. Drugs Aging 1998; 12: 495–514.
- [15] Hubble JP, Koller WC, Cutler NR, et al. Pramipexole in patients with early Parkinson´s disease. Clin Neuropharmacol 1995; 18: 338–347.
- [16] Parkinson Study Group. Safety and efficacy of pramipexole in early Parkinson disease: A randomized dose-ranging study. JAMA 1997; 278: 125–130.
- [17] Shannon KM, Bennett JPJ, Friedman JH. Efficacy of pramipexole, a novel dopamine agonist, as monotherapy in mild to moderate Parkinson´s disease. Neurology 1997; 49: 724–728.
- [18] Holloway R, Shoulson I, Kieburtz K. et al. Pramipexole vs Levodopa as initial treatment for Parkinson disease: A randomized controlled trial. JAMA 2000; 284: 1931–1938.
- [19] Holloway R, Shoulson I, Fahn S et al. Pramipexole vs levodopa as initial treatment for Parkinson disease: a 4-year randomized controlled trial. Archives of Neurology 2004; 61: 1044–1053.
- [20] Clarke CE, Speller JM, Clarke JA. Pramipexole for levodopa-induced complications in Parkinson´s disease. The Cochrane Database of Systematic Reviews, 2006, 1. (Last update 7. 2001).
- [21] Moller JC, Oertel WH, Koster J, et al. Long-term efficacy and safety of pramipexole in advanced Parkinson´s disease: results from a European multicenter trial. Mov Disord. 2005; 20: 602–610.
- [22] European Public Assessment Report. EMEA. http: //www.emea.eu.int/ (on-line, 14. 2. 2006).
- [23] Etminan M, Sudeep G, Samii A. Comparison of the risk of adverse events with pramipexole and ropinirole in patients with Parkinson´s disease: a meta-analysis. Drug Saf 2003; 26: 439–444.