Prognostické markery u roztroušené sklerózy – update
Roztroušená skleróza (RS) je heterogenní onemocnění s komplexní patofyziologií. Pojímá v sobě zánětlivou i neurodegenerativní složku a otevírá řadu otázek, na které ještě neznáme odpovědi. Prognostickým markerům u RS a aktuálnímu vývoji této problematiky byl věnován blok přednášek na kongresu ECTRIMS (European Committee for Treatment and Research in Multiple Sclerosis) konaném ve dnech 25.–28. října 2017 v Paříži.
Prognostické biomarkery
Klinické a demografické charakteristiky nemocného jen slabě predikují další vývoj nemoci a progresi disability. Důležitým nástrojem pro stanovení diagnózy a zhodnocení prognózy se stalo zobrazení magnetickou rezonancí (MR). V současné době se rozvíjejí snahy o nalezení biomarkerů, určitých měřitelných parametrů, které by umožnily predikovat další vývoj onemocnění (obr. 1). Díky nim bychom byli schopni určit pravděpodobný průběh nemoci a míru postižení (disabilitu, kognitivní postižení aj.). Na základě toho by pak bylo možné individualizovat a optimalizovat terapii.
O nových biomarkerech u RS byla publikována již řada
prací. Profesor Eric Thouvenot z French
National Centre for Scientific Research v Paříži ve své
přednášce nazvané Prognostické biomarkery u roztroušené
sklerózy představil hodnotné ukazatele průběhu RS,
zmínil důležité práce, které dokládají
jejich prediktivní význam, a představil i práce
zkoumající nové slibné biomarkery.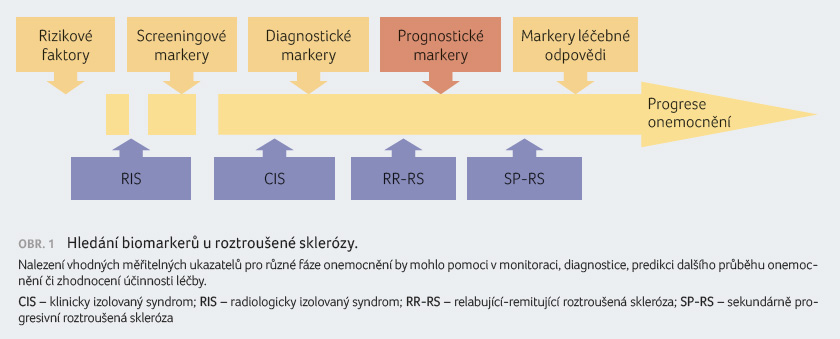
„Klinické příznaky a zobrazení pomocí magnetické rezonance umožňují diagnostikovat RS s dobrou senzitivitou, nicméně stále máme nedostatek ukazatelů, které by nám umožnily předpovědět chování nemoci – pravděpodobnost konverze klinicky izolovaného syndromu (CIS) do klinicky definitivní RS, rozvoj progresivní formy RS a rychlost progrese disability. Chybějí prognostické biomarkery, které jsou zásadní pro určení průběhu onemocnění.“
Biomarkery u radiologicky izolovaného syndromu
K dispozici máme již některé prediktivní biomarkery, které můžeme využít v praxi. Například u radiologicky izolovaného syndromu (RIS, tj. abnormálního nálezu zobrazení mozku s ložisky demyelinizace, ale bez klinických příznaků nemoci) vysledovalo retrospektivní hodnocení z 22 databází (Okuda, PLoS One 2014) jako nezávislé prediktory nástupu symptomatologie věk, mužské pohlaví a přítomnost míšních lézí – markery, které můžeme využít v praxi. Pravděpodobnost a riziko konverze RIS v klinicky izolovaný syndrom (CIS, tj. první neurologické potíže, které jsou podezřelé z rizika rozvoje definitivní RS) se zvyšuje s přítomností míšních lézí. Práce Kantarciho a kol. (Ann Neurol 2016) taktéž doložila přítomnost míšních lézí a jejich vyšší počet jako prognostický faktor konverze RIS, v tomto případě v primárně progresivní RS oproti nižšímu riziku jeho konverze v CIS RS. Závislost rizika konverze na pohlaví a věku se zde také uplatnila.
Biomarkery u klinicky izolovaného syndromu
Mezi prognostické markery pro riziko konverze CIS v klinicky definitivní RS používané v praxi patří mladší věk při stanovení CIS, přítomnost oligoklonálních pásů a vícečetných lézí na MR. Tyto závěry přineslo rozsáhlé hodnocení 1 058 nemocných s CIS sledovaných v letech 1995–2013 s cílem stanovit demografické, klinické, radiologické a biologické determinanty rozvoje RS (Tintore, et al., Brain 2015). Oligoklonální pásy, léze na MR a věk potvrdilo jako zásadní prediktivní markery přechodu do klinicky definitivní RS i hodnocení velké mezinárodní kohorty 1 047 pacientů s CIS (Kuhle, et al., Mult Scler 2015). Autoři publikace poukázali též na možnou roli vitaminu D, kterou je třeba dále prozkoumat.
Rozsáhlá metaanalýza (Dobson, et al., J Neurol Neurosurg Psychiatry 2013) rovněž potvrdila prediktivní význam oligoklonálních pásů v mozkomíšním moku pro konverzi CIS v klinicky definitivní RS. Ukázalo se také, že pacienti s RS a s pozitivitou oligoklonálních pásů mají dvakrát vyšší riziko rozvoje disability.
Fenotyp nemoci
Přesný popis klinického průběhu onemocnění RS (fenotyp nemoci) je důležitý pro komunikaci, klinické hodnocení (uspořádání studie, nábor sledovaných pacientů) i pro rozhodování o vedení terapie. Přezkoumáním původních deskriptivních charakteristik RS na základě rostoucího poznání nemoci a její patofyziologie se zabývala mezinárodní komise International Advisory Committee on Clinical Trials of MS se snahou o přehodnocení pojetí (Lublin, et al., Neurology 2014).
Zobrazovací a biologické markery, které mohou poskytnout objektivní kritéria pro odlišení klinických fenotypů, zatím chybějí. K dispozici máme charakteristiky ukazující na aktivitu nemoci a její progresi (roční míra relapsů, nález prostřednictvím zobrazovacích metod).
Relabující remitující RS (RR RS) je nyní více vnímána jako aktivní forma nemoci, která se klinicky projevuje relapsy, akutními či subakutními epizodami nového nebo rostoucího neurologického postižení následovanými plným nebo částečným zotavením, bez přítomnosti horečky nebo infekce. Z hlediska zobrazovacích metod (MR) se pak vyznačuje přítomností nových nebo zvětšujících se kontrastních T1 nebo T2 lézí.
Hledání nových biomarkerů
V době diagnózy nelze spolehlivě predikovat průběh, máme jen obecná kritéria, která naznačují riziko rychlé progrese. Spolehlivé biomarkery, podle nichž bychom mohli predikovat průběh RS i léčebnou odpověď, stále nemáme.
Výzkum se soustřeďuje na možné biologické markery RS – proteiny, peptidy, mRNA, imunitní buňky i neurony, ideálně v oblasti probíhajícího onemocnění, tj. v mozkomíšním moku. Zkoumány jsou také možné biomarkery v séru – markery imunitní aktivace (cytokiny, chemokiny, protilátky, adhezní molekuly), markery porušení hematoencefalické bariéry/stresového stavu (matrixové metaloproteinázy), markery demyelinizace (bazický protein myelinu, proteolytické enzymy), markery gliové aktivace (kyselý gliový fibrinální protein), markery neuronálního poškození (neurofilamenta) aj.
Neurofilamenta
Jako jeden z nejspolehlivějších biomarkerů neurodegenerace při RS jsou zavedena neurofilamenta, vláknité buněčné struktury, které jsou obrazem axonální ztráty. Na jejich výzkumu se stále pracuje. Jedná se o částice bílkovinné povahy specifické pro nervové buňky. Tyto heteropolymery jsou složeny z podjednotek lehkých, středně těžkých a těžkých řetězců. V progresivní fázi RS narůstá axonální poškození, které koreluje s progresí disability. Kvantifikace axonální ztráty by mohla být klíčová pro monitoraci i pochopení patologie. Profesor Petzold a kol. už v roce 2005 publikovali práci hodnotící koncentrace neurofilament v séru a jejich korelaci s progresí onemocnění. V patnáctiletém tzv. follow-up sledování (Petzold, et al., J Neurol Neurosurg Psych 2015) se jako slibný kandidát s prognostickou hodnotou jevily těžké řetězce neurofilament v mozkomíšním moku, jejichž koncentrace korelovaly s progresí hodnot EDSS (Expanded Disability Status Scale, škála hodnotící míru disability u pacientů s RS). Práce poukázala i na možné bias a na důležitost způsobu použití biomarkeru a jeho vyhodnocení.
Nedávno se do centra pozornosti dostaly lehké řetězce neurofilament a otázka vyšší pravděpodobnosti přechodu CIS do klinicky definitivní RS při jejich vyšší koncentraci. Sérové koncentraci lehkých řetězců neurofilament jako možnému ukazateli aktivity nemoci a prognostickému markeru se věnovaly četné práce (Arrambide, et al., Neurology 2016; Disanto, et al., J Neurol Neurosurg Psych 2016; Disanto, et al., Ann Neurol 2017).
Další slibné prognostické biomarkery
Dalšími zajímavými proteiny, na které se obrací pozornost, jsou chitinázy a proteiny podobné chitinázám (CHIL3L1, chitinase 3 like 1). Byly doloženy zvýšené koncentrace CHIL3L1 v mozkomíšním moku u pacientů s CIS, kteří konvertovali v klinicky definitivní RS (Cantó, et al., Brain 2015; Modvig, et al., Mult Scler 2015).
Práce van der Vuursta de Vries a spolupracovníků (JAMA Neurol 2017) sledovala, zda jsou koncentrace solubilní molekuly CD27 v mozkomíšním moku, která se uplatňuje v aktivaci T buněk a v syntéze imunoglobulinů, u pacientů s CIS asociovány s následnou diagnózou RS a s vyšší roční mírou relapsů. Retrospektivní hodnocení rizika rozvoje RS po první demyelinizační epizodě, jakou je optická neuritida, také poukazuje na souvislost se zvýšenými koncentracemi, v tomto případě CHIL3L2 a chitotriosidázy (Møllgaard, et al., Eur J Neurol 2016).
Další možný směr vývoje a snahu využít biomarkery v mozkomíšním moku ukazuje práce dr. Barboura a spolupracovníků (Ann Neurol 2017) s cílem vyvinout diagnostické klasifikátory RS z měření spektra bílkovin v mozkomíšním moku založené na DNA aptamerech.
Shrnutí
Profesor Thouvenot v závěru shrnul, že současnou snahou zaměřenou na to, abychom se dostali v poznání dále, je zmapovat molekulární expresi RS v preklinické fázi i ve fázích klinické manifestace. Protokol hodnocení založený na použití validovaných biomarkerů v raném stadiu onemocnění by umožnil zachytit abnormální neuroimunologické jevy a následnou intervenci dříve, než by došlo k poškození tkáně.
Prognostické zobrazovací markery
Prognostickým zobrazovacím markerům u RS věnovala svou přednášku dr. Christina Azevedo z Keck Hospital of USC v Los Angeles. Zobrazovací metody se v posledních několika dekádách staly u RS nepostradatelným nástrojem jak v klinické praxi, tak v oblasti klinického výzkumu. Snahou i v této oblasti je vyvinout nástroje, které by umožnily predikovat ireverzibilní poškození nervové tkáně a míru klinické disability nemocných.
Doktorka Azevedo se věnovala současnému stavu i výhledu do budoucna: „Konvenčním nástrojem pro zobrazení lézí bílé hmoty je MR. Magnetická rezonance hraje zásadní roli v diagnostice a monitoringu RS. Má vysokou citlivost k detekci lézí bílé hmoty, které jsou charakteristickým rysem patologie u RS. Léze na MR mají prediktivní hodnotu pro riziko progrese a míru disability dle EDSS v dalších letech.“
Nutnost standardizace
Z měření používaných v běžné klinické praxi lze i v současné době vyzískat hodnotné informace. Nutností je ovšem standardizace měření. Byla zavedena doporučení pro zobrazení MR a stanoveny standardizované protokoly. Vzhledem ke klinickému významu je standardizace postupů pro klinickou praxi nutností. Odstranění heterogenity měření by dále umožnilo automatizovanou analýzu. Přednášející přiblížila možnosti dalšího vývoje a problémy, s nimiž se metody potýkají. „V současné době spoléháme na vizuální kontrolu, porovnání jednotlivých zobrazení. To je jednak časově náročné a může to být také zatíženo subjektivním vnímáním a posouzením změn (určení nové léze, její zvětšení či změny zobrazení dané přístrojově).“
Překážkou je ale navzdory publikovaným doporučením standardizovaného protokolu MR heterogenita v získávání obrazů. Stále velmi záleží na vstupním obraze. Jako možné řešení se nabízí způsob zpracování, který by s touto heterogenitou pracoval, umožnil provést harmonizaci napříč platformami se snížením rozdílů daných odlišnostmi přístrojů (například v kontrastech tkání), normalizací intenzity a korekcí nehomogenity. Toto by mohlo představovat základ pro automatizovanou analýzu (segmentaci lézí, odečítání obrazu a volumetrické měření). Jako příklad uvedla dr. Azevedo korekci obrazů na základě intenzity, její odečtení, provedení filtrace a barevného mapování k získání možného výstupu pro klinické lékaře. Řešenou otázkou je stále volba algoritmu, který by byl nejlepší. Metody se potýkají s problémem „překladu měření“ do klinicky relevantní informace a použití vhodných statistických metod.
Mezi nestandardní výzkumné nástroje patří zatím měření změn objemu mozku (mozkové atrofie) či míšních lézí. Vyhodnocení zobrazení MR s využitím magnetického transferu a stanovením hodnoty MTR (magnetization transfer ratio), difuzně vážený obraz (diffusion weighted imaging, DWI), MR zobrazení s intenzitou 7T nebo MR spektroskopie patří mezi nekonvenční techniky zobrazení. Je potřeba začlenit klinické výzkumné nástroje do rutinní klinické péče a zajistit jejich maximální reprodukovatelnost.
Volumetrické měření mozku
Měření celého objemu mozku a jeho jednotlivých oblastí představuje obraz poškození nervových tkání u RS (neuroaxonální ztrátu, demyelinizaci, ztrátu gliových buněk aj.). Volumetrické měření mozku je měřítkem neurodegenerace a má prediktivní hodnotu; mnoha pracemi byla doložena korelace mezi objemem mozku (celým a jeho regionů) a mírou disability v pozdějších letech.
Otázkou ale zůstává připravenost měření objemu mozku pro klinickou praxi. Cílem je stanovit tzv. zlatý standard, definovat „cut off hodnoty“ pro odlišení abnormálního od normálního, standardní software i vhodné statistické metody, které by umožnily převést data a klinický výstup na úroveň jednotlivého pacienta. Při volumetrickém měření je třeba také zohlednit možné rozdíly mezi jednotlivými měřeními; ty mohou být způsobeny tkáňovými změnami během dne, výkyvem objemu tekutin (stavem hydratace pacienta), medikací i tvorbou nových lézí.
Měření objemu šedé hmoty
Další možnou metodou, která nabízí své výhody, je MR volumetrické měření šedé hmoty. Jeví se být lepším prediktorem fyzické a kognitivní disability a kvality života než měření objemu mozku nebo bílé hmoty, s vyšší citlivostí, vyšší specifitou pro neurodegeneraci a pro celý průběh nemoci.
Pro volumetrická měření mohou být vhodné změny určitých regionů. Slibnou oblastí MR zobrazení šedé hmoty je talamická atrofie u RS, která odráží některé navazující aspekty patologie. Talamická atrofie se rozvíjí konstantně po dobu trvání onemocnění, koreluje s fyzickou i kognitivní disabilitou a je abnormální v časné fázi demyelinizačního onemocnění.
Spinální atrofie
Fyzická disabilita u RS často souvisí také s oblastí míchy. Vedle zobrazení mozku mohou být míšní léze a atrofie horní oblasti krku prognostickým faktorem dalšího vývoje. Mnohé práce doložily prognostickou hodnotu míšní patologie a její souvislost s disabilitou (hodnocenou dle EDSS). Léze v oblasti míchy se ukázaly být také silným rizikovým faktorem konverze RIS do klinicky definitivní RS.
Shrnutí
Existují nekonvenční metody zatím využívané převážně na poli výzkumu. Sledování lézí bílé hmoty, atrofie mozku a dílčích oblastí šedé hmoty, míšní léze i atrofie této oblasti nesou prognostickou hodnotu. Výzvou je začlenit výzkumné nástroje do rutinní klinické praxe pro zlepšení monitoringu pacientů s RS.
Prediktivní markery sekundárně progresivní RS
Doktor W. J. Brownlee z Queen Square Multiple Sclerosis Centre v UCL Institute of Neurology v Londýně v dalším sdělení představil přítomným hodnocení sledující možnou asociaci mozkových a míšních abnormalit na zobrazení MR během prvních tří let po stanovení CIS a rozvoje sekundárně progresivní formy RS. U celkem 164 pacientů s CIS byly studovány skeny MR v čase diagnózy, po jednom roce a po třech letech. Zkoumány byly nové míšní léze, léze situované infratentoriálně, léze vychytávající gadolinium, procentuální změna objemu mozku a změna UCCA (upper cervical cord cross sectional area). Pacienti byli prospektivně sledováni zhruba 15 let. Cílem bylo stanovit na základě dat z MR v prvních třech letech po CIS nezávislé prediktory rozvoje sekundárně progresivní RS po 15 letech.
U pacientů bez tvorby nových míšních nebo infratentoriálních lézí v průběhu prvních tří let po první klinické manifestaci neurologických obtíží bylo riziko sekundárně progresivní RS 0,9 % oproti 53,1% riziku u pacientů, kde k jejich tvorbě došlo. Tvorba nových míšních a infratentoriálních lézí v počátečním stadiu se tedy jeví být důležitou prognostickou informací pro pozdější rozvoj sekundárně progresivní formy onemocnění.
Predikce poklesu kognitivních funkcí
Pokles kognitivních funkcí u RS je velmi heterogenní, nicméně výrazně ovlivňuje kvalitu života pacientů s RS. Práci, která se pokoušela vysledovat prediktivní ukazatele míry poklesu kognice, představil účastníkům sekce Update on MS prognostic markers A. J. Eijlers z Departments of Anatomy and Neurosciences VU University Medical Center a MS centra v Amsterdamu.
Změny u celkem 234 pacientů s klinicky definitivní RS a u 60 zdravých kontrol byly v průběhu pětiletého sledování dvakrát zaznamenány. Předmětem sledování byly objemy kortikální, hluboké šedé a bílé hmoty, objemy lézí (měřené v sekvenci FLAIR) a míra ztráty integrity bílé hmoty (pomocí zobrazení tenzorů difuze, DTI). V obou časech hodnocení bylo rovněž provedeno rozsáhlé neuropsychiatrické hodnocení založené na BRB N (The Brief Repeatable Battery of Neuropsychological Tests). Zohledněny byly pohlaví, věk i vzdělání.
Závěry sledování potvrdily, že míra poškození šedé a bílé hmoty umožňuje předpovídat budoucí poškození kognitivních funkcí. Nicméně k objasnění jejich mechanismu jsou potřeba další klinická hodnocení.
Redakčně zpracovala PharmDr. Kateřina Viktorová