Věkem podmíněná makulární degenerace (VPMD) je progresivní degenerativní onemocnění žluté skvrny, které je v rozvinutých zemích hlavní příčinou těžké a nevratné ztráty zraku u osob starších 50 let a dosud je zdrojem značných terapeutických nesnází. VPMD se vyskytuje ve formě suché, atrofické, a ve formě vlhké. Vlhká čili exsudativní, tedy neovaskulární forma VPMD představuje pouze 10 % celkové prevalence této choroby, avšak je zodpovědná za 90 % případů těžké ztrá
ty zraku (těžká ztráta zraku znamená pokles
zrakové ostrosti o 6 řádků optotypů ETDRS – Early Treatment Diabetic Retinopathy Study). Neléčená choroba působí u většiny nemocných pokles vizu na 6/60 a horší. Postižení pacienti mají vzhledem k centrálnímu skotomu s následkem ztráty samostatnosti často sekundární komplikace choroby v podobě depresí (až 40 %!) a zvýšené frekvence poranění.
Pacienti s těžkou degenerací makuly hod
notí svou kvalitu života jako sníženou o 63
%, tedy stejně jako postižení pokročilou rakovinou prostaty s neléčitelnými bolestmi nebo jako pacienti po masivní ochromující mrtvici. Podle odhadu celosvětové incidence vlhké formy VPMD (500 000 nových případů ročně) lze odhadovat počet nových pacientů v ČR asi na 1000 ročně. Celkovou prevalenci VPMD lze odhadnout ze studie kanadské populace (Beaver Dam Eye Study), podle níž je chorobou postiženo 23 % obyvatel ve věku od 43 do 64 let, avšak až 30 % obyvatel starších 75 let. Podle jiných studií je sice incidence VPMD nižší, avšak lze očekávat, že počet nemocných se během následujících 25 let ztrojnásobí. Vzhledem k „šedivějící" populaci v naší zemi se tato skutečnost stává velmi závažným sociálním a ekonomickým problémem. Zahra
niční analýzy typu cost-benefit jednoznačně ukazují, že investice vynaložené na léčbu i výzkum této choroby jsou návratné, jelikož náklady na léčbu VPMD jsou poloviční ve srovnání s náklady na péči o slepé osoby [1].
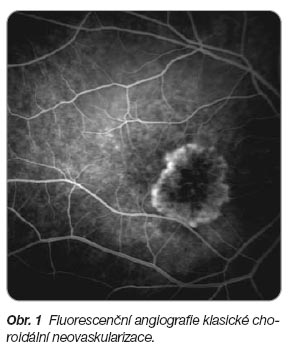
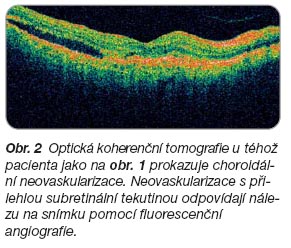
Rizikové faktory ovlivňující vznik VPMD zahrnují genetické vlivy, věk, pohlaví, rasu, kouření, hypercholesterolémii, hypertenzi a kardiovaskulární onemocnění a dietu s nízkým obsahem antioxidantů. U vlhké formy VPMD proniká choroidální neovaskularizace (CHNV) přes Bruchovu membránu do subretinálního prostoru, kde způsobuje exsudaci, která může být serózní i hemoragická. Není-li choroba léčena, jsou poškozeny fotoreceptory (tyčinky a čípky) a nastává ztráta centrálního vizu. Po několika měsících až letech je neovaskulární tkáň nahrazena fibrovaskulární jizvou, která může nabývat vzhledu až pseudotumoru. Výpadek uprostřed zorného pole, centrální skotom, vyřazuje nemocné z činností, jako je čtení, řízení auta, chůze mezi překážkami či rozeznávání obličejů, čímž se výrazně snižuje kvalita jejich života. Klasickou formu choroidální neovaskularizace ukazují
obr. 1
a
2
.
Možnosti léčby VPMD byly donedávna omezené na zpomalení či zastavení progrese neovaskularizací. Přímá laserová koagulace léze působí destrukci nejen patologické neovaskulární tkáně, ale i destrukci neuroretiny se vznikem irever
zibilního absolutního skotomu. Chirurgic
ká extrakce fibrovaskulárního ložiska přináší většinou ztrátu pigmentového epitelu,
nezbytného pro funkci fotoreceptorů. Foto
dynamická terapie kombinuje fotosenzibilizující efekt porfyrinu podaného intravenózně a následně vychytaného v neovaskulární lézi a ozáření této léze
laserovým paprskem s následnou koa
gulací těchto neovaskularizací. Funkční efekt této léčby spočívá spíše ve stabilizaci než ve zlepšení zrakové ostrosti a je omezen na tzv. predominantně klasické, případně na malé okultní neovaskulární membrány.
Klíčovou součástí patogeneze vlhké formy VPMD je novotvorba cév, nové léčebné postupy se proto zaměřují na inhibici angiogeneze ve smyslu prevence neovaskularizace a regrese již existujících cév. U různých očních chorob spojených s neovaskularizací a hyperpermeabilitou hraje kauzální úlohu cévní endoteliální růstový faktor (vascular endothelial growth factor),
VEGF-A. Tento faktor existuje v pěti izofor
mách s různým počtem aminokyselin:
VEGF
110
(přesněji: štěpný produkt VEGF),
VEGF
121
, VEGF
165
, VEGF
189
a VEGF
206
.
Tento hlavní endoteliální růstový faktor, specifický mitogen pro cévní endotelové buňky, je na podkladě hypoxie secernován buňkami pigmentového epitelu sítnice a po své vazbě na VEGF receptor na endoteliích (VEGFR-1 a VEGFR-2) stimuluje růst endo
teliálních buněk a cévní permeabilitu, vše při
spolupůsobení zánětlivých mediátorů a angiogenních cytokinů, čímž vzniká choroidální neovaskularizace a následná exsudace.
Působení VEGF mohou ovlivnit různá léčiva: triamcinolon, angiostatické steroi
dy či přímo antagonisté VEGF (terapie anti-
VEGF) [2]. Steroidy mají kontroverzní účinky a používají se dnes spíše v kombi
naci s jinými postupy. Klinické studie s tera
pií anti-VEGF však již přinesly pozitivní výsledky jak ve smyslu antiangiogenního působení, tak i antipermeabilního účinku. Pegaptanib, aptamer RNA specificky blokující VEGF
165
, prokázal u léčených pacientů lepší výslednou zrakovou ostrost v porovnání s kontrolní skupinou, avšak zlepšení vizu o 3 řádky optotypů nastalo u pouhých 6 % nemocných [3]. Prvním léčivem, u něhož bylo prokázáno zlepšení vizu u 34 % nemocných a které FDA v roce 2006 schválila pro léčbu neovaskulární formy VPMD, byl ranibizumab.
Farmakologické vlastnosti
Ranibizumab je produkován buňkami
Escherichia coli
procesem aktivní mutace za účelem zvýšení afinity k vazbě a zlepšení inaktivace růstového faktoru. Ranibizumab je fragment humanizované monoklonální protilátky IgG1 (Fab) proti proteinu
VEGF. Váže se s vysokou afinitou na
všech
ny biologicky aktivní formy VEGF
-A
(VEGF
121
, VEGF
165
, VEGF
189
a VEGF
206
)
a inhibuje jejich vazbu na endoteliální
receptor, čímž inhibuje angiogenezi a cévní permeabilitu. Je určen specificky pro oční použití. Jako fragment protilátky díky své malé molekulové hmotnosti 48 kD po aplikaci do sklivce snadno proniká pod sítnici. Jeho poločas vyloučení ze sklivce je poměrně krátký (10 dnů). Díky odstranění Fc části původní murinní protilátky má sníženou imunogenitu a cytotoxicitu.
Klinické studie
K nejdůležitějším studiím, které zkou
mají ranibizumab v léčbě VPMD, patří MARINA, ANCHOR, PIER, SAILOR a PRONTO.
Účinnost a bezpečnost ranibizumabu prokázaly klinické studie fáze I/II. Nitrooční injekce ranibizumabu v dávce až 0,5 mg měsíčně byly 120 pacienty dobře snášeny. Následovaly rozsáhlé randomizované dvojitě zaslepené kontrolované studie fáze III, MARINA, ANCHOR a PIER, které ukázaly schopnost ranibizumabu zabránit ztrátě zrakové ostrosti o více než 15 písmen během 2 let.
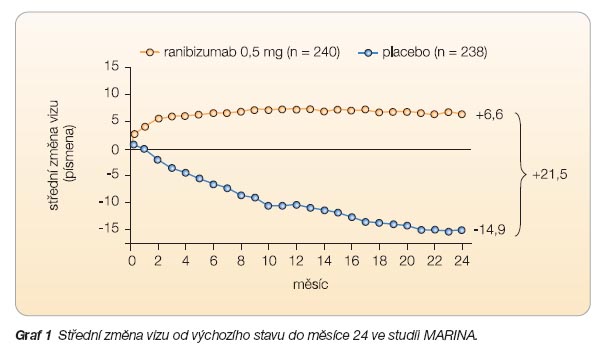
Studie MARINA
zkoumala léčbu minimálně klasických a okultních neovasku
larizací dávkou ranibizumabu 0,3 mg
a 0,5 mg, podávanou jednou měsíčně 716 pacientům po dobu 24 měsíců. Kontrolní skupina měla simulovanou injekci.
Cílem studie bylo zabránit ztrátě vizu o 15 písmen (3 řádky); tohoto cíle bylo po 12 měsících u nemocných léčených dávkou 0,3 mg, resp. 0,5 mg dosaženo
v 94,5 %, resp. v 94,6 % případů a po 24 měsících u 92,0 %, resp. u 90,0 % případů. Ranibizumab navíc zlepšil zrakovou ostrost o 15 a více písmen u 24,8 %, resp. u 33,8 % pacientů; účinek přetrvával po
24 měsících u 26,1 %, resp. 33,3 % pacien
tů. Průměrná zraková ostrost se zlepšila u léčené skupiny o 6,5, resp. 7,2 řádku; účinek přetrvával po 24 měsících (zlepšení o 5,4, resp. 6,6 řádku). Ranibizumab rovněž ovlivnil strukturu sítnice: bránil růstu CHNV do plochy, bránil nárůstu prosakování léze a navodil ústup edému sítnice v průměru o 100
m
m [4] (viz
graf 1
).
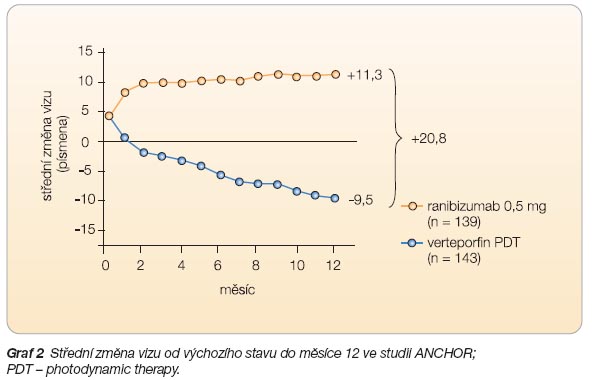
Studie ANCHOR
zkoumala léčbu klasických CHNV dávkou ranibizumabu 0,3 a 0,5 mg, podávanou měsíčně 423 pac
ientům po dobu 24 měsíců. Kontrolní
skupina dostávala verteporfin nebo simulovanou injekci. Cíle studie byly shodné se studií MARINA. Podobné byly i výsledky: ranibizumab zabránil ztrátě vizu o 15 a více písmen u 94,3 %, resp. u 96,4 % nemoc
ných po 12 měsících. Zlepšení vizu o 15
a více písmen nastalo u 35,7 %, resp. u 40,3 % nemocných. Průměrný vizus se po 12 měsících zlepšil o 8,5 %, resp. 11,3 %. I u klasických CHNV bránil ranibizumab růstu CHNV do plochy, bránil nárůstu prosakování léze a navodil ústup
edému sítnice. Příznivý účinek ranibizu
ma
bu kontrastoval s relativně chabým účin
kem verteporfinu podávaného kontrolní skupině (viz
graf 2
).
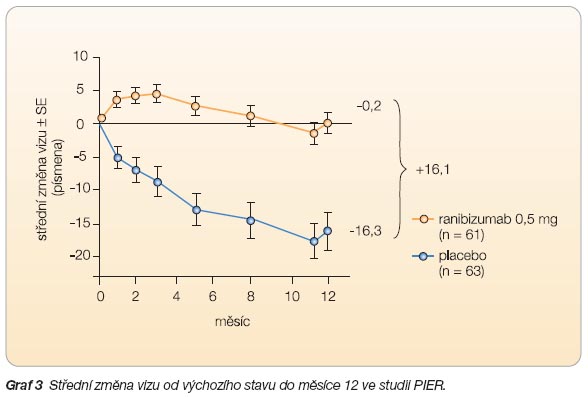
Studie PIER
, další dvouletá studie fáze IIIb, zahrnula 184 pacientů. Studie zkoumala možnost snížení frekvence aplikace ranibizumabu u minimálně klasických a okultních lézí. Schéma léčby podle této studie spočívá v podání tří injekcí ranibizumabu v měsíčních intervalech následovaných opakováním injekce po třech měsících. Všichni pacienti dostali tudíž 6 injekcí během jednoho roku. Po počátečním zlepšení vizu po měsíčních aplikacích průměrná zraková ostrost poklesla při kvartálním podávání k původní hodnotě (
graf 3
). Nebylo tomu tak u všech pacientů, studie PIER ukázala, že u 40 % pacientů lze při léčbě aplikovat individualizovaný režim, zatímco u 60 % je nutno injekce opakovat
každý měsíc. Tyto výsledky podporují koncept flexibilního režimu léčby, který spočívá v podávání dalších dávek léčiva podle vývoje zrakové ostrosti.
Studie SAILOR
byla další studií fáze
IIIb zkoumající bezpečnost léčby ranibizumabem. Tato unicentrická studie zahrnovala 4300 pacientů a porovnávala rizika léčby v dávkách 0,3 mg a 0,5 mg. Pacienti, kteří dostávali dávku 0,5 mg ranibizumabu, prodělali častěji (v 1,2 %) cévní mozkovou příhodu než pacienti s dávkou 0,3 mg (v 0,7 %); tento rozdíl však nebyl statisticky signifikantní, a navíc výskyt cévní mozkové příhody v této věkové skupině činí 1,4 %.
Studie PRONTO
byla unicentrickou nezaslepenou studií zkoumající u 40 pac
ientů během dvou let spolehlivost optic
ké koherenční tomografie (OCT) jako vodítka při indikaci další aplikace ranibizumabu. Pacienti nejprve dostali tři úvodní injekce v měsíčním intervalu, po nichž následovalo sledování zrakové ostrosti a tloušťky sítnice, měřené pomocí OCT. Další aplikace byla indikována pouze v případě progrese choroby. Ukázalo se, že během prvního roku byl průměrný počet potřebných injekcí ranibizumabu pouhých 5,6 a během dvouletého období 9,9. U 37 pacientů, kteří studii dokončili, se vizus stabilizoval v 78 %. U 43 % nemocných se vizus zlepšil o 15 a více písmen; průměrně se vizus
zlepšil o 10,7 písmene. Tloušťka makuly
se zmenšila v průměru o 215
m
m.
Bezpečnost podávání
Přestože je koncentrace léčiva při nit
rooční aplikaci v systémové cirkulaci velmi nízká, vzhledem k možnému vlivu anti-VEGF-A na oběhový systém, na jeho
růst, reparaci a regeneraci je nutno zkoumat možné nežádoucí účinky léčby, zejména se zaměřením na hypertenzi či arteriální tromboembolické komplikace.
Ze studií ANCHOR, MARINA a PIER jsou dostupná data od 875 pacientů léčených ranibizumabem. Během těchto studií bylo podáno celkem více než 13 000 injekcí. Oční bezpečnostní profil ranibizumabu byl podle studie MARINA velmi dobrý, závažné nežádoucí příhody se vyskytly u méně než 1,5 % nemocných. Endoftalmitida či uveitida se objevily u 1 %, resp. u 1,5 % nemocných, vzestup nitroočního tlaku po injekci byl pouze přechodný. Iatrogenní katarakta, trhliny a odchlípení sítnice se vyskytly ojediněle. Systémová bezpečnost byla rovněž dobrá: nebylo pozorováno zvýšení krevního tlaku, výskyt arteriálních tromboembolických příhod nebyl vyšší než u kontrolní skupiny, stejně jako počet úmrtí. Počet pacientů s protilátkami proti ranibizumabu se během 24 měsíců zvýšil z 1 % před léčbou (zřejmě na podkladě preexistující imunoreaktivity anti-Fab) na 4,4 %, resp. na 6,3 % (v závislosti na dávce 0,3 mg, resp. 0,5 mg). Velmi podobné, numericky ještě příznivější výsledky jsou k dispozici i ze studií ANCHOR a PIER, proto je zde podrobně neuvádím.
Léčba ranibizumabem podávaným jednou měsíčně ve formě nitrooční injekce nejen zabránila progresi choroby, ale díky ústupu edému a ztluštění sítnice umožnila zlepšení vizu. Průměrný vizus se během prvních tří měsíců léčby rychle zlepšil a udržel se během celého období léčby. Klinické studie prokázaly bezpečnost ranibizu
mabu; závažné nežádoucí příhody se
nevyskytovaly častěji než v běžné popu
la
ci této věkové skupiny. Zlepšení vizu odrážely i výsledky dotazníku VFQ-25 (Visual Function Questionnaire 25), které ukazovaly zlepšení vidění na blízko i na dálku a zlepšení schopnosti vykonávat činnosti
závislé na zraku, a zejména zlepšení soběstačnosti
nemocných. Všechny rozdíly mezi
ranibi
zumabem podávaným v dávce
0,5 mg
a dvěma kontrolními skupinami byly statisticky
i klinicky významné s p-hodnotami v roz
mezí od 0,009 do < 0,0001.
Dávkování
Na základě výsledků studií MARINA, ANCHOR a PIER je doporučená dávka ranibizumabu 0,5 mg, jelikož prokázala nejlepší účinnost. Z týchž studií vychází i doporučené schéma podávání injekcí:
• �Úvodní fáze (nasycovací) spočívá v aplikaci injekce jednou měsíčně po dobu tří po sobě jdoucích měsíců. Tato fáze navozuje nejlepší zisk zrakové ostrosti.
• �
Udržovací fáze je období individualizované terapie, během něhož pacienti dostávají další injekci podle aktuálního klinického nálezu, tedy na základě vývoje zrakové ostrosti, tloušťky makuly měřené pomocí OCT a biomikroskopie. Tento režim umožňuje individuálně snižovat frekvenci podávání.
Závěr
Ranibizumab prokazatelně zlepšuje zrakovou ostrost u pacientů s vlhkou formou VPMD. Má individuální dávkovací schéma a je doporučován pro léčbu všech podtypů vlhké formy VPMD. V klinických studiích byla prokázána příznivá systémová i oční bezpečnost.
Léčba VPMD v České republice
Léčba ranibizumabem není zatím
v České republice rutinně hrazena zdravotními pojišťovnami (pouze několik vybraných pracovišť). Cena jedné aplikace je nyní 36 098,50 Kč. Zdravotní pojišťovny částečně hradí fotodynamickou terapii verteporfinem, ta je ovšem omezena na klasické CHNV; u vybraných pacientů hradí zdravotní pojišťovny léčbu pegaptanibem, tato terapie však dosahuje nižší účinnosti. V léčbě VPMD je stále častěji používán bevacizumab, monoklonální protilátka proti VEGF-A s molekulovou hmot
ností 149 kDa. Tato látka, primárně urče
ná k léčbě kolorektálního karcinomu, je v oftalmologii používána „off-label", jeli
kož čekáme na výsledky randomizova
ných studií. Z dosavadních zkušeností je ale zřejmé, že tato léčba je velmi účinná a bezpečná.
Výčet dalších léčebných postupů a klinických studií přesahuje rámec této publi
kace, stejně jako indikace použití ranibi
zumabu v léčbě diabetické retinopatie a dalších chorob. Lze však zmínit, že pozornost výzkumných týmů se upíná ke kombinační léčbě, která umožňuje snížit frekvenci aplikace, a samozřejmě k dalším látkám inhibujícím patologickou neovaskularizaci.




