Revoluce v chápání patoimunologie roztroušené sklerózy a další témata Jedličkových dnů
Na 19. Jedličkových dnech, které se konaly 24.–25. května 2019 v Praze, přednášel světový leader v imunologii roztroušené sklerózy (RS) profesor Amit Bar‑Or, MD, FRCP, ředitel Centra pro zánětlivá onemocnění a léčbu neurologických onemocnění Pensylvánské univerzity. Jeho tři přednášky prezentované v průběhu dvou dní vyvolaly obrovský zájem i bouřlivé diskuse. První z nich (Inflammation in multiple sclerosis and anti‑CD20 antibody) zazněla na sympoziu společnosti Roche. Jak profesor Bar‑Or předeslal, jeho pracoviště má zkušenosti již s více než 700 pacienty léčenými okrelizumabem.
V průběhu odborného setkání sympatický profesor Bar Or ještě přednesl příspěvky „Targeting T cells and B cells throughout the phases of MS“ a „Immunotherapy in prevention of loss of CNS function“. V úvodu článku přinášíme nejdůležitější teze tohoto významného odborníka, jež na 19. Jedličkových dnech zazněly.
„O velmi časných změnách v mozku žijících nemocných s RS mnoho nevíme, změny jsme však zachytili v autoptických preparátech,“ podotkl Bar Or. Jak je známo z nálezů na magnetické rezonanci (MR), již v preklinickém období (možná již v dětství) dochází k tvorbě lézí v bílé hmotě mozku, které následně vyústí v klinicky izolovaný syndrom. Léze v tomto období jsou lokalizovány perivaskulárně a představují jen časnou fázi neuronálního poškození. Následuje klinická relabující remitující RS (RR RS), u níž jsou již přítomny i chronické léze, a v důsledku meningeálního autoimunitního zánětu začínají vznikat kortikální léze, které s postupným přechodem do sekundárně progresivní fáze (SP RS) progredují. Kortikální patologie a postupující mozková atrofie jsou charakteristické pro progresivní stadia, kde jsou relapsy výjimečné a RS trvale progreduje. Atrofizace se týká též centrální šedé hmoty mozku. Pro tyto léze je typické, že nejsou lokalizovány perivaskulárně, ale jsou difuzní. Jde tedy o dva odlišné patologické procesy [1‒3].
Zjednodušený (původní) model imunopatogeneze RS
Na periferii dochází k aktivaci (deregulaci povrchových molekul) T lymfocytů po kontaktu s antigen prezentujícími leukocyty (z myeloidní řady) a následně k adherenci aktivovaných T lymfocytů na hematoencefalickou bariéru, kterou narušují. Dochází k tomu, že do mozkového kompartmentu přestupují z T lymfocytů prozánětlivé faktory, které aktivují mozkové T lymfocyty, a odpovědí na tento proces je poškození glií a neuronů. Tento proces byl prokázán na myším modelu u experimentální autoimunní encefalitidy. Podle tohoto modelu, který vnímal RS jako onemocnění zprostředkované T lymfocyty, byly vyvíjeny léčivé přípravky, jež byly zacíleny proti T lymfocytům.
Hlavní kontrolní body imunitní regulace
Podle profesora Bar Ora mají imunitní onemocnění komplexnější patologické mechanismy. U lidských chorob způsobených imunitním systémem (jako je RS) dochází k interakci T lymfocytů (například Treg; ThIL 17; ThIL 17/IFNγ; ThGM CSF) s leukocyty myeloidní řady (produkující např. interleukin [IL] 10 nebo IL 12/IL 23). Oba typy buněk mohou u pacientů s RS vyvolávat přímo v CNS antigen specifickou odpověď, ale nevyvolají ji u zdravých lidí. Pravděpodobně se na zánětlivé odpovědi CNS podílí porušená rovnováha mezi T lymfocyty regulačními (Treg) a efektorovými (prozánětlivými, Teff) [4].
Podle tradičního pohledu se B lymfocyty podílejí na imunitním procesu až po aktivaci ze strany T lymfocytů, a to produkcí protilátek v CNS, které jsou detekovány jako depozita protilátek či oligoklonální pásy (OCB).
Dětská „lekce“
Podle profesora Bar Ora dochází k prvním změnám již v útlém dětství, kdy interagují desítky genů s environmentálními faktory, a v důsledku toho dochází k odlišné modulaci imunitního systému. V kanadské studii s dětskými pacienty s RS byl prokázán vyšší výskyt abnormálních T lymfocytů (CD4+, CCR2+, CCR5+), vyšší produkce interferonu gama (IFNγ) s původem v Th1 lymfocytech a IL 17 z Th17 lymfocytů a nižší počet Treg lymfocytů v porovnání se zdravou populací. Rovněž byl nalezen abnormální poměr mezi Teff a Treg lymfocyty, přičemž Treg lymfocyty působí supresivně na patologické změny u RS. Z toho vyplývá, že RS může být důsledkem nedostatečné funkce Treg, zvýšené aktivity Teff nebo kombinací obou možností [5].
Vyvážená aktivita regulační a efektorové složky imunitního systému je důležitá nejen z hlediska autoimunitních chorob, ale na druhou stranu taktéž v ochraně před infekcí a v protinádorové imunitě.
Překvapivá role B lymfocytů
„Již desetiletí je známo, že T lymfocyty nepůsobí izolovaně, ale ve spolupráci s dalšími buňkami a složkami imunitního systému, pravděpodobně včetně komplementu,“ prohlásil profesor Bar Or. Poprvé se objevily B lymfocyty jako předmět zkoumání u RS při léčbě rituximabem, který působí depleci CD20+ B lymfocytů [6], a následně při vývoji a ověřování účinnosti okrelizumabu, monoklonální protilátky cílené taktéž proti povrchovému antigenu CD20 na B lymfocytech.
Na tomto místě profesor Bar Or připomněl výsledky studií OPERA I a II, které ve svém vystoupení podrobně rozebrala na 19. Jedličkových dnech profesorka Eva Kubala Havrdová.
Rituximab i okrelizumab působí selektivní depleci vývojových stadií B lymfocytů, které exprimují antigen CD20, tj. všech vývojových stadií s výjimkou pluripotentní a unipotentní kmenové buňky, plazmablastů a plazmatických buněk [7].
Dále profesor Bar Or uvedl, že studie prokázaly, že koncentrace imunoglobulinů (IgG i OCB) v likvoru nejsou deplecí CD20+ B lymfocytů ovlivněny, zatímco B lymfocyty se uplatňují při rozvoji nové ataky, přičemž se zdá, že tento efekt není ve vztahu k protilátkám. Ukazuje se tedy, že B lymfocyty mají svou roli bez ohledu na produkci protilátek [6].
Co stojí za setrvalým efektem deplece B lymfocytů?
B lymfocyty pacientů s RS v porovnání se zdravými kontrolami vykazují nerovnováhu v produkci prozánětlivých a protizánětlivých cytokinů (leukotoxin, IL 10 a jejich poměr) [8].
Jsou B lymfocyty tvořené de novo jiné než původní?
V experimentálním modelu bylo prokázáno, že lidské CD27+ B lymfocyty (antigen CD27 je považován za marker paměťové buňky) nejsou po depleci obnoveny, zatímco u CD27 negativních buněk došlo v rekonstituci k obnovení jejich počtu. Z toho vyplývá, že rovněž nastaly změny v poměru produkce pro a protizánětlivých cytokinů. Po depleci se tvoří B lymfocyty odlišného typu od původních.
Studie o vlivu B lymfocytů na T lymfocyty u RS
Výsledky dvou studií [8,9] svědčí o úzké spolupráci a vzájemném ovlivnění mezi B a T lymfocyty, a to několika mechanismy. Vliv faktoru stimulujícího růst kolonií granulocytů a makrofágů (GM CSF), který je exprimován na určitém podtypu B lymfocytů, na vznik RS zkoumali Li a kol. [10]. Autoři práce zjistili, že GM CSF+ B lymfocyty jsou významnými producenty tumor nekrotizujícího faktoru alfa (TNFα) a IL 6, ale nikoliv IL 10. Počet GM CSF+ B lymfocytů je u nemocných s RS abnormálně zvýšený. Po depleci B lymfocytů došlo k trvale snížené prozánětlivé odpovědi myeloidních buněk a pravděpodobně k posílení protizánětlivé odpovědi. Z výše uvedeného vyplývá, že se vzájemně ovlivňují T a B lymfocyty, myeloidní leukocyty a všechny zmíněné složky imunitního systému mohou vyvolávat antigen specifickou odpověď v CNS [4]. Deplece B lymfocytů však může spustit změny T lymfocytů, a to i změny v produkci jejich cytokinů, a může vést k normalizaci funkce makrofágů.
Recentní práce uvádějí, že plazmatické buňky mohou mít jak prozánětlivé, tak protizánětlivé účinky, a tím modifikovat průběh RS. Z určitého úhlu pohledu se zdají být B lymfocyty regulátory pochodů u RS.
Kortikální patologie
Infiltrace mening zánětlivými buněčnými elementy vede k zánětlivým a následně k degenerativním změnám kortexu [11,12]. S přechodem do SP-RS dochází ke ztrátě objemu mozku nejen v důsledku ztrát bílé hmoty způsobených lézemi, ale také v důsledku kortikálních lézí, ztráty centrální šedé mozkové hmoty a k průběžné difuzní atrofii mozku. Aktivace mikroglií postupuje od povrchu směrem k bazálním gangliím, což by vysvětlovala hypotéza, která praví, že meningeální imunitní buňky secernují faktory poškozující mozkovou tkáň. I zde mají B lymfocyty svou roli. Touile a kol. ve své práci [13] prokazují, že lidské glie mohou podporovat přežití B lymfocytů a spouštějí jejich aktivaci, což vede k významné aktivaci T lymfocytů. Chronické subpiální změny jsou spojeny především s infiltrací B lymfocyty. Počet B lymfocytů v likvoru koreluje s koncentrací neurofilament (korelát axonálního poškození) i s počtem aktivovaných T lymfocytů. To svědčí o tom, že i v kompartmentu CNS dochází k interakci všech složek imunitního systému, která u RS vede k poškození tkáně. Solubilní (toxické) faktory produkované efektorovými B lymfocyty (jejich exozomy) indukují prozánětlivé změny a následně i působení mikroglií a astrocytů, což v důsledku vede k poškození nervové tkáně, uvedl profesor Bar Or.
Měnící se paradigma v léčbě RS: jak může ovlivnit způsob terapie a její výsledky?
První léky (injekční) pro pacienty s RS byly na světový trh uvedeny v roce 1993. Od té doby do současnosti přibyly léky perorální a infuzní. V roce 2019 se očekává příchod dalších přípravků a ve vývoji je minimálně osm nových látek s očekávaným vstupem na trh do roku 2024. Jako v dalších medicínských oborech i oblast RS zaznamenává příchod generických a biosimilárních léků, které sníží náklady na léčbu a umožní tak zvýšit dostupnost terapie. Kromě zvýšené účinnosti nových přípravků se sleduje i jejich bezpečnost.
Cílem terapie RS již není redukovat aktivitu onemocnění „k průměru“, ale dosáhnout stavu NEDA (No Evidence of Disease Activity) a zabránit tak dalšímu poškození CNS u všech pacientů. Tento přístup vyžaduje pečlivý monitoring, inovaci v léčebných postupech se zohledněním a pochopením specifických nálezů u konkrétního pacienta a s přihlédnutím k riziku výskytu nežádoucích účinků. Léčba RS je týmovou spoluprací, v níž záleží na vzájemné informovanosti.
Kdy ukončit léčbu – svatý grál RS
V důsledku léčby vysoce účinnými přípravky může dojít po imunorekonstituci k normalizaci imunitního systému, který již nepůsobí chronický zánět. Otázkou je, zda léčbu zcela ukončit, nebo zda přejít na „udržovací“ terapii vysoce bezpečným přípravkem. Profesor Bar Or uvedl, že v Kanadě byla provedena malá studie s 24 mladými pacienty s vysoce aktivní, agresivní RS, jimž byla pro selhání jiné dostupné léčby transplantována kostní dřeň. Jeden pacient zemřel, ale u přeživších došlo ve 100 % k redukci aktivity onemocnění podle MR a klinických relapsů. Dokonce došlo i k zastavení extrémní atrofizace mozku. Existují již patnáctiletá data sledování, která potvrzují vysokou účinnost transplantace kostní dřeně. Podle profesora Bar Ora je nutné do transplantačního programu zařazovat pacienty s velkou ztrátou funkce na počátku onemocnění v prvních letech od stanovení diagnózy RS. Pozdější transplantace by již nebyla pro nemocné přínosem, jen vysokým rizikem.
U některých léčivých přípravků je nutné zvážit ukončení terapie po zvládnutí vystupňované aktivity choroby, a to i vzhledem k riziku sekundárního autoimunitního onemocnění.
Proti ukončení léčby stojí riziko rebound fenoménu, kdy se aktivita RS objeví znovu, mnohdy vystupňovaná. Lze toto riziko predikovat? Mnohé napoví mechanismus účinku použitého přípravku, zda ukončení jeho podávání „uvolní prostor“ pro znovuvzplanutí choroby. Podle dosavadních zkušeností se zdá, že po depleční terapii CD20+ B lymfocytů dochází k tak významným změnám v repopulaci B lymfocytů, že rebound fenomén není pravděpodobný.
Terapeutický efekt záleží i na kvalitě komunikace mezi lékařem a pacientem. Ta se odehrává přímo v ordinaci nebo na dalších místech RS centra, ale může se jednat i o komunikaci prostřednictvím vyvíjených mobilních aplikací, během níž jsou zaznamenána také data v intervalu mezi neurologickými kontrolami. Navíc moderní technologie umožňují zachycení i subklinických projevů RS, které při osobní návštěvě ordinace nejsou klinicky patrné, což umožní dříve diagnostikovat přechod od RR RS k SP RS. Výsledky testu jemné motoriky (Nine Hole Peg Test, 9HPT) nebo kognice (Symbol Digit Modalities Test, SDMT) lze zaznamenat i v chytrém telefonu, stejně tak pacientovo subjektivní hodnocení zdravotního stavu.
Highlight of new reality: lidé nejsou stejní/people are different
Lidé mají odlišné genetické predispozice, které formují spolu s environmentálními vlivy imunitní systém. U různých jedinců fungují regulační mechanismy odlišně, proto také všichni pacienti neodpovídají na konkrétní léčebný postup při určité chorobě stejně. Z tohoto důvodu je nutné hledat biomarkery, které by predikovaly nejen další průběh imunitního onemocnění, ale také předpověděly pravděpodobnost účinnosti zvoleného léčivého přípravku.
„Abychom mohli maximálně využít dat z reálné praxe, která jsme získali od velkého počtu pacientů i za použití nejrůznějších biomarkerů, ale především v dlouhodobém sledování účinnosti léků u nemocných s určitými charakteristikami, musíme zadávat data do registrů a sdílet je s co nejširší komunitou lékařů. Příkladem může být celosvětová MSBase,“ uzavřel profesor Bar Or.
Z diskuse:
- Z dlouhodobého sledování kohort pacientů léčených injekčními přípravky první linie vyplynulo, že i při léčbě těmito přípravky klesla mortalita oproti neléčeným pacientům.
- Příchod biosimilárních léků do léčebného portfolia RS neznamená nic, co by již nebylo přítomno. V průběhu doby se mění výrobní technologie, takže i originální přípravek není zcela totožný s tím, který byl původně schválen k použití. Regulatorní orgány však vydávají rozhodnutí o registraci po každé technologické změně.
- Rozdíl mezi účinky alemtuzumabu (anti CD52), který může navodit další autoimunitní onemocnění, rituximabu a okrelizumabu (anti CD20) spočívá v tom, že alemtuzumab působí depleci B i T lymfocytů, zatímco rituximab a okrelizumab vyvolávají cílenou depleci CD20+ B lymfocytů. Při rekonstituci po léčbě alemtuzumabem se dostatečně rychle neobnovují regulační T lymfocyty, což poskytuje prostor pro dysbalanci. U okrelizumabu nejsou k dispozici data z dostatečně dlouhého sledování, ale farmakovigilanční sledování zatím vznik autoimunit nezachytilo.
- Problematika očkování, která je v současnosti řešena především v souvislosti s epidemií spalniček, obecně zahrnuje několik aspektů. Populační přístup jasně hovoří ve prospěch očkování, ale u jednotlivce je nutné vážit konkrétní riziko. U imunokompromitovaných nelze doporučit očkování živými vakcínami (vakcína proti spalničkám je živá), i když kanadští epidemiologové nevnímají riziko ohrožení jako příliš vysoké. Další otázkou je, zda suprimovaný imunitní systém dokáže vytvořit dostatečnou imunologickou odpověď, která je nutná k protekci. Podle dosavadních zjištění je tvorba protilátek po depleci CD20+ B lymfocytů nižší, ale dostatečná pro ochranu. Je jen velmi málo onemocnění, proti nimž je organismus chráněn jen protilátkami. Navíc se při protekci proti infekci významně uplatňuje buněčná imunita, která není při terapii okrelizumabem zásadně narušena. Lépe je očkovat před podáním imunomodulační léčby.
Cíle v léčbě roztroušené sklerózy: dlouhodobá data okrelizumabu včetně kritérií NEDA a NEPAD
Předsedající sympozia společnosti Roche na 19. Jedličkových neuroimunologických dnech profesorka MUDr. Eva Kubala Havrdová, CSc., (Centrum pro demyelinizační onemocnění, Neurologická klinika a Centrum klinických neurověd 1. LF UK a Všeobecné fakultní nemocnice v Praze) představila auditoriu dlouhodobé výsledky vypovídající o účinnosti a bezpečnosti okrelizumabu, a to i na základě dat z otevřených extenzí studií OPERA I a II i ORATORIO.
Výsledky první fáze studií OPERA
I a II svědčí o superiorní účinnosti
okrelizumabu v porovnání s interferonem beta 1a
(IFNβ 1a) ‒ v kritériu ročního počtu relapsů
(annual relapse rate, ARR) došlo k 46%, respektive k 47%
redukci výskytu relapsů v okrelizumabové větvi v porovnání
s interferonovým ramenem v průběhu prvních dvou let
sledování (p < 0,001),
graf 1. Uvedené účinky přetrvávaly i v dalších
třech letech a snížení ARR bylo zaznamenáno také
u nemocných převedených na okrelizumab z IFNβ 1a
(podle dat z otevřené extenze) [14]. „Pacienti se dostali
velmi rychle na stejnou úroveň v počtu relapsů za rok
po převedení z původní terapie na okrelizumab,“
zdůraznila profesorka Kubala Havrdová.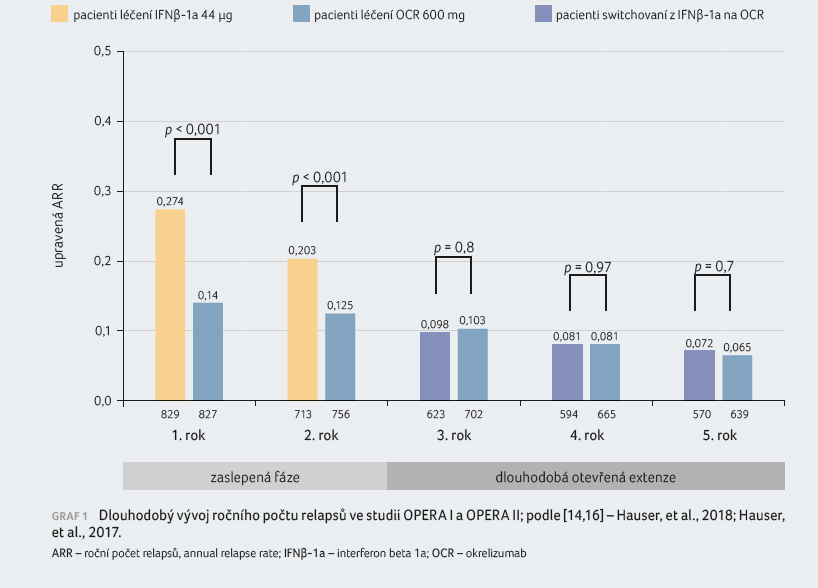
Potvrzená progrese postižení
Další kritérium, jímž je potvrzená progrese postižení (Confirmed Disability Progression, CDP), poukázalo na již známé paradigma, že úbytek neurologických funkcí v počátcích onemocnění již nelze po čase zvrátit. Po 12 týdnech terapie se v hodnotě CDP začínají projevovat rozdíly mezi oběma rameny studií OPERA I a II, ale k významnému rozevření nůžek dochází po 24 týdnech léčby. Rozdíl ve výši 40 % v CDP, jehož bylo dosaženo po 96 týdnech léčby, se nezměnil ani po převedení nemocných z IFNβ 1a na okrelizumab, avšak do 240. týdne se již neprohloubil.
Dlouhodobý vývoj kumulativního počtu T1 Gd+ a T2 lézí
Okrelizumab od počátku léčby
výrazně redukoval celkový počet T1 gadolinium enhancujících
lézí (Gd+), a to jak v prvních dvou letech
studií OPERA I a II, tak v otevřené extenzi studie
(graf 2). Po převedení pacientů z IFNβ 1a
na okrelizumab došlo také u těchto nemocných
k radikálnímu zmírnění aktivity RS v podobě absence
nových lézí a podobný průběh byl zaznamenán rovněž
v případě rozvoje chronických T2 lézí. Po celých
pět let se jeví účinky okrelizumabu jako setrvalé [15].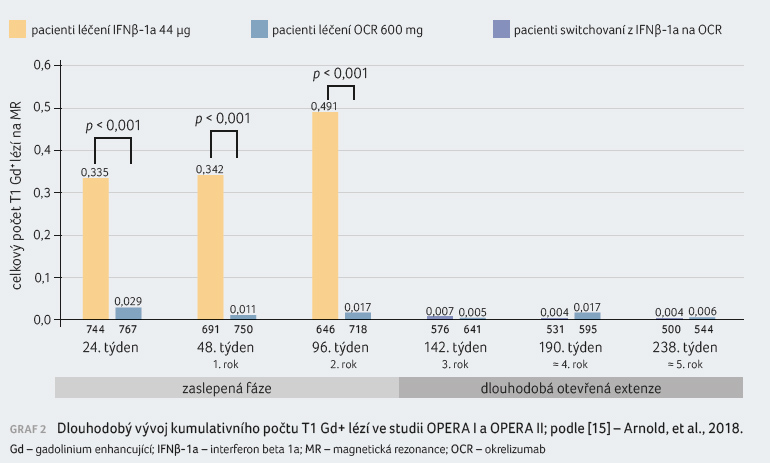
Pacienti bez známek progrese a aktivního onemocnění (NEPAD)
Nový léčebný cílový ukazatel NEPAD (No Evidence of Progression or Active Disease) hodnotí stav pacienta s RS detailněji než kritérium NEDA (No Evidence of Disease Activity). „Tento cíl potřebujeme k přesnějšímu posouzení progrese onemocnění. Jak víme, choroba probíhá subklinicky a my potřebujeme citlivé parametry, které zachytí progresi, jež se neprojeví relapsem nebo zhoršením na škále disability. Rychlost chůze na vzdálenost 25 stop a test jemné motoriky, v němž je měřen čas umisťování devíti kolíků do devíti jamek a následně jejich uložení do krabičky, jsou velmi citlivými markery jinak velmi diskrétní progrese,“ vysvětlila přednášející.
Ve studiích, které probíhaly v Centru pro demyelinizační onemocnění 1. LF UK, bylo zpomalení chůze pozorováno i u pacientů se skóre EDSS (Expanded Disability Status Scale) 1, tedy bez zjevných klinických příznaků. „Tento test může predikovat postupující subklinické změny nervové soustavy stejně jako drobná změna jemné motoriky podle Nine Hole Peg testu. Funkce ruky a jemná motorika je velmi potřebná pro pacienty s RS k ovládání počítačů či aplikací chytrých telefonů,“ sdělila profesorka Kubala Havrdová. „Progrese nevzniká ve stadiu EDSS 4, ale probíhá od samého začátku choroby ještě před prvními klinickými projevy RS. Naším úkolem je zastavit tuto progresi co nejdříve,“ upřesnila přednášející.
Účinnost při mozkové atrofizaci
K sekundárním, ale velmi významným cílovým ukazatelům studií OPERA I a II patřila atrofizace mozku. V obou hodnoceních byl prokázán účinek okrelizumabu na pokles úbytku mozkové tkáně, a to statisticky významně [15,16]. Ve studii OPERA I byla zaznamenána 22,8% redukce ztráty mozkové tkáně při léčbě okrelizumabem v porovnání s pacienty léčenými IFNβ 1a, ve studii OPERA II pak rozdíl činil 14,9 %. Po převedení pacientů z IFNβ 1a na okrelizumab došlo ke snížení rychlosti atrofizace mozkové tkáně na úroveň pacientů léčených od počátku okrelizumabem.
Profesorka Kubala Havrdová dále uvedla, že efekt léčby na zpomalení progrese úbytku mozkové tkáně se projeví v horizontu minimálně dvou let po změně terapie. „To, co pacienti ztratili méně účinnou léčbou, už neumíme nahradit, protože zatím nemáme k dispozici léky, které by uměly restaurovat poškozenou nervovou tkáň,“ zdůraznila přednášející.
Shrnutí výsledků studií OPERA I a OPERA II
Klinická hodnocení OPERA I a OPERA II prokázala účinnost okrelizumabu v léčbě RR RS. Jeho bezpečnostní profil byl srovnatelný s léčbou IFNβ 1a během prvních 96 týdnů, avšak okrelizumab v porovnání s IFN β1a významně snížil ARR, zpomalil 12týdenní a 24týdenní CDP, redukoval počet T1 Gd+ lézí a počet nových a/nebo zvětšujících se T2 lézí. Podle výzkumných analýz okrelizumab ve srovnání s IFNβ 1a rovněž zmírnil rychlost úbytku mozkové tkáně a významně zvýšil podíl pacientů dosahujících stavu NEDA.
Účinnost okrelizumabu na zmíněné parametry a konzistentní bezpečnostní profil jsou v tuto chvíli již potvrzeny až pětiletými daty sledování v rámci otevřené extenze studií OPERA I a OPERA II.
Účinnost okrelizumabu u pacientů s primárně progresivní RS ve studii ORATORIO a v její otevřené extenzi
Nemocní s primárně progresivní RS (PP RS) jsou starší, což se může projevit i v mírně redukovaném počtu pacientů, kteří studii dokončili (podle souhrnných pětiletých dat). Ve studii ORATORIO byli pacienti randomizováni v poměru 2 : 1 k terapii okrelizumabem a k podávání placeba. Pro PP RS není zatím dostupná žádná léčba kromě okrelizumabu, proto bylo jako komparátor zvoleno placebo. Ve studii ORATORIO došlo ke snížení CDP ve 24. týdnu o 25 % oproti placebu [17,18].
Vliv na rychlost chůze (Timed 25 Foot Walk test, T25FW) je patrný již ve 24. týdnu. Rychlost chůze se snižovala u pacientů léčených okrelizumabem o 29 % pomaleji než u pacientů léčených placebem (p = 0,04), přičemž rozdíl přetrvával i ve 120. týdnu.
Podstatná je podle profesorky Kubala Havrdové odlišnost v objemu T2 lézí, který se u pacientů s placebem zvětšil o 7,4 % (120. týden), zatímco u nemocných léčených okrelizumabem došlo ke zmenšení o 3,4 % [19]. Jde o rozdíl 146 %, což se pohybuje na velmi významné statistické hladině. „V současnosti máme již dostatek důkazů o korelaci progrese disability s patologickými procesy vedoucími k atrofizaci mozku, například z prací profesorky Sormani,“ podotkla přednášející.
Shrnutí výsledků studie ORATORIO
Jak uvedla profesorka Kubala Havrdová, třikrát více pacientů s PP RS se má při terapii okrelizumabem lépe než ti bez léčby (s placebem). Je to prokázáno nálezy na MR v ústupu jak akutních (zánětlivých Gd+) lézí, tak chronických změn (rozvoje T2 lézí, atrofizace mozku).
Stále však potřebujeme dlouhodobá data, abychom si byli jisti bezpečností, a současně potřebujeme data k diskusi s plátci zdravotní péče, abychom prokázali, že včasné zahájení léčby má také pozitivní ekonomický dopad.
Počáteční analýza i data z otevřené extenze prokázaly, že okrelizumab ve srovnání s placebem významně snižuje:
- 12- a 24týdenní CDP,
- změnu délky doby chůze na vzdálenost 25 stop,
- změnu objemu T2 lézí,
- úbytek objemu mozku.
- Dlouhodobá bezpečnost okrelizumabu
V počátku implementace léčby okrelizumabem byly vysloveny pochybnosti týkající se zejména možného vzniku onkologických onemocnění. „Budeme li sledovat mortalitní data, pak uvidíme, že u nemocných léčených okrelizumabem nedošlo k nárůstu počtu úmrtí, včetně těch na onkologická onemocnění, a to jak v porovnání se zdravou populací, tak ve srovnání se skupinami léčenými komparátory ve všech zmíněných studiích,“ uvedla profesorka Kubala Havrdová. Například incidence karcinomu prsu na 100 pacientoroků se nelišila u nemocných léčených okrelizumabem oproti běžné populaci [19].
Dlouhodobá četnost nežádoucích účinků na 100 pacientoroků je v souladu s bezpečnostním profilem pozorovaným v průběhu zaslepených fází studií OPERA I a II a studie ORATORIO:
- Dlouhodobě nebyly pozorovány žádné nové typy závažných infekcí.
- K únoru 2018 byly hlášeny dvě závažné oportunní infekce u pacientů léčených okrelizumabem.
- K únoru 2018 rovněž zůstává nezměněna četnost malignit ve skupině léčené okrelizumabem, která je v souladu s incidencí očekávatelnou v běžné populaci pacientů s RS.
Farmakovigilance však bude i nadále pokračovat. Jediný způsob, jak monitorovat nežádoucí účinky, je vkládání dat do registrů, uzavřela profesorka Eva Kubala Havrdová.
Komplexní monitoring pacienta s roztroušenou sklerózou
Docentka MUDr. Dana Horáková, Ph.D., (Centrum pro demyelinizační onemocnění, Neurologická klinika a Centrum klinických neurověd 1. LF UK a Všeobecná fakultní nemocnice v Praze) se věnovala na sympoziu společnosti Roche významu monitorování pacientů s RS.
První otázka, kterou si docentka Dana Horáková položila, zněla: Proč potřebujeme monitorovat? Jedním z hlavních důvodů je výrazná heterogenita onemocnění. „Nelze tvrdit, že všichni pacienti mají vysoce agresivní formu RS, nepochybně jsou i pacienti s mírnějším průběhem nemoci, proto je nutné je pečlivě monitorovat a zajistit individuální péči pro každého nemocného,“ uvedla docentka Horáková. V posledních deseti letech se ukázalo, že správnou diagnózou u mnohých pacientů považovaných za nemocné s RS může být neuromyelitis optica, ať už s protilátkami proti akvaporinu 4, nebo bez nich, s protilátkami proti myelinovému oligocytárnímu glykoproteinu (MOG IgG+), a další choroby.
Druhým důvodem monitorace jsou výrazné pokroky v terapeutických možnostech. Protože se do praxe dostaly další účinné léky, je dnes maximální snaha léčbu individualizovat a každému pacientovi tzv. ušít terapii na míru, tj. vybrat přípravek, ze kterého bude mít největší prospěch při zohlednění bezpečnostních rizik. Zahájení léčby se tak stává začátkem celoživotního monitoringu, kdy při každé další návštěvě vyhodnocujeme aktivitu nemoci a snažíme se dosáhnout klinického stavu bez měřitelné aktivity choroby.
V současnosti jsou k dispozici léky, které pacientům mohou dramaticky pomoci, ale také je výrazně poškodit. To je velmi závažný důvod pro monitoraci nežádoucích účinků, protože jejich dlouhodobé sledování bude v budoucnosti jedním z pilířů terapeutické strategie.
Nesmírně důležitý je sběr dat a jejich zadávání do registru, neboť jedině dlouhodobá a dostatečně robustní data nám poskytnou zpětnou vazbu, jak účinkuje léčba a jakým rizikům je nutné se vyhýbat v praxi reálného světa.
Typy markerů pro monitoring
V současnosti již nestačí prosté neurologické vyšetření, proto se hledají spolehlivé ukazatele svědčící pro stabilizaci či hrozící progresi RS.
Klinické markery
Počet relapsů je základním klinickým markerem, ale je nutné sledovat nejen počet relapsů, ale i jejich typ, jejich tíži a to, zda po relapsu zůstává neurologické reziduum. Otázkou je, zda by pro vyhodnocení toho, jestli se jedná o relaps, či nikoliv, mohlo pomoci sledování sérové koncentrace lehkých řetězců neurofilament.
Ještě větší výzvou je objektivní hodnocení disability. V současné praxi převládá monitoring fyzické disability podle Kurtzkeho škály (EDSS), která má jak své výhody, tak samozřejmě nevýhody. Proto je snahou doplnit vyšetření o kvantitativní parametry, jako jsou test chůze na 25 stop (T25FW), vyšetření jemné motoriky (9HPT), posouzení kognice (SDMT; Brief International Cognitive Assessment for MS, BICAMS) a vyšetření zrakových funkcí (Sloan Chart Test).
Významná část pacientů má zhoršené kognitivní funkce, nejedná se ovšem o těžší postižení typu demence, jde o problémy s koncentrací, krátkodobou pamětí, rychlostí zpracování informací, které jsou na první pohled špatně detekovatelné. V rychlém screeningu těchto poruch nám může pomoci právě jednoduchý SDMT. Toto desetiminutové vyšetření nemusí provádět jen lékař, ale může jej vyhodnotit i zaškolený zdravotnický pracovník.
Žijeme v éře mobilních aplikací a chytrých telefonů, prohlásila docentka Horáková. Ve fázi testování jsou nyní různé mobilní aplikace jako například Floodlight nebo MSPT (Multiple Sclerosis Performance Test), které umožňují selfmonitoring.
Abychom však mohli efektivně těžit ze všech získaných informací, musejí být výsledky tohoto monitoringu dostupné v reálném čase a všechna data musejí směřovat do jednotného systému (např. databáze iMED, MDS apod.) [20,21].
Paraklinické markery
Nejdůležitějším paraklinickým markerem zůstává MR, na jejímž zobrazení typicky sledujeme lezionální patologii. Většina pracovišť vyhodnocuje pouze kvalitativní parametry, tj. počet nových lézí, nikoliv hodnoty kvantitativní. Navíc zatím stále postrádáme širší dostupnost volumetrických technik, které sledují objemové změny mozku a míchy související s narůstající mozkovou atrofií, a tedy s nedostatečným léčebným efektem.
Dále se docentka Dana Horáková věnovala problematice podávání kontrastních látek, které se hromadí (enhancují) v nových lézích. Do mozkové tkáně se dostávají při porušené hematoencefalické bariéře a enhancement v nových lézích přetrvává od dvou do dvanácti týdnů. Záleží tedy na časovém odstupu vzniku nové léze do provedení kontrastního vyšetření, zda se nová léze projeví jako enhancující ložisko.
V posledních letech se objevily práce prokazující, že některé kontrastní látky se kumulují v určitých částech mozku (nejčastěji v zadní jámě a v oblasti bazálních ganglií) [22]. Se vzrůstajícím počtem dávek dochází k progresi hyperintenzních ložisek, přičemž není jasné, jaké důsledky tato kumulace může mít.
Skupina autorů z Mnichova vyhodnotila celkem 866 nálezů na MR u 359 pacientů s RS a klinicky izolovaným syndromem. Všichni pacienti byli vyšetřováni na stejném přístroji (3T) podle stejného protokolu. K hodnocení autoři použili metodu tzv. subtrakce s použitím sekvence double inversion recovery (DIR), kde bylo nalezeno celkem 1 992 nových nebo zvětšených lézí. V subtrakci s využitím sekvence FLAIR (fluid attenuated inversion recovery) bylo nalezeno o 27 % méně lézí (1 442), což je z klinického pohledu stále přijatelné, uzavřela docentka Horáková. Významné je, že z celkového počtu 207 enhancujících lézí na T1 váženém obraze bylo při DIR subtrakci zachyceno 203 (98,1 %) nových lézí [23,24].
Neurofilamenta, strukturální stavební proteiny, které se uvolňují při rozpadu axonů, jsou podle prací uveřejněných v posledních letech velmi nadějným markerem sledování průběhu RS [25]. Je prokázána korelace mezi progresí disability či progresí na MR a koncentrací neurofilament v séru.
Další práce prokazuje korelaci mezi účinností terapie a koncentrací neurofilament v séru, a to i v porovnání s kontrolní skupinou zdravých osob [26]. Důležité je zjištění, že koncentrace neurofilament v likvoru a séru spolu vysoce korelují [27].
Pacientem hlášené výsledky (Patients Reported Outcomes, PRO) zatím nejsou validovanou metodou, přestože pravděpodobně v budoucnosti přinesou nový pohled na péči o pacienta s RS.
Význam registrů pro dlouhodobé sledování pacientů s RS
„Dobře vedené registry se stávají klíčovým zdrojem dat z reálné klinické praxe. Registry potřebujeme nejen ke sledování účinnosti, ale především bezpečnosti léčby,“ předeslala docentka Dana Horáková. Česká republika má vybudovanou infrastrukturu pro zadávání dat do národního registru ReMuS (www.multiplesclerosis.cz) s možností zapojení do mezinárodních výzkumných projektů především cestou celosvětové databáze MSBase, ale i evropských projektů. Je potřeba zdůraznit, že v této oblasti došlo během posledních pěti let k zásadnímu posunu v chápání významu dat z reálné klinické praxe. To je reflektováno i ve vyjádření Evropské lékové agentury (EMA), která již cestou registrů vydala řadu metodických doporučení pro sběr dat o efektivitě a bezpečnosti léčby u chronických onemocnění.
Redakčně zpracovala MUDr. Marta Šimůnková
Seznam použité literatury
- [1] Rice CM, Cottrell D, Wilkins A, Scolding NJ. Primary progressive multiple sclerosis: progress and challenges. J Neurol Neurosurg Psychiatry 2013; 84: 1100–1106.
- [2] Antel J, Antel S, Caramanos Z, et al. Primary progressive multiple sclerosis: part of the MS disease spectrum or separate disease entity? Acta Neuropathol 2012; 123: 627–638.
- [3] Thompson AJ, Kermode AG, Wicks D, et al. Major differences in the dynamics of primary and secondary progressive multiple sclerosis. Ann Neurol 1991; 29: 53–62.
- [4] Li R, Patterson KR, Bar‑Or A. Reassessing B cell contributions in multiple sclerosis. Nat Immunol 2018; 19: 696‒707.
- [5] Mexhitaj I, Nyirenda MH, Li R, et al. Abnormal effector and regulatory T cell subsets in paediatric‑onset multiple sclerosis. Brain 2019; 142: 617–632.
- [6] Bar‑Or A, Calabresi PA, Arnold D, et al. Rituximab in relapsing‑remitting multiple sclerosis: a 72‑week, open‑label, phase I trial. Ann Neurol 2008; 63: 395‒400.
- [7] Edwards JC, Cambridge G. B‑cell targeting in rheumatoid arthritis and other autoimmune diseases. Nat Rev Immunol 2006; 6: 394‒403.
- [8] Bar‑Or A, Fawaz L, Fan B, et al. Abnormal B‑cell cytokine responses a trigger of T‑cell‑mediated disease in MS? Ann Neurol 2010; 67: 452‒461.
- [9] Barr TA, Shen P, Brown S, et al. B cell depletion therapy ameliorates autoimmune disease through ablation of IL‑6‑producing B cells. J Exp Med 2012; 209: 1001‒1010.
- [10] Li R, Rezk A, Miyazaki Y, et al. Proinflammatory GM‑CSF–producing B cells in multiple sclerosis and B cell depletion therapy. Sci Trans Med 2015; 7: 310ra166.
- [11] Howell OW, Reeves CA, Nicholas R, et al. Meningeal inflammation is widespread and linked to cortical pathology in multiple sclerosis. Brain 2011; 134: 2755‒2771.
- [12] Howell OW, Schulz‑Trieglaff, Carassiti D, et al. Extensive grey matter pathology in the cerebellum in multiple sclerosis is linked to inflammation in the subarachnoid space. Neuropathol Applied Neurol 2015; 41: 798‒813.
- [13] Touil H, Kobert A, Lebeurrier N, et al. Human central nervous system astrocytes support survival and activation of B cells: implications for MS pathogenesis. J Neuroinflamm 2018; 15: 114.
- [14] Hauser SL, Brochet B, Montalban X, et al. Long‑term reduction of relapse rate and confirmed disability progression after 5 years of ocrelizumab treatment in patients with relapsing multiple sclerosis. ECTRIMS 2018, Poster P590.
- [15] Arnold DL, Kappos L, Hauser SL, et al. Long‑term reduction in brain MRI disease activity and atrophy after 5 years of ocrelizumab treatment in patients with relapsing multiple sclerosis. ECTRIMS 2018, Poster P588.
- [16] Hauser SL, Bar‑Or A, Comi G, et al. Ocrelizumab versus Interferon Beta‑1a in Relapsing Multiple Sclerosis. N Engl J Med 2017; 376: 221‒234.
- [17] Montalban X, Hauser SL, Kappos L, et al. Ocrelizumab versus Placebo in Primary Progressive Multiple Sclerosis. N Engl J Med 2017; 376: 209‒220.
- [18] Montalban X, Hemmer B, Rammohan K, et al. Efficacy and safety of ocrelizumab in primary progressive multiple sclerosis ‒ results of the placebo‑controlled, double‑blind, Phase III ORATORIO study. ECTRIMS 2015, Abstract 228.
- [19] Hauser SL, Kappos L, Montalban X, et al. Safety of ocrelizumab in multiple sclerosis: updated analysis in patients with relapsing and primary progressive multiple sclerosis. ECTRIMS 2018, Abstract P1229.
- [20] Motl RW, et al. Multiple Scler J 2017; Benedict R, et al. Multiple Scler J 2017; Strober L, et al. Multiple Scler J 2018; Feys P, et al. Multiple Scler J 2017.
- [21] Balcer L, et al. Multiple Scler J 2017; La Rocca NG, et al. Multiple Scler J 2018; Ontaneda D, Multiple Scler J 2017.
- [22] Zivadinov R, Bergsland N, Hagemeier J, et al. Atrophied lesion volume: A novel and robust imaging biomarker in multiple sclerosis for predicting disability progression. AAN 2018, P3.346.
- [23] Eichinger P, Schön S, Pongratz V, et al. Accuracy of Unenhanced MRI in the Detection of New Brain Lesions in Multiple Sclerosis. Radiology 2019 Mar 12; https://doi.org/10.1148/radiol.2019181568.
- [24] Eichinger P, Wiestler H, Zhang H, et al. A novel imaging technique for better detecting new lesions in multiple sclerosis. J Neurol 2017; 264: 1909‒1918.
- [25] Khalil M, Teunissen CE, Otto M, et al. Neurofilaments as biomarkers in neurological disorders. Nature Rev Neurol 2018; 14: 577‒589.
- [26] Disanto G, Barro C, Benkert P, et al. Serum Neurofilament light: A biomarker of neuronal damage in multiple sclerosis. Ann Neurol 2017; 81: 857‒870.
- [27] Bar-Or A. Results from the OBOE study. AAN 2019, Platform Presentation S56.008.