Roztroušená skleróza včera a dnes
Témata odborného sympozia farmaceutické společnosti Novartis, které se konalo 23. listopadu 2017 v rámci 31. českého a slovenského neurologického sjezdu v Brně, byla vybrána tak, aby zmapovala současný pohled na změnu diagnostiky, monitoring a léčbu roztroušené sklerózy (RS) a v neposlední řadě i možnosti péče o pacienty v sekundární progresi.
Současný pohled na diagnostiku a monitoring roztroušené sklerózy
Sympozium zahájila doc. MUDr. Dana Horáková, Ph.D., předsedkyně Sekce klinické neuroimunologie a likvorologie, z RS centra při Neurologické klinice a Centru klinických neurověd 1. LF UK a VFN v Praze. Ve svém přehledném sdělení se věnovala aktualizaci nových diagnostických kritérií RS a současným doporučením týkajícím se monitoringu RS.
„V poslední době jsme se ve znalostech etiopatogeneze RS velmi posunuli kupředu a nikdo již nepochybuje o tom, že klíčový moment se odehrává hned na počátku. Tímto momentem je zánět, který startuje většinu dalších procesů, tak jak jsou dnes podrobně popsány. Tedy oxidativní vzplanutí s uvolněním volných radikálů, poškozením mitochondrií, DNA a tkáňovou degenerací. Většina léků, které máme k dispozici, je schopna v první fázi zasáhnout, bohužel v progresivní fázi jsou možnosti terapeutické intervence omezené. Léky sice existují a procházejí různými fázemi testování, výsledky však nejsou příliš povzbudivé. Stále tedy platí, že čím dříve začneme RS léčit, tím lépe. Je rovněž nutné pacienty pečlivě monitorovat, abychom v případě přetrvávající aktivity RS mohli zvolit účinnější léčbu, jejíž spektrum se stále rozšiřuje,“ řekla v úvodu docentka Horáková.
Diagnostická kritéria a jejich aktuální změny
Diagnostická kritéria se v průběhu posledních dvaceti
let vyvíjejí a mění s tím, jak přibývají znalosti
o RS. Klíčový byl rok 2001, kdy byla publikována McDonaldova
kritéria [1], která implementovala do diagnostického procesu
magnetickou rezonanci (MR) nahrazující čekání na druhou
klinickou ataku RS. Tato kritéria byla ještě několikrát
aktualizována. Poslední oficiální aktualizace provedená v roce
2010 je běžně užívána v klinické praxi. Aktualizovaná
kritéria říkají, že diagnózu můžeme stanovit pouze na základě
klinického průběhu, pokud nemocný vyvine dvě klinické ataky
z různého místa nervového systému a v různém
čase. Atakou se rozumí nové příznaky nebo zhoršení stavu
objevující se po období relativního klidu (remise). Kritéria
definují i další situace pro stanovení diagnózy RS (tab. 1). Jedním z nich je přípa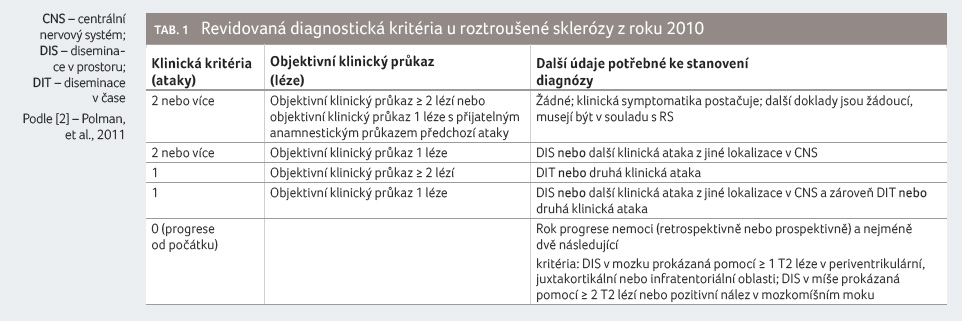 d, kdy má pacient dvě
ataky ze stejného místa nervového systému, například dvě
optické neuritidy. Pak je možné nahradit diseminaci v prostoru
právě pomocí MR. Stejně tak v případě, že pacient vyvine
jen jednu klinickou ataku. Diseminace
v prostoru (DIS) požaduje přítomnost alespoň
jedné asymptomatické léze ve dvou typických lokalitách,
jako jsou ložiska periventrikulární, juxtakortikální, oblast
mozkového kmene nebo ložiska v oblasti míchy, především
cervikální. Diseminaci v čase
(DIT) lze naplnit již při výskytu jedné klinické
ataky buď současným průkazem enhancujících a neenhancujících
ložisek na první MR, nebo průkazem nové léze na druhé
MR, provedené s libovolným odstupem po MR první. Rozumný
interval mezi oběma vyšetřeními je 3‒6 měsíců.
d, kdy má pacient dvě
ataky ze stejného místa nervového systému, například dvě
optické neuritidy. Pak je možné nahradit diseminaci v prostoru
právě pomocí MR. Stejně tak v případě, že pacient vyvine
jen jednu klinickou ataku. Diseminace
v prostoru (DIS) požaduje přítomnost alespoň
jedné asymptomatické léze ve dvou typických lokalitách,
jako jsou ložiska periventrikulární, juxtakortikální, oblast
mozkového kmene nebo ložiska v oblasti míchy, především
cervikální. Diseminaci v čase
(DIT) lze naplnit již při výskytu jedné klinické
ataky buď současným průkazem enhancujících a neenhancujících
ložisek na první MR, nebo průkazem nové léze na druhé
MR, provedené s libovolným odstupem po MR první. Rozumný
interval mezi oběma vyšetřeními je 3‒6 měsíců.
Nová diagnostická kritéria [3] byla představena na mezinárodním kongresu ECTRIMS (European Committee for Treatment and Research in Multiple Sclerosis) konaném v roce 2017 v Paříži a byla již publikována v časopise Lancet Neurology. Byla sestavena na návrh panelu expertů, který se sešel v průběhu let 2016 a 2017 a jehož cílem bylo implementovat do kritérií aktuální poznatky o RS z posledních sedmi let. Nová kritéria nepřinášejí zásadní změny, ale snaží se zjednodušit a upřesnit některé body doporučení z roku 2010. Jejich ambicí je umožnit časnější diagnostiku, pokud je RS vysoce pravděpodobná, ale není možné ji stanovit pomocí současných diagnostických kritérií. Zachovávají kontinuitu a specificitu stávajících kritérií a podporují jejich správnou aplikaci. Nová diagnostická kritéria RS mají pět hlavních bodů.
Vyšetřování oligoklonálních pásů
Do diagnostiky se opět zavádí vyšetřování oligoklonálních pásů v likvoru, které čeští neurologové nikdy neopustili.
1.Pozitivní nález oligoklonálních pásů v likvoru umožňuje u pacienta s první klinickou atakou a s naplněním klinických nebo MR kritérií DIS a se současným splněním podmínky, že není žádné lepší vysvětlení pro tyto klinické obtíže, diagnostikovat RS i bez přítomnosti DIT.Lezionální patologie
Body 2 a 3 upřesňují a zjednodušují lezionální patologii. Kritéria z roku 2010 zohledňovala při hodnocení DIS pouze asymptomatické léze. V bodě 4 se rozšiřují také možnosti diagnostiky primárně progresivní RS (PP RS).
2. Pro naplnění kritérií DIS a DIT mohou být použity oba typy MR lézí – symptomatické i asymptomatické.
3. Kromě lézí juxtakortikálních mohou být pro potvrzení DIS využity i léze kortikální.
4. V případě diagnostiky PP RS platí původní definice v roku 2010, ale nově mohou být kromě lézí asymptomatických použity i léze symptomatické a kromě lézí juxtakortikálních i léze kortikální.
„Měli bychom se připravit na to, že přijde určitá revoluce, protože v okamžiku, kdy budeme mít k dispozici lepší zobrazovací techniku, uvidíme i mnohem více kortikálních lézí, které jsou dnes přítomné, ale kvůli technice nejsou zřetelné,“ upozornila docentka Horáková.
Očekávaný průběh nemoci
Poslední bod se zaměřuje na management nemoci a současně
odkazuje na klasifikaci RS publikovanou v časopise
Neurology (tab. 2, 3), jejímž pilířem je MR.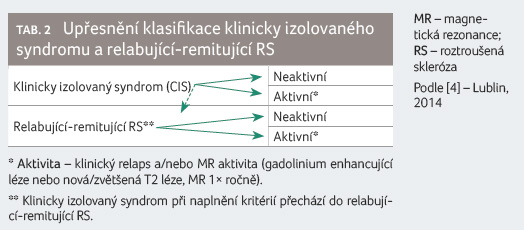
5. Již
na začátku, tedy v době diagnózy, by měl být navržen
očekávaný typ průběhu nemoci, který by měl být pravidelně
revidován tak, jak se stav pacienta mění v ča se, s využitím
nových informací.
se, s využitím
nových informací.
„Osobně bych se přimlouvala za to, abychom do diagnostiky a klasifikace RS více zařazovali MR, protože nám umožní lépe charakterizovat klinicky izolovaný syndrom a relabující remitující RS (RR RS) podle jejich aktivity. Ještě více se MR uplatní při popisu progresivních forem onemocnění, kde je opět snahou k formě onemocnění doplňovat i jeho aktivitu na MR a tím lépe odhadnout budoucí vývoj nemoci,“ poznamenala docentka Horáková.
Monitorace aktivity nemoci
„Poté, co stanovíme diagnózu a léčbu, následuje fáze monitorace aktivity nemoci, kterou můžeme hodnotit pomocí klinicky měřitelných parametrů nebo paraklinickými vyšetřeními. Současným trendem je dosáhnout onemocnění bez měřitelné aktivity. Neaktivní RS je definována konceptem NEDA 3 (no evidence of disease activity) jako onemocnění bez relapsů, disability a nových lézí na MR. Nároků na neaktivní onemocnění bude jistě v budoucnu přibývat. Již nyní je diskutován koncept NEDA 4 rozšířený o srovnání atrofie mozku nemocných s RS a zdravých kontrol. Právě mozková atrofie úzce koreluje s nárůstem disability pacienta. Dále je možné kvantifikovat rychlost chůze, jemnou motoriku, kognici a řadu dalších ukazatelů, které koncept NEDA rozšíří,“ uvedla docentka Horáková.
Klinická vyšetření
V praxi se používají hlavně klinická vyšetření prováděná v ordinaci lékaře, ale snahou by mělo být do monitoringu stále více zapojovat samotné pacienty. Pomocí nových technologií pak mohou nemocní zaznamenaná data posílat přímo do registrů. Ukazuje se, že relapsy a škála EDSS (Expanded Disability Status Scale) nejsou k vyjádření skutečné disability pacientů s RS dostatečně senzitivní. Dokazuje to i studie publikovaná v roce 2017, do níž se zapojilo více než 17 000 pacientů s RS [5]. Studie sbírala data o práceschopnosti a příznacích, které u nemocných s RS ovlivňují kvalitu života. Bylo zjištěno, že 30 % pacientů, kteří na škále EDSS dosáhli hodnoty 2, ztrácí práceschopnost, přestože ještě nemají výraznou disabilitu. Mezi hlavními příčinami pacienti na prvním místě referovali únavu, dále problémy s kognicí a stres. Tyto symptomy v reálné praxi ve většině případů pozornosti lékařů unikají. „Bude nutné postihnout i tyto jemnější změny a tzv. invisible symptoms. Máme k tomu jednoduché testy, jako je měření rychlosti chůze, hodnocení jemné motoriky, testy kognice, škálovací systémy na únavu a depresi. Důležitou úlohu bude hrát i selfmonitoring se sdílením dat. Je to věc, která je v popředí u většiny chronických onemocnění, ale u RS zatím nejsme dostatečně připraveni,“ konstatovala docentka Horáková.
Paraklinická vyšetření
Mezi hlavní paraklinická vyšetření patří MR. V praxi je důležité zaznamenávat nejen výskyt a počet nových lézí, ale také hodnotit jejich objem. Protože je obtížné porovnávat výsledky z různých přístrojů a rezonančních technik, je maximální snahou zavedení softwaru ke sledování vývoje charakteru a morfologických změn lézí. Kupředu postupuje rozvoj metodiky a techniky měření objemu mozku a kvantifikace celkového a zejména regionálního objemu některých struktur, jako je thalamus, šedá hmota, corpus callosum, mícha a další. Stále více se mluví i o kombinaci měření různých regionů v mozku, protože z těchto měření je možné získat lepší přehled o patologii probíhajícího onemocnění. Následovat bude měření kortexu, čeká se ovšem na vývoj nových MR technik. V praxi se začíná stále více používat optická koherenční tomografie zobrazující změny na očním pozadí. Je to vyšetření velmi nadějné, protože je neinvazivní, bezkontaktní a trvá jen 10 minut. Přináší informace o vrstvě nervových vláken sítnice, oblasti hlavy optického nervu a případně o makulární tloušťce. Vyšetření je užitečné jednak pro diferenciální diagnostiku, jednak pro sledování bezpečnosti některých léků a v budoucnu bude jistě přínosem i pro monitoraci průběhu RS. Problémem je, že není hrazeno zdravotními pojišťovnami. „Poměrně dlouho jsme byli skeptičtí k tomu, že bychom mohli používat spolehlivý laboratorní marker. Zdá se však, že by to mohlo změnit stanovení koncentrace neurofilament, známé už od 90. let minulého století. Neurofilamenta tvořená tripletem lehkých, středních a těžkých řetězců tvoří základní bílkovinu cytoskeletu neuronu a uvolňují se při axonálním postižení. Míru axonální patologie signalizuje hodnota neurofilament v séru a likvoru, kterou lze novými laboratorními metodami i ve velmi malých koncentracích stanovit,“ řekla docentka Horáková a připomněla i nutnost sběru dat a výsledků všech vyšetření do jedné databáze, na což je třeba myslet také při zavádění nových metod.
„Závěrem je možné shrnout, že nová diagnostická kritéria neznamenají pro české neurology žádnou velkou revoluci, protože vyšetření likvoru jsme v praxi vždy používali. Akceptace oligoklonálních pásů, symptomatických i kortikálních lézí a důraz na novou klasifikaci se zohledněním MR bude jistě pro pacienty s RS přínosem. Klíčovou roli hraje rovněž monitorace nemoci. Stále se rozšiřuje paleta klinických vyšetření v ambulancích, ale monitoraci RS bude zlepšovat i selfmonitoring, na který se musíme připravit. Zlepšení diagnostiky závisí také na rozvoji technik pro zobrazení patologie v oblasti kortexu, kvantifikaci lézí a celkové, respektive regionální atrofie,“ uzavřela svoji přednášku docentka Horáková.
Časné zahájení a eskalace léčby RS v kontextu dlouhodobých dat
Po docentce Horákové se slova ujal MUDr. Marek Peterka, vedoucí lékař RS centra při Neurologické klinice LF UK a FN v Plzni. Ve svém sdělení se soustředil na argumenty pro včasné zahájení terapie u pacientů s RS.
„Invalidita je slovo, které by nás mělo enormně zajímat, protože se musíme snažit jejímu rozvoji u našich pacientů zabránit. Pro někoho může invalidita znamenat jen motorický deficit, ale je potřeba ho vnímat v širším kontextu, včetně poruch senzorických i kognitivních funkcí. Všechny tyto poruchy vydělují nemocné z pracovního procesu i z běžného života. Příčinou je zánět vedoucí k demyelinizaci a axonálnímu poškození, které je hlavním problémem úzce spjatým s invaliditou čili disabilitou. Původní domněnka, že k axonálním ztrátám vede chronický zánět a dochází k nim až v pokročilé fázi RS, se nepotvrdila. Z práce publikované již v roce 1998 víme, že k axonálním ztrátám a k nastartování degenerativních procesů dochází už na počátku onemocnění. Nejvíce ke ztrátám axonů dochází v ložiscích aktivního zánětu, tzv. plakách, kde je možné v jednom mm3 detekovat více než 11 000 axonálních lézí,“ zahájil svoji přednášku MUDr. Peterka. Pacienty s RS postihuje významná mozková atrofie pohybující se během jednoho roku v rozmezí 0,6‒1,35 %, zatímco zdravý jedinec přichází za stejnou dobu jen o 0,1‒0,3 % mozkové tkáně. Jak ztráta axonů, tak mozková atrofie jsou ireverzibilní a regenerační pochody, které současná medicína není schopna terapeuticky ovlivnit. Je tedy žádoucí chovat se protektivně.
Dvě fáze RS z hlediska progrese disability
Progrese disability je předvídatelná a zdokumentovaná
v několika klinických studiích. Lze například jmenovat
práci Evidence for a two stage
disability progression in multiple sclerosis [6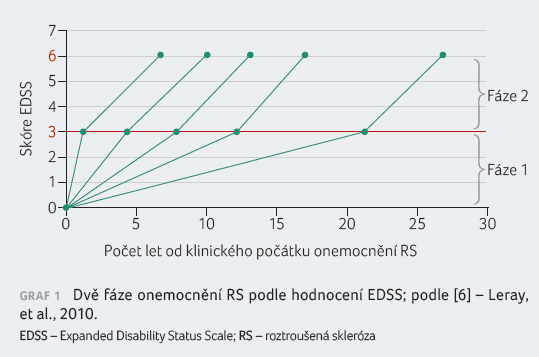 ], která
k posouzení tíže disability při RS používá škálu EDSS
s několika milníky (graf 1). Tím prvním je EDSS 3, který můžeme považovat
za středně těžkou invaliditu. Dalším milníkem je EDSS 6
představující již invaliditu těžkou, kdy pacient potřebuje
k tomu, aby ušel 100 metrů, jednostrannou oporu. Práce
ukazuje, že trvání první fáze od začátku onemocnění
do dosažení EDSS 3 je velmi individuální, závislá
na fenotypu onemocnění a na řadě dalších
faktorů. Může trvat několik roků až několik desítek let. Vliv
na prodloužení této fáze má včas zahájená léčba. Druhá
fáze progrese od EDSS 3 do dosažení EDSS 6 probíhá
u všech pacientů téměř stabilně a trvá přibližně
šest let. Tato fáze už je terapeuticky jen velmi obtížně
ovlivnitelná.
], která
k posouzení tíže disability při RS používá škálu EDSS
s několika milníky (graf 1). Tím prvním je EDSS 3, který můžeme považovat
za středně těžkou invaliditu. Dalším milníkem je EDSS 6
představující již invaliditu těžkou, kdy pacient potřebuje
k tomu, aby ušel 100 metrů, jednostrannou oporu. Práce
ukazuje, že trvání první fáze od začátku onemocnění
do dosažení EDSS 3 je velmi individuální, závislá
na fenotypu onemocnění a na řadě dalších
faktorů. Může trvat několik roků až několik desítek let. Vliv
na prodloužení této fáze má včas zahájená léčba. Druhá
fáze progrese od EDSS 3 do dosažení EDSS 6 probíhá
u všech pacientů téměř stabilně a trvá přibližně
šest let. Tato fáze už je terapeuticky jen velmi obtížně
ovlivnitelná.
Tato zjištění podporuje i studie autorů Confavreuxa a kol. [7], která jako milníky označila EDSS 4 a 6, ale prakticky ukazuje to samé, tedy že u pacientů s RR RS dochází, na rozdíl od progresivních forem, k velmi pozvolnému rozvoji disability. Druhá fáze se pro obě skupiny téměř neliší. I z této studie vyplývá zásadní poznatek, že léčbu je třeba zahájit či eskalovat již v první fázi onemocnění.
Na základě analýz více populačních skupin nemocných s přirozeným průběhem RR RS byla vytvořena časová osa progrese tohoto onemocnění. Hodnoty EDSS 3,0 na této ose dosáhlo 50 % pacientů za 6‒9 let od diagnostiky CIS, EDSS 4,0 za 12 let, EDSS 6,0 za 16‒17 let a EDSS 7,0 za 20‒30 let. Milníkem je přibližně období 10 let od prvních symptomů RS, kdy polovina nemocných s RR RS vstupuje do sekundárně progresivní formy RS (SP RS). „Léčbu je optimální zahájit nebo eskalovat v okamžiku, kdy je otevřeno terapeutické okno, tedy v okamžiku diagnostiky CIS nebo časné formy RR RS s nepříznivou prognózou. Jedním z hlavních nepříznivých prognostických faktorů je pak aktivita na MR. Účinnost léčby indikované v pozdějších stadiích RS významně klesá a disabilita v průběhu času významně roste,“ upozornil MUDr. Peterka.
Prediktivní faktory konverze klinicky izolovaného syndromu do klinicky definitivní RS
Vyšetření počtu lézí na MR je důležitým prediktorem konverze CIS do klinicky definitivní RS (clinically definite multiple sclerosis, CDMS) potvrzeným klinickými studiemi. Již jedna léze je významným prediktorem rizika, které většinou znamená vznik další klinické ataky. Z výsledků studií rovněž plyne, že má smysl léčit CIS léky první linie, protože lze redukovat konverzi CIS do CDMS,“ uvedl MUDr. Peterka. Tento závěr byl učiněn na základě výsledků tříleté registrační studie CHAMPIONS [8] porovnávající vliv placeba a interferonu beta 1a na redukci vzniku CDMS. Léčba interferonem zredukovala vznik CDMS o 51 %. Studie měla i prodlouženou pětiletou fázi, v níž byli pacienti původně randomizovaní do ramene s placebem převedeni na léčbu interferonem beta 1a. Pacienti randomizovaní do ramene s interferonem v léčbě dále pokračovali. Ve skupině s včasnou léčbou byl i nadále vidět velký rozdíl v redukci CDMS proti skupině s léčbou opožděnou. Rozdíl dosáhl 43 % a po 10 letech trvání studie 40 %. Znamená to tedy, že efekt včasné léčby dlouhodobě přetrvává a pacienti z něj mají prospěch. Je to jeden z dalších argumentů, proč léčbu zahájit již v okamžiku CIS.
Algoritmus léčby klinicky izolovaného syndromu a relabující remitující RS
Abychom zabránili disabilitě, je kromě včasného zahájení léčby důležité současně monitorovat stav pacienta, aby bylo možné v případě nutnosti včas terapii eskalovat. Rozhodovací algoritmus pro léčbu pacientů s RS je uveden na obrázku 1.
V tomto algoritmu stojí na jedné straně stabilizovaní nemocní s CIS a s nízkým rizikem konverze do CDMS či RR RS v první linii léčby, kteří jsou na MR i klinicky stabilní a nemají významné nežádoucí účinky. U nich o eskalaci neuvažujeme. Na straně druhé stojí skupina nestabilních pacientů, kteří mají vysoký počet atak a progredující onemocnění, ti by měli být eskalováni do vyšší linie léčby co nejdříve. Uprostřed algoritmu stojí nejsložitější skupina nemocných s nežádoucími účinky, které pro ně nejsou přijatelné, a to i přes jejich maximální ovlivnění podpůrnou léčbou, se špatnou adherencí. U nich bychom měli léky první linie změnit. Pokud se ovšem přidává i suboptimální odpověď na léky první linie, je potřeba zvážit eskalaci do vyšší linie. O eskalaci je potřeba uvažovat i v případě, že četnost relapsů je při stávající léčbě nezměněna nebo je její snížení neuspokojivé. Dále pokud dochází u pacienta k rychlé deterioraci intelektu a fyzického stavu. „O eskalaci lze uvažovat i při přetrvávající aktivitě onemocnění na MR, a to i přes absenci klinických relapsů. Bohužel dnešní úhradová kritéria toto doporučení zcela ignorují. Přitom platí, že časná a dobře zvolená změna léčby je výhodná pro pacienta, zejména pro pacienta se špatnou prognózou,“ upozornil MUDr. Peterka. Eskalovat lze na základě úhradových kritérií Státního ústavu pro kontrolu léčiv (SÚKL). Pro eskalaci máme k dispozici dvě skupiny léků schopných ovlivnit průběh onemocnění (disease modifying drugs, DMDs). Po jedné těžké či středně těžké atace při léčbě první linie lze eskalovat do skupiny DMDs s pracovním názvem léky 1,5. linie (dimetylfumarát, fingolimod). Při dvou atakách za rok při terapii léky první linie lze eskalovat do DMDs druhé linie (natalizumab, alemtuzumab a nejnovější perorální kladribin).
„Cílem léčby pacientů s RS by mělo být dosažení konceptu NEDA 4, tedy pacient v plné remisi. Tento koncept přináší mnohá úskalí, zejména v hodnocení úbytku mozkové tkáně, ale je potřeba si klást vyšší cíle. Osobně věřím, že se nám podaří úskalí hodnocení atrofie překonat. Současná terapeutická paleta obsahuje více než deset DMDs k léčbě RS a další účinnější látky přicházejí. Některé jsou již v klinických studiích a během krátké doby budou k dispozici. Už teď je ale možné každého nemocného léčit individuálně. Neměli bychom zapomínat naše pacienty rovněž edukovat a respektovat jejich názory. I v léčbě RS, stejně jako v medicíně, platí primum non nocere. V případě RS to však neznamená, že budeme čekat a nebudeme nic dělat. Právě naopak, měli bychom dělat vše pro dosažení co nejrychlejší remise nemoci,“ rozloučil se s posluchači MUDr. Peterka.
Když už léčba DMD nestačí aneb Péče o pacienty s progresí
Současné možnosti intervence v různých etapách vývoje RS doplnila svou přenáškou primářka MUDr. Olga Zapletalová z RS centra při Neurologické klinice FN v Ostravě. Jak sama v úvodu poznamenala, úkol připravit sdělení na téma péče o pacienty s progresí byl velmi obtížný, protože na rozdíl od stále se rozvíjejících možností diagnostiky a včasné léčby RS nemá medicína v případě progresivních forem RS velký terapeutický potenciál. Na druhou stranu se péče o pacienta v progresi dotýká celé řady oblastí, které není jednoduché během jednoho sdělení postihnout.
Roztroušená skleróza má několik typů, z nichž nejčastější je CIS a RR RS. Pro progresivní formy, ať již primárně, nebo sekundárně, je společné postupné narůstání neurologického deficitu a s tím spojené disability. U primárně progresivní formy již po zjištění prvotních symptomů nedochází k remisi a stav nemocného se pomalu nebo rychle, ale vždy trvale zhoršuje. Sekundárně progresivní forma nastává po fázi RR, při níž se ataky střídají s obdobím remisí. Primárně progresivní forma RS postihuje přibližně 10‒15 % případů. Léčba CIS a RR RS probíhá podle úhradové vyhlášky a podle odborných doporučení. U progresivních průběhů RS jsou léčebné možnosti omezené a převažuje léčba symptomatická. (Pozn. red.: Pro terapii primárně a sekundárně progresivní formy RS byl v závěru roku 2017 v EU schválen rovněž ocrelizumab, v ČR zatím není stanovena úhrada.)
Patogeneze progresivního postižení
„Pochopení mechanismu vzniku RR RS vedlo k rozvoji imunomodulační léčby, jejíž účinnost je ověřena mnohaletou klinickou zkušeností. Interferony spolu s dalšími DMDs se na našem pracovišti používají již 21 let, v poslední době s možností eskalace do druhé linie léčby. Včasnou terapií dokážeme sekundární progresi oddálit, přesto část nemocných do této fáze dospěje,“ uvedla primářka Zapletalová. Hlavní rozdíl v etiopatogenezi progresivních forem RS spočívá v tom, že zánětlivý proces probíhá za uzavřenou hematoencefalickou bariérou, je difuzní a nepřístupný, či jen minimálně přístupný protizánětlivé terapii. Progresivní formy se současně vykazují minimální účastí zánětu, ale velkou ztrátou mozkové tkáně. Neuropatolog profesor Lassman v roce 2012 označil jako hlavního původce rozvoje demyelinizace a neurodegenerace oxidativní stres. Při něm dochází k poškození mitochondrií, což vede k jejich následnému energetickému selhání a k ovlivnění integrity a funkce axonů. Mitochondriální změny v neuronech probíhají nezávisle na zánětu. Na procesu axonální degenerace se podílí i porucha homeostázy kalcia a iontová dysbalance v axonech a neuronech. Při procesu demyelinizace se uvolňuje intracelulární železo akumulované v mikrogliích a oligodendrocytech. Zvyšující se množství železa a jeho reaktivních kyslíkových sloučenin rovněž způsobuje poškození mozkové tkáně a atrofii. Ve chvíli, kdy se funkční axonální rezervy CNS vyčerpají, začne progredovat nevratné neurologické postižení.
Postižení bílé i šedé hmoty
Progresivní změny postihují jak bílou, tak šedou hmotu mozkovou. „V bílé hmotě infiltruje spektrum zánětlivých buněk leptomeningy přes subpiální kortikální demyelinizaci. Studie MR zobrazení prokazují sníženou permeabilitu hematoencefalické bariéry a reflektují uzavření zánětu za relativně intaktní hematoencefalickou bariéru. Imunitní pochody ukryté za touto bariérou jsou postiženy nedostatkem energie a klíčovou pro celý proces je i dysfunkce membránových kanálů. Prozánětlivých pochodů a tvorby autoprotilátek proti myelinu se účastní též B lymfocyty. Axonální postižení je pak důsledkem difuzního chronického zánětu bílé hmoty s redukcí myelinu. Demyelinizace v šedé hmotě se v průběhu RS zvyšuje a u progresivního typu převažuje nad postižením bílé hmoty. Kortikální léze mohou být klíčové pro konverzi RR typu do SP fáze. Kortikální subpiální léze formou kortikální pásky jsou u chronických progresí typicky nezánětlivé a nemají imunoglobulinová depozita. Jsou však spojeny s meningeálním zánětem a s folikuly bohatými na B lymfocyty, jež korelují s kortikální atrofií a s klinickým nálezem. Poškození a následná atrofie míchy, a to nejen provazců, ale i šedé hmoty, maximálně ovlivňuje klinický stav, především prohlubování motorického postižení,“ vysvětlila primářka Zapletalová, která se zastavila u dvou minikazuistik. Obě referované pacientky se dlouhodobě léčí s diagnózou RR RS. U první pacientky došlo k rozvoji sekundární progrese s významnou atrofií šedé i bílé mozkové hmoty na MR a s typickým klinickým obrazem. Druhá pacientka, rovněž s významným nálezem atrofie mozku na MR, sekundární progrese zatím nedosáhla. Je bez relapsů, soběstačná, pracuje, EDSS 2,5, a může být i nadále léčena DMD (fingolimod). „Celková atrofie je dynamický proces, který začíná již v časných fázích RS. Neurologický deficit vzniká v závislosti na postižení bílé i šedé hmoty mozkové. Naším cílem by mělo být zabránit atrofii, tedy zahájit léčbu co nejdříve,“ zdůraznila primářka Zapletalová.
Možnosti léčení progresivní RS
Léčba progresivní fáze RS je zatím omezená a vědci se pokoušejí postihnout rozdílné patogenní mechanismy. Ve studiích se zkoušejí léky ovlivňující dysfunkci imunitního systému a léky používané u RR RS. Ovšem tyto studie zatím nezaznamenaly úspěch. Dále je možné cílit na metabolické abnormality spojené s mitochondriálním poškozením a na různé iontové kanály, antioxidanty, Na+ inhibitory a Ca2+ aktivátory, jako jsou antikonvulziva, glutamátové receptory a další. Zkoušeny jsou také neuroprotektivní léky nebo terapie podporující reparaci. V klinické praxi a v počátku chronické progrese, kdy jsou ještě jasné známky zánětu, je možné indikovat cytostatické imunosupresivní režimy – metotrexát, cyklofosfamid, azathioprin.
„V klinické praxi se snažíme s léčbou začít co nejdříve a případně ji eskalovat. Mohu potvrdit, že existují pacienti, kteří jsou u nás od roku 1996 včasně léčeni a průběh onemocnění má stále relabující remitující charakter. Jakmile se nemocný začne progresivně zhoršovat a také MR nález progreduje beze známek zánětlivé aktivity, je potřeba začít s pacientem mluvit o tom, že je nutné léčbu ukončit, protože mu již neprospívá, je neúčinná a nese s sebou množství nežádoucích účinků. Nejdříve musíme přesvědčit sami sebe a pak pacienta. Ukončení léčby DMD řeší také úhradová vyhláška, která je v tomto jednoznačná. Můžeme ještě zkusit některé z imunosupresiv, například cyklofosfamid nebo rituximab (off label). Musíme se připravit na to, že u pacienta nastane psychologický zlom, bude se bránit nebo hroutit a objíždět jiná pracoviště. Po vysazení DMD zbývá symptomatická terapie zahrnující antispastickou léčbu, antidepresiva, fampridin, vitamin D, případně kortikoidy. Součástí péče je i doporučení vhodných zdravotnických pomůcek a sociální i psychologické péče. Velmi důležitá je rehabilitace a udržování fyzické i psychické kondice nemocného,“ řekla primářka Zapletalová a svoji přednášku zakončila slovy: „Léčba RS představuje obsáhlou knihu se stále ještě nedopsanými kapitolami. Roztroušenou sklerózu se snažíme zastavit včasnou léčbou, ale přesto nejsme v některých případech úspěšní. Nezbývá nám než se o naše pacienty maximálně starat a udělat vše pro to, aby kvalita jejich života byla co nejvíce přijatelná. Lék, který by RS zcela vyléčil, stále ještě intenzivně hledáme.“
Redakčně zpracovala PharmDr. Hana Šindelářová
Seznam použité literatury
- [1] McDonald WI, Compston A, Edan G, et al. Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis. Ann Neurol 2001; 50: 121–127.
- [2] Polman CH, Reingold SC, Banwell B, et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann Neurol 2011; 69: 292–302.
- [3] Thompson AJ, Banwell BL, Barkhof F, et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2017 Dec 21; doi: 10.1016/S1474‑4422(17)30470‑2 [Epub ahead of print]
- [4] Lublin FD. New multiple sclerosis phenotypic classification. Eur Neurol 2014; 72(Suppl 1): 1–5.
- [5] Kobelt G, Thompson A, Berg J, et al. New insights into the burden and costs of multiple sclerosis in Europe. Mult Scler 2017; 23: 1123‒1136.
- [6] Leray E, Yaouanq J, Le Page E, et al. Evidence for a two‑stage disability progression in multiple sclerosis. Brain 2010; 133: 1900–1913.
- [7] Confavreux C, Vukusic S, Moreau T, Adeleine P. Relapses and Progression of Disability in Multiple Sclerosis. N Engl J Med 2000; 343: 1430–1438.
- [8] Kinkel RP, Kollman C, O’Connor P, et al. CHAMPIONS Study Group. IM interferon beta‑1a delays definite MS 5 years after a first demyelinating event. Neurology 2006; 66: 678–684.
- [9] Gallo P, Van Wijmeersch B, ParadiqMS Group. Overview of the management of relapsing‑remitting multiple sclerosis and practical recommendations. Eur J Neurol 2015; 22(Suppl 2): 14–21.