Sitagliptin
Sitagliptin je prvním registrovaným zástupcem ze skupiny inhibitorů dipeptidyl peptidázy 4 (DDP-4) v České republice. Inhibitory DPP-4, někdy označované jako gliptiny, jsou novou skupinou perorálních antidiabetik využívající léčebný potenciál aktivních forem inkretinů (GLP-1 a GIP) k terapii diabetu 2. typu. Inhibicí DPP-4 vede sitagliptin ke zvýšení hladin GLP-1 i GIP. Tím zesiluje a prodlužuje účinek GLP a GIP, které společně působí na zvýšení glukózou stimulované sekrece inzulinu. GLP-1 navíc snižuje hladinu glukózy zpomalením vyprazdňování žaludku a inhibicí sekrece glukagonu. V klinických hodnoceních byla prokázána nejen účinnost sitagliptinu, vyjádřená redukcí glykovaného hemoglobinu, ale i příznivé ovlivnění funkce -buněk, dobrá tolerance preparátu a neutrální vliv na hmotnost léčených osob. Cenný je také komplementární terapeutický účinek sitagliptinu s metforminem, prokázaný experimentálně i klinickou efektivitou kombinační léčby. Uvedené vlastnosti činí sitagliptin perspektivní látkou zejména pro kombinační léčbu pacientů s diabetem 2. typu.
Úvod
Pro léčbu diabetu 2. typu v současné době je k dispozici několik terapeutických možností, přesto řada nemocných s tímto onemocněním nedosahuje cílových hodnot kompenzace nebo není schopna tyto hodnoty dlouhodobě udržet. Tento stav je zčásti zapříčiněn progresivním charakterem dysfunkce b-buňky pankreatu, dále ovšem i nežádoucími účinky stávajících léčiv (např. zažívací obtíže, s léčbou spoje-ný vzestup hmotnosti), ale také omezením možnosti užití těchto léčiv u některých nemocných (pacienti se selháním srdce či ledvin). Klinické výsledky dosavadních léčebných modalit svědčí pro potřebu nových léčivých přípravků určených pro terapii diabetu 2. typu.
Primárním regulačním mechanismem syntézy inzulinu a jeho sekrece v b-buňce pankreatu je koncentrace okolní glukózy. Sekrece inzulinu je ovšem také modulována peptidovými hormony vylučovanými z endokrinních buněk gastrointestinálního traktu. Fyziologický koncept předpokláda-jící existenci látek produkovaných střevem v návaznosti na příjem potravy a ovlivňujících sekreci inzulinu z pankreatu byl navržen již v roce 1902 [1]. Pojem inkretiny po-užitý k označení těchto látek se objevuje v literatuře v roce 1929 [2], tedy dlouhou dobu předtím, než se podařilo tyto substance skutečně izolovat. V roce 1986 byl kvantifikován účinek inkretinů, tzv. inkretinový efekt, měřením, které prokázalo, že glukóza podaná perorálně stimuluje výraznější vzestup inzulinové sekrece z b-buněk pankreatu než intravenózní infuze glukózy, která dosáhne stejného průběhu hladin glykémie [3, 4].
Prvním zjištěným inkretinem byl „na glukóze závislý inzulinotropní peptid" (GIP) [5, 6]. Další identifikovanou látkou inkretinové povahy byl glukagonu podobný peptid 1 (GLP-1) [7].
Z hlediska kvantity účinku jsou GIP a GLP-1 nejvýznamnějšími inkretiny, jejich působení na zvýšení glukózou stimulované sekrece inzulinu se sčítá a kvantitativně v podstatě odpovídá plnému inkretinovému efektu [8, 9].
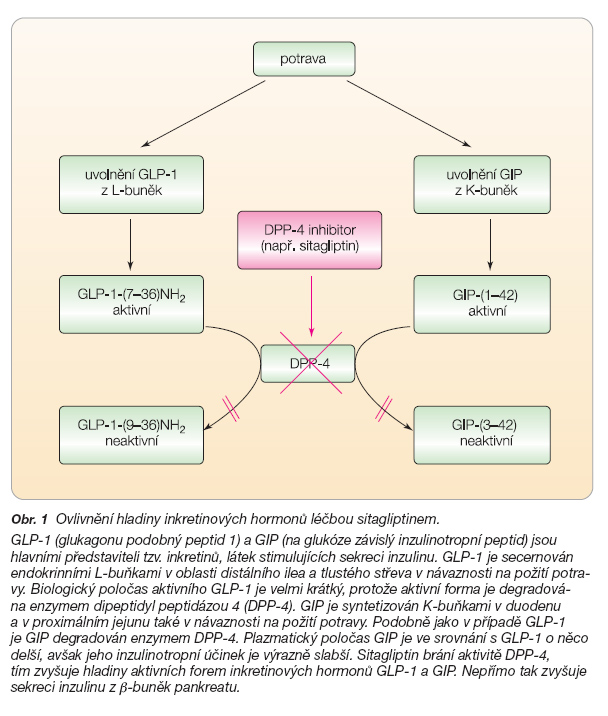
GLP-1 je secernován endokrinními L-buňkami v oblasti distálního ilea a tlustého střeva v návaznosti na požití smíšené stravy nebo jednotlivých živin (glukózy nebo tuku). GLP-1 je in vivo uvolňován z L-buněk v několika formách, ale dominuje aktivní forma GLP-1-(7–36)NH2 [10]. U lidí ve stavu nalačno jsou plazmatické hladiny intaktního, tedy aktivního GLP-1 v rozsahu 5–10 pmol/l a stoupají na úroveň cca 50 pmol/l postprandiálně. Biologický poločas aktivního GLP-1 je ovšem velmi krátký (~1–2 minuty) a je podmíněn vysokou aktivitou enzymu dipeptidyl peptidázy 4 (DPP-4), který katalyzuje odštěpení dipeptidu v pozici 2 Ala a aktivní for-mu takto velmi rychle degraduje. Produkt této reakce GLP-1-(9–36)NH2, který je biologicky inaktivní, je v plazmě hojněji zastoupen než aktivní GLP-1-(7–36)NH2 a v poměrném vyjádření odpovídá za více než 75 % cirkulujícího GLP-1 detekovaného imunoesejemi [11].
GLP-1 v b-buňkách pankreatu působí zvýšení glukózou stimulované inzulinové sekrece [12]. GLP-1 působí nejen na sekreci inzulinu, ale navíc zvyšuje trans-kripci genu pro inzulin, stabilitu mRNA a biosyntézu inzulinu, čímž zajišťuje doplňování inzulinu do granulí a brání vyčerpání rezerv inzulinu intracelulárně [13, 14].
Důkaz, že GLP-1 zvyšuje v b-buňkách expresi komponent, které zajišťují senzitivitu b-buněk na glukózu (glukózových trans-portérů a glukokinázy), může částečně vysvětlit příznivý efekt GLP-1 na citlivost b-buněk vůči glukóze [15, 16].
GLP-1 inhibuje sekreci glukagonu a naopak stimuluje sekreci somatostatinu. I bazální hladiny GLP-1 jsou významným regulátorem hladin glukózy nalačno, protože i velmi nízké hladiny GLP-1 zajišťují tonický inhibiční efekt na a-buňky produkující glukagon [17]. Inzulinotropní a glukagonostatický efekt GLP-1 je závislý na hladině glukózy [18, 19]. Pokud dojde k poklesu hladin glukózy, GLP-1 již dále nestimuluje sekreci inzulinu ani neinhibuje sekreci glukagonu, a tak je redukováno riziko vzniku hypoglykémie [19].
GLP-1 dále inhibuje sekreci HCl v žaludeční sliznici a vyprazdňování žaludku – toto působení je závislé na vagové inervaci a uplatňuje se zde účinek GLP-1 v CNS i na periferii [20].
Inhibiční vliv GLP-1 na příjem potravy může být zprostředkován přímým vlivem na centra v hypotalamu, která modulují chování jedince ve vztahu k potravě, ale i nepřímo prostřednictvím reflexních drah z gastrointestinálního traktu [21–24].
GLP-1 tedy navíc působí na snížení hladin glukózy kromě inkretinového efektu (potenciace glukózou stimulované inzulinové sekrece) též neinkretinovými efekty: inhibicí vyprazdňování žaludku a inhibicí sekrece glukagonu.
GIP (na glukóze závislý inzulinotropní peptid), druhý významný inkretinový hormon, je syntetizován K-buňkami v duodenu a proximálním jejunu v návaznosti na požití glukózy nebo tuku v biologicky aktivní formě GIP-(1–42). Bazální hladiny GIP-(1–42) se pohybují v rozmezí 0,06–0,1 nmol/l a postprandiální vzestupy dosahují hodnot 0,2–0,5 nmol/l [25].
Poločas biologicky aktivního GIP-(1–42) je asi 7 minut u zdravých osob a 5 minut u osob s diabetem 2. typu [26].
GIP-(1–42) je taktéž substrátem pro DPP-4, která odštěpením dipeptidu vytvoří inaktivní fragment GIP-(3–42). Srovnání hladin intaktního GIP-(1–42) a celkového GIP ukázalo, že množství intaktního GIP dosahuje cca 40 % celkových hladin. Ve srovnání s GLP-1 je tedy GIP méně náchylný k degradaci DPP-4, čemuž odpovídá i delší biologický poločas [26].
GIP působí v b-buňce, stejně tak jako GLP-1, zvýšení glukózou stimulované inzulinové sekrece [27]. GIP také zvyšuje tran-skripci genu pro inzulin a stimuluje biosyntézu inzulinu [28]. Receptory pro GIP se ovšem nacházejí i na osteoblastech, v nichž působení GIP vede ke zvýšení hladin alkalické fosfatázy a mRNA pro kolagen typu I, tedy k procesům formace kostní hmoty [29]. V žaludku působily suprafyziologické dávky GIP inhibici sekrece HCl. Od tohoto pozorování byl odvozen původní název GIP – gastrický inhibiční peptid [30].
U nemocných s nedostatečnou kompenzací diabetu 2. typu a s elevací glykémie má GIP omezený inzulinotropní efekt vlivem poruchy na intracelulární úrovni [31]. Zcela nedávné výzkumy ovšem nasvědčují tomu, že tato porucha účinku částečně odeznívá při zlepšení kompenzace diabetu, a lze očekávat, že GIP bude nadále studovanou látkou s potenciálním příznivým efektem na sekreci inzulinu.
Inzulinotropní efekt GLP-1 je u nemocných s diabetem 2. typu zachován i při vyšších glykémiích a v kvantitativním hodnocení GLP-1 odpovídá za většinu inkretinového efektu na pankreatické b-buňky. Farmakologické podání GLP-1 v experimentu snížilo hladinu glukózy u nemocných s diabetem 2. typu na úroveň zdravých osob a tento efekt byl zřetelný po celou dobu podávání GLP-1.
Léčebné využití vlastního GLP-1 je ovšem výrazně limitováno jeho rychlou inaktivací pomocí enzymu dipeptidyl peptidázy 4 (DPP-4) a tedy velmi krátkým eliminačním poločasem (~1–2 min.). GLP-1 by proto musel být podáván kontinuálně v infuzi, což není vhodné pro léčbu chronického onemocnění, jakým je DM 2. typu. Výzkum směřující k využití terapeutického potenciálu GLP-1 vedl k vývoji látek, které napodobují účinky GLP-1 (inkretinová mimetika), a látek, které prodlužují aktivitu endogenního GLP-1 (inhibitory dipeptidyl peptidázy 4) [32].
Enzym DPP-4 specificky odštěpuje dipeptidy z N-konce peptidů či proteinů, které obsahují alanin nebo prolin v předposlední pozici. DPP-4 v organismu degraduje kromě GLP-1 a GIP ještě i řadu dalších proteinů (GHRH, peptid YY, substanci P, neuropeptid Y a některé chemokiny), avšak inhibice DPP-4 pomocí gliptinů nevede ke klinicky významným změnám ve fyziologických procesech spojených s těmito proteiny.
Sitagliptin tedy inhibicí DPP-4 působí zvýšení hladin aktivních forem GLP-1 i GIP a tím zesílení a prodloužení účinku obou peptidů (obr. 1).
Mechanismus účinku
Sitagliptin je kompetitivní, reverzibilní a vysoce selektivní inhibitor dipeptidyl peptidázy 4 (DPP-4) (IC50=17 nmol/l, Ki = 9 nmol/l), a nikoli jiných příbuzných pepti-dáz DPP-8 a DPP-9 (IC50 > 50 mmol/l). Jde o velmi důležitou vlastnost, protože látky, které působí inhibici DPP neselektivně, vykazují vysokou míru toxicity právě prostřednictvím blokády DPP-8 a DPP-9.
U zvířecího modelu štíhlých myší vedlo jednotlivé podání sitagliptinu, ve zvyšují-cím se dávkování od 0,1 mg/kg p.o. do 3,0 mg/kg p.o., k redukci hladin glykémie sledované glukózovým tolerančním testem (oGTT), který po podání sitagliptinu navazoval, v závislosti na podané dávce sita-gliptinu, od 23 % do 55 %. Při nejvyšší podané dávce 3 mg/kg, která odpovída-la vrcholové koncentraci cca 600 nmol/l sitagliptinu, bylo dosaženo cca 96% inhibice DPP-4 a dvoj- až trojnásobného zvýšení hladin biologicky aktivní formy GLP-1-(7–36)NH2. Vzestup hladin GLP-1 byl analogický modelu pozorovanému u myší s deficitem aktivity DPP-4.
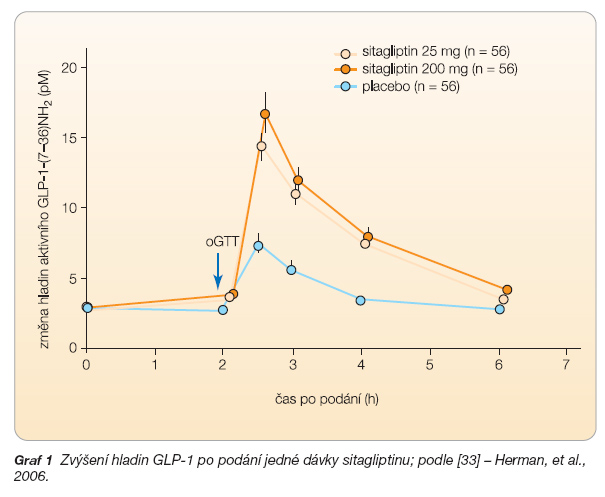
Sitagliptin byl již v rámci klinického zkoušení fáze 1 sledován v randomizované, placebem kontrolované studii za použití cross-over designu u 56 nemocných s diabetem 2. typu léčených dietou k posouzení efektivity a tolerance podání jednotlivé dávky. Sledované osoby dostávaly jednotlivé dávky 25 mg nebo 200 mg sitagliptinu nebo placebo. Po nočním lačnění nemocný užil dávku medikace a v odstupu 2 hodin následovalo provedení oGTT. Sitagliptin byl velmi dobře tolerován a byl spojen se signifikantním snížením glykemických exkurzí po provedeném oGTT: vzestup AUC glukózy byl redukován cca o 22 % (p < 0,001) u dávky 25 mg a o 26 % (p < 0,001) u dávky 200 mg sitagliptinu ve srovnání s placebem. Podání obou dávek vedlo ke dvojnásobnému vzestupu hladin aktivního GLP-1 a taktéž ke vzestupu poměru mezi hladinami aktivního a celkového GLP-1 ve srovnání s placebem (p < 0,001) (graf 1).
Podání dávek 25 mg a 200 mg sitagliptinu vedlo ke vzestupu AUC inzulinu v plazmě (22 % a 23 %, p < 0,001), ke vzestupu AUC C-peptidu (13 % a 21 %, p < 0,001) a k redukci AUC plazmatického glukagonu (o 8 %, p = 0,015) při léčbě dávkou 25 mg sitagliptinu a k redukci o 14 % (p < 0,001) při podávání dávky 200 mg sitagliptinu) [33].
Farmakokinetika
Farmakokinetika sitagliptinu byla stu- dována po podání jednotlivé dávky u zdravých osob i u nemocných s diabetem 2. typu. Sitagliptin podaný v dávce 100 mg per os je rychle absorbován s vrcholovými plazmatickými koncentracemi (medián tmax) v odstupu jedné až čtyř hodin po podání. Po podání této dávky byla maximální koncentrace cmax 950 nmol/l a poločas eliminace (t1/2) 12,4 hodin. Intraindividuální i interindividuální koeficienty variace pro sitagliptin jsou nízké (5,8 % a 15,1 %). Farmakokinetika sitagliptinu je obecně velmi podobná u zdravých i nemocných osob s DM 2. typu.
Sitagliptin se vyznačuje po podání per os vysokou biologickou dostupností (cca 87 %), která není ovlivněna příjmem potravy. Zhruba 79 % sitagliptinu je z těla odstraněno ledvinami v nezměněné formě. Jen malá část sitagliptinu podléhá metabolismu prostřednictvím CYP 3A4 s přispěním CYP 2C8. Bylo detekováno celkem 6 metabolitů ve stopových množstvích a předpokládá se, že tyto metabolity nemají inhibiční efekt na DPP-4 [34].
Farmakokinetika sitagliptinu byla také posuzována u osob s různým stupněm renální nedostatečnosti a srovnávána se zdravými osobami jako kontrolní skupinou. U osob s mírnou renální insuficiencí (clearance kreatininu 50–80 ml/min) bylo patrné 1,1–1,6násobné zvýšení AUC sitagliptinu oproti zdravým osobám. Dávkování sitagliptinu u osob s mírnou renální insuficiencí tedy nemusí být redukováno. U osob se střední (clearance kreatininu 30–50 ml/min) či těžkou renální insuficiencí (clearance kreatininu < 30 ml/min) jsou plazmatické AUC sitagliptinu 2–4násobné ve srovnání se zdravými osobami, proto by byla nutná korekce dávek sitagliptinu u osob se střední a těžkou renální insuficiencí. Sitagliptin se ovšem v EU prozatím nedoporučuje používat u osob se střední nebo s těžkou renální nedostatečností, protože zkušenosti s léčbou těchto nemocných jsou příliš omezené.
U nemocných s jaterní insuficiencí byl sitagliptin podáván osobám s mírnou až středně těžkou poruchou jaterní funkce (Child-Pugh skóre ≤ 9). Výsledky farmakokinetiky sitagliptinu u těchto osob umožňují podávat tento preparát bez úpravy dávkování, tedy stejně jako u zdravé populace. U nemocných s těžkou jaterní nedostatečností (Child-Pugh skóre > 9) nejsou k dispozici žádné klinické zkušenosti. Vzhledem k tomu, že eliminace sitagliptinu probíhá převážně prostřednictvím ledvin, předpokládá se, že ani těžká jaterní insuficience nemění výrazněji farmakokinetiku sitagliptinu.
Z populační farmakokinetické analýzy studií fáze I a II vyplývá, že věk nemá na farmakokinetiku sitagliptinu klinicky významný vliv, a proto úprava dávkování podle věkové kategorie není nutná.
Interakce s jinými léčivými přípravky
Sitagliptin neinhibuje ani neindukuje izoenzymy CYP-450. V klinických studiích podání sitagliptinu neměnilo významně farmakokinetiku metforminu, glibenklamidu, simvastatinu, rosiglitazonu, warfarinu ani perorálních kontraceptiv. Sitagliptin má tedy velmi nízkou tendenci k interakcím se substráty CYP 3A4, CYP 2C8, CYP 2C9 a s organickým kationtovým trans-portérem.
Klinické zkušenosti
Klinická účinnost a bezpečnost sitagliptinu byla hodnocena ve studiích, kde tato účinná látka byla podávána buď v monoterapii, nebo v kombinaci s dalšími perorálními antidiabetiky (nejčastěji s metforminem nebo s thiazolidindiony).
Účinnost sitagliptinu v monoterapii v dávce 100 mg a 200 mg jednou denně byla posuzována ve studii trvající 24 týdnů. Na konci studie bylo dosaženo redukce glykovaného hemoglobinu (HbA1c) o 0,79 % při podávání sitagliptinu v dávce 100 mg/den a o 0,94 % při podávání sitagliptinu 200 mg/den ve srovnání s podáváním placeba. Sitagliptin příznivě ovlivnil funkci b-buněk posuzovanou pomocí HOMA indexu a poměru proinzulin/inzulin. Sitagliptin byl velmi dobře tole-rován a jeho podávání nevedlo ke vzestupu hmotnosti [35].
Další studií se sitagliptinem v monoterapii byl 18týdenní multicentrický projekt, do něhož bylo zařazeno 521 nemocných s DM 2. typu se vstupním HbA1c v rozsahu 7–10 %. Sitagliptin byl opět podáván v dávkách 100 mg a 200 mg jednou denně, které vedly k signifikantní redukci HbA1c a ke zlepšení funkčního stavu b-buněk (vyjádřeno HOMA-B indexem a poměrem proinzulin/inzulin). Podávání sitagliptinu nemělo v průběhu studie vliv na hmotnost nemocných a nevedlo ke vzniku závažných či signifikantních nežádoucích příhod. Účinnost a bezpečnost sitagliptinu 100 mg a 200 mg byla v podstatě srovnatelná. Dalším zajímavým výsledkem studie byl fakt, že nemocní s kratším trváním onemocnění diabetem (< 3 roky) dosáhli relativně většího poklesu v parametru HbA1c [36].
Byly taktéž provedeny studie, v nichž byl sitagliptin přidán do kombinační terapie za situace, kdy selhával účinek původního perorálního antidiabetika.
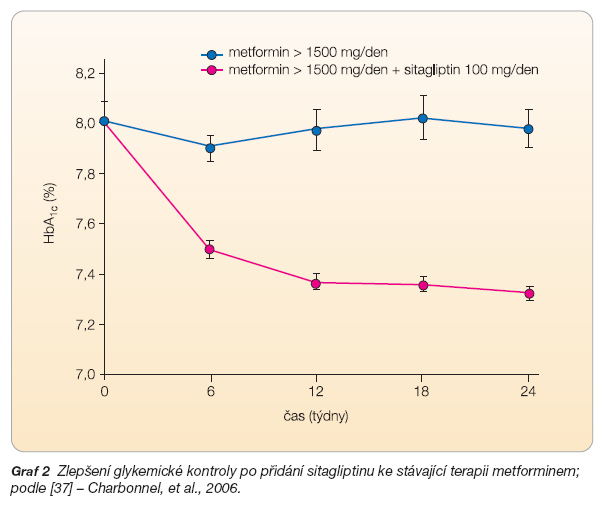
V první z těchto studií byl sitagliptin při-dán osobám s nedostatečnou kompenzací diabetu (průměrný HbA1c = 8 % dle DCCT), které doposud užívaly samostatný metformin v dávce nejméně 1500 mg. Přidání sitagliptinu po dobu 24 týdnů vedlo ke zlepšení kompenzace diabetu vyjádřené snížením HbA1c o 0,65 % (graf 2) [37].
V další studii byl sitagliptin přidáván do kombinační terapie nemocných, kteří nebyli dostatečně kompenzováni (vyjádřeno HbA1c v rozmezí 7–10 % dle DCCT) při monoterapii pioglitazonem podávaným nejméně 8–14 týdnů. V době randomizace všichni zařazení nemocní dostávali 30 mg nebo 45 mg pioglitazonu. Sitagliptin přidaný k pioglitazonu a podávaný po dobu 24 týdnů vedl k redukci HbA1c o 0,7 % a k redukci hladiny glykémie nalačno o 1 mmol/l. Nežádoucí účinky vedoucí k ukončení účasti ve studii byly mírně vyšší ve skupině léčené sitagliptinem (5,7 % vs. 1,1 %) [38].
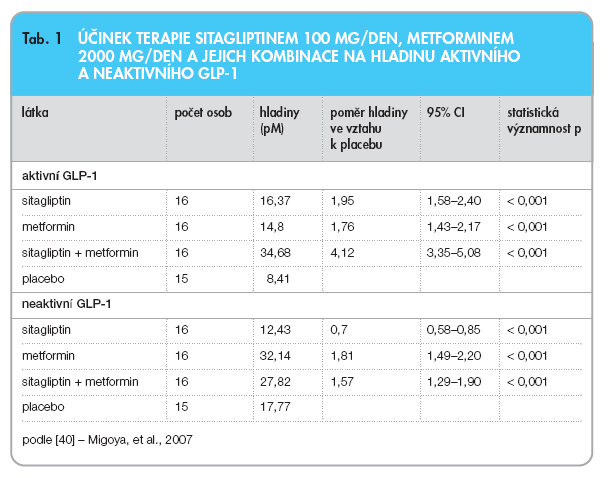
Účinky sitagliptinu v kombinaci s metforminem, ovšem ve formě zahajovací kombinační terapie pro pacienty s diabetem 2. typu, byly hodnoceny ve studii publikované zcela nedávno. 24týdenní podávání kombinační terapie sitagliptin/metformin bylo signifikantně efektivnější než po-užití jednotlivých látek v monoterapii. Průměrný vstupní HbA1c byl 8,8 % dle DCCT a léčba kombinací sitagliptin 100 mg s metforminem 2000 mg dosáhla redukce HbA1c o 2,07 %, zatímco metformin 2000 mg podávaný v monoterapii snížil glykovaný hemo-globin o 0,99 % a sitagliptin v dávce 100 mg denně redukoval HbA1c o 0,83 %. Četnost gastrointestinálních nežádoucích účinků byla u kombinační terapie sitagliptin s metforminem podobná jako u monoterapie metforminem [39]. Poněkud překvapivé výsledky týkající se účinnosti kombinace sitagliptinu s metforminem zjištěné v této klinické studii byly vysvětleny experimenty sledujícími hladiny aktivního a celkového GLP-1 po podání sitagliptinu, metforminu a jejich kombinace. Výsledky této experimentální práce prokázaly komplementární účinek sitagliptinu a metforminu na zvýšení hladin aktivního GLP-1. Metformin sám totiž zvyšuje hladiny aktivního i celkového GLP-1, což svědčí o jeho účinku na sekreci GLP-1 z L-buněk. Sitagliptin zvyšuje hladiny aktivního GLP-1 související s inhibicí degradace aktivního hormonu. Podávání kombinace metforminu a sitagliptinu vedlo k synergickému účinku na hladiny aktivního GLP-1 (tab. 1) [40].
Indikace a dávkování
Sitagliptin je indikován u nemocných s diabetem 2. typu s cílem zlepšit kontrolu glykémie v kombinaci s metforminem v případech, kdy úprava stravy a cvičení při současném užívání metforminu nezajis-tí dostatečnou kontrolu glykémie.
U pacientů s diabetes mellitus 2. typu, pro něž je užití agonisty PPAR-g (tj. thiazolidindionu) vhodné, je sitagliptin indikován v kombinaci s agonistou PPAR-g≥ v případech, kdy úprava stravy a cvičení v kom-binaci s agonistou PPAR-g nezajistí dostatečnou kontrolu glykémie.
Dávka sitagliptinu je 100 mg jednou denně. Je nutné zachovat dávkování metforminu nebo agonisty PPAR-g≥ a sitagliptin podávat souběžně.
Kontraindikace a nežádoucí účinky
Velkou výhodou sitagliptinu je vynikajicí bezpečnostní profil daný nízkou incidencí nežádoucích účinků. Jedinou kontraindikací podání sitagliptinu je hypersenzitivita na léčivou látku.
V 9 rozsáhlých klinických studiích, ve kterých dostávalo sitagliptin v dávce 100 mg denně více než 2700 nemocných, byly jako časté nežádoucí účinky (frekvence ≥ 1/100 a zároveň < 1/10) zaznamenány nevolnost a flatulence, jako méně časté (frekvence ≥ 1/1000 a zároveň < 1/100) bolest epigastria, průjem a hypoglykémie. Nízký výskyt hypoglykemických epizod při léčbě sitagliptinem lze vysvětlit závislostí inzulinotropního účinku GLP-1 na hladině glukózy. Účinek GLP-1 se uplatní při hladině glykémie > 5 mmol/l. Pokud se glykémie vrátí k normálním hodnotám, působení GLP-1 na sekreci inzulinu mizí, což je fenomén odlišný od účinku derivátů sulfonylurey, které indukují sekreci inzulinu nezávisle na glykémii. Z nežádoucích účinků hlášených s frekvencí 5 % a vyšší bez ohledu na příčinnou souvislost s podáním sita-gliptinu byly uváděny infekce horních cest dýchacích a nazofaryngitida.
Závěr
Sitagliptin má celou řadu výhod ve srovnání s ostatními skupinami léčiv, i přestože není účinnější ve vztahu k redukci HbA1c (snížení o 0,8–1,0 %) než jiná užívaná per-orální antidiabetika. Jeho velmi dobrá snášenlivost, neutrální vliv na hmotnost a bezpečnost užití u nemocných s renální či kardiální insuficiencí jej činí perspektivním preparátem [41]. Terapeuticky cenný je také komplementární účinek s metforminem, prokázaný experimentálně i klinickou efektivitou kombinační léčby sitagliptin + metformin na snížení HbA1c [39].
Seznam použité literatury
- [1] Bayliss WM, Starling EH. On the causation of the so-called “peripheral reflex secretion” of the pan-creas. Proc R Soc Lond 1902; 69: 352–353.
- [2] Zunz E, LaBarre J. Contributions a l´etude des variations physioloques de la secretion interne du pancreas: relations entre les secretions externe et interne du pancreas. Arch Int Physiol Biochim 1929; 31: 20–44.
- [3] Fehmann HC, Goke R, Goke B. Cell and molecular biology of the incretin hormones glucagon-like peptide 1 and glucose-dependent releasing polypeptide. Endocrine Rev 1995; 16: 390–410.
- [4] Kieffer TJ, Habener JF. The glucagon-like peptides. Endocr Rev 1999; 20: 876–913.
- [5] Dupre J, Ross SA,Watson D, Brown JC. Stimulation of insulin secretion by gastric inhibitory polypeptide in man. J Clin Endocrinol Metab 1973; 37: 826–828.
- [6] Elahi D, Andersen DK, Brown JC, et al. Pancrea-tic alpha- and beta-cell responses to GIP infu-sion in normal man. Am J Physiol 1979; 237: E185–E191.
- [7] Drucker DJ. The glucagon-like peptides. Diabetes 1998; 47: 159–169.
- [8] Nauck MA, Bartels E, Orskov C, et al. Additive insulinotropic effects of exogenous synthetic human gastric inhibitory polypeptide and glucagon-like peptide-1(7-36) amide infused at near-physiological insulinotropic hormone and glucose concentrations. J Clin Endocrinol Metab 1993; 76: 912–917.
- [9] Fehmann HC, Goke B, Goke R, et al. Synergistic stimulatory effect of glucagon-like peptide-(7-36) amide and glucose-dependent insulin relea-sing polypeptide on the endocrine pancreas. FEBS Lett 1989; 252: 109–112.
- [10] Orskov C, Rabenhoj L, Wettergren A, et al. Tissue and plasma concentrations of amidated and glycine-extended glucagon-like peptide I in humans. Diabetes 1994; 43: 535–539.
- [11] Deacon CF, Nauck MA, Toft-Nielsen M, et al. Both subcutaneously and intravenously administered glucagon-like peptide 1 are rapidly degraded from the NH2-terminus in type II diabetic patients and in healthy subjects. Diabetes 1995; 44: 1126–1131.
- [12] Kreymann B, Ghatei MA, Williams G, Bloom SR. Glucagon-like peptide-1 7-36: a physiological incretin in man. Lancet 1987; 2(8571): 1300–1304.
- [13] Skoglund G, Hussain MA, Holz GG. Glucagon-like peptide1 stimulates insulin gene promoter activity by protein kinase A- independent activation of the rat insulin I gene cAMP response element. Diabetes 2000; 49: 1156–1164.
- [14] Lawrence MC, Bhatt HS, Easom RA. NFAT regulates insulin gene promoter activity in response to synergistic pathways induced by glucose and glucagon-like peptide-1. Diabetes 2002; 51: 691–698.
- [15] Wang YH, Egan JM, Raygada M, et al. Glucagon-like peptide-1 affects gene transcription and messenger ribonucleic acid stability of components of the insulin secretory system in RIN 1046–38 cells. Endocrinology 1995; 136: 4910–4917.
- [16] Wang Y, Perfetti R, Greig NH, et al. Glucagon-like peptide-1 can reverse the age- related decline in glucose tolerance in rats. J Clin Invest 1997; 99: 2883–2889.
- [17] Schirra J, Sturm K, Leicht P, et al. Exendin -(9–39) amide is an antagonist of glucagon-like peptide-1(7–36) amide in humans. J Clin Invest 1998; 101: 1421–1430.
- [18] Goke R, Wagner B, Fehmann HC, Goke B. Glucose-dependency of the insulin stimulatory effect of glucagon-like peptide-1(7–36) amide on the rat pancreas. Res Exp Med (Berl) 1993; 193: 97–103.
- [19] Nauck MA, Heimesaat MM, Behle K, et al. Effects of glucagon-like peptide-1 on counter regulatory hormone responses, cognitive functions, and insulin secretion during hyperinsulinemic, stepped hypoglycemic clamp experiments in healthy volunteers. J Clin Endocrinol Metab 2002; 87: 1239–1246.
- [20] Imeryuz N, Yegen BC, Bozkurt A, et al. Glucagon-like peptide-1 inhibits gastric emptying via vagal afferent-mediated central mechanisms. Am J Physiol 1997; 273: G920–G927.
- [21] Toft-Nielsen MB, Madsbad S, Holst JJ. Continuous subcutaneous infusion of glucagons-like peptide-1 lowers plasma glucose and reduces appetite in type 2 diabetic patients. Diabetes Care 1998; 22: 1137–1143.
- [22] Flint A, Raben A, Astrup A, Holst JJ. Glucagon-like peptide 1 promotes satiety and suppresses energy intake in humans. J Clin Invest 1998; 101: 515–520.
- [23] Gutzwiller JP, Drewe J, Goke B, et al. Glucagon-like peptide-1 promotes satiety and reduces food intake in patients with diabetes mellitus type 2. Am J Physiol 1999; 276: R1541–R1544.
- [24] Naslund E, Barkeling B, King N, et al. Energy intake and appetite are suppressed by glucagon-like peptide-1 (GLP-1) in obese men. Int J Obes Relat Metab Disord 1999; 23: 304–311.
- [25] Pederson RA, Schubert HE, Brown JC. The insulinotropic action of gastric inhibitory polypeptide. Can J Physiol Pharmacol 1975; 24, 1050–1056.
- [26] Deacon CF, Nauck MA, Meier J, et al. Degradation of endogenous and exogenous gastric inhibitory polypeptide in healthy and in type 2 diabetic subjects as revealed using a new assay for the intact peptide. J Clin Endocrinol Metab 2000; 85: 3575–3581.
- [27] Gromada J, Bokvist K, Ding WG, et al. Glucagon-like peptide-1(7-36)amide stimulates exocytosis in human pancreatic beta-cells by both proximal and distal regulatory steps in stimulus-secretion coupling. Diabetes 1998; 47: 57–65.
- [28] Wang Y, Montrose–Rafizadeh C, Adams L, et al. GIP regulates glucose transporters, hexokinases, and glucose-induced insulin secretion in RIN 1046–38 cells. Mol Cell Endocrinol 1996; 116: 81–87.
- [29] Bollag RJ, Zhong Q, Phillips P, et al. Osteoblast-derived cells express functional glucose-depen dent insulinotropic peptide receptors. Endocrinology 2000; 141: 1228–1235.
- [30] Brown JC. A gastric inhibitory polypeptide I: the amino acid composition and the tryptic peptides. Can J Biochem 1971; 49: 255–261.
- [31] Nauck M, Stockmann F, Ebert R, Creutzfeldt W. Reduced incretin effect in type 2 (non-insulin-dependent) diabetes. Diabetologia 1986; 29: 46–52.
- [32] Drucker DJ. Enhancing incretin action for the treatment of type 2 diabetes. Diabetes Care 2003; 26: 2929–2940.
- [33] Herman GA, Bergman A, Stevens C, et al. Effect of single oral doses of sitagliptin, a dipeptidyl peptidase-4 inhibitor, on incretin and plasma glucose levels after an oral glucose tolerance test in patients with type 2 diabetes. J Clin Endocrinol Metab 2006; 91: 4612–4619.
- [34] Vincent SH, Reed JR, Bergman AJ, et al. Metabolism and excretion of the dipeptidyl peptidase 4 inhibitor [14C]sitagliptin in humans. Drug Metab Dispos 2007; 35: 533–538.
- [35] Aschner P, Kipnes MS, Lunceford JK, et al. Effect of dipeptidyl peptidase-4 inhibitor sitagliptin in monotherapy on glycemic control in patients with type 2 diabetes. Diabetes Care 2006; 29: 2632–2637.
- [36] Raz I, Hanefeld M, Xu L, et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor sitagliptin as monotherapy in patients with type 2 diabetes mellitus. Diabetologia 2006; 49: 2564–2571.
- [37] Charbonnel B, Karasik A, Liu J, et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor sitagliptin added to ongoing metformin therapy in patients with type 2 diabetes inadequately controlled with metformin alone. Diabetes Care 2006; 29: 2638–2643.
- [38] Rosenstock J, Brazg R, Andryuk PJ, et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor sitagliptin added to ongoing pio-glitazone therapy in patients with type 2 diabetes: A 24-week, multicenter, randomized, double-blind, placebo-controlled, parallel-group study. Clin Ther 2006; 28:1556–1568.
- [39] Goldstein BJ, Feinglos MN, Lunceford JK, et al. Effect of Initial Combination Therapy with Sita-gliptin, a Dipeptidyl Peptidase-4 Inhibitor, and Metformin on Glycemic Control in Patients with Type 2 Diabetes. Diabetes Care 2007; [Epub ahead of print] – PMID: 17485570.
- [40] Migoya E, Miller J, Larson P, et al. Sitagliptin, a Selective DPP-4 Inhibitor, and Metformin Have Complementary Effects to Increase Active GLP-1 Concentrations. Oral Presentation at 67th ADA Scientific Sessions, Chicago, 2007.
- [41] Nathan DM, Buse JB, Davidson MB, et al. Management of hyperglycemia in type 2 diabetes; a consensus algorithm for the initiation and adjustment of therapy.