Sorafenib
Současné možnosti systémové léčby nemocných s metastazujícím, recidivujícím nebo neresekabilním konvenčním karcinomem ledviny spočívají v aplikaci cytokinů (interleukinu-2, interferonu ) a nově v podávání multikinázových tyrozinkinázových inhibitorů. Klinický vývoj sorafenibu a jeho registrace Evropskou lékovou agenturou je významným krokem v léčbě metastatického renálního karcinomu. Je prvním lékem schváleným k léčbě pokročilého karcinomu ledviny od zavedení terapie interleukinem-2 v roce 1992. V současnosti probíhá řada studií zkoumajících účinnost sorafenibu u dalších nádorových onemocnění, např. u nemalobuněčného karcinomu plic, melanomu, hepatocelulárního karcinomu, kolorektálního karcinomu a jiných.
Úvod
Maligní onemocnění ledvin tvoří asi 1–3 % ze všech maligních onemocnění. U mužů se vyskytuje dvakrát častěji než u žen. Nejvíce nádorů je diagnostikováno mezi čtyřicátým a šedesátým rokem života, ale může se vyskytnout v jakékoliv věkové skupině [1]. Incidence zhoubných nádorů ledvin je v celosvětovém měřítku nejvyšší v České republice [2]. Konvenční světlobuněčný karcinom je nejčastější formou karcinomu ledviny a tvoří asi 70 % všech nádorů [3]. Onemocnění je spojeno s chromozomálními abnormalitami. Delece krátkého raménka třetího chromozomu se vyskytuje u karcinomu ledviny sdruženého s von Hippelovou-Lindauovou chorobou. Nejméně u 60 % těchto nádorů je inaktivován von Hippelův-Lindauův (VHL) tumor supresorový gen.
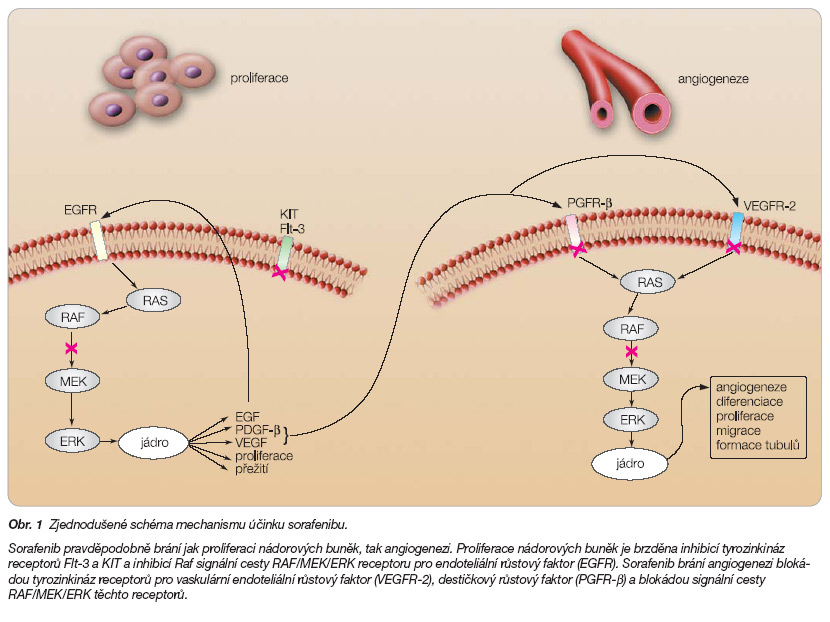
Novotvorba cév je podmínkou nádorového růstu a vzniku metastáz. Inhibice procesu angiogeneze je významnou strategickou možností protinádorové léčby. U konvenčních karcinomů ledviny hraje proces angiogeneze obzvláště významnou roli. Ztráta aktivity genu VHL (von Hippel-Lindau) při mutaci, deleci či inaktivaci vede k významnému zvýšení produkce HIF (hypoxií indukovaný transkripční faktor), který má stimulační vliv na produkci VEGF (vaskulární endotelový růstový faktor) a PDGF (destičkový růstový faktor) a TGF-a (transformující růstový faktor a). VEGF stimuluje růst nových cév, PDGF stimuluje růst pericytů, které podporují vývoj nových cév. TGF-a může stimulovat nádorový růst cestou EGFR (receptory pro epidermální růstové faktory) a prostřednictvím signální cesty Raf/MEK/ERK. Tato signální dráha hraje významnou roli v procesu proliferace a diferenciace nádorových buněk a v procesu inhibice apoptózy.
Mechanismus účinku
Sorafenib (dříve označovaný též BAY 43–9006) patří k nové generaci protinádorových léčiv, jejichž působení umožňuje tzv. cílenou molekulární léčbu. Sorafenib je účinný při perorálním podání.
Sorafenib byl původně vyvinut jako inhibitor Raf kinázy. Jedná se o multikinázový inhibitor, jehož spektrum účinku zahrnuje rovněž inhibici angiogenních faktorů.
Sorafenib inhibuje kinázovou aktivitu Raf-1 a B-Raf. („wild" typ a V600E mutaci) stejně jako MEK a ERK fosforylaci u různých linií nádorů a xenograftů. Sorafenib působí dále inhibičně na receptorové kinázy receptorů pro endotelový růstový faktor (VEGFR) 1, 2 a 3, destičkový růstový faktor (PDGFR), c-KIT a Flt-3. Všechny tyto receptory se uplatňují v procesech proliferace nádorových buněk a angiogeneze. Tak sorafenib působí přímo na vlastní nádor (inhibicí Raf, c-KIT, a Flt-3 signalizace) a na proces neovaskularizace nádoru (inhibicí VEGFR a PDGFR signálních cest) (obr. 1) [4–8].
Farmakokinetika
Po podání tabletové lékové formy je střední relativní biologická dostupnost sorafenibu 38–49 % v porovnání s perorálním roztokem. Absolutní biologická dostupnost není známa, protože dosud nebyla připravena injekční léková forma. Po perorálním podání sorafenibu je maximální plazmatické koncentrace dosaženo přibližně za 3 hodiny, za 10 hodin byl pozorován další nárůst koncentrace ukazující na reabsorpci vylučované látky ze střeva. Byl-li sorafenib podán společně s velmi tučným jídlem, jeho absorpce se snížila o 30 % ve srovnání s absorpcí při podání nalačno. Sorafenib se z velké části váže na plazmatické bílkoviny (99,5 %). Sorafenib se zčásti metabolizuje na celkem 8 metabolitů, většina podané dávky je však vylučována do stolice v nezměněné formě. Sorafenib je metabolizován primárně v játrech, kde podléhá oxidační přeměně pomocí CYP3A4, stejně jako glukuronidaci prostřednictvím UDP-glukuronosyltransferázy 1A9 (UGT1A9). Po perorálním podání dávky 100 mg ve formě roztoku sorafenibu bylo 96 % dávky vyloučeno během 14 dní, přitom se 77 % dávky vyloučilo stolicí a 19 % močí ve formě glukuronidovaných metabolitů. Nezměněný sorafenib, v množství 51 % z dávky, byl nalezen ve stolici, ale ne v moči. Poločas eliminace sorafenibu je přibližně 25–48 hodin.
Klinické zkušenosti
Klinické studie fáze I a II
Do čtyř studií fáze I bylo zařazeno celkem 163 nemocných s cílem stanovit toxicitou limitující dávku využitelnou pro klinické studie fáze II. Nežádoucí účinky spojené s podáváním byly hlášeny u tří čtvrtin sledovaných subjektů a byly většinou mírné nebo středně závažné. Na základě získaných výsledků bylo pro studie fáze II doporučeno dávkování 400 mg dvakrát denně kontinuálně bez přerušení [9].
Výsledky multicentrické randomizované klinické studie fáze II (Randomized Discontinuation Trial-RDT) byly vyhodnoceny v roce 2005 [10]. Uspořádání této klinické studie umožňovalo oddělit stabilizující efekt léčby (SD – stable disease) od pomalu progredující nádorové choroby. Všichni nemocní zahájili léčbu sorafenibem. Všichni nemocní s doloženou objektivní léčebnou odpovědí (≥ 25 %) pokračovali v léčbě do progrese choroby nebo do projevů toxicity léčby. U nemocných se SD byla provedena druhá dvojitě slepá randomizace, kdy byli pacienti zařazeni do skupiny, která pokračovala v léčbě, nebo do skupiny, jíž bylo podáváno placebo. Všichni nemocní v rameni s placebem však mohli dostat znovu sorafenib při progresi onemocnění. Nemocní s progresí choroby byli ze studie vyřazeni.
Do studie bylo možné zařadit všechny histologické typy onemocnění. Většina nemocných dostala sorafenib ve druhé linii léčby (56 %) a nebo ve třetí linii léčby (34 %). Všichni nemocní byli v příznivém stavu výkonnosti PS < 1. U 56 % z nich byla provedena nefrektomie; 65 % nemocných se stabilní chorobou bylo po 12 týdnech znovu randomizováno (sorafenib n = 32, placebo n = 33). Po 24 týdnech bylo 6 nemocných (18 %) ve skupině s placebem bez známek progrese choroby ve srovnání s 16 pacienty (50 %) léčenými sorafenibem (p = 0,007). Medián doby bez progrese choroby (PFS) byl delší ve skupině se sorafenibem (23 vs. 6 týdnů, HR 0,29, p = 0,0001). Nejčastěji se vyskytujícími nežádoucími projevy byly rash (62 %), tzv. hand-foot syndrom (61 %) a únava (56 %).
Shrnutí: klinická studie RDT prokázala efekt léčby sorafenibem, který byl hodnocen jako PFS, při přijatelné toxicitě.
V další randomizované klinické studii fáze II porovnávající sorafenib s interferonem a v léčbě metastazujícího karcinomu ledviny bylo v současnosti ukončeno přijímání pacientů.
Probíhající klinické studie se neomezují jen na maligní onemocnění ledvin. Je prokázáno, že u nemalobuněčného karcinomu plic dochází k zvýšené expresi EGFR, PDGF hraje roli ve vývoji glioblastomů a chronických myeloproliferativních onemocnění, Flt-3 je aktivováno u myeloidních leukémií, aktivace c-Kit a mutace RAS jsou přítomny u kolorektálních a pankreatických karcinomů. Mutované BRAF (V600E) je přítomno u melanomů. Všechny zmíněné molekuly a procesy mohou být ovlivněny sorafenibem, proto probíhá řada studií zkoumajících účinnost sorafenibu u těchto malignit.
Klinická studie fáze III
Výsledky randomizované, dvojitě slepé, placebem kontrolované studie fáze III se sorafenibem byly publikovány v lednu 2007 [11]. Do klinické studie probíhající od listopadu 2003 do března 2005 bylo zařazeno 903 nemocných s karcinomem ledviny (histologicky z jasných buněk) rezistentních k standardní léčbě. Nemocní byli randomizováni k podávání sorafenibu (400 mg 2krát denně) nebo placeba (451 nemocných dostalo sorafenib, 452 nemocných dostalo placebo). Primárním cílem klinické studie byla doba přežití. První plánovaná statistická analýza s hodnocením období bez progrese onemocnění (PFS) byla provedena v lednu 2005 a prokázala statisticky signifikantní výhodu léčby sorafenibem ve srovnání s podáváním placeba [12].
Následně bylo povoleno podávání sorafenibu u nemocných, kteří dostávali placebo, počínaje květnem 2005. V lednu 2005 byl medián doby bez progrese onemocnění ve skupině se sorafenibem 5,5 měsíců a 2,8 měsíce ve skupině s placebem (HR 0,44 CI 0,35–0,55, p < 0,01). První interim analýza celkové doby přežití v květnu 2005 prokázala snížení rizika úmrtí při léčbě sorafenibem ve srovnání s podáváním placeba (HR 0,72 CI 0,54–0,94, p < 0,02). Parciální objektivní léčebné odpovědi bylo dosaženo u 10 % nemocných léčených sorafenibem (2 % při podávání placeba, p < 0,001). Nejčastěji se vyskytujícími nežádoucími účinky při léčbě sorafenibem byly průjmy, rash, únava a syndrom palmoplantární dysestezie (též nazývaný hand-foot syndrom, HF sy). Hypertenze a kardiální ischémie byly vzácně se vyskytujícími nežádoucími účinky, častějšími ve skupině se sorafenibem.
Shrnutí: ve srovnání s placebem prodlužuje sorafenib období bez progrese choroby u nemocných s pokročilým karcinomem ledviny z jasných buněk, u kterých selhala předchozí léčba. Léčba byla spojena s vyšším výskytem nežádoucích účinků.
Vzhledem k účinnosti u metastazujícího onemocnění byly zahájeny klinické studie v adjuvantní indikaci. První je klinická studie SORCE srovnávající u nemocných s resekovaným karcinomem ledviny vysokého a intermediárního rizika sorafenib v jedno- nebo tříletém podávání s placebem. Další je klinická studie ASSURE u nemetastazujícího karcinomu ledviny srovnávající po nefrektomii skupinu pacientů léčených sunitinibem podávaným v dávce 50 mg denně po 4 týdny ze 6týdenního cyklu, sorafenibem podávaným v dávce 800 mg denně kontinuálně a skupinu pacientů, kteří dostávali placebo [12].
Indikace a dávkování
Sorafenib patří mezi protinádorová léčiva s cytostatickým účinkem na podkladě inhibice proteinových kináz. Jeho hlavní indikací je léčba pokročilého karcinomu ledviny (histologicky světlobuněčný karcinom) po selhání předchozí léčby cytokiny (interferon a a/nebo interleukin-2) anebo u nemocných pro tento typ léčby nevhodných.
Doporučená dávka pro dospělé je 400 mg (dvě tablety po 200 mg) dvakrát denně, tzn. 800 mg denně. Doporučuje se, aby sorafenib byl podáván bez jídla nebo s nízkotučným, případně mírně tučným jídlem. Trvání léčby do progrese anebo projevů toxicity. Při projevech nežádoucích účinků může být léčba na nezbytnou dobu přerušena nebo je možné snížit dávku na 200 mg 2krát denně, tzn. 400 mg denně. U starších nemocných není nutná úprava dávkování. U nemocných s mírně až středně zhoršenou funkcí ledviny (clearance kreatininu > 30 ml/min) není nutná úprava dávky. Dávkování rovněž není nutné upravovat u nemocných s mírně nebo středně zhoršenou funkcí jater. V případě výskytu očekávaných nežádoucích účinků může být nezbytné přechodně léčbu přerušit nebo dávky snížit. Pokud pacient zapomene dávku užít, nesmí následující dávku zdvojnásobit.
Kontraindikace a nežádoucí účinky
Kontraindikaci podávání představuje hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku obsaženou v přípravku.
Nejčastěji se vyskytujícími nežádoucími účinky v klinických studiích byly: průjem (cca 50 % pacientů), kožní projevy (cca 50 % pacientů), únava (40 % pacientů), anorexie (40 % pacientů), alopecie (25 % pacientů), nevolnost (20 % pacientů) a hypertenze (10 %). Monitorování krevního tlaku jednou týdně je doporučeno během prvních čtyř týdnů léčby a dále podle potřeby. Stomatitida, pankreatitida a elevace sérových hladin bilirubinu byly hlášeny u méně než 5 % nemocných.
Nejčastějším projevem toxicity limitujícím dávku byl průjem, únava a kožní změny (G3). Nežádoucí projevy stupně 3, jako je pankreatitida, anorexie, nevolnost, stomatitida, alopecie a elevace bilirubinu, byly velmi vzácné. Všechny nežádoucí účinky byly reverzibilní po ukončení léčby sorafenibem.
Rozdělení výskytu nežádoucích účinků podle jejich četnosti je následující:
– velmi časté (> 10 %) – lymfopenie, hypofosfatémie, hemoragie, hypertenze, vyrážka, alopecie, syndrom palmoplantární erytrodysestezie, únava, bolest, zvýšení hladiny amyláz, lipáz;
– časté (1–10 %) – leukopenie, neutropenie, anémie, trombocytopenie, anorexie, periferní senzorická neuropatie, tinitus, chrapot, zácpa, stomatitida, dyspepsie, dysfagie, suchá kůže, exfoliativní dermatitida, akné, olupování kůže, artralgie, myalgie, erektilní dysfunkce, astenie, horečka, chřipkové příznaky, pokles hmotnosti, přechodné zvýšení hladiny transamináz.
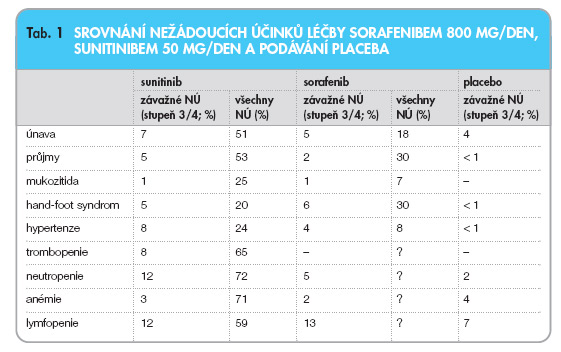
Srovnání nežádoucích účinků léčby sorafenibem 800 mg/den a sunitinibem 50 mg/ den je uvedeno v tab. 1.
Podpůrná léčba projevů toxicity
Syndrom palmoplantární dysestezie (HF syndrom) se objevuje nejčastěji na dlaních nebo na ploskách nohou a je vždy bilaterální. Nejčastěji postihují kožní změny místa zvýšeného otlaku. HF syndrom se může objevit i při podávání dalších léčiv s antiangiogenním účinkem. Je odlišný od HF syndromu při konvenční chemoterapii. Objevuje se obvykle během prvních šesti týdnů léčby, nejčastěji v prvním nebo druhém týdnu. Podpůrná léčba by měla být zahájena co nejdříve, aby bylo možné v léčbě pokračovat. Silné projevy mohou vést až k přerušení léčby.
U nemocných s HF syndromem je vhodné podávat lokální emoliens a/nebo perorálně kortikoidy, antihistaminika nebo vitamin B6 (50–150 mg/den).
Vyrážka (rash) je dalším z možných nežádoucích projevů léčby. Může se objevit na obličeji nebo na těle obvykle během prvních šesti týdnů léčby. Je možno pozorovat tři typy kožních projevů: 1. rash v obličeji, který je obvykle erytematózní s mírnou deskvamací kolem obočí a vlasové linie; 2. makulopapulární rash na těle, který může být doprovázen pruritem; 3. erytematózní tělový rash s drobnými pustulkami. V podpůrné léčbě pomáhají místně aplikované hydratační krémy, volný oděv, při svědění antihistaminika.
Průjmy jsou dalším možným nežádoucím projevem. Jedná se více o častější řídké stolice, často urgentní, spíše než vodnaté průjmy. Při průjmu při vyloučení jiných možných příčin je doporučeno podávání loperamidu.
Na začátku léčby se může objevit hypertenze, proto je doporučeno měřit krevní tlak týdně během prvních šesti týdnů léčby a včas zahájit léčbu antihypertenzivy. V případě závažných nežádoucích účinků nebo jejich přetrvávání musí být zváženo přechodné přerušení léčby, úprava dávky nebo úplné přerušení léčby.
Interakce
Farmakodynamické interakce
Ve stadiu klinických zkoušek jsou různé režimy podávání sorafenibu s dalšími „cílenými" látkami, např. s bevacizumabem, cetuximabem, temsirolimem, erlotinibem. Analyzováno je též přidání sorafenibu do různých standardních režimů chemoterapie (kombinace s cisplatinou, karboplatinou, etoposidem, paklitaxelem atd.) s cílem potvrdit možný aditivní účinek sorafenibu v kombinační terapii.
Farmakokinetické interakce
Sorafenib teoreticky může interagovat se současně podávanými léky na úrovni vazby na plazmatické bílkoviny (sorafenib z 99,5 % vázán na plazmatické bílkoviny), metabolismu na cytochromu CYP3A4, glukuronidace cestou UGT1A9. Sorafenib se ukázal také jako inhibitor CYP2C8 izoformy (bez klinické relevance), jako inhibitor UDP-glukuronyltransferáz (UGT) i jako inhibitor P-glykoproteinu.
Induktory CYP3A4 a UGT1A9
Látky, které indukují aktivitu enzymů (např. rifampicin, třezalka, fenytoin, karbamazepin, fenobarbital a dexamethason) mohou urychlit metabolismus sorafenibu cestou CYP3A4 a UGTIA9, a tak snížit koncentraci sorafenibu. Tato léčiva mohou být podávána současně pouze po pečlivém zvážení poměru prospěšnosti a rizika.
Inhibitory CYP3A4
Ketokonazol, silný inhibitor CYP3A4, podávaný jednou denně po dobu 7 dnů zdravým dobrovolníkům mužského pohlaví, nezměnil střední hodnotu AUC po podání jednorázové dávky 50 mg sorafenibu. Z těchto dat lze usuzovat, že klinická významnost farmakokinetické interakce sorafenibu s inhibitory CYP3A4 je nepravděpodobná.
CYP izoformy selektivních substrátů
Současné podávání sorafenibu a midazolamu, dextromethorfanu nebo omeprazolu, jež jsou substráty pro cytochromy CYP3A4, CYP2D6 a CYP2C19, neovlivnilo expozici těmto látkám. To ukazuje, že sorafenib není ani inhibitorem, ani induktorem těchto izoenzymů cytochromu P-450. Proto je klinicky významná farmakokinetická interakce sorafenibu se substráty těchto enzymů nepravděpodobná.
Inhibice P-glykoproteinu
Sorafenib inhiboval v koncentracích nižších, než jsou dosahovány v krevní plazmě, eflux loperamidu a dipyridamolu.
Další interakce
Sorafenib neovlivňoval účinky warfarinu, zvyšoval v dávce 800 mg/den plazmatické hladiny aktivního metabolitu irinotekanu (SN-38) a doxorubicinu.
Závěr
Léčba sorafenibem vyžaduje od klinického onkologa znalost všech předvídatelných nežádoucích účinků. Nežádoucí účinky jsou zvládnutelné při pečlivém klinickém a laboratorním monitorování pacienta během léčby. Zavedení sorafenibu do klinické praxe významně rozšiřuje armamentarium léčby světlobuněčného karcinomu ledviny při jinak v současnosti velmi omezených léčebných možnostech [13, 14].
Seznam použité literatury
- [1] Petruželka L, Konopásek B. Klinická onkologie. Praha, nakladatelství Karolinum 2003.
- [2] www.svod.cz
- [3] Dvořáček J, Babjuk M, et al. Onkourologie, Praha, Galen a nakladatelství Karolinum 2005.
- [4] Haan O, Stadler W. Sorafenib. Curr Opin Oncol 2006; 18: 615–621.
- [5] Iliopoulos O. Molecular biology of renal cell cancer and the identification of therapeutic targets. J Clin Oncol 2007: 25: 5593–5600.
- [6] Wilhelm SM, Carter C, Tang LY, et al. BAY 43-9006 exhibits broad spectrum oral antitumour activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumour progression and angiogenesis. Cancer Res 2004; 64: 7099–7109.
- [7] Carlomagno F, Anaganti S, Guida T, et al. BAY 43-9006 inhibition of oncogenic RET mutants. J Natl Cancer Inst 2006; 98: 326–334.
- [8] Faivre S, Djelloul S, Raymond E. New paradigma in anticancer therapy: Targeting multiple signaling pathways with kinase inhibitors. Sem Oncol 2006; 33: 407–420.
- [9] Awada A, Hendlisz A, Gil T, et al. Phase I safety and pharmacokinetics of BAY 43-9006 administered for 21 days on/7 days off in patients with advanced, refractory solid tumours. Br J Cancer 2005; 92: 1855–1861.
- [10] Ratain MJ, Eisen T, Stadler WM, et al. Phase II placebo-controlled randomized discontinuation trial of sorafenib in patients with metastatic renal cell carcinoma. J Clin Oncol 2006; 24: 2505–2512.
- [11] Escudier B, Eisen T, Stadler WM, et al. Sorafenib in Advanced Clear-Cell Renal-Cell Carcinoma. N Engl J Med 2007; 356: 125–134.
- [12] Larkin JMG, Eisen T. Renal cell carcinoma and the use of sorafenib. Therapeutics and Clinical Risk Management 2006; 2: 89–100.
- [13] Ozols RF, Herbst RS, Colson YL, et al. Clinical cancer advances 2006: Major research advances in cancer treatment, prevention, and screening – a report from the American Society of Clinical Oncology. J Clin Oncol, 2007; 25: 146–162.
- [14] Motzer RJ, Bukowski RM. Targeted therapy for metastatic renal cell carcinoma. J Clin Oncol 2006; 25: 5601–5608.