Sunitinib v léčbě karcinomu ledviny
Maligní onemocnění ledvin tvoří asi 1–3 % ze všech maligních onemocnění a jejich incidence je v České republice nejvyšší v celosvětovém měřítku. Pacienti s metastazujícím, recidivujícím nebo neresekabilním konvenčním karcinomem ledviny jsou léčeni pomocí cytokinů (interferonu-alfa a interleukinu-2). Nově je možné použít také sunitinib, perorální inhibitor mnoha receptorových kináz, který má prokazatelnou antiangiogenní a antitumorózní aktivitu.
Úvod
Maligní onemocnění ledvin tvoří asi 1–3 % ze všech maligních onemocnění. U mužů se vyskytuje dvakrát častěji než u žen. Nejvíce nádorů je diagnostikováno mezi čtyřicátým a šedesátým rokem života, ale může se vyskytnout v jakékoliv věkové skupině [1].
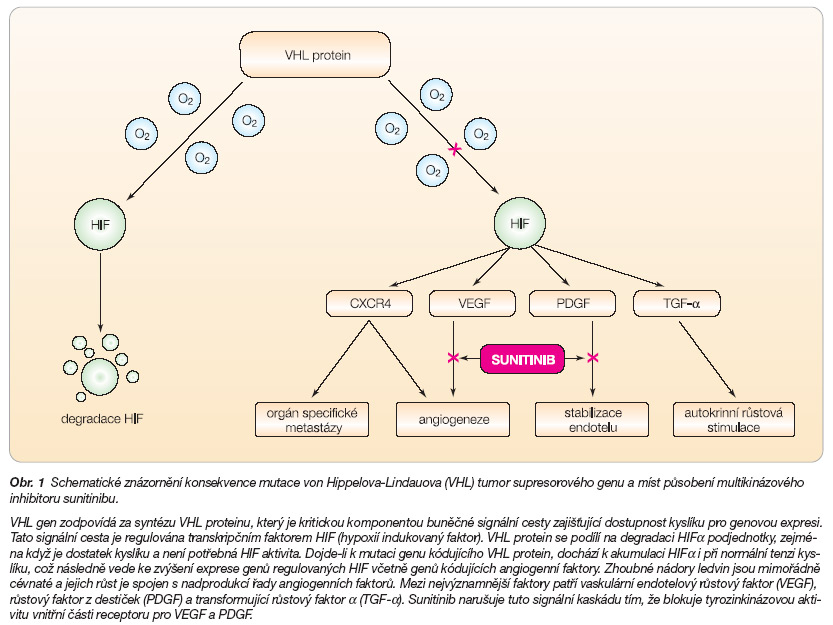
Incidence zhoubných nádorů ledvin je v celosvětovém měřítku nejvyšší v České republice [2]. Dělení nádorů ledvin vychází z Heidelberské klasifikace, která odráží výsledky molekulárně genetických vyšetření těchto nádorů. Mezi maligní parenchymální nádory patří konvenční renální karcinom, papilární renální karcinom, chromofobní renální karcinom, karcinom ze sběrných kanálků a medulární karcinom a neklasifikovatelný renální karcinom. Konvenční světlobuněčný karcinom je nejčastější formou karcinomu ledviny a tvoří asi 70 % všech nádorů [3]. Onemocnění je spojeno s chromozomálními abnormalitami. Delece krátkého raménka třetího chromozomu se vyskytuje u karcinomu ledviny sdruženého s von Hippelovou-Lindauovou chorobou. Nejméně u 60 % těchto nádorů je inaktivován von Hippelův-Lindauův (VHL) tumor supresorový gen. Von Hippelova-Lindauova choroba je hereditární nádorový syndrom, který byl poprvé popsán koncem devatenáctého století [4]. Má úzký vztah k patogenezi zhoubných nádorů ledvin. Nemocní s VHL chorobou mají zvýšené riziko onemocnění různými typy nádorů včetně konvenčního karcinomu ledviny, hemangioblastomů CNS (zvláště v oblasti mozečku a míchy), angiomu retiny a feochromocytomu [5]. U postižených rodin se jedná o autozomálně dominantní onemocnění. Nejčastější příčinou úmrtí u VHL syndromu jsou karcinomy ledviny a heman-gioblastomy. Tumor supresorový VHL gen lokalizovaný na chromozomu 3p25 byl popsán v roce 1980. VHL gen zodpovídá za syntézu VHL proteinu (pVHL), který je kritickou komponentou buněčné signální cesty zajišťující dostupnost kyslíku pro genovou expresi regulovanou transkripčním faktorem HIF (hypoxií indukovaný faktor). HIF a/b je heterodimerický transkripční faktor, který se skládá z nestabilní a-podjednotky a stabilní b-podjednotky. Tento transkripční faktor reguluje genovou expresi a ovlivňuje adaptaci na tkáňovou hypoxii. V lidském genomu byly identifikovány tři geny HIFa (HIF1a , HIF2a a HIF3a ). VHL protein se podílí na degradaci HIFa podjednotky, zejména když je nadbytek kyslíku a není potřebná HIF aktivita. Na rozdíl od normálních buněk, buňky s inaktivním VHL genem nadměrně akumulují HIFa při normální tenzi kyslíku a dochází ke zvýšené expresi genů regulovaných HIF včetně genů kódujících angiogenní faktory (obr. 1). V hypoxických podmínkách nebo v buňkách postrádajících pVHL dochází k akumulaci HIFa s vazbou na HIFb a transkripční aktivaci genů s elementy reagujícími na hypoxii (HRE). Řada těchto genů, které jsou regulovány prostřednictvím HIF, je zapojena do adaptačních mechanismů při akutní i chronické hypoxii. Kovalentní vazba polyubiquitinového řetězce (polyubiquitinace) na proteiny je signálem k jejich degradaci v proteazomu. V normooxických podmínkách dochází k destrukci HIF, naopak při hypoxii dochází ke stabilizaci HIFa a jeho působením dochází k aktivaci sestupné genové kaskády. Je doloženo, že HIFa, zvláště HIF2a, mají kauzální roli ve vzniku pVHL defektních renálních karcinomů.
Cílená léčba karcinomů ledviny inhibitory tyrozinkináz vychází z molekulárně biologických poznatků. Teoreticky by měl být HIF ideální terčovou strukturou cílené léčby renálních karcinomů. Přímá inhibice transkripčních faktorů je v praxi všeobecně velmi obtížná. Proto pro praktické využití jsou vhodnější růstové faktory závislé na HIF. Bylo popsáno více než sto genů závislých na HIF. Zhoubné nádory ledvin jsou mimořádně cévnaté a jejich růst je spojen s nadprodukcí řady angiogenních faktorů, jejichž produkce závisí na aktivaci genů závislých na HIF. Mezi nejvýznamnější faktory patří vaskulární endotelový růstový faktor (VEGF), růstový faktor z destiček (PDGF), transformující růstový faktor a (TGF-a), bazální fibroblastový růstový faktor (bFGF) a karbonická anhydráza IX (CA IX). VEGF stimuluje proliferaci endotelových buněk a byla též popsána VEGF zprostředkovaná suprese protinádorové imunitní reakce [7]. Účinnost inhibice VEGF pomocí monoklonálních protilátek (bevacizumab) byla v klinické praxi prokázána u metastazujícího karcinomu tlustého střeva a konečníku, karcinomu prsu, nemalobuněčných karcinomů plic a je předmětem klinických studií u karcinomu ledviny. Další cestou inhibující angiogenezi využitelnou v cílené léčbě karcinomu ledviny je blokáda tyrozinkinázové aktivity vnitřní části receptoru pro VEGF a PDGF. PDGF je dalším růstovým faktorem závislým na HIF, působí na životnost pericytů a stabilizuje již vytvořené cévy. Novotvorbě cév lze nejlépe zabránit přímou inhibicí VEGF. Naopak k involuci již vytvořených cév je nutná duální inhibice, a to jak VEGF, tak PDGF [8]. Dalším faktorem závislým na HIF je TGF-a, který zprostředkovává u renálních karcinomů autokrinní aktivaci receptorů pro epidermální růstové faktory (EGFR) [9]. Nachází-li se v organismu gen VHL v mutované nebo inaktivní formě, jak je tomu u konvenčního renálního karcinomu, k degradaci HIF nedochází. Právě pozorování, že inaktivace pVHL vede ke zvýšení HIF aktivity, což způsobuje zvýšení exprese VEGF, PDGF a TGF-a, bylo podkladem pro identifikaci terčových struktur pro cílenou léčbu konvenčních renálních karcinomů [10, 11]. Cílený účinek multikinázového inhibitoru sunitinibu spočívá v inhibici aktivační signální cesty VEGF a PDGF blokádou tyrozinkinázové aktivity receptoru VEGF a PDGF receptoru a a b [12].
Mechanismus účinku
Sunitinib (dříve označovaný SU11248) je perorální inhibitor mnoha receptorových kináz s prokazatelnou antiangiogenní a antitumorózní aktivitou doloženou na řadě in vitro a in vivo modelů. In vitro bylo prokázáno, že sunitinib inhibuje fosforylaci ligand-dependentních VEGFR2 a PDGFRb stejně jako VEGF indukovanou proliferaci endotelových buněk a PDGF indukovanou proliferaci myších fibroblastů. Při pokusech na zvířatech byla demonstrována inhibice fosforylace receptorů v plazmě při hladině od 50 ng/ml do 100 ng/ml. Protinádorová aktivita sunitinibu byla kromě karcinomu ledviny prokázána v preklinických studiích a ve studiích u zvířecích modelů malobuněčného plicního karcinomu, karcinomu prsu, karcinomu tlustého střeva a v léčbě leukémií [13].
Mechanismus účinku sunitinibu spočívá ve vícečetném zásahu signálních struktur (obr. 1).
Mezi cílové struktury patří jak receptorové, tak nereceptorové tyrozinkinázy – receptory pro růstový faktor z destiček (PDGFRa a PDGFRb), receptory pro vaskulární endoteliální růstový faktor (VEGFR1, VEGFR2 a VEGFR3), receptory faktoru kmenových buněk (KIT), Fms-podobné tyrozinkinázy 3 (Flt3, Fms-like tyrosine kinase-3), receptory kolonie stimulujícího faktoru (CSF-1R) a receptory pro neurotrofický faktor odvozený od gliálních buněk (RET, glial cell-line derived neutrotrophic factor receptor).
Ačkoliv jak sunitinib, tak imatinib se váží na receptorovou ATP vazebnou doménu KIT a PDGF, mají vzhledem k odlišnosti chemické struktury rozdílnou afinitu k receptorům a odlišnou vazebnou charakteristiku. Sunitinib inhibuje další VEGFR kinázy, které jsou důležité pro nádorovou angiogenezi a nejsou terčovou strukturou imatinibu. Těmito rozdíly je vysvětlován klinický benefit u nemocných s gastrointestinálními stromálními nádory (GIST) rezistentními k léčbě imatinibem. Předběžné výsledky analýz nemocných s imatinib rezistentním GIST prokázaly relativně vyšší protinádorovou účinnost a vyšší klinický benefit po podání sunitinibu u nádorů s primární mutací KIT v exonu 9 ve srovnání s mutací KIT v exonu 11 [14]. Definitivní odpověď by mělo přinést ověření účinnosti léčby sunitinibem u pacientů nepředléčených imatinibem.
Farmakokinetika
Po jednorázovém podání 50 mg sunitinibu per os pacientům s pokročilým karcinomem byl medián dosažení maximálních plazmatických koncentrací jak sunitinibu, tak jeho aktivního metabolitu (SU012662) 5 hodin. Maximální plazmatické koncentrace sunitinibu a SU012662 byly 27,7 ng/ml, resp. 4,12 ng/ml. V klinických studiích nebylo pozorováno ovlivnění biologické dostupnosti sunitinibu při současném podání potravy. Terapeutické plazmatické koncentrace (50–100 ng/ml) byly dosaženy u většiny nemocných při léčbě denní dávkou ≥ 50 mg. Sunitinib a jeho hlavní metabolit se in vitro váží na plazmatické bílkoviny z 95 %, resp. z 90 %, distribuční objem sunitinibu je 2230 l. Léčivo je primárně metabolizováno enzymy cytochromu P-450 (CYP3A4), aktivní metabolit tvoří 23–27 % podané dávky. Sunitinib je převážně vylučován stolicí (61 %) a močí (16 %). V průběhu podávání nebyla zaznamenána kumulace léčiva. Biologický poločas po perorálním podání jednorázové dávky 50 mg činil u pacientů s pokročilým karcinomem 41–86 hodin. Dle dosavadních poznatků se zdá, že farmakokinetika sunitinibu není ovlivněna typem karcinomu, věkem, pohlavím nebo tělesnou hmotností. Doposud nejsou k dispozici farmakokinetické údaje u pediatrických pacientů. Podání sunitinibu s induktory enzymu CYP3A4 může snižovat jeho plazmatické koncentrace a naopak současné podání s inhibitory enzymu CYP3A4 může jeho plazmatické koncentrace zvýšit (viz Interakce a dávkování) [15–19].
Dosavadní klinické zkušenosti
Klinické studie fáze I/II
V klinických studiích fáze I bylo dosaženo objektivní léčebné odpovědi v léčbě nemocných s pokročilými nádory, jako jsou renální karcinom, gastrointestinální stromální tumory, neuroendokrinní nádory, sarkomy, nádory štítné žlázy, maligní melanom a nemalobuněčný karcinom plic [20]. V klinických studiích byla použita denní eskalace dávky od 25 mg do 75 mg podávané po dobu dvou týdnů následované dvoutýdenní přestávkou nebo jednotýdenní přestávkou a čtyřtýdenní podávání s dvoutýdenní přestávkou. Limitací dávky z hlediska nežádoucích účinků byla únava (cca 70 % pacientů), gastrointestinální toxicita, cytopenie a kožní toxicita.Výskyt únavy souvisel s podanou dávkou sunitinibu, při podání 25 mg/den se únava objevila u 65–85 % pacientů, při podání 75 mg/den u 80–96 % pacientů. Dávkování 50 mg denně po 4 týdny s dvoutýdenní přestávkou bylo doporučeno pro studie fáze II.
Do dvou klinických studií fáze II bylo zařazeno celkem 169 nemocných s metastatickým renálním karcinomem při použití šestitýdenního dávkovacího cyklu s čtyřtýdenním podáváním 50 mg sunitinibu denně následovaným dvoutýdenní pauzou. Do obou klinických studií byli zařazováni nemocní refrakterní k léčbě cytokiny s měřitelnou lézí pro sledování léčebné odpovědi. Do první klinické studie bylo zařazeno 63 nemocných s karcinomem ledviny všech histologických typů, bylo dosaženo 40 % objektivních léčebných odpovědí (PR) a stabilizace onemocnění (SD) v trvání více než 3 měsíce u dalších 27 % nemocných [21]. Do druhé klinické studie fáze II bylo zařazeno celkem 106 nemocných po nefrektomii pro karcinom ledviny z jasných buněk s progresí při léčbě cytokiny. Ve studii bylo dosaženo 43 % PR a 22 % SD v trvání více než 3 měsíce. Medián doby přežití bez progrese onemocnění (PFS, progression-free survival) byl 8,1 měsíců [22]. Nejčastějšími nežádoucími účinky v těchto klinických studiích většinou stupně 1 a 2 byly únava a astenie, nauzea, průjmy, stomatitida a cytopenie [21, 22].
Klinické studie fáze III
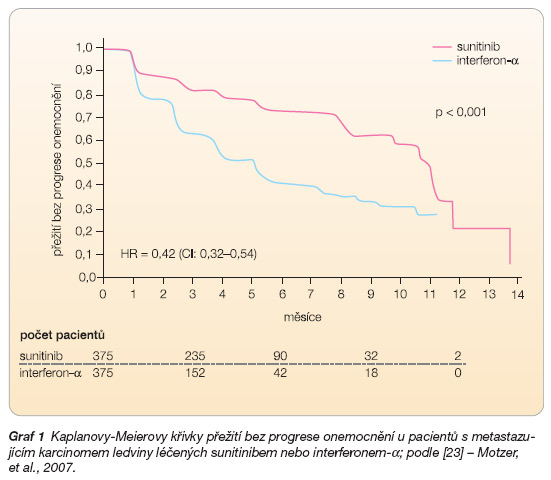
Do klinické studie fáze III bylo zařazeno 750 nemocných s dříve systémově neléčeným metastazujícím karcinomem ledviny. Nemocní byli randomizováni buď k opakovaným 6týdenním cyklům podávání sunitinibu (v dávce 50 mg perorálně jedenkrát denně po dobu 4 týdnů s následnou 2týdenní přestávkou) nebo k léčbě interferonem-a (IFN-a) v dávce 9 MIU s.c. třikrát týdně. Primárním cílem bylo stanovení doby přežití bez progrese onemocnění (PFS). Sekundárními cíli byly počet objektivních léčebných odpovědí, celková doba přežití a profil nežádoucích účinků. Medián PFS byl signifikantně delší v rameni se sunitinibem (11 měsíců) než v rameni s IFN-a (5 měsíců), viz graf 1.
Podávání sunitinibu bylo spojeno s vyšším počtem objektivních léčebných odpovědí ve srovnání s léčbou IFN-a (31 % vs. 6 %, p < 0,001). Zastoupení nemocných s únavovým syndromem stupně 3 nebo 4 bylo signifikantně vyšší v rameni s IFN-a, zatímco výskyt průjmů byl četnější v rameni se sunitinibem (p < 0,05). Nemocní léčení sunitinibem měli při hodnocení pomocí FACT-G dotazníku signifikantně vyšší kvalitu života (p < 0,001) [23].
Vzhledem k účinnosti v léčbě metastazujícího onemocnění byly zahájeny klinické studie v adjuvantní indikaci. Příkladem je studie ASSURE u nemetastazujícího karcinomu ledviny po nefrektomii srovnávající sunitinib 50 mg/den podávaný po dobu 4 týdnů ze 6týdenního cyklu, sorafenib 800 mg/den podávaný kontinuálně a placebo.
Současné možnosti systémové léčby karcinomu ledviny
Současné možnosti systémové léčby nemocných s metastazujícím, recidivujícím nebo neresekabilním konvenčním karcinomem ledviny spočívají v aplikaci cytokinů – interleukinu 2 (IL-2) a interferonu-a (IFN-a) – a nově v aplikaci multikinázových inhibitorů [24, 25]. Otázkou je postavení cytokinů v léčbě metastazujícího karcinomu ledviny při současných nových léčebných možnostech. Při minimální účinnosti konvenční chemoterapie byla imunoterapie cytokiny (IL-2 a IFN-a) historicky hlavní systémovou léčebnou modalitou. V blízké budoucnosti je potřebné správně vymezit skupinu nemocných, u kterých se dá očekávat léčebný prospěch z podávání cytokinů. Cochranova metaanalýza [26] z roku 2005 srovnávající výsledky léčby interferonem s kontrolami bez imunoterapie prokázala prodloužení mediánu doby přežití o 3,8 měsíce (p = 0,007). Celkem bylo hodnoceno 376 nemocných léčených IFN-a, v kontrolní skupině bylo rovněž 376 nemocných. Počet objektivních léčebných odpovědí vyzněl výrazně ve prospěch léčby IFN-a (13,9 % vs. 2,2 %), obdobné bylo i jednoleté přežití (53 % vs. 43 %). Monoterapie vyšší i.v. dávkou IL-2 je upřednostňována více v USA než na evropském kontinentě, kde je častěji užíván IL-2 v nižší dávce aplikované subkutánně. Přímé srovnání rozdílného dávkování IL-2 bylo publikováno v roce 2003 [27]. Výsledky studií vyzněly ve prospěch vyšší dávky IL-2, ale je nutné připomenout až život ohrožující rizika tohoto léčebného postupu [27, 28]. Klinické studie s podáváním kombinace IL-2 a IFN-a vyzněly ve prospěch kombinační léčby, celková doba přežití ale ovlivněna nebyla [29]. Rovněž využití biomarkerů pro volbu léčby je jednou z možných cest, příkladem je stanovení exprese CA IX pro predikci léčebné odpovědi na IL-2 [30].
Nové léčebné možnosti neznamenají úplné opuštění terapie cytokiny. U správně vybrané skupiny nemocných lze očekávat léčebný prospěch při léčbě IFN-a a IL-2. Při výběru terapeutického postupu je třeba vycházet z prognostického odhadu a dělení do tří základních prognostických skupin [31]. U nemocných patřících do nepříznivé prognostické skupiny nelze očekávat přínos léčby cytokiny a u všech intermediárních rizikových skupin není efekt podávání cytokinů jednoznačný. Léčba cytokiny (IL-2) musí být bedlivě zvažována u nemocných s komorbiditami (onemocnění kardiální, plicní, renální, hepatální a onemocnění CNS). Po podání IFN-a může dojít ke zhoršení kvality života nemocných projevující se těžkým únavovým syndromem, neuropsychiatrickým onemocněním a autoimunními komplikacemi. Do budoucna lze odhadnout, že léčba cytokiny bude vhodná pro 20–25 % všech nemocných s metastazujícím karcinomem ledviny.
V budoucnosti lze očekávat začlenění do léčebných protokolů jak sunitinibu, tak i dalších biologicky aktivních agens účinných v systémové léčbě karcinomu ledviny. Patří sem inhibitory mTOR kinázy (mammalian target of rapamycin) AG013736 a temsirolimus (CCI-779). Výsledky klinické studie fáze III hodnotící temsirolimus, IFN-a nebo kombinaci temsirolimu s IFN-a v první linii léčby u 626 nemocných s metastazujícím karcinomem ledviny byly publikovány v roce 2006 [32]. Celková doba přežití při monoterapii temsirolimem byla 10,9 měsíců ve srovnání s 7,3 měsíci při monoterapii IFN-a a 8,4 měsíci při kombinované léčbě. Doba přežití byla signifikantně delší u nemocných léčených temsirolimem ve srovnání s IFN-a, ale rozdíl v přežití při podávání kombinace temsirolimu a IFN-a ve srovnání s podáváním IFN-a samotného nebyl statisticky významný. Výsledky klinické studie porovnávající IFN-a s kombinací IFN-a a bevacizumabu zatím nejsou dostupné.
Indikace a dávkování
Sunitinib je indikován k léčbě pokročilého a/nebo metastazujícího renálního karcinomu z jasných buněk a/nebo metastatického maligního stromálního nádoru (GIST) po selhání léčby imatinibem. Jeho hlavní indikací je léčba metastazujícího světlobuněčného karcinomu ledviny po selhání léčby cytokiny nebo u nemocných, pro něž je léčba cytokiny nevhodná.
Sunitinib je dostupný v tobolkách obsahujících 50 mg, 25 mg a 12,5 mg účinné látky. Doporučená dávka je 50 mg jedenkrát denně po dobu 4 po sobě následujících týdnů, dále následuje dvoutýdenní pauza, která zakončuje šestitýdenní cyklus. Celková dávka v 6týdenním cyklu je 2400 mg. Je možné provádět úpravu dávky podle tolerability v 12,5 mg přírůstcích. Denní dávka by neměla překročit 87,5 mg a neměla by klesnout pod 37,5 mg.
Protože klinickými studiemi dosud nebyla zodpovězena otázka, zda-li dlouhodobá blokáda VEGFR při kontinuálním podáváním nepřinese zvýšení léčebného efektu, probíhá v současnosti klinická studie s kontinuálním podáváním sunitinibu v dávce 37,5 mg/den.
Kontraindikace a nežádoucí účinky
Kontraindikací pro podávání sunitinibu je přecitlivělost na účinnou látku nebo na jakoukoliv pomocnou látku. Nejčastějšími pozorovanými nežádoucími účinky spojenými s podáváním sunitinibu byly celkové symptomy (únavnost/astenie), gastrointestinální symptomy (nevolnost, průjmy, stomatitida, dyspepsie) dermatologické nežádoucí projevy (dermatitida, kožní diskolorace, vlasová depigmentace) a myelosuprese (neutropenie, trombocytopenie). Vzhledem k poklesu LVEF (left ventricular ejection fraction, ejekční frakce levé komory) zaznamenaném v klinických studiích je doporučeno echokardiografické vyšetření před zahájením a v průběhu léčby. Doporučeno je též pravidelné monitorování tlaku krve a standardní léčba hypertenze. Nejčastěji se vyskytujícím nežádoucím účinkem stupně 4 bylo zvýšení hladiny lipázy, které nebylo doprovázeno příznaky pankreatitidy.
Interakce
Lékové interakce jsou pravděpodobné při podání sunitinibu s inhibitory nebo induktory enzymu CYP3A4, a je proto vhodné se jejich současnému podávání vyhnout. Při nutnosti současného podání je třeba upravit dávku sunitinibu. V případě inhibitorů CYP3A4 (ritonavir, ketokonazol, itrakonazol, erythromycin, klarithromycin, grapefruitová šťáva) je doporučeno snížení dávky sunitinibu o 12,5 mg na minimální dávku 37,5 mg a u induktorů CYP3A4 (dexametazon, fenobarbital, fenytoin, karbamazepin, rifampicin, třezalka) je doporučeno postupné zvyšování dávky sunitinibu o 12,5 mg na maximální dávku 87,5 mg/den.
Závěr
Sunitinib je v současné době v České republice indikován k léčbě pokročilého a/nebo metastatického adenokarcinomu ledviny po selhání léčby IFN-a nebo IL-2. Sunitinib je rovněž indikován k léčbě neresekovatelného a/nebo metastatického maligního GIST po selhání léčby imatinibem v důsledku rezistence nebo intolerance. Klinické použití sunitinibu znamená významné rozšíření možností léčby světlobuněčného karcinomu ledviny při jinak v současnosti velmi omezených léčebných možnostech [33]. Léčba sunitinibem vyžaduje od klinického onkologa znalost všech předvídatelných nežádoucích účinků, které však jsou zvládnutelné při pečlivém klinickém a laboratorním monitorování během léčby. Výsledky klinických studií jsou prozatím velmi slibné, ale rozhodující bude až vyhodnocení výsledků v delším časovém odstupu a vyhodnocení výsledků dalších v současnosti probíhajících klinických studií.
Seznam použité literatury
- [1] Petruželka L, Konopásek B. Klinická onkologie. Praha, nakladatelství Karolinum 2003.
- [2] Epidemiologie zhoubných nádorů v České republice. www.svod.cz.
- [3] Dvořáček J, Babjuk M, et al.. Onkourologie, Praha, Galen a nakladatelství Karolinum 2005.
- [4] Collins E. Intra-ocular growths (two CASE, brother and sister, with peculiar vascular new growth, probably retina, affecting both eyes) Trans Ophtalmotol Soc UK 1894; 14: 141–149.
- [5] Kim WY, Kaelin WG. Molecular pathways in renal cell carcinoma – rationale for targeted therapy.Semin Oncol 2006; 33: 588–595.
- [6] Semena GL. Targeting HIF-1 for cancer therapy. Nat Rev Cancer 2003; 3: 721–732.
- [7] Ohm JE, Gabrilovich DI, Sempowski GD, et al. VEGF inhibits T-cell development and may contribute to tumor-induced immuno suppression. Blood 2003: 101: 4878–4886.
- [8] Osusky KL, Hallahan DE, Fu A, et al. The receptor tyrosine kinase inhibitor SU11248 impedes endothelial cell migration, tubule formation, and blood vessel formation in vivo, but has little effect on existing tumor vessels. Angiogenesis 2004: 7; 225–33.
- [9] Rowinsky EK, Schwarz GH, Gollob JA, et al. Safety, pharmacokinetics and aktivity of ABX-EGF, a fully human antiepeidermal growth factor receptor monoclonal antibody in patents with metastatic renal cell cancer. J Clin Oncol 2004: 22: 3003–3015.
- [10] Motzer RJ, Rini BI, Bukowski RM, et al. Sunitinib in patients with metastatic renal cell carcinoma. JAMA 2006; 295: 2516–2524.
- [11] Motzer RJ, Bukowski RM. Targeted therapy for metastatic renal cell carcinoma. J Clin Oncol 2006; 25: 5601–5608.
- [12] Faivre S, Djelloul S, Raymond E. New paradigma in anticancer therapy. Targeting multiple signaling pathways with kinase inhibitors. Sem Oncol 2006; 33: 407–420.
- [13] Abrams TJ, Lee LB, Murray LJ, et al. SU11248 inhibits KIT and platelet-derived growth factor receptor beta in preclinical models of human small cell lung cancer. Mol Cancer Ther 2003; 2: 471–478.
- [14] Demetri GD, van Oosterom A.T, Garrett Ch.R.: Eficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: a randomised controlled trial. Lancet. 2006; 368: 1329–1338.
- [15] Faivre S, Delbaldo C, Vera K, et al. Safety, pharmacokinetic, and antitumor activity of SU11248, a novel oral multitarget tyrosine kinase inhibitor, in patients with cancer. J Clin Oncol. 2006; 24: 25–35.
- [16] Pfizer. Sutent prescribing information (PI). http: //www.pfizer.com/pfizer/download/uspi_sutent.pdf
- [17] Bello C, Laure S, Zhou J, et al. Food does not effect the pharmacokinetics of sunitinib malate (SU11248), a multitargeted receptor tyrosine kinase inhibitor, in healthy subjects [abstract no. B175 plus poster]. 17th AACR-NCI-EORTC International Konference on Molecular Targets and Cancor Therapeutics; 2005 Nov 14–18; Philadephia (PA).
- [18] Bello C, Houk B, Sherman L, et al. The effect of rifampin on the pharmacokinetics of sunitinib malate (SU11248) in Caucasian and Japanese populations [abstract no. 1485]. EJC Suppl 2005 Oct; 3 (2): 430.
- [19] Washington E, Eli M, Bello C, et al. The effect of ketoconazole (KETO), a potent CYP3A4 inhibitor, on SU011248 pharmacokinetics (PK) in Caucasian and Asian healthy subjects [abstract no. 553]. Annual Meeting of the American Society of Clinical Oncology; 2003 May 31-Jun 3; Chicago (IL).
- [20] Choueiri TK, Bukowski RM, Rini BI. The current role of angiogenesis inhibitors in the treatmnet of renal cell carcinoma. Semin Oncol 2006; 33: 596–606.
- [21] Motzer RJ, Michaelson MD, Redman BG, et al. Activity of SU11248, a multitargeted inhibitor of vascular endothelial growth factor receptor and platelet-derived growth factor receptor, in patients with metastatic renal cell carcinoma. J Clin Oncol 2006; 24: 16–24.
- [22] Motzer RJ, Rini BI, Bukowski RM, et al. Sunitinib in patients with metastatic renal cell carcinoma. JAMA. 2006; 295: 2516–2524.
- [23] Motzer RJ, Hutson TE, Tomczak DP, et al. Sunitinib versus Interferon Alfa in Metastatic Renal-Cell Carcinoma. N Engl J Med 2007; 356: 115–124.
- [24] National Comprehensive Cancer Network Version 2.2007.
- [25] Zásady cytostatické léčby maligních onkologických onemocnění ČOS JEP 2006.
- [26] Coppin C, et al. Cochrane Database Syst Rev 2005.
- [27] Yang JC, Sherry RM, Steinberg SM, et al. Randomized study of high-dose and low-dose interleukin-2 in patients with metastatic renal cancer. J Clin Oncol 2003; 21: 3127–3132.
- [28] Dutcher JP, Fisher RI, Weiss G, et al. Outpatient subcutaneous interleukin-2 and interferon-alpha for metastatic renal cell cancer: five-year follow-up of the Cytokine Working Group Study. Cancer J Sci Am 1997; 3: 157–162.
- [29] Negrier S, Escudier B, Lasset C, et al. Recombinant human interleukin-2, recombinant human interferon alfa-2a, or both in metastatic renal-cell carcinoma. N Engl J Med 1998; 338: 1273–1278.
- [30] Atkins M, Regan M, McDermott D, et al. Carbonic anhydrase IX expression predicts outcome of interleukin 2 therapy for renal cancer. Clin Cancer Res. 2005; 11: 3714–3721.
- [31] DeVita VT Jr, Hellman S, Rosenberg SA, et al. Cancer Principles and Practice of Oncology. 6th ed. Philadelphia: Lippincott Williams and Wilkins, 2001.
- [32] Hudes G, Carducci M, Tomczak P, et al. A phase 3, randomized, 3 arm study of temsirolimus or interferon-alpha or the combination of TEMSR + IFN in the treatment of first line, poor-risk with advanced renal cell carcinoma. J Clin Oncol 2006; 24 (Suppl. 1): 2s. Abstract 4.
- [33] Ozols RF, Herbst RS, Colson YL, et al. Clinical cancer advances 2006: Major research advances in cancer treatment, prevention, and screening – a report from the American Society of Clinical Oncology. J Clin Oncol 2007; 25: 146–162.