Tigecyklin
Nozokomiální nákazy způsobené rezistentními mikroorganismy zvyšují náklady na léčbu i počet úmrtí pacientů a jsou závažným problémem všech zdravotních systémů. Tigecyklin je nové širokospektré antibiotikum ze skupiny glycylcyklinů, semisyntetických derivátů tetracyklinů, které se vyznačuje účinností na problémové vysoce rezistentní grampozitivní i gramnegativní mikroorganismy. Zkušenosti s podáváním tigecyklinu jsou zatím omezeny, nejvíc klinických studií bylo provedeno u pacientů s komplikovanými infekcemi kůže a měkkých tkání a s komplikovanými nitrobřišními infekcemi. Tigecyklin je novým alternativním antibakteriálním agens pro pacienty, u nichž je v anamnéze zjištěna alergie na léčbu b-laktamovými antibiotiky nebo jsou-li dosud používaná antibiotika pro ně toxická.
Úvod
Prevence nozokomiálních nákaz je cílem všech zdravotních systémů. Ve Spojených státech je incidence nozokomiálních infekcí 2 miliony případů za rok. Tyto infekce zvyšují náklady na léčbu o 2–11 miliard (bilionů) $ a počty úmrtí na 20 000–88 000 ročně [1]. V ČR nejsou úplná čísla známá, ale situace bude podobná. Problémovými mikroorganismy, jejichž incidence v posledních letech významně stoupá, jsou jak grampozitivní bakterie, jmenovitě meticilin-rezistentní stafylokoky (MRSA), vancomycin-intermediárně rezistentní stafylokoky (VISA), vancomycin-rezistentní enterokoky (VRE), tak multirezistentní kmeny gramnegativních bakterií Acinetobacter baumannii a Stenotrophomonas maltophilia, ale také Escherichia coli [1]. Nozokomiální nákazy představují nebezpečí zejména pro pacienty jednotek intenzivní péče. Incidence nozokomiálních infekcí vyvolaných grampozitivními meticilin-rezistentními kmeny Staphylococcus aureus (MRSA) v posledních letech v České republice významně stoupá. Výsledky monitorování antibiotické rezistence původců invazivních infekcí, sledované v rámci EARSS (European Antimicrobial Resistance Surveillance System), prokázaly trvalé zvyšování počtu infekcí způsobených tzv. problémovými multirezistentními bakteriemi, jako jsou Staphylococcus aureus rezistentní k léčbě oxacilinem (MRSA), Enterococcus faecium rezistentní k léčbě vankomycinem (VRE) a producenti širokospektré b-laktamázy (ESBL), zejména E. coli [2].
V posledních letech se objevily na trhu látky jako linezolid a daptomycin, účinné proti rezistentním grampozitivním kokům, ale neúčinné v léčbě onemocnění vyvolaných multirezistentními gramnegativními bakteriemi. Kromě toho b-laktamová antibiotika používaná v současné době k léčení infekcí způsobených problémovými gramnegativními mikroorganismy nelze pacientům s přecitlivělostí k b-laktamům podat.
Tigecyklin
Novým léčivem se širokým spektrem a účinností u onemocnění vyvolaných problémovými vysoce rezistentními grampozitivními i gramnegativními mikroorganismy je tigecyklin, nové antibiotikum ze skupiny glycylcyklinů. Glycylcykliny jsou semisyntetické deriváty tetracyklinů.
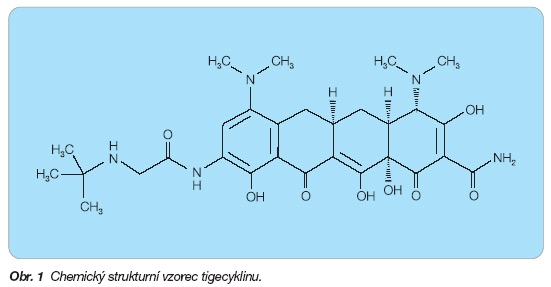
Tigecyklin je první glycylcyklin v klinickém používání. Jedná se o 9-t-butylglycyl-amido derivát minocyklinu (obr. 1).
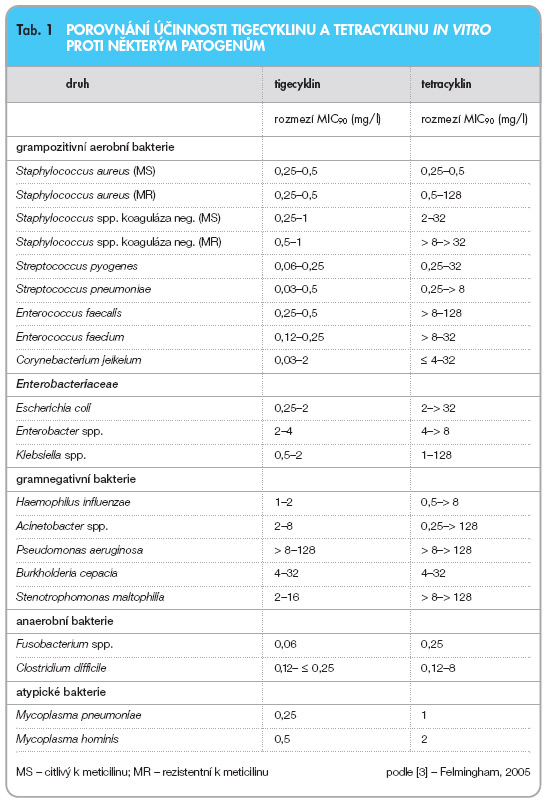
Patří mezi antibiotika se širokým spektrem účinku, která nejsou inaktivována klasickými mechanismy rezistence k tetracyklinům, jako je eflux z buňky mikroba nebo zabránění vazbě na jeho ribozom. Tigecyklin se na ribozomy váže s vyšší afinitou a v jiné prostorové orientaci než tetracykliny. In vitro je tigecyklin aktivní proti mnoha grampozitivním, gramnegativním, atypickým i anaerobním bakteriím. Na kmeny jednoho druhu bakterií působí tigecyklin stejně bez ohledu na jejich citlivost nebo rezistenci k jiným antibiotikům [3, 4]. Zvláště významná je tato skutečnost u kmenů bakterií rezistentních k lékům volby, jejichž počet v ČR vzrůstá. Patří mezi ně Staphylococcus aureus rezistentní k oxacilinu (MRSA), Enterococcus faecium rezistentní k vankomycinu (VRE) a producenti širokospektré b-laktamázy (ESBL), zejména E. coli. Vzhledem k tomu, že při vyšetření citlivosti bakterií in vitro se aktivita tigecyklinu může oxidací snižovat, je zapotřebí používat čerstvé půdy pro vyšetření citlivosti [2, 3]. Patogeny čeledi Proteeae (Proteus spp, Providentia spp a Morganella spp) jsou všeobecně méně citlivé na tigecyklin než ostatní členové Enterobacteriaceae. Přirozeně rezistentními mikroorganismy jsou pseudomonády. V tab. 1 jsou uvedeny MIC90 některých mikroorganismů v porovnání s tetracyklinem [3]. Glycylcykliny působí bakteriostatickým účinkem in vivo v závislosti na čase a mají postantibiotický efekt: od 1,8 hod. pro E. coli do 4,1 hod. pro S. aureus. V experimentu na zvířatech byl pozorován baktericidní efekt u endokarditidy u krys s MRSA a proti S. pneumoniae.
Farmakokinetické vlastnosti
Tigecyklin je určen pouze pro nitrožilní aplikaci. V klinických studiích in vitro se váže na plazmatické bílkoviny v 71–89 %. Farmakokinetické studie u zvířat i lidí prokázaly jeho snadnou distribuci do tkání. Distribuční objem se u člověka pohybuje v rozmezí 7–9 l/kg, zdánlivý distribuční objem v ustáleném stavu (VSS) byl 500–700 l. AUC0–12h (plocha pod křivkou plazmatických koncentrací) v ustáleném stavu byla 2349 Î 850 ng . h/ml. Renální clearance (ClR) u zdravých dobrovolníků byla 0,03 l/h/kg, což je 10–15 % systémové clearance tigecyklinu (0,2–0,3 l/h/kg). Eliminační poločas (t1/2) je 36 hodin. Eliminuje se z organismu biliární exkrecí. Přibližně 14–17 % tigecyklinu se vylučuje v nezměněné formě močí a méně než 14 % stolicí. Studie ukázaly, že u osob s renálním postižením není nutné měnit dávkování tigecyklinu. Ovšem u nemocných se závažným jaterním postižením se následná dávka (první dávka je 100 mg) snižuje na 25 mg [5, 6]. Existuje jen málo studií, které by sledovaly průnik tigecyklinu přes hematoencefalickou bariéru. U 17 zdravých dobrovolníků bylo dosaženo v nezánětlivém mozkomíšním moku po podání 100 mg tigecyklinu od 5,5 % do 52,4 % sérové koncentrace [7].
Předběžné klinické zkušenosti
V klinickém použití je tigecyklin v USA od června 2005. FDA registroval tuto látku pro léčbu komplikovaných infekcí kůže a podkoží a komplikovaných infekcí intraabdominálních u osob starších 18 let.
Zkušenosti s podáváním tigecyklinu jsou zatím omezené. Nejvíc klinických studií bylo provedeno u pacientů s komplikovanými infekcemi kůže a měkkých tkání a u nemocných s komplikovanými nitrobřišními infekcemi. Klinické studie u komplikovaných infekcí kůže a podkoží byly většinou srovnávací. Nejčastějším typem infekce u pacientů léčených tigecyklinem byla celulitida (59 %), resp. velké abscesy kožní (27,5 %), dále bylo do studií zařazeno několik pacientů s diabetickou nohou. Jen ojediněle byly zařazeny osoby s komorbiditou (diabetes, onemocnění periferních cév, intravenózní narkomani, HIV). Málo zkušeností je doposud s farmakoterapií pacientů s bakteriémií [4, 8–11].
V klinických studiích u komplikovaných nitrobřišních infekcí byla léčba tigecyklinem nejčastěji indikována u pacientů s komplikovanou apendicitidou, méně často u komplikované cholecystitidy, intraabdominálního abscesu či při perforaci střev, duodena a žaludku. Více než tři čtvrtiny z těchto nemocných měly průběh infekce komplikovaný difuzní peritonitidou. V klinických studiích byl počet pacientů se závažnými základními chorobami omezen [4, 9, 11].
Nežádoucí účinky
Celkový počet pacientů léčených tigecyklinem v klinických studiích ve fázi III byl 1415. Nežádoucí účinky byly hlášeny přibližně u 41 % pacientů, 5 % pacientů muselo léčbu přerušit [6, 12]. Přehled nejčastějších nežádoucích účinků je uveden v tab. 2.
Terapeutické indikace
Tigecyklin je indikován k léčbě komplikovaných infekcí kůže a měkkých tkání, zejména u nozokomiálních infekcí vyvolaných MRSA, a k léčbě komplikovaných intraabdominálních infekcí (se smíšenou grampozitivní i gramnegativní flórou). Podává se pouze nitrožilně v infuzi po dobu 30–60 minut, iniciální dávka je 100 mg, následována dávkou 50 mg každých 12 hodin po dobu 5–14 dnů. U pacientů se závažnou komplikovanou nitrobřišní infekcí (např. při perforaci střev) nebo u pacientů se sepsí je vhodné zvážit možnost kombinované antibakteriální léčby. Nedoporučuje se podávat dětem a mladistvým do 18 let věku. Pro tuto věkovou kategorii nejsou k dispozici dostatečná data o bezpečnosti a účinnosti. Protože antibiotika glycylcyklinové skupiny jsou strukturálně podobná tetracyklinům, mohou mít nežádoucí účinky podobné tetracyklinové skupiny antibiotik, jako je fotosenzitivita, pseudotumor cerebri, pankreatitida a antianabolické působení. Tigecyklin může prodloužit jak protrombinový čas (PT), tak aktivovaný parciální tromboplastinový čas (aPTT), a proto je nutné důkladně sledovat koagulační testy, je-li tigecyklin podáván současně s antikogulancii. Jako u všech širokospektrých antibiotik je potřeba sledovat i možný vznik pseudomembranózní kolitidy.
Závěr
Tigecyklin je novým alternativním antibakteriálním agens, které je vhodné pro léčbu rezistentních infekcí vyvolaných gramnegativními a grampozitivními bakteriemi. Léčba tigecyklinem je vhodná zejména u těch pacientů, u nichž je v anamnéze zjištěna alergie na léčbu b-laktamovými antibiotiky nebo jsou-li dosud používaná antibiotika pro ně toxická [8].
Seznam použité literatury
- [1] Felminghman D. Preface and Summary. J Chemother 2005; 17 (S1): 3–4.
- [2] Urbášková P, Jakubů V, Žemličková H, et al. Rezistence k antibiotikům u sedmi druhů invazivních bakterií, sledovaných v rámci EARSS v České republice v letech 2000–2006. Prakt Lék 2007; 87 (1): 32–39.
- [3] Felmingham D. Tigecycline – the first glycylcycline to undergo clinical development: an overview of in vitro activity compared to tetracycline. J Chemother 2005; 17 (S1): 5–11.
- [4] Frampton JE, Curran MP. Tigecyclin. Drugs 2005; 65: 2623–2635.
- [5] Greer ND. Tigecycline (Tygacil): the first in the glycylcycline class of antibiotics. Proc (Bayl. Univ. Med. Cent.) 2006; 19: 155–161.
- [6] Rello J. Pharmacokinetics, pharamacodynamics, safety and tolerability of tigecycline. J Chemother 2005; 17 (S1): 12–22.
- [7] Townsend ML, Pound MW, Drew RH. Tigecycline: a new glycylcycline antimicrobial. Int J Clin Pract 2006; 60: 1662–1672.
- [8] Kasbekar N. Tigecycline: A new glycylcyclin antimicrobial agent. Am J Health-Syst Pharm 2006; 63: 1235–1243.
- [9] Noskin GA. Tigecyclin: A new glycylcycline for treatment of serious infections. Clin Infect Dis 2005; 41 (Suppl. 5): S303–S314.
- [10] Pankey GA. Tigecyclin. J Amer Chemother 2005; 56: 470–480.
- [11] Wilcox MH. Efficacy of tigecycline in complicated structure infections and complicated intra-abdominal infections. J Chemother 2005; 17 (S1): 23–29.
- [12] Tygacil®, tigecycline IV. Souhrn údajů o přípravku. Wyeth®.