Yescarta ‒ nová naděje pro pacienty s relabovaným difuzním velkobuněčným lymfomem?
Souhrn:
Polgárová K, Trněný M. Yescarta ‒ nová naděje pro pacienty s relabovaným difuzním velkobuněčným lymfomem? Remedia 2019; 29: 472–476.
B buněčné non‑hodgkinské lymfomy (B‑NHL) představují nejčastější hematologickou malignitu dospělého věku. I přes extenzivní snahy a rychle postupující výzkum je chemoterapeutický režim (R‑)CHOP již po několik desetiletí pilířem jejich terapie. U části pacientů je však tato nemoc ke standardní chemoterapii refrakterní nebo časně relabuje. Prognóza těchto pacientů je špatná, proto je dnes velká pozornost věnována novým možnostem léčby, především využití imunoterapie. Jeden z nejslibnějších objevů představují T lymfocyty s chimérickým antigenním receptorem (chimeric antigen receptor T, CAR T) specifickým pro CD19. Příkladem těchto produktů vytvořených z autologních T lymfocytů je i axicabtagene ciloleucel. Jeho efektivitu v léčbě refrakterních či relabovaných B‑NHL prokázaly fáze I a II studie ZUMA‑1, v nichž více než polovina pacientů dosáhla kompletní remise (58 %; 83 % celková odpověď), což znamená ve srovnání s historickou kohortou výrazné zlepšení. Navíc 39 % nemocných setrvalo v remisi i po dvouletém sledování. Tato příznivá data potvrdila i retrospektivní analýza několika kohort pacientů léčených axicabtagene ciloleucelem po jeho schválení americkým Úřadem pro kontrolu potravin a léčiv (FDA).
Summary:
Polgarova K, Trneny M. Yescarta – new hope for patients with relapsed diffuse large‑cell lymphoma? Remedia 2019; 29: 472–476.
B‑cell non‑Hodgkin lymphomas (B‑NHL) represent the most common hematological malignancy of adulthood. Despite extensive efforts and advanced research, the (R‑)CHOP chemotherapy regimen has been a therapy standard for decades. However, in some patients, the disease is refractory to this standard treatment or it relapses early, worsening their prognosis dramatically. Thus, great attention is paid to new treatment options, especially the use of immunotherapy. One of the most promising discoveries is the CD19‑specific T‑lymphocytes with chimeric antigen receptor (CAR T). Axicabtagene ciloleucel is one of the first FDA approved products, prepared from autologous T‑lymphocytes. Its effectiveness against refractory or relapsed B‑NHL has been demonstrated in Phase I and II of the ZUMA‑1 trial, in which more than half of the patients achieved complete remission (58%; overall response 83%), which is unprecedented success compared to the historical cohort with the same diagnosis. Moreover, 39% of patients remained in remission after two years of follow‑up observation. These favorable data were also confirmed “in real world” by retrospective analyses of several patients’ cohorts treated with axicabtagene ciloleucel after its approval by the FDA.
Key words: chimeric antigen receptor, immunotherapy, axicabtag
ene ciloleucel, diffuse large B‑cell lymphoma.
Úvod
Difuzní velkobuněčný B lymfom (diffuse large B cell lymphoma, DLBCL) je nejčastěji se vyskytujícím podtypem non Hodgkinova lymfomu (NHL). I přes intenzivní snahy se zatím nepodařilo najít lepší terapii, než je na antracyklinu založený režim s přidáním rituximabu – R CHOP. Difuzní velkobuněčný B lymfom představuje potenciálně kurabilní onemocnění a zmíněná standardní chemoimunoterapie vede k dosažení kompletní remise (CR) u přibližně 60 % nemocných [1]. Pacienti s refrakterní nemocí a pacienti po relapsu (R/R) jsou léčeni záchrannou terapií a v případě chemosenzitivity nemoci jsou za ideálních okolností směrováni k autologní transplantaci (autologous stem cell transplantation, ASCT). V dalších liniích léčby a u vysoce selektované skupiny pacientů je pak alternativou při dosažení odpovědi i alogenní transplantace kostní dřeně (aloSCT), která se nicméně pojí s vysokým rizikem komplikací a s úmrtností (kromě relapsu) kolem 25 % [2,3]. Část nemocných není schopna SCT podstoupit v důsledku komorbidit či poléčebných toxicit, nebo je jejich nemoc refrakterní k terapii. Tito pak mají mimořádně špatnou prognózu s mediánem přežití 4,4 měsíce, resp. ročním přežitím 23 % [4,5]. U pacientů s primárně chemorezistentní chorobou nebo časným relapsem po ASCT činí medián přežití 6,3 měsíce a odpověď na další linii léčby se podaří navodit pouze u 26 % nemocných (CR pouze u 7 %) [6]. To je v ostrém kontrastu s prognózou pacientů, kteří dosáhnou a udrží CR alespoň dva roky, kde celkové přežití (overall survival, OS) po pěti letech činí 87,6 % [7]. Opakovaně se tak ukazuje, že za použití konvenční chemoterapie je navození odpovědi a její trvání po léčbě první linie v jasné korelaci s celkovým dlouhodobým přežitím. Proto je věnováno intenzivní úsilí hledání nových léčebných strategií, které by pacientům s R/R lymfomem přinesly naději. Pozornost se aktuálně obrací především k imunoterapii – vedle nových monoklonálních protilátek, případně konjugátů protilátek s cytostatiky [8,9] nebo checkpoint inhibitorů [10], jsou to hlavně bispecifické protilátky [11,12] a T lymfocyty s chimérickým antigenním receptorem (chimeric antigen receptor T, CAR T) [13], které využívají cytotoxické působení T lymfocytů pacienta ve snaze obejít mechanismy chemorezistence a úniku z imunitní kontroly [13]. Z těchto zmíněných principů se nejslibněji jeví léčba CAR T.
První zmínky o využití
imunitního systému v terapii nádorů se objevily na přelomu
19. a 20. století, kdy zánět indukovaný
bakteriálními toxiny vedl k regresi sarkomů měkkých tkání
[14]. První využití T lymfocytů v léčbě
malignity (melanomu) pak bylo publikováno v roce 1988
[15]; rok nato byl vytvořen první
chimérický receptorový konstrukt [16].
Chimérický antigenní receptor je arteficiální produkt, který
obsahuje tři domény ‒ extracelulární doménu vázající
(nádorový) antigen a intracelulární kostimulační a TCR
(T buněčný receptor) signalizační domény (CD28 či 4 1BB,
resp. CD3e), obrázek 1.
Pro potřeby CAR T terapie jsou T lymfocyty ex
vivo transformované, aby vedle svéh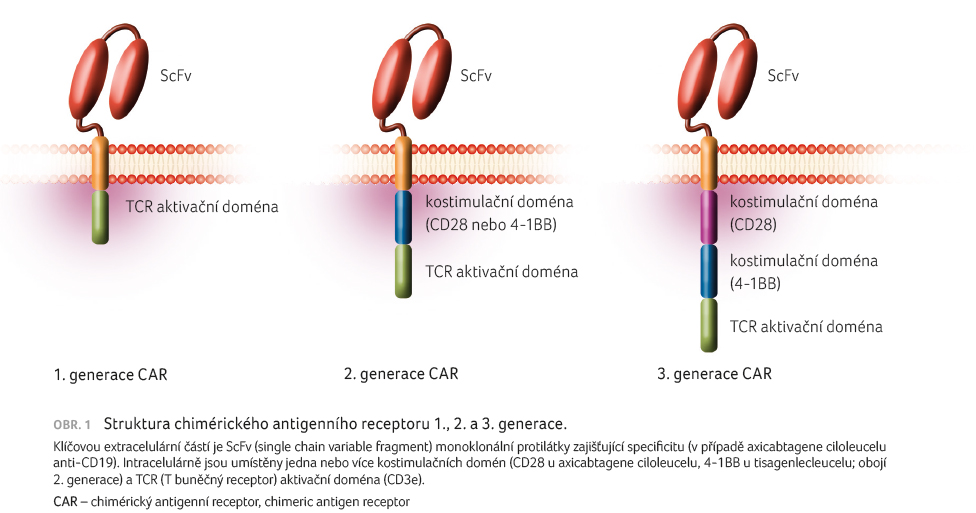 o přirozeného TCR
exprimovaly i tento chimérický s vysokou specificitou.
První generace CAR T měla poměrně malou antitumorovou efektivitu,
především v důsledku omezené aktivace a expanze
aktivovaných buněk. Příčinou byla IL 2 dependentní
aktivace s absencí dalších kostimulačních signálů
[17,18]. Zlepšení antitumorové aktivity
pak přinesla druhá generace CAR T s již obsaženou doménou
pro kostimulační signál (CD28 či 4 1BB), která je nezbytná
k zajištění adekvátní aktivity. Produkty této druhé
generace se pak dostaly i do klinické praxe [13].
Jednotlivé CAR T buněčné produkty se liší mimo jiné právě
v tomto kostimulačním signálu, což podmiňuje i jejich
další vlastnosti – aktivaci, expanzi či délku odpovědi
[13]: konstrukty s CD28 doménou
výrazněji expandují; produkty s 4 1BB doménou mají
zase delší perzistenci. Třetí generace CAR T obsahuje dvě
kostimulační domény [19], nicméně se
u ní popisují fulminantní cytokinové bouře s fatálním
následkem [20]. V současnosti není
k dispozici studie, která by tyto různé produkty přímo
srovnávala.
o přirozeného TCR
exprimovaly i tento chimérický s vysokou specificitou.
První generace CAR T měla poměrně malou antitumorovou efektivitu,
především v důsledku omezené aktivace a expanze
aktivovaných buněk. Příčinou byla IL 2 dependentní
aktivace s absencí dalších kostimulačních signálů
[17,18]. Zlepšení antitumorové aktivity
pak přinesla druhá generace CAR T s již obsaženou doménou
pro kostimulační signál (CD28 či 4 1BB), která je nezbytná
k zajištění adekvátní aktivity. Produkty této druhé
generace se pak dostaly i do klinické praxe [13].
Jednotlivé CAR T buněčné produkty se liší mimo jiné právě
v tomto kostimulačním signálu, což podmiňuje i jejich
další vlastnosti – aktivaci, expanzi či délku odpovědi
[13]: konstrukty s CD28 doménou
výrazněji expandují; produkty s 4 1BB doménou mají
zase delší perzistenci. Třetí generace CAR T obsahuje dvě
kostimulační domény [19], nicméně se
u ní popisují fulminantní cytokinové bouře s fatálním
následkem [20]. V současnosti není
k dispozici studie, která by tyto různé produkty přímo
srovnávala.
Nejvíce studovaným cílem pro B lymfoidní malignity včetně DLBCL je CD19, který představuje povrchový antigen B lymfocytů přítomný od časných diferenciačních stadií až po terminální diferenciaci do plazmocytu, a to včetně jejich maligních protějšků. Naopak není exprimován na jiných tkáních, což umožňuje vysokou selektivitu anti CD19 terapie [21]. První úspěchy CAR T v léčbě hematologických malignit byly publikovány v roce 2010 za použití anti CD19 CAR T v léčbě pacienta s opakovaně relabovaným folikulárním lymfomem (FL), který dosáhl parciální remise (PR). Remise trvala sedm měsíců, přičemž progrese byla opět léčena CAR T produktem (FMC63 28Z) s dosažením PR trvajícím po dobu několika let [22,23]. Tato a další práce [24] pak představovaly tzv. proof of principle dále uplatňovaný v širším spektru nových konstruktů a klinických jednotek. Zároveň vedly k rozpoznání nejčastějších toxických projevů, jako jsou syndrom z uvolnění cytokinů (cytokine release syndrome, CRS) či neurotoxicita [22,25]. Dlouhodobější sledování a přibývající studie pak potvrdily nejen účinnost CAR T v navození odpovědí u hematologických malignit, ale i jejich dlouhodobý charakter [26,27]. Aktuálně jsou pro léčbu DLBCL k dispozici dva CAR T přípravky – axicabtagene ciloleucel (axi cel, KTE C19, YescartaTM, Gilead) a tisagenlecleucel (KymriahTM, Novartis). Třetí slibný produkt ‒ lisocabtagene maraleucel (Celgene) ‒ zatím čeká na definitivní výsledky studie fáze I TRANSCEND NHL 001 (NCT02631044) [28]. Tyto přípravky se liší ve svých kostimulačních molekulách, v detailech lymfodeplečních a dávkovacích režimů, nicméně studie jasně prokazují jejich efektivitu. Axicabtagene ciloleucel byl pro léčbu R/R DLBCL schválen americkým Úřadem pro kontrolu potravin a léčiv (FDA) v roce 2017, Evropská léková agentura (EMA) jej schválila pro totéž použití v roce 2018.
Produkce
Produkci CAR T znázorňuje obrázek 2. Prvním
krokem v celém procesu je leukaferéza se sběrem
mononukleárních buněk (ve studii ZUMA 1 s axicabtagene
ciloleucelem 5‒10 × 109 mononukleárních buněk)
s následnou selekcí T lymfocytů,
s transfekcí genu pro CAR pomocí retrovirového vektoru
a expanzí transferovaných T lymfocytů pomocí IL 2
stimulace a anti CD3
protilátek. Tento proces výroby trvá 2‒3 týdny.
Expandované autologní CAR T jsou pak infundovány zpět pacientovi.
Před touto infuzí je potřebná aplikace lymfodepleční
chemoterapie (nejčastěji na bázi fludarabinu
a cyklofosfamidu), která mj. vede
ke snížení počtu regulačních T lymfocytů s následným
vzestupem hodnot stimulačně působících cytokinů jako IL 7
a IL 15. Uvedené
podmínky pak podporují expanzi transfundovaných CAR T a jejich
protinádorovou aktivitu [29]. Efektivita
CAR T není u většiny přípravků vázána na konkrétní
podtyp T lymfocytů (CD4 vs. CD8). Po infuzi CAR T dochází
k expanzi in vivo,
která dosahuje vrcholu typicky mezi 7. a 14. dnem.
Například axicabtagene ciloleucel bývá detekovatelný i přibližně
180 dní od podání [30]. Intenzita
expanze v prvním měsíci po aplikaci přímo koreluje
s efektivitou terapie, jakož i s nežádoucími
účinky. CAR T jsou rovněž označovány jako tzv. živá léčiva.
Vyplývá to z jejich schopnosti dlouhodobě přetrvávat
v organismu a expandovat se zajištěním protinádorového
působení po jediné infuzi.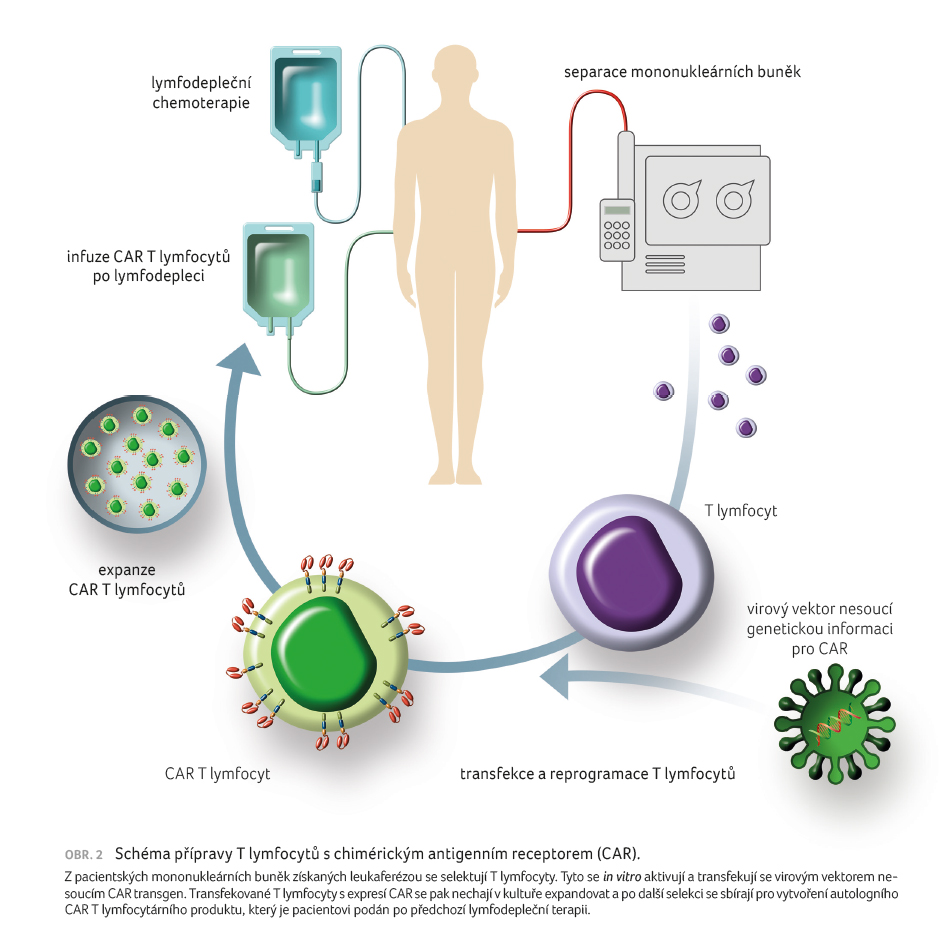
Axicabtagene ciloleucel
Axicabtagene ciloleucel (YescartaTM) představuje CAR T produkt druhé generace namířený proti CD19, využívající CD28 kostimulační doménu. Aplikuje se v dávce 2× 106/kg hmotnosti pacienta (max. 2× 108) po předchozí lymfodepleční terapii (fludarabin 30 mg/m2 a cyklofosfamid 500 mg/m2 s aplikací 5., 4., a 3. den před podáním autologních modifikovaných T lymfocytů). Účinnost axicabtagene ciloleucelu v léčbě R/R DLBCL byla prokázána v klíčové studii fáze I/II ZUMA 1 (NCT02348216) zahájené roku 2015. Do první fáze bylo zahrnuto sedm pacientů, z nichž pět (71 %) na léčbu odpovědělo, z toho čtyři (57 %) dosáhli CR [31]. Část (71 %) pacientů trpěla projevy CRS, většinou stupně 1‒2 (vyjma jednoho nemocného se stupněm 4), všichni pacienti měli projevy neurotoxicity, z toho u tří nemocných (43 %) šlo o stupeň 3. Pacient s CRS stupně 4 měl jako jediný v této studii rovněž projevy neurotoxicity stupně 4 a zemřel na komplikace nasedající na pseudomonádovou sepsi, která se u něj rozvinula.
Na základě těchto výsledků byla zahájena fáze II. Do této multicentrické studie pak bylo zahrnuto 111 pacientů s R/R DLBCL, s primárním mediastinálním lymfomem či s transformovaným FL, axicabtagene ciloleucel byl podán 101 z těchto pacientů [32]. Absence aplikace vyplývala z neúspěšné produkce, z progrese nemoci či z komplikací lymfodepleční léčby. Medián času od leukaferézy po aplikaci činil 17 dní; přemosťující chemoterapie nebyla povolena. Z léčených pacientů dosáhlo CR 54 % (55/101), celková odpověď činila 82 % (83/101). Většina pacientů odpověděla již v prvním měsíci po aplikaci, OS po 12 měsících činilo 59 %. Výsledky nebyly odlišné ani pro skupinu primárně chemorefrakterních DLBCL, což je ve srovnání s historickými kohortami velmi příznivé. Neurotoxicita stupně 3 a CRS komplikovaly průběh u 14 %, resp. 28 % pacientů. Recentně byl publikován follow up těchto 108 pacientů z fáze I a II studie ZUMA 1 [30]. Ukázalo se, že část nemocných pak s delším časovým odstupem (někteří až po 15 měsících) dosáhla lepší odpovědi než při počátečním hodnocení, a to i bez další terapie. Medián trvání odpovědi byl 11 měsíců, mediánu OS nebylo po 27 měsících sledování dosaženo. V obou fázích této studie zemřeli celkem čtyři pacienti – dva v souvislosti s těžkým CRS, dva bez souvislosti s aplikací axicabtagene ciloleucelu. Data získaná ze sledování ZUMA 1 potvrdily i recentně prezentované retrospektivní studie – např. studie prezentovaná loni na kongresu Americké hematologické společnosti Lorettou J. Nastoupil a kol. [33] zahrnovala 165 pacientů s R/R DLBCL léčených axicabtagene ciloleucelem, kde v souladu s předchozími daty dosáhlo odpovědi 79 % a CR 50 % nemocných. Neurotoxicita stupně 3 komplikovala průběh terapie u 31 % pacientů, CRS stupně 3 se vyskytl u 7 % pacientů. Pozoruhodné je, že významná část nemocných nesplňovala kritéria původní studie ZUMA 1 (např. byli po aloSCT, měli anamnézu postižení CNS, hematologickou toxicitu po předchozích léčebných liniích apod.), přesto však dosáhli podobných výsledků s podobným toxickým profilem. Další „real life“ studie uvedené výsledky rovněž potvrdily [34–36]. Čas od leukaferézy do aplikace axicabtagene ciloleucelu byl v těchto studiích ve srovnání se ZUMA 1 delší (21‒27 dnů), přemosťovací terapie ke snížení rizika progrese tak byla u části pacientů potřebná. Zároveň se tyto studie snažily lépe definovat faktory zvyšující riziko výskytu nežádoucích účinků léčby CAR T [36,37]. V současnosti jsou také aktivní studie srovnávající efektivitu axicabtagene ciloleucelu se záchrannou terapií na bázi platiny následovanou ASCT (ZUMA 7, NCT03391466), studie kombinující axicabtagene ciloleucel s rituximabem či s lenalidomidem (ZUMA 14, NCT04002401), studie testující možnosti snížení neurotoxicity (NCT03954106) nebo hodnotící účinnost axicabtagene ciloleucelu v léčbě pacientů s lymfomem z plášťové zóny (ZUMA 2, NCT02601313).
Nežádoucí účinky
Jak vyplývá z předchozího textu, u signifikantního podílu pacientů je léčba komplikována CRS a neurotoxicitou; dalším častým nežádoucím účinkem jsou pak cytopenie, především neutropenie. CRS představuje systémovou zánětlivou odpověď plynoucí z aktivace imunitního systému důsledkem uvolnění cytokinů jako IL 1, IL 6, IL 10, interferon gama (IFNγ) či tumor nekrotizující faktor alfa (TNFα) [38,39]. CRS má širokou škálu projevů, od prosté horečky přes izolovanou orgánovou toxicitu až po cirkulační nestabilitu či syndrom děravých kapilár. Vzácně může progredovat až do fulminantně probíhající hemofagocytární lymfohistiocytózy [40,41]. Závažnější stupeň CRS postihuje 10‒20 % pacientů [31,32]. CRS se obvykle projeví v prvních 14 dnech od aplikace CAR T [21]. Terapeutický přístup je pak závislý na stupni závažnosti a vedle symptomatické léčby spočívá především v inhibici působení klíčového IL 6 pomocí tocilizumabu, případně, dle vývoje, spolu s kortikosteroidy. Tato inhibice, i přes prvotní obavy, neovlivňuje efektivitu terapie [42].
Neurotoxicita je dalším specifickým nežádoucím účinkem, který je pozorován u terapie CAR T. Objevuje se souběžně s CRS nebo po něm a zavedl se pro ni pojem CRES (CAR T cell related encephalopathy syndrome) [41]. Projevy jsou opět široké, od lehkých změn v chování přes akalkulii či fatickou poruchu až po generalizované křeče a vzácně i kóma. Nejčastěji se objevuje v prvním týdnu od aplikace [43]. Patofyziologie je nejasná, předpokládá se porucha hematoencefalické bariéry vlivem aktivovaných T lymfocytů a jejich působků. Aktivovaný endotel pak může atrahovat další buňky s potenciací neurotoxických projevů [44]. Ve většině případů jsou tyto toxické projevy reverzibilní, terapie je podobná jako u prostého CRS s využitím dexametazonu [43].
Závěr
CAR T strategie, tedy i axicabtagene ciloleucel, představují zcela unikátní princip léčby B lymfocytárních malignit. Dosavadní studie prokazují jejich vysokou protinádorovou efektivitu a přinášejí novou naději pacientům s R/R B NHL. Tito měli donedávna za použití konvenční chemoterapie mimořádně nepříznivou prognózu s ročním přežitím 23 %. Výsledky studie ZUMA 1 s téměř 60% přežitím po 18 měsících jsou tedy v tomto kontextu velmi slibné. I přes veškeré velmi specifické komplikace, které s sebou terapie CAR T přináší, představuje tato léčba zcela novou perspektivu v přístupu k pacientům trpícím R/R B NHL.
Seznam použité literatury
- [1] Coiffier B, Lepage E, Briere J, et al. CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large‑B‑cell lymphoma. N Engl J Med 2002; 346: 235–242.
- [2] Rigacci L, Puccini B, Dodero A, et al. Allogeneic hematopoietic stem cell transplantation in patients with diffuse large B cell lymphoma relapsed after autologous stem cell transplantation: a GITMO study. Ann Hematol 2012; 91: 931–939.
- [3] Fenske TS, Ahn KW, Graff TM, et al. Allogeneic transplantation provides durable remission in a subset of DLBCL patients relapsing after autologous transplantation. Br J Haematol 2016; 174: 235–248.
- [4] Van Den Neste E, Schmitz N, Mounier N, et al. Outcome of patients with relapsed diffuse large B‑cell lymphoma who fail second‑line salvage regimens in the International CORAL study. Bone Marrow Transplant 2016; 51: 51–57.
- [5] Pytlik R, Polgarova K, Janikova A, et al. Outcome of patients with relapsed/refractory diffuse large B‑cell lymphoma (DLBCL) not eligible for autologous stem cell transplantation (ASCT). HemaSphere 2018; 2(Suppl 1): 1–1113.
- [6] Crump M, Neelapu SS, Farooq U, et al. Outcomes in refractory diffuse large B‑cell lymphoma: results from the international SCHOLAR‑1 study. Blood 2017; 130: 1800–1808.
- [7] Maurer MJ, Habermann TM, Shi Q, et al. Progression‑free survival at 24 months (PFS24) and subsequent outcome for patients with diffuse large B‑cell lymphoma (DLBCL) enrolled on randomized clinical trials. Ann Oncol Off J Eur Soc Med Oncol 2018; 29: 1822–1827.
- [8] Sehn LH, Herrera AF, Matasar MJ, et al. Polatuzumab Vedotin (Pola) Plus Bendamustine (B) with Rituximab (R) or Obinutuzumab (G) in Relapsed/Refractory (R/R) Diffuse Large B‑Cell Lymphoma (DLBCL): Updated Results of a Phase (Ph) Ib/II Study. Blood 2018; 132: 1683–1683.
- [9] Hicks SW, Lai KC, Gavrilescu LC, et al. The Antitumor Activity of IMGN529, a CD37‑Targeting Antibody‑Drug Conjugate, Is Potentiated by Rituximab in Non‑Hodgkin Lymphoma Models. Neoplasia 2017; 19: 661–671.
- [10] Zhang J, Medeiros LJ, Young KH. Cancer Immunotherapy in Diffuse Large B‑Cell Lymphoma. Front Oncol 2018; 8: 351.
- [11] Goebeler M‑E, Knop S, Viardot A, et al. Bispecific T‑Cell Engager (BiTE) Antibody Construct Blinatumomab for the Treatment of Patients With Relapsed/Refractory Non‑Hodgkin Lymphoma: Final Results From a Phase I Study. J Clin Oncol 2016; 34: 1104–1111.
- [12] Bannerji R, Arnason JE, Advani R, et al. Emerging Clinical Activity of REGN1979, an Anti‑CD20 x Anti‑CD3 Bispecific Antibody, in Patients with Relapsed/Refractory Follicular Lymphoma (FL), Diffuse Large B‑Cell Lymphoma (DLBCL), and Other B‑Cell Non‑Hodgkin Lymphoma (B‑NHL) Subtypes. Blood 2018; 132: 1690–1690.
- [13] Brudno JN, Kochenderfer JN. Chimeric antigen receptor T‑cell therapies for lymphoma. Nat Rev Clin Oncol 2017; 15: 31.
- [14] McCarthy EF. The toxins of William B. Coley and the treatment of bone and soft‑tissue sarcomas. Iowa Orthop J 2006; 26: 154–158.
- [15] Rosenberg SA, Packard BS, Aebersold PM, et al. Use of tumor‑infiltrating lymphocytes and interleukin‑2 in the immunotherapy of patients with metastatic melanoma. A preliminary report. N Engl J Med 1988; 319: 1676–1680.
- [16] Gross G, Waks T, Eshhar Z. Expression of immunoglobulin‑T‑cell receptor chimeric molecules as functional receptors with antibody‑type specificity. Proc Natl Acad Sci U S A 1989; 86: 10024–10028.
- [17] Duell J, Lurati S, Dittrich M, et al. First Generation Chimeric Antigen Receptor Display Functional Defects In Key Signal Pathways Upon Antigen Stimulation. Blood 2010; 116: 2088–2088.
- [18] Lamers CHJ, Sleijfer S, Vulto AG, et al. Treatment of metastatic renal cell carcinoma with autologous T‑lymphocytes genetically retargeted against carbonic anhydrase IX: first clinical experience. J Clin Oncol 2006; 24: 20‒22.
- [19] Hopfinger G, Jäger U, Worel N. CAR‑T Cell Therapy in Diffuse Large B Cell Lymphoma: Hype and Hope. HemaSphere 2019; 3: e185.
- [20] Morgan RA, Yang JC, Kitano M, et al. Case report of a serious adverse event following the administration of T cells transduced with a chimeric antigen receptor recognizing ERBB2. Mol Ther 2010; 18: 843–851.
- [21] Scheuermann RH, Racila E. CD19 Antigen in Leukemia and Lymphoma Diagnosis and Immunotherapy. Leuk Lymphoma 1995; 18: 385–397.
- [22] Kochenderfer JN, Wilson WH, Janik JE, et al. Eradication of B‑lineage cells and regression of lymphoma in a patient treated with autologous T cells genetically engineered to recognize CD19. Blood 2010; 116: 4099–4102.
- [23] Brudno JN, Kochenderfer JN. Chimeric antigen receptor T‑cell therapies for lymphoma. Nat Rev Clin Oncol 2018; 15: 31–46.
- [24] Kochenderfer JN, Dudley ME, Kassim SH, et al. Chemotherapy‑refractory diffuse large B‑cell lymphoma and indolent B‑cell malignancies can be effectively treated with autologous T cells expressing an anti‑CD19 chimeric antigen receptor. J Clin Oncol 2015; 33: 540–549.
- [25] Kochenderfer JN, Dudley ME, Feldman SA, et al. B‑cell depletion and remissions of malignancy along with cytokine‑associated toxicity in a clinical trial of anti‑CD19 chimeric‑antigen‑receptor‑transduced T cells. Blood 2012; 119: 2709–2720.
- [26] Kochenderfer JN, Somerville RPT, Lu T, et al. Long‑Duration Complete Remissions of Diffuse Large B Cell Lymphoma after Anti‑CD19 Chimeric Antigen Receptor T Cell Therapy. Mol Ther 2017; 25: 2245–2253.
- [27] Schuster SJ, Svoboda J, Dwivedy Nasta S, et al. Sustained Remissions Following Chimeric Antigen Receptor Modified T Cells Directed Against CD19 (CTL019) in Patients with Relapsed or Refractory CD19+ Lymphomas. Blood 2015; 126: 183.
- [28] Palomba ML, Garcia J, Wang L, et al. TRANSCEND: Lisocabtagene Maraleucel (liso‑cel; JCAR017) Healthcare Resource Utilization in Patients with Relapsed/Refractory Diffuse Large B‑Cell Lymphoma (DLBCL). Blood 2018; 132: 3545.
- [29] Gattinoni L, Finkelstein SE, Klebanoff CA, et al. Removal of homeostatic cytokine sinks by lymphodepletion enhances the efficacy of adoptively transferred tumor‑specific CD8+ T cells. J Exp Med 2005; 202: 907–912.
- [30] Locke FL, Ghobadi A, Jacobson CA, et al. Long‑term safety and activity of axicabtagene ciloleucel in refractory large B‑cell lymphoma (ZUMA‑1): a single‑arm, multicentre, phase 1‑2 trial. Lancet Oncol 2019; 20: 31–42.
- [31] Locke FL, Neelapu SS, Bartlett NL, et al. Phase 1 Results of ZUMA‑1: A Multicenter Study of KTE‑C19 Anti‑CD19 CAR T Cell Therapy in Refractory Aggressive Lymphoma. Mol Ther 2017; 25: 285–295.
- [32] Neelapu SS, Locke FL, Bartlett NL, et al. Axicabtagene Ciloleucel CAR T‑Cell Therapy in Refractory Large B‑Cell Lymphoma. N Engl J Med 2017; 377: 2531–2544.
- [33] Nastoupil LJ, Jain MD, Spiegel JY, et al. Axicabtagene Ciloleucel (Axi‑cel) CD19 Chimeric Antigen Receptor (CAR) T‑Cell Therapy for Relapsed/Refractory Large B‑Cell Lymphoma: Real World Experience. Blood 2018; 132: 91.
- [34] Spiegel JY, Sahaf B, Hossain N, et al. Elevated Axicabtagene Ciloleucel (CAR‑19) Expansion By Immunophenotyping Is Associated with Toxicity in Diffuse Large B‑Cell Lymphoma. Blood 2018; 132: 576.
- [35] Sano D, Nastoupil LJ, Fowler NH, et al. Safety of Axicabtagene Ciloleucel CD19 CAR T‑Cell Therapy in Elderly Patients with Relapsed or Refractory Large B‑Cell Lymphoma. Blood 2018; 132: 96.
- [36] Jacobson CA, Hunter B, Armand P, et al. Axicabtagene Ciloleucel in the Real World: Outcomes and Predictors of Response, Resistance and Toxicity. Blood 2018; 132: 92.
- [37] Faramand R, Kotani H, Morrissey D, et al. Prediction of CAR T‑Related Toxicities in R/R DLBCL Patients Treated with Axicabtagene Ciloleucel Using Point of Care Cytokine Measurements. Blood 2018; 132: 95.
- [38] Frey N V, Porter DL. Cytokine release syndrome with novel therapeutics for acute lymphoblastic leukemia. ASH Educ Progr B 2016: 567–572.
- [39] Liu D, Zhao J. Cytokine release syndrome: grading, modeling, and new therapy. J Hematol Oncol 2011; 11: 121.
- [40] Barrett DM, Teachey DT, Grupp SA. Toxicity management for patients receiving novel T‑cell engaging therapies. Curr Opin Pediatr 2014; 26: 43–49.
- [41] Neelapu SS, Tummala S, Kebriaei P, et al. Chimeric antigen receptor T‑cell therapy – assessment and management of toxicities. Nat Rev Clin Oncol 2017; 15: 47.
- [42] Shimabukuro‑Vornhagen A, Gödel P, Subklewe M, et al. Cytokine release syndrome. J Immunother Cancer 2018; 6: 56.
- [43] Hunter BD, Jacobson CA. CAR T‑Cell Associated Neurotoxicity: Mechanisms, Clinicopathologic Correlates, and Future Directions. JNCI J Natl Cancer Inst 2019; 111: 646–654.
- [44] Klinger M, Zugmaier G, Naegele V, et al. Pathogenesis‑Based Development of Potential Mitigation Strategies for Blinatumomab‑Associated Neurologic Events (NEs). Blood 2016; 128: 1589.