Benepali – údaje z reálné klinické praxe v zemích Evropské unie a stav v České republice
V rámci satelitního sympozia společnosti Biogen, které bylo součástí letošních Zimních revmatologických dnů pořádaných ve dnech 10.‒12. ledna v Plzni, přednesl prof. MUDr. Jiří Vencovský, DrSc., z Revmatologického ústavu v Praze příspěvek cílený na užívání biosimilárního etanerceptu registrovaného pod názvem Benepali. Uvedená přednáška mapuje údaje z reálné klinické praxe v některých evropských zemích i v České republice.
Benepali je biologický přípravek
(SB4) biosimilární k etanerceptu jako k referenčnímu
produktu. Biosimilars obecně jsou skupinou přípravků
vyráběných biotechnologickými postupy, které jsou odvozeny
od originálních
biologických léků a na trh
jsou uváděny po vypršení
patentové ochrany originálních léků.
V Evropské unii je možné uvedení
biosimilars na trh teprve po absolvování
evropské centralizované
procedury, která je povinná
pro všechny přípravky vyrobené
biotechnologickými postupy. Při ní
jsou vyžadovány srovnávací
preklinické a klinické
studie prokazující
podobnou kvalitu, účinnost a bezpečnost,
jakou má originální
referenční léčivý
přípravek. Doložení účinnosti
a bezpečnosti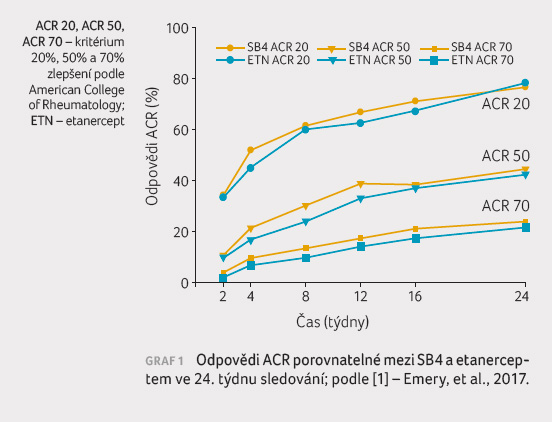 je jedinečné pro každý takový
přípravek a pro každou účinnou
látku, kterou obsahuje.
je jedinečné pro každý takový
přípravek a pro každou účinnou
látku, kterou obsahuje.
Etanercept, solubilní receptor pro tumor nekrotizující faktor alfa (TNFα), je účinný v léčbě revmatoidní artritidy (RA), juvenilní idiopatické artritidy (JIA), psoriatické artritidy (PsA), axiální spondylartritidy (axSpA), ankylozující spondylitidy (AS) a ložiskové psoriázy u dětí i dospělých. Ve stejných indikacích byl schválen rovněž přípravek Benepali.
Účinnost a bezpečnost SB4 versus etanercept
Studie sledující data z reálné
klinické praxe, jež porovnávaly efekt podávání originálního
etanerceptu (Enbrel) 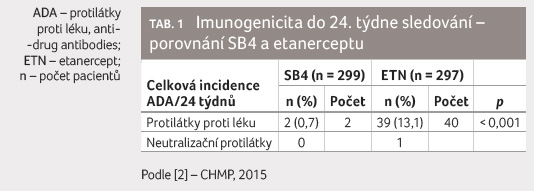 a biosimilárního přípravku SB4,
prokázaly trvalou účinnost a bezpečnost a dobrou
adherenci k léčbě u pacientů, kteří zahájili terapii
SB4. Výsledky uvedených studií byly prezentovány
v rámci loňského výročního kongresu Evropské ligy proti
revmatismu (EULAR) v Madridu. Jedním z klinických
hodnocení byla také studie Emeryho a kol. [1]. Tato
randomizovaná, dvojitě zaslep
a biosimilárního přípravku SB4,
prokázaly trvalou účinnost a bezpečnost a dobrou
adherenci k léčbě u pacientů, kteří zahájili terapii
SB4. Výsledky uvedených studií byly prezentovány
v rámci loňského výročního kongresu Evropské ligy proti
revmatismu (EULAR) v Madridu. Jedním z klinických
hodnocení byla také studie Emeryho a kol. [1]. Tato
randomizovaná, dvojitě zaslep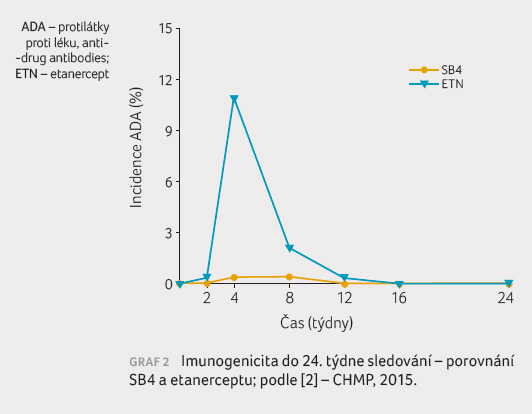 ená, multicentrická studie fáze III
porovnávala účinnost a bezpečnost SB4 a etanerceptu
u pacientů s aktivní RA podstupujících terapii
metotrexátem. Pacienti byli randomizováni do dvou ramen
s dávkou 50 mg SB4 nebo 50 mg etanerceptu subkutánně
podávanou jednou týdně. Primárním cílovým ukazatelem byla
odpověď ACR 20 (20% zlepšení v klasifikačních kritériích
American College of Rheumatology [ACR] pro RA) ve 24. týdnu
(graf 1). Podle
hodnotící zprávy Výboru pro humánní léčivé přípravky
(CHMP) [2] byly u významně menšího počtu osob užívajících
SB4 zaznamenány protilátky proti léku (anti drug antibodies,
ADA) v porovnání s etanerceptovou skupinou (tab. 1,
graf 2).
V souvislosti s imunogenicitou se trend k nižší
odpovědi v kritériích ACR 20 projevil při srovnání
pacientů s ADA a bez ADA
v rameni s etanerceptem, v případě SB4
nebylo možné vzhledem k malému počtu pacientů (n = 2)
tento parametr hodnotit (graf 3).
ená, multicentrická studie fáze III
porovnávala účinnost a bezpečnost SB4 a etanerceptu
u pacientů s aktivní RA podstupujících terapii
metotrexátem. Pacienti byli randomizováni do dvou ramen
s dávkou 50 mg SB4 nebo 50 mg etanerceptu subkutánně
podávanou jednou týdně. Primárním cílovým ukazatelem byla
odpověď ACR 20 (20% zlepšení v klasifikačních kritériích
American College of Rheumatology [ACR] pro RA) ve 24. týdnu
(graf 1). Podle
hodnotící zprávy Výboru pro humánní léčivé přípravky
(CHMP) [2] byly u významně menšího počtu osob užívajících
SB4 zaznamenány protilátky proti léku (anti drug antibodies,
ADA) v porovnání s etanerceptovou skupinou (tab. 1,
graf 2).
V souvislosti s imunogenicitou se trend k nižší
odpovědi v kritériích ACR 20 projevil při srovnání
pacientů s ADA a bez ADA
v rameni s etanerceptem, v případě SB4
nebylo možné vzhledem k malému počtu pacientů (n = 2)
tento parametr hodnotit (graf 3).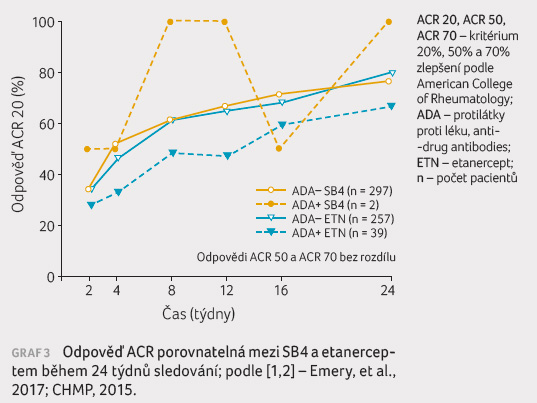
Jiná práce Emeryho a kol. [3] hodnotila v průběhu 52 týdnů terapii SB4 v dávce 50 mg nebo etanerceptem v dávce 50 mg podávanými subkutánně jednou týdně pacientům podstupujícím léčbu metotrexátem s mírnou až těžkou formou RA. Po tomto období byli pacienti z České republiky a Polska převedeni do otevřeného extenzního sledování s terapií SB4 v průběhu dalších 48 týdnů. Účinnost, bezpečnost a imunogenicita byly hodnoceny do 100. týdne (graf 4) [4].
Benepali v evropské klinické praxi
Tabulka 2 přináší přehled biosimilárních léčiv
schválených Evropskou lékovou agenturou (EMA) či americkým
Úřadem 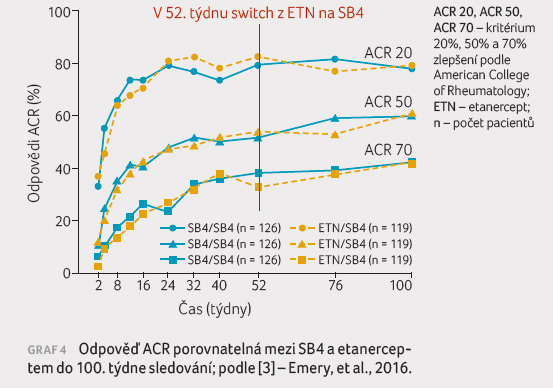 pro kontrolu potravin a léčiv (FDA)
v revmatologických indikacích. Přípravek Benepali bych
schválen EMA v lednu 2016. Z grafu 5 je patrné, v jaké míře byl tento lék užíván
ve vybraných evropských zemích po svém uvedení na trh
[5]. Během časového úseku 18 měsíců se zvýšil počet
pacientů užívajících SB4 na 60 000 osob.
pro kontrolu potravin a léčiv (FDA)
v revmatologických indikacích. Přípravek Benepali bych
schválen EMA v lednu 2016. Z grafu 5 je patrné, v jaké míře byl tento lék užíván
ve vybraných evropských zemích po svém uvedení na trh
[5]. Během časového úseku 18 měsíců se zvýšil počet
pacientů užívajících SB4 na 60 000 osob.
Například dánský
registr zaznamenává klinické výsledky při přechodu
pacientů s RA z terapie etanerceptem k užívání
SB4 (tzv. switch) po pětiměsíčním sledování. Z celkového
počtu 1 548 osob zahrnutých do sledování trpělo RA
891 nemocných, PsA 335 nemocných a SpA 322 nemocných.
Předchozí léčba etanerceptem trvala v průměru 5,2
(3,2‒8,0) roku, přičemž etanercept byl prvním biologickým
přípravkem v případě 49 % pacientů a druhým
biologickým přípravkem v případě 33 % pacientů.
Souběžnou terapii metotrexátem podstoupilo 60 % osob s RA,
49 % osob s PsA a 15 % osob se SpA. Ke vzplanutí
choroby v době tří měsíců před změnou léku a v době
tří měsíců po této změně došlo u 8 %/13 %
pacientů s RA, u 9 %/13 % pacientů s PsA
a u 5 %/5 % pacientů se SpA. Pouze 129 osob (9 %)
ukončilo léčbu SB4 během pětiměsíčního sledování. Vyšší
skóre VAS (hodnocení celkové bolesti pacientem) a absence
metotrexátu na počátku terapie byly asociovány s ukončením
léčby [6].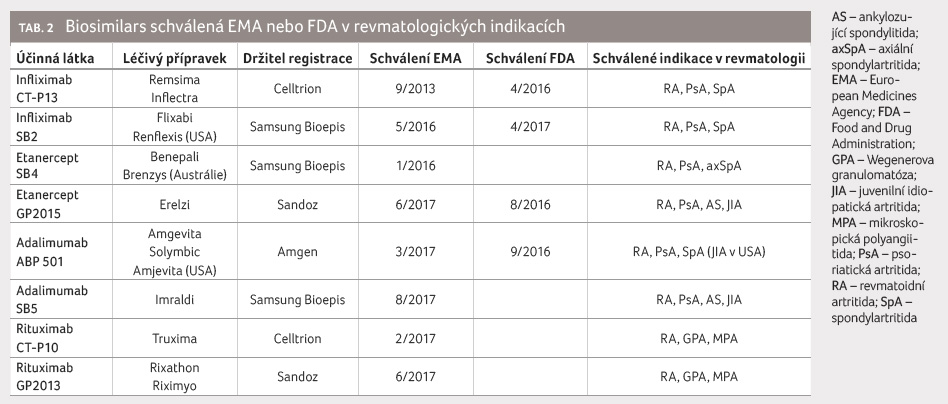
Hodnocení switche z etanerceptu
na SB4 proběhlo rovněž ve Švédsku, kde bylo sledováno
celkem 147 pacientů, z toho 76 trpících RA, 28 s PsA, 13
s axSpA, 12 trpících AS, 10 s nespecifickou
artritidou a osm pacientů s JIA. Po osmi
měsících užívalo SB4 126 osob (86 %). Devět pacientů
zažádalo o zpětný přechod k podávání etanerceptu
beze změny aktivity choroby, sedm pacientů léčbu ukončilo
z důvodu remise onemocnění. Pět pacientů bylo převedeno
na terapii jinými biologickými léky z důvodu
nedostatečného účinku dosavadní léčby, který byl však
rovněž přítomen při terapii etanerceptem. Skóre aktivity nemoci
DAS 28 bylo v případě RA zaznamenáno v hodnotě 2,8
před změnou přípravku a 2,79 po jeho změně,
v případě PsA 2,54 před změnou léčby a 2,06 po její
změně [7].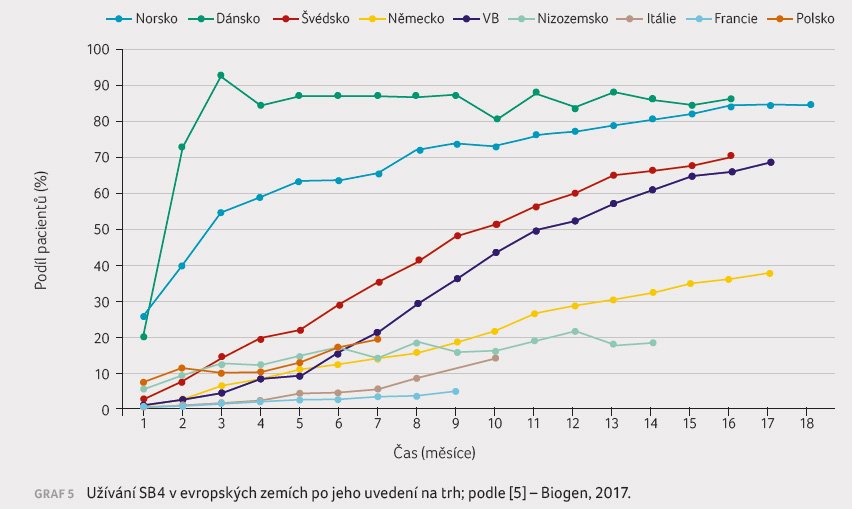
Převedení pacientů z terapie etanerceptem na SB4 ve Velké Británii bylo v rámci sledování celkem 92 osob doprovázeno jejich důslednou edukací, jejímž výsledkem byl souhlas se změnou léčby u 99 % nemocných. Do hodnocení bylo zařazeno 58 pacientů s RA, 15 s AS, 16 s PsA a tři pacienti s enteropatickou artritidou, u nichž terapie SB4 trvala minimálně šest měsíců [8].
Také sledování v dalších evropských zemích doložila účinnost a bezpečnost změny terapie na SB4 a její dobré přijetí pacienty.
Benepali v České republice
Český registr
ATTRA je multicentrický systém pro hodnocení průběhu
a výsledků biologické léčby zánětlivých
revmatických onemocnění. Tabulka 3 přináší přehled užití SB4 v České
republice na základě údajů z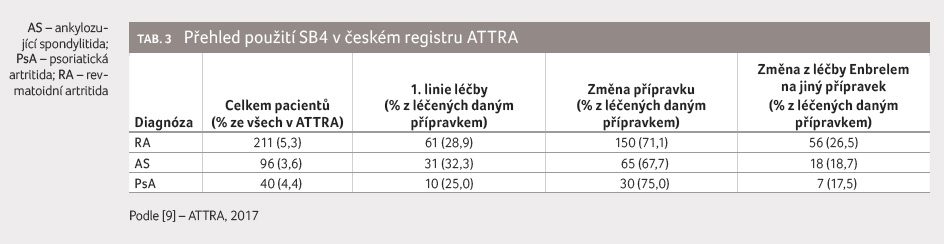 tohoto registru.
tohoto registru.
V období od července 2016
do listopadu 2017 přešlo z terapie etanerceptem k terapii
SB4 celkem 150 pacientů trpících revmatoidní artritidou.
Padesát pět osob změnilo léčbu z farmakoekonomických
důvodů, 42 kvůli ztrátě účinku 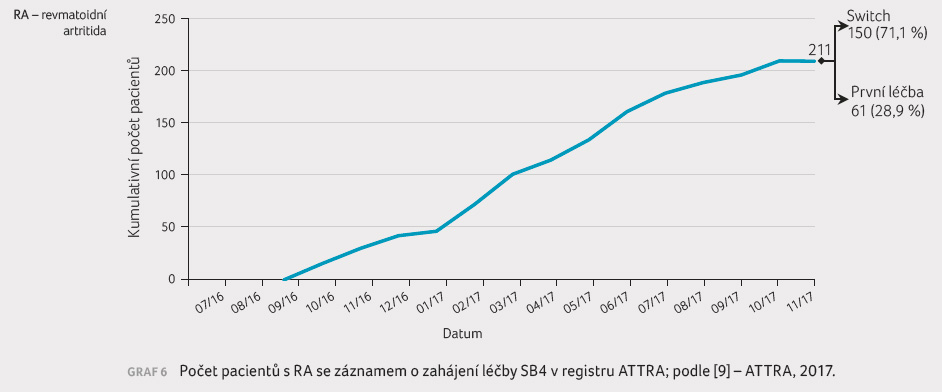
 předchozí terapie (sekundární
selhání), 15 kvůli nežádoucím účinkům,
osm z důvodu neúčinnosti předchozí terapie (primární
selhání), jeden pacient z důvodu remise onemocnění
a 27 osob z jiných či neznámých příčin. V průběhu
stejného časového úseku ukončilo léčbu SB4 celkem 30 pacientů
(14,2 %) – 12 osob z důvodu neúčinnosti předchozí
terapie (primární selhání), sedm osob kvůli nežádoucím
účinkům, čtyři osoby kvůli ztrátě účinku předchozí
terapie (sekundární selhání) a sedm pacientů z jiných
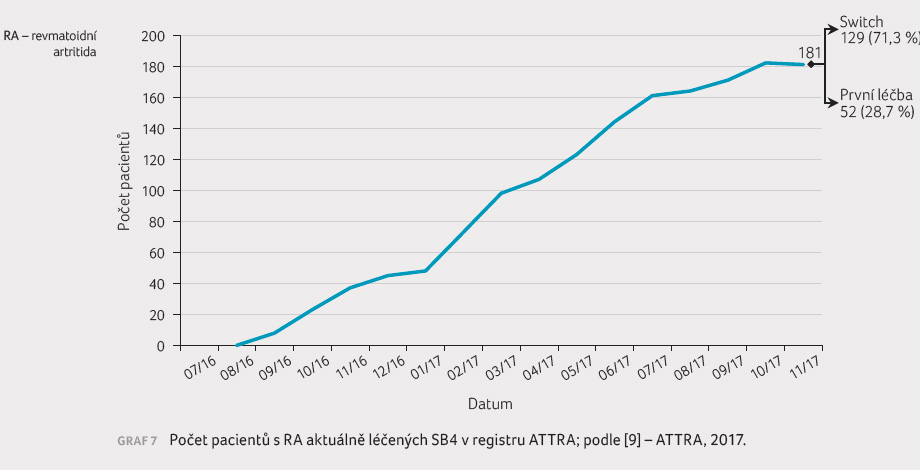
či neznámých důvodů (graf 6,
7). Data o účinnosti
léčby SB4 z hlediska dosažení remise a nízké aktivity
onemocnění u pacientů s RA
(podle DAS 28) ukazuje graf 8.
předchozí terapie (sekundární
selhání), 15 kvůli nežádoucím účinkům,
osm z důvodu neúčinnosti předchozí terapie (primární
selhání), jeden pacient z důvodu remise onemocnění
a 27 osob z jiných či neznámých příčin. V průběhu
stejného časového úseku ukončilo léčbu SB4 celkem 30 pacientů
(14,2 %) – 12 osob z důvodu neúčinnosti předchozí
terapie (primární selhání), sedm osob kvůli nežádoucím
účinkům, čtyři osoby kvůli ztrátě účinku předchozí
terapie (sekundární selhání) a sedm pacientů z jiných
či neznámých důvodů (graf 6,
7). Data o účinnosti
léčby SB4 z hlediska dosažení remise a nízké aktivity
onemocnění u pacientů s RA
(podle DAS 28) ukazuje graf 8.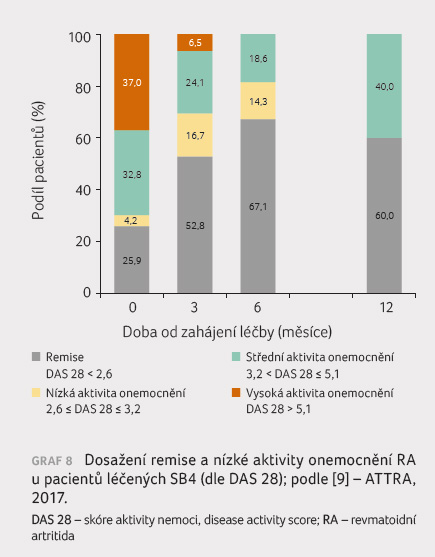
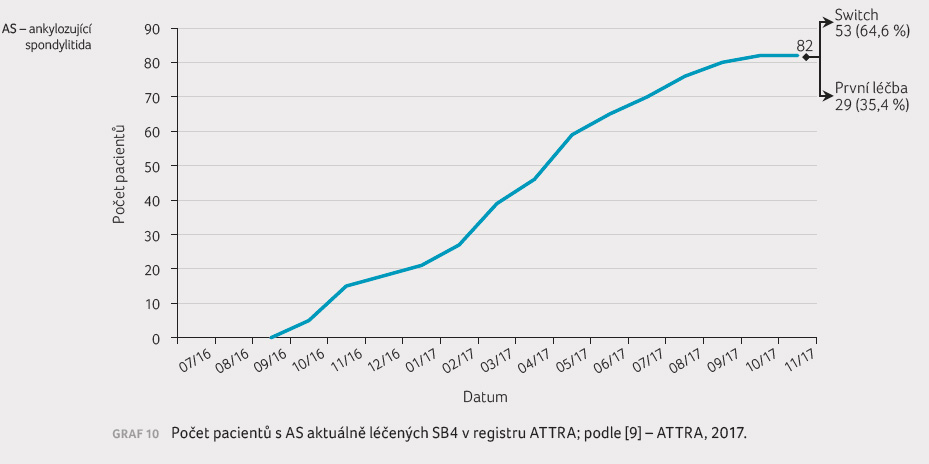
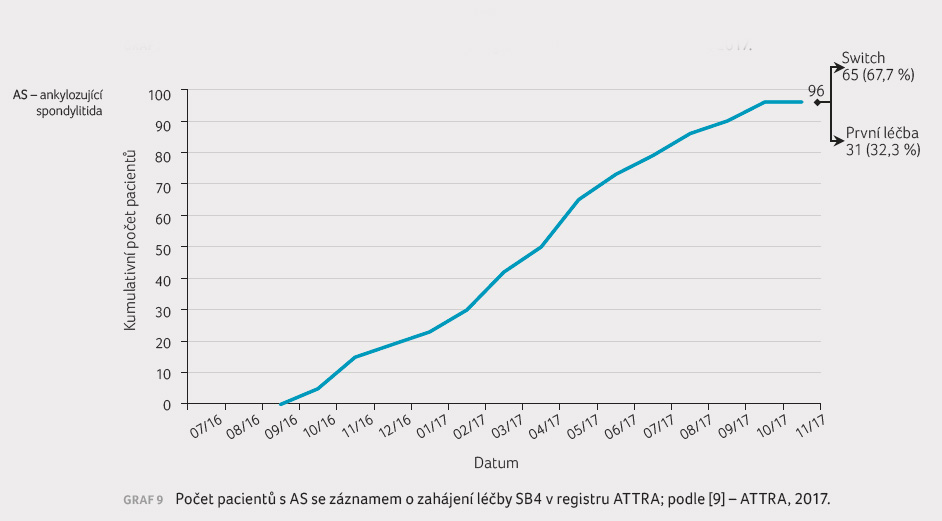
V období od července 2016
do listopadu 2017 přešlo z terapie etanerceptem k terapii
SB4 celkem 65 pacientů trpících ankylozující spondylitidou.
Čtrnáct osob změnilo léčbu
z farmakoekonomických důvodů, 20 kvůli ztrátě účinku
předchozí terapie (sekundární selhání), sedm kvůli nežádoucím
účinkům, sedm z důvodu neúčinnosti
předchozí terapie (primární selhání), 17 osob z jiných
či neznámých příčin. V průběhu stejného časového
úseku ukončilo léčbu SB4 celkem 14 pacientů (14,5 %) –
čtyři osoby z důvodu
neúčinnosti předchozí terapie (primární selhání), čtyři
osoby kvůli nežádoucím účinkům, dvě osoby kvůli ztrátě
účinku předchozí terapie (sekundární selhání) a čtyři
pacienti z jiných či neznámých
důvodů (graf 9, 10).
Data o účinnosti léčby SB4 z hlediska aktivity
onemocnění dle BASDAI u pacientů s AS ukazuje graf 11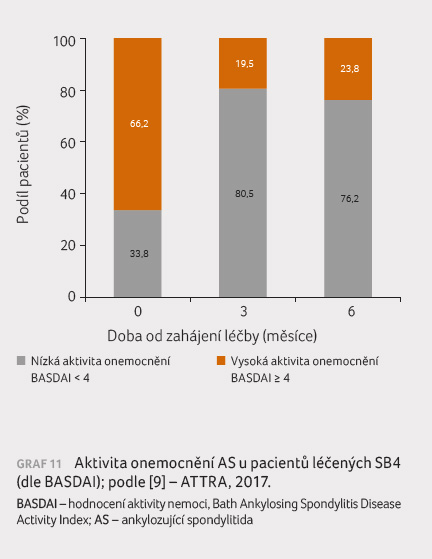 .
.
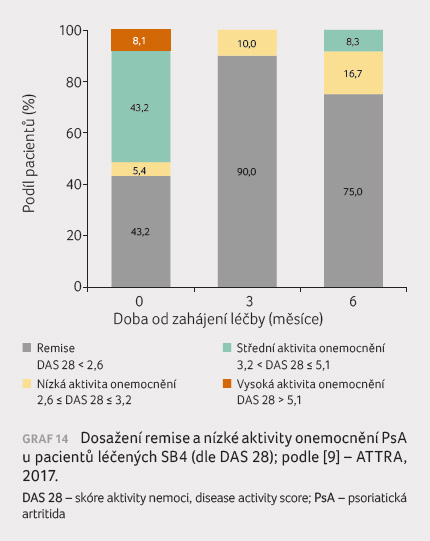
V období od července 2016 do listopadu 2017 přešlo z terapie etanerceptem k terapii SB4 celkem 30 pacientů trpících psoriatickou artritidou. Jedenáct osob změnilo léčbu z farmakoekonomických důvodů, osm kvůli ztrátě účinku předchozí terapie (sekundární selhání), dvě z důvodu neúčinnosti předchozí terapie (primární selhání), devět osob z jiných či neznámých příčin. V průběhu stejného časového úseku ukončilo léčbu SB4 celkem devět pacientů – tři osoby z důvodu neúčinnosti předchozí terapie (primární selhání), tři osoby kvůli nežádoucím účinkům a tři pacienti z jiných důvodů (graf 12, 13). Data o účinnosti léčby SB4 z hlediska dosažení remise a nízké aktivity onemocnění u pacientů s PsA (dle DAS 28) ukazuje graf 14.
Z dostupnýc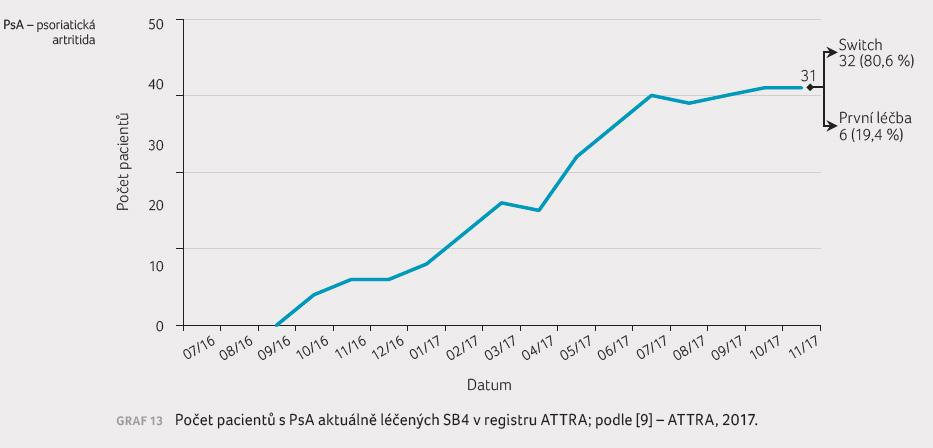 h údajů vyplývá,
že minimální rozdíly v imunogenicitě a kožních
reakcích nejsou překážkou v biosimilaritě SB4 (Benepali)
k referenčnímu přípravku etanerceptu. Přibývají rovněž
údaje z registrů, jež dokládají
pouze nevýznamné změny při přechodu z referenčního
přípravku na biosimilární. V současné době užívá
SB4 podle registru ATTRA celkem 294 nemocných trpících RA, AS
a PsA. Pro 25‒32 % pacientů je to první biologický
přípravek, u ostatních nemocných se jedná
o změnu terapie, včetně přechodu
z referenčního
h údajů vyplývá,
že minimální rozdíly v imunogenicitě a kožních
reakcích nejsou překážkou v biosimilaritě SB4 (Benepali)
k referenčnímu přípravku etanerceptu. Přibývají rovněž
údaje z registrů, jež dokládají
pouze nevýznamné změny při přechodu z referenčního
přípravku na biosimilární. V současné době užívá
SB4 podle registru ATTRA celkem 294 nemocných trpících RA, AS
a PsA. Pro 25‒32 % pacientů je to první biologický
přípravek, u ostatních nemocných se jedná
o změnu terapie, včetně přechodu
z referenčního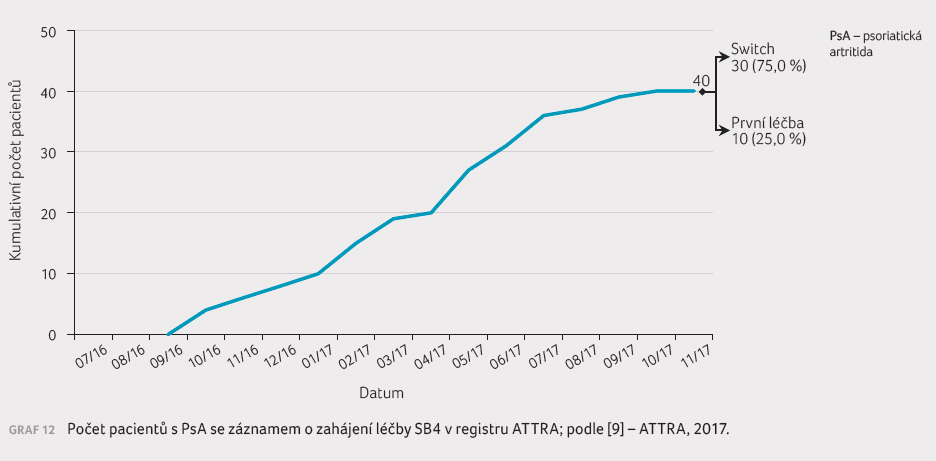 přípravku (podíl switche z etanerceptu
je 23‒37 %).
přípravku (podíl switche z etanerceptu
je 23‒37 %).
Redakčně zpracovala PhDr. Nikola Homolová Richtrová