Brentuximab vedotin – zkušenosti z klinické praxe
Souhrn:
Marková J, Móciková H. Brentuximab vedotin – zkušenosti z klinické praxe. Remedia 2018; 28: 382–386.
Primární léčba Hodgkinova lymfomu (HL) je úspěšná ve více než 80 % případů. Prognóza opakovaných relapsů byla doposud špatná. Zavedení nových léků, jako je brentuximab vedotin (BV), a přípravků anti‑PD‑1 významně zlepšilo prognózu relapsů HL po autologní transplantaci kmenových buněk (autologous stem‑cell transplantation, ASCT). Kazuistika: 32letá pacientka s HL nodulární sklerózou, klinické stadium IVB, IPS 3, byla léčena šesti cykly chemoterapeutického režimu BEACOPP eskalovaný (8–12/2011). Restaging po chemoterapii potvrdil kompletní remisi s PET negativním reziduem v mediastinu 3,5 cm. Radioterapie nebyla indikována. První relaps (časný) se objevil za pět měsíců po první léčbě (5/2012). Salvage: 2× DHAP (dexametazon, cytarabin, cisplatina), radioterapie reziduálního mediastinálního nádoru (30 Gy), vysokodávkovaná chemoterapie BEAM (BCNU, etoposid, cytarabin, melfalan) a ASCT. Tři měsíce po ASCT (12/2012) PET negativní kompletní remise. Druhý časný relaps CD30‑pozitivního HL 06/2013. Léčba: 16 dávek BV (7/2013 až 6/2014). Po čtyřech dávkách nastala významná redukce nádoru a po osmi dávkách BV kompletní remise PET negativní. Polyneuropatie (CTCAE stupeň III) byla jedinou komplikací léčby BV a vymizela rok po poslední infuzi BV. Pacientka odmítla alogenní transplantaci kmenových buněk. PET/CT negativní kompletní remise trvá čtyři roky, pacientka je ve velmi dobrém klinickém stavu. Cílem léčby BV u relabovaného HL po ASCT je dosáhnout dlouhodobé kompletní remise. Léčba nepředstavuje jen přemostění („bridge“) k alogenní transplantaci kmenových buněk a časná alogenní transplantace je otázkou. Zavedení inhibitorů PD‑1 umožňuje odložit rozhodnutí týkající se transplantace alogenních kmenových buněk až do doby dalšího relapsu.
Summary:
Markova J, Mocikova H. Brentuximab vedotin treatment in clinical practice. Remedia 2018; 28: 382–386.
Hodgkin lymphoma (HL) is cured in more than 80% of cases with the first‑line treatment, however, the prognosis of relapses has been poor so far. The introduction of new drugs like brentuximab vedotin (BV) and anti‑PD‑1 preparations significantly improved the prognosis of relapses of HL after autologous stem cell transplantation (ASCT). Case report: 32‑year‑old female patient with HL nodular sclerosis, clinical stage IVB, IPS 3 was treated with 6 cycles of BEACOPP escalated between 08–12/2011. Re‑staging after chemotherapy confirmed a complete metabolic remission with PET‑negative mediastinal mass (3.5 cm). Radiotherapy was not indicated. The first relapse occurred early – 5 months after the first line‑treatment (5/2012). Salvage therapy included: 2 DHAP (dexamethasone, cytarabine, cisplatinum), irradiation of residual mediastinal tumour (30 Gy), high dose chemotherapy BEAM (BCNU, etoposide, cytarabine, melphalan) and ASCT. PET‑negative complete remission 3 months after ASCT (12/2012). The second early relapse of the CD30‑positive HL occured in 06/2013. She received 16 doses of BV (7/2013–6/2014). A significant tumour reduction was observed after 4 doses and a PET‑negative complete remission was confirmed after 8 doses of BV. Polyneuropathy (CTCAE grade III) was the only complication of BV treatment and it disappeared one year after the last infusion of BV. The patient refused allogenic stem cell transplantation. The patient is in continuous complete remission (PET/CT‑negative) lasting 4 years and she is in a very good clinical condition. The goal of BV treatment in relapsed HL after ASCT is to achieve a long‑lasting complete remission and it is not only a bridge to allogenic stem cell transplantation. Currently, the best approach after BV‑observation or early indication to allogenic stem cell transplantation is still a matter of debate. Introduction of PD‑1 inhibitors enables to postpone the decision regarding allogenic stem cell transplantation to the next relapse.
Key words: relapsed Hodgkin lymphoma, autologous stem cell transplantation, brentuximab vedotin.
Úvod
Léčba Hodgkinova lymfomu (HL) patří mezi největší úspěchy v moderní onkologii. Zhruba 70–80 % pacientů jsou mladí lidé ve věku 17–35 let. Z nich dlouhodobě přežívá (podle stadia onemocnění a rizikových faktorů) 75–95 %. Jejich životní naděje je v současné době více než 40 let. Bohužel, pozdní následky úspěšné léčby (především kardiotoxicita a sekundární malignity) zvyšují morbiditu i mortalitu vyléčených pacientů ve srovnání s normální populací. Pacienti s progresí/relapsem HL mají jen 50% naději na vyléčení druhou linií léčby. Indikovaná je záchranná (salvage) terapie s vysokodávkovanou chemoterapií následovaná podporou autologních kmenových buněk (high dose therapy + autologous stem cell transplantation, HDT + ASCT). Pacienti, u nichž z nějakého důvodu není transplantace únosná, dostávají jen standardní záchrannou léčbu, obvykle s platinovými cytostatiky. Špatnou prognózu mají nemocní, kteří po první linii léčby nedosáhli kompletní remise (CR), progredovali do tří měsíců po terapii a/nebo relabovali během prvního roku po ukončené primární léčbě (tzv. časný relaps). Osud primárně refrakterních pacientů nebo pacientů s druhým relapsem (po HDT + ASCT) je tristní (relapsed/refractory Hodgkin lymphoma, RR HL). Většinou umírají během 2−3 let.
Brentuximab vedotin v léčbě Hodgkinova lymfomu
Velkou naději přinesly v posledních
letech studie s ADC (antibody drug conjugate) brentuximab
vedotinem (BV). Monoklonální protilátka anti CD30 je navázaná
bílkovinným můstkem na mitotický toxin monomethyl
auristatin E (MMAE). Brentuximab vedotin působí selektivně
pouze na CD30 pozitivní buňky. Konjugát se naváže na antigen
CD30 H/RS buňky (Hodgkinovy a Reedové–Sternbergovy
buňky) a je transportován do lysozomu. Lysozomální
proteázy štěpí bílkovinnou vazbu monoklonální protilátky
anti CD30 a toxického MMAE, který způsobí destrukci
tubulů (cytoskeletu) a tím zástavu buněčného cyklu
a apoptózu nádorové buňky (obr. 1). Buňky tumoru (H/RS buňky) tvoří v postižené
uzlině jen 0,5–1 %, ostatní jsou buňky zánětlivého pozadí.
Výsledkem je léčba přísně cílená jen na nádorové buňky
[1].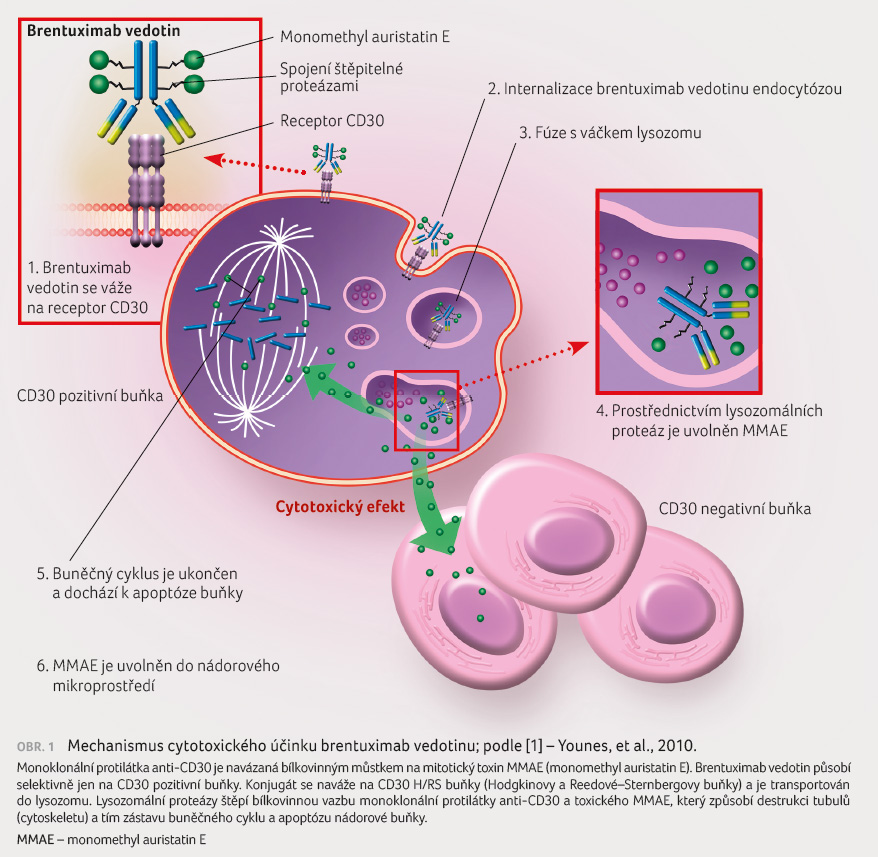
Younes se spolupracovníky prokázal v klinickém hodnocení celkovou odpověď (overall response rate, ORR) po léčbě BV u RR HL 75 %, z toho CR dosáhlo 34 pacientů (33 %) [1,2]. Povzbudivé je konečné hodnocení studie RR HL, která dokumentuje pětileté trvání CR u části pacientů s RR HL léčených jen monoterapií BV [4]. U 13 ze zmíněných 34 pacientů (38 %) trvala CR v době posledního hodnocení více než pět let. Devět z těchto 13 pacientů (9 % všech zařazených pacientů) bylo léčeno jen samotným BV, bez další konsolidační léčby alogenní transplantací. Celkové pětileté přežití (overall survival, OS) celého souboru (102 pacientů) dosahuje 41 % a pětileté přežití bez progrese (progression free survival, PFS) 22 %. Pacienti, kteří dosáhli CR po léčbě BV, mají OS 64 % a PFS 52 %. Konečné hodnocení prokázalo, že část pacientů s RR HL je léčitelná jen monoterapií BV [3,4].
Profil toxicity BV je relativně příznivý. Z nežádoucích účinků je nejvýznamnější neurotoxicita (kumulativní dávka BV), jejíž příčinou je antitubulární toxicita MMAE v distálních neuronech. Periferní senzorickou neuropatií trpí více než 50 % pacientů (< 10 % stupně ≥ 3). Periferní motorická neuropatie se vyskytuje asi u 10 % pacientů (< 5 % stupně 3).
Přibližně u poloviny pacientů neuropatie vymizí, u jedné třetiny přetrvává v mírné formě. Závažnými, i když vzácnými nežádoucími účinky jsou akutní pankreatitida, těžké kožní reakce a progredující multifokální leukoencefalopatie. Pravděpodobným vysvětlením je skutečnost, že pankreas exprimuje u některých pacientů malé množství antigenů CD30. Ostatní nežádoucí účinky jsou mírné [2].
Centra intenzivní hematologicko onkologické a transplantační péče v ČR mají s BV v léčbě relapsů po ASCT již několikaletou zkušenost, včetně komplikací a nežádoucích účinků. V průměru je terapie dobře snášena, medikace se podává ambulantně v krátkodobé infuzi.
Na našem pracovišti sledujeme mladou pacientku, která je již čtyři roky ve třetí CR po ukončení monoterapie BV (16 cyklů, 1,8 mg/m2 intravenózně v intervalu 3 týdnů).
Popis případu
Pacientka, 32 let, s nově diagnostikovaným klasickým HL, nodulární skleróza (dg. mediastinoskopie FN Motol, 07/2011) byla odeslána v srpnu 2011 na naši kliniku k dokončení iniciálního stagingu a k léčbě. V anamnéze byla prokázána vrozená trombofilie (homozygotní mutace MTHFR 677). Pacientka začala pociťovat bolestivý tlak za hrudní kostí, bolesti v zádech a dušnost, zejména vleže, objevily se noční poty, výrazná únava. Typická byla tzv. alkoholová bolest na hrudníku. Při laboratorním vyšetření byla zjištěna leukocytóza 26 × 109/l, lymfopenie 8 %, absolutně 1,29 × 109/l, vysoká sedimentace erytrocytů (66 mm/h), C reaktivní protein 97 mg/l a na RTG plic byl prokázán tumor mediastina.
Iniciální staging jsme uzavřeli jako klinické stadium IVB. Zvětšené krční uzliny bilaterálně, masivní mediastinální tumor, postižení obou plicních hilů, oboustranné postižení plic, vpravo tumor prorůstal do pleury a perikardu, cirkulární perikardiální výpotek. Parasternálně prorůstal tumor přední hrudní stěnu, kde bylo patrné zarudnutí a lehké vyklenutí. Mezinárodní prognostické skóre (IPS) 3 (leukocytóza, lymfopenie, stadium IV).
Léčba byla zahájena v srpnu 2011 po prefázi vysokými dávkami dexametazonu (40 mg/den po 4 dny). Následovala chemoterapie šesti cykly režimu eskalovaný BEACOPP (eBEACOPP: bleomycin, etoposid, adriamycin, cyklofosfamid, oncovin – vinkristin, prokarbazin, prednison). Výsledek vyšetření PET/CT2 (po prvních dvou cyklech eBEACOPP) byl hodnocen jako pozitivní, ale byl patrný výrazný efekt léčby (parciální metabolická i morfologická remise). Restaging po ukončení chemoterapie (PET/CT6) v prosinci 2011 konstatoval kompletní metabolickou remisi a parciální morfologickou remisi s PET negativním reziduálním tumorem v mediastinu 3,5 cm × 1 cm. Přetrvávaly známky vinkristinové neuropatie horních i dolních končetin a výrazná únava.
První relaps HL (časný), klinické stadium IIB, byl diagnostikován pět měsíců po ukončení první linie terapie (05/2012). Histologická verifikace byla provedena z materiálu získaného tzv. core cut biopsií pod CT kontrolou (parakardiální tumor vpravo). Znovu se vytvořil perikardiální výpotek. V červnu 2012 byla zahájena záchranná terapie 2× DHAP (dexametazon, HD – cytarabin a cisplatina). V prvním cyklu byla provedena stimulace a úspěšná separace periferních kmenových buněk. V červenci absolvovala pacientka radioterapii (30 Gy involved field) a v srpnu 2012 byla podána vysokodávkovaná chemoterapie BEAM (karmustin, etoposid, cytarabin, melfalan) následovaná autologní transplantací periferních kmenových buněk. Restaging 100 dní po transplantaci v prosinci 2012 byl hodnocen jako kompletní metabolická remise a parciální morfologická remise s regredujícím PET negativním reziduem parakardiálně. Perikardiální výpotek vymizel.
Deset měsíců po transplantaci byl diagnostikován druhý časný relaps (06/2013). Nález na PET/CT parakardiálně vpravo progredoval, v perikardu byl zřejmý cystický útvar a byl znovu patrný cirkulární perikardiální výpotek. Subxifoideálním přístupem byla pod CT kontrolou znovu provedena core cut biopsie útvaru, při které došlo k poranění perikardu. Objevily se kruté bolesti za sternem vyzařující pod pravou lopatkou, perikardiální výpotek se zvětšoval a echokardiografické vyšetření signalizovalo počínající tamponádu srdeční. Po pokusu o konzervativní léčbu bylo indikováno kardiochirurgické řešení (thorakoskopická fenestrace a vyprázdnění již zčásti organizovaného hemoragického obsahu perikardu). Histologický nález potvrdil, že se jedná o druhý relaps CD30 pozitivního klasického HL.
Léčba BV byla zahájena 23. července 2013 dávkou 1,8 mg/kg. V třítýdenních intervalech jsme tuto dávku aplikovali ambulantně celkem 16× (BV byl ředěn do 500 ml fyziologického roztoku). První kontrolní vyšetření PET/CT po 4. cyklu BV (10/2013) prokázalo výrazný ústup aktivity (vychytávání radioindikátoru fluorodeoxyglukózy, FDG) v oblasti tumoru parakardiálně vpravo. Reziduální aktivita PET/CT mohla být způsobena aktivitou tumoru nebo jen zánětlivými změnami. Po osmi aplikacích BV prokázalo kontrolní vyšetření další zmenšení reziduálního tumoru v perikardu (14 mm × 8 mm), zobrazení PET bylo negativní. Stav jsme hodnotili jako metabolickou 3. kompletní remisi a morfologickou parciální remisi s drobným PET negativním reziduem. Opět bylo povoleno v terapii pokračovat čtyřmi cykly.
Pacientka léčbu velmi dobře snášela. Dne 31. března 2014, po dvanácti aplikacích BV, bylo provedeno další vyšetření PET/CT, kde byla konstatována metabolická i morfologická remise. Mezitím byl nalezen shodný nepříbuzný dárce kostní dřeně v Německu. Během čtrnáctého cyklu BV se objevily první známky neuropatie dolních i horních končetin, parestezie, brnění. Pacientka začala vnímat pocit lehce zhoršené chůze. Na aplikaci zbylých dvou dávek BV ale trvala. Poslední, 16. cyklus byl podán 5. června 2014. Po posledním cyklu BV došlo ke zhoršení neuropatie (WHO toxicita stupně III). Neurologické vyšetření: těžká, rychle progredující polyneuropatie toxické etiologie. Na EMG nález bilaterální akutní léze v L5 těžkého stupně, magnetická rezonance nepotvrdila útlak kořenů L5. Neurolog indikoval medikaci, pomůcky a rehabilitace. Další, opakované kontroly PET/CT kompletní remisi potvrdily. Známky neuropatie během dalších měsíců postupně ustupovaly, během asi jednoho roku prakticky vymizely. V současné době přetrvává mírný únavový syndrom. Pacientka opět sportuje, je v kondici, stará se o manžela a dceru. Je zatím v invalidním důchodu, má možnost si upravit svůj denní režim a je spokojená.
V dobrém celkovém stavu se pacientka neodhodlala k další nabízené terapii (alogenní transplantaci). K datu 5. června 2018 trvá 3. kompletní remise čtyři roky.
Závěr
Jak potvrdily výsledky klinického hodnocení, u části pacientů s RR HL po monoterapii BV trvá kompletní remise již pět let [4].
Naše pacientka dospěla po osmi cyklech léčby BV do stadia kompletní remise. Je možné, že se jednalo o remisi již po čtvrtém cyklu a reziduální aktivitu FDG PET bylo možno připsat hojícím se pooperačním změnám po kardiochirurgickém výkonu (fenestrace perikardu).
Kvalita života naší pacientky je čtyři roky po ukončení terapie 16 cykly léčby BV výborná. První rok byl ovlivněn problémy s neuropatií, která však zcela vymizela.
Jak ukazuje výše uvedená kazuistika, není nutné u všech pacientů s relapsem po autologní transplantaci, kteří jsou léčeni BV, okamžitě indikovat ASCT. Zatím není jasně definována podskupina vysoce rizikových pacientů, u nichž by během léčby BV došlo k progresi a/nebo k časnému relapsu onemocnění. Vzhledem k dostupnosti dalších možností léčby, jako jsou checkpoint inhibitory nivolumab a pembrolizumab, je možné odložit rozhodnutí o alogenní transplantaci do dalšího relapsu.
Tato práce byla podpořena grantem AZV 16 29857A MZ ČR a výzkumným projektem Q28 Progres a Q40 / 08 Progres udělenými Univerzitou Karlovou, 3. lékařskou fakultou v Praze.
Seznam použité literatury
- [1] Younes A, Bartlett NL, Leonard JP, et al. Brentuximab vedotin (SGN‑35) for relapsed CD30‑positive lymphomas. N Engl J Med 2010; 363: 1812−1821.
- [2] Younes A, Gopal AK, Smith SE, et al. Results of a pivotal phase II study of brentuximab vedotin for patients with relapsed or refractory Hodgkinʼs lymphoma. J Clin Oncol 2012; 30: 2183−2189.
- [3] Gopal AK, Chen R, Smith SE, et al. Durable remissions in a pivotal phase 2 study of brentuximab vedotin in relapsed or refractory Hodgkin lymphoma. Blood 2015; 125: 1236−1243.
- [4] Chen R Gopal AK, Smith SE, et al. Five‑Year Survival and Durability Results of Brentuximab Vedotin in Patients with Relapsed or Refractory Hodgkin Lymphoma. Blood 2016; 128: 1562–1566.