Čtyřletá data o účinnosti a bezpečnosti sekukinumabu v léčbě ankylozující spondylitidy
Key words: ankylosing spondylitis, biological therapy, secukinumab.
Úvod
Ankylozující spondylitida (AS) je chronické zánětlivé revmatické onemocnění postihující axiální skelet (sakroiliitida a spondylitida), periferní struktury (artritida, entezitida), s častým výskytem extraskeletálních manifestací, jako jsou uveitida, idiopatické střevní záněty a psoriáza. Toto onemocnění výrazně zvyšuje disabilitu nemocných, zhoršuje kvalitu jejich života a zvyšuje kardiovaskulární riziko úmrtí [1].
Doporučení EULAR pro léčbu spondylartritid
Nová doporučení Evropské ligy proti revmatismu (EULAR) pro léčbu AS zdůrazňují nutnost časné diagnostiky choroby např. při použití kritérií ASAS (Assessment of SpondyloArthritis International Society) [2], individuálního vyhodnocení fenotypu onemocnění u konkrétního pacienta, a zvláště pak vyhodnocení aktivity nemoci pomocí validizovaných indexů, jakým je např. BASDAI (Bath Ankylosing Spondylitis Disease Activity Index), nebo nověji prostřednictvím indexu ASDAS (Ankylosing Spondylitis Disease Activity Score) [3].
EULAR vydala svoje doporučení pro léčbu AS v roce 2006 a jejich aktualizaci v roce 2016 [4]. Obsahují pět nadřazených principů a 13 doporučení. První tři doporučení zdůrazňují nutnost personalizovaného přístupu a monitorování a čtvrté doporučení se věnuje nefarmakologické léčbě. Páté doporučení mapuje centrální úlohu nesteroidních antirevmatik (NSA) v léčbě AS jako léku první volby. Doporučení 6‒8 popisují jen mírný efekt analgetik (slabých i silných) a nedoporučují použití systémových glukokortikoidů a konvenčních syntetických chorobu modifikujících antirevmatických léků (disease modifying antirheumatic drugs, DMARDs) ‒ například metotrexátu nebo sulfasalazinu ‒ u nemocných s čistě axiální formou AS.
Doporučení 9‒11 se věnují
biologické léčbě AS. Zde jsou patrné rozdíly mezi postupy
staršími a novějšími. Základní odlišnosti se objevují
již v terminologii, když v doporučeních z roku
2006 se hovoří o léčbě ankylozující spondylitidy
a v novějších pak o léčbě axiálních
spondylartritid (axSpA) dle kritérií ASAS [2]. Z těchto
postupů vycházejí rovněž Doporučení České revmatologické
společnosti pro léčbu ankylozující spondylitidy [5]. Pro
indikaci biologické léčby je požadováno selhání léčby NSA,
u periferních forem pak při polyartritidě selhání léčby
sulfasalazinem a při oligoartritidě selhání lokální léčby
glukokortikoidy (obr. 1).
Dále je stanovena prahová aktivita AS jako hodnota indexu
BASDAI ≥ 4 a je též požadován pozitivní názor
revmatologa. U non radiografických forem AS by měly být
doloženy pozitivní nález sakroiliitidy na MR a dvojnásobné
zvýšení hodnoty C reaktivního proteinu (CRP). Při výběru
biologického léku je možné zvolit buď inhibitor tumor
nekrotizujícího faktoru alfa (TNFα), nebo interleukinu 17A
(IL 17A). V této chvíli je zatím jediným schváleným
inhibitorem IL 17A sekukinumab. Při volbě mezi inhibitorem
TNFα a IL 17A je podle současné praxe upřednostňován
inhibitor TNFα [4]. Zdůvodněním tohoto postupu je především
delší klinická praxe při užívání blokátorů TNFα a rovněž
dostupnost bezpečnostních dat, která jsou v tomto případě
téměř dvacetiletá a zahrnují i data z běžné
klinické praxe registrů. Doporučení je nicméně doplněno
informací, že rychle získávaná data z klinických studií
i z praxe mohou tuto formulaci změnit, a to ještě
před uveřejněním budoucích guidelines (tento postup je znám
např. z praxe při léčbě revmatoidní artritidy).
biologické léčby je požadováno selhání léčby NSA,
u periferních forem pak při polyartritidě selhání léčby
sulfasalazinem a při oligoartritidě selhání lokální léčby
glukokortikoidy (obr. 1).
Dále je stanovena prahová aktivita AS jako hodnota indexu
BASDAI ≥ 4 a je též požadován pozitivní názor
revmatologa. U non radiografických forem AS by měly být
doloženy pozitivní nález sakroiliitidy na MR a dvojnásobné
zvýšení hodnoty C reaktivního proteinu (CRP). Při výběru
biologického léku je možné zvolit buď inhibitor tumor
nekrotizujícího faktoru alfa (TNFα), nebo interleukinu 17A
(IL 17A). V této chvíli je zatím jediným schváleným
inhibitorem IL 17A sekukinumab. Při volbě mezi inhibitorem
TNFα a IL 17A je podle současné praxe upřednostňován
inhibitor TNFα [4]. Zdůvodněním tohoto postupu je především
delší klinická praxe při užívání blokátorů TNFα a rovněž
dostupnost bezpečnostních dat, která jsou v tomto případě
téměř dvacetiletá a zahrnují i data z běžné
klinické praxe registrů. Doporučení je nicméně doplněno
informací, že rychle získávaná data z klinických studií
i z praxe mohou tuto formulaci změnit, a to ještě
před uveřejněním budoucích guidelines (tento postup je znám
např. z praxe při léčbě revmatoidní artritidy).
Inhibitor IL 17A sekukinumab
Přestože jsou data o účinnosti
inhibitorů TNFα při léčbě AS vysoce přesvědčivá, stále
zůstává až kolem 30 % pacientů k této terapii
rezistentních. Proto je logické, že pokračovala snaha o získání
nových biologických DMARDs k léčbě tohoto onemocnění.
Tato snaha byla zpočátku velmi neúspěšná, když postupně
prokázaly neúspěch studie s dalšími biologickými léky,
které však byly účinné v terapii revmatoidní artritidy
(např. rituximab, abatacept, inhibitory IL 6 a IL 1).
V současné době je již dostupná evidence o tom, že
účinnost biologických léků je v případě autoimunitních
onemocnění rozdílná, jak dokládá tabulka 1.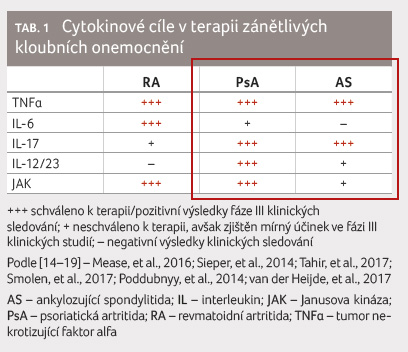
Velmi důležité pro získání nových léků byly poznatky z oblasti bazální imunologie a pochopení významu IL 17 pro rozvoj zánětu u AS. Původně se patogeneze AS koncentrovala na popis systému subpopulace pomocných lymfocytů Th1 a TNFα. Naše znalosti o důležitosti osy IL 17/IL 23 se zvýšily po získání experimentálních dat o tom, že uvedená osa hraje klíčovou roli v patogenetických procesech u AS. První evidence z genetických studií odhalila protektivní polymorfismus u genu pro receptor IL 23, který zhoršuje schopnost lymfocytů Th17 produkovat IL 17 prostřednictvím osy IL 23. Dále bylo zjištěno zvýšení exprese IL 17 vlivem expanze lymfocytů Th17 u HLA B27 transgenních myší. Zvířecí studie rovněž ukázaly, že nadprodukce IL 23 může u zvířat indukovat onemocnění podobné AS.
Klinické studie
Sekukinumab je plně humánní
monoklonální protilátka, která blokuje membránově vázaný
i volný cytokin IL 17A (obr. 2).
Po úspěšném ukončení preklinického zkoušení a fáze II
klinického zkoušení byly realizovány dvě zásadní studie fáze
III. Na základě jejich výsledků byl sekukinumab registrován
v indikaci léčby AS.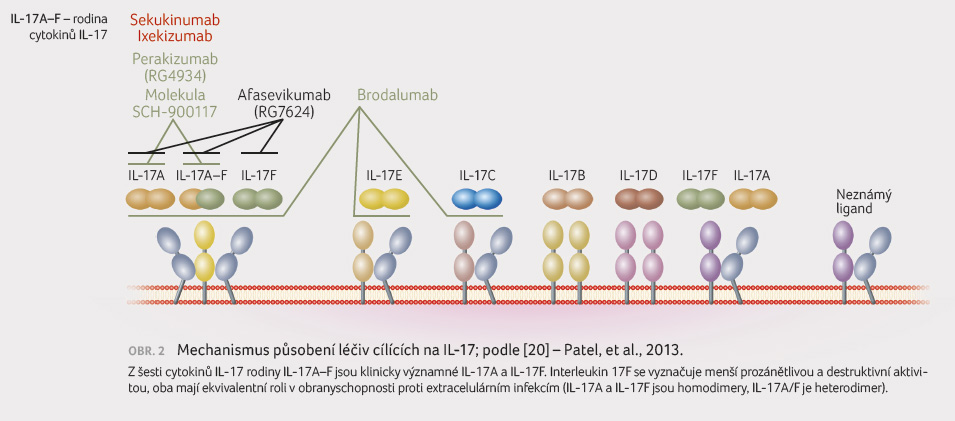
MEASURE 1 byla multicentrická
randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie
fáze III [7]. Do uvedeného klinického hodnocení bylo
zařazeno celkem 371 pacientů, z nichž 70 % bylo anti TNF
naivních a 30 % mělo již za sebou selhání jednoho
anti TNF přípravku (obr. 3).
Pacienti měli diagnózu AS podle modifikovaných newyorských
klasifikačních kritérií s hodnotou BASDAI ≥ 4
a se skóre bolestí páteře ≥ 40 mm (na škále
0‒100 mm) a selhávala u nich léčba NSA. Nemocní
byli randomizováni do tří ramen. První skupina užívala
sekukinumab v udržovací fázi v dávce 150 mg
subkutánně každé čtyři týdny, druhá skupina dostávala 75 mg
sekukinumabu každé čtyři týdny a třetí užívala placebo.
V iniciální fázi dostávali pacienti bolus 10 mg/kg
hmotnosti intravenózně každé dva týdny. Primární cíl byl
splněn, když v 16. týdnu bylo odpovědi hodnocené jako
ASAS 20 (zlepšení v kritériích alespoň o 20 %)
po dávce 150 mg 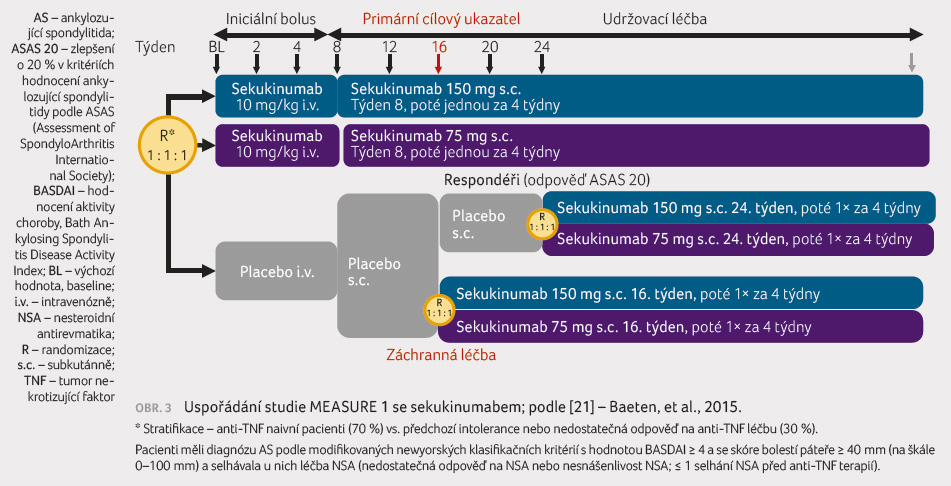 sekukinumabu dosaženo u 60,8 %
pacientů oproti 28,7 % u placeba (p = 0,001).
Kromě subjektivních ukazatelů byly hodnoceny i objektivní
ukazatele zánětu u AS, z nichž nejlepší vypovídací
hodnotu má v současné době nejspíše MR sakroiliakálních
(SI) kloubů a páteře. Při hodnocení tohoto zánětu bylo
použito modifikované berlínské skóre, které prokázalo výraznou
redukci zánětu jak na SI kloubech, tak na páteři, a to
v týdnech 16, 52 a 104 (graf 1) [8].
sekukinumabu dosaženo u 60,8 %
pacientů oproti 28,7 % u placeba (p = 0,001).
Kromě subjektivních ukazatelů byly hodnoceny i objektivní
ukazatele zánětu u AS, z nichž nejlepší vypovídací
hodnotu má v současné době nejspíše MR sakroiliakálních
(SI) kloubů a páteře. Při hodnocení tohoto zánětu bylo
použito modifikované berlínské skóre, které prokázalo výraznou
redukci zánětu jak na SI kloubech, tak na páteři, a to
v týdnech 16, 52 a 104 (graf 1) [8].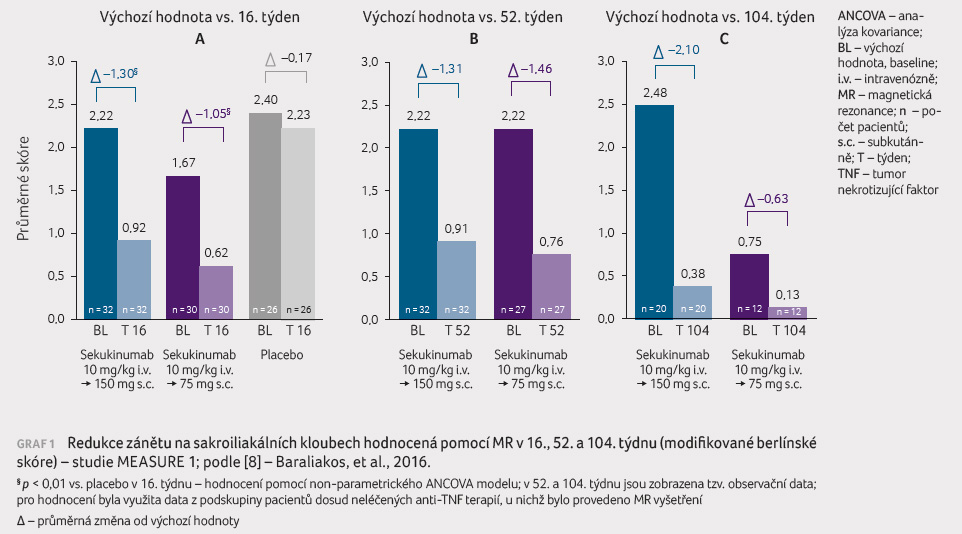
Radiografická progrese hodnocená pomocí modifikovaného Stokesova skóre (mSASSS) po 24 měsících byla velmi pomalá ‒ ve skupině léčené oběma dávkami sekukinumabu byla zaznamenána hodnota 0,30 + 2,53, zatímco ve skupině pacientů přecházejících z placeba na užívání sekukinumabu byla tato hodnota 0,54 + 2,45. Při použití kritéria nejmenšího detekovatelného rozdílu nemělo 80 % jedinců léčených sekukinumabem žádnou radiografickou progresi [7]. Prediktivními faktory radiografické progrese u pacientů užívajících sekukinumab od počátku léčby byly přítomnost syndesmofytů, mužské pohlaví, zvýšená hodnota CRP a kouření. Z osob, které užívaly sekukinumab od počátku léčby a neměly v tomto období syndesmofyty, jich bez syndesmofytů po dvou letech zůstalo 61/64 (95,3 %).
Studie MEASURE 2 měla obdobné uspořádání jako MEASURE 1 s tím rozdílem, že v tomto hodnocení byl v úvodní, nasycovací fázi aplikován sekukinumab nikoliv intravenózně, nýbrž subkutánně v průběhu prvního měsíce v týdenních intervalech v dávce buď 150 mg, nebo 75 mg. Primárního cílového ukazatele bylo dosaženo, když odpověď ASAS 20 po 16. týdnu byla ve skupině se sekukinumabem 150 mg 61,1 %, ve skupině se sekukinumabem 75 mg 41,10 % a v placebové skupině 28,4 % [9]. Ve studii MEASURE 2 na rozdíl od MEASURE 1 již byla patrná vyšší účinnost dávky 150 mg než dávky 75 mg sekukinumabu, což jež možné vysvětlit ovlivněním výsledků prostřednictvím intravenózní nasycovací fáze ve studii MEASURE 1.
Ve studii MEASURE 3 byli pacienti
randomizováni do tří ramen, a to s dávkou 300 mg
sekukinumabu podávanou subkutánně každé čtyři týdny, s dávkou
150 mg sekukinumabu a s placebem ‒ vždy od 4. týdne,
přičemž v prvních 43 týdnech byla použita nasycovací
dávka 10 mg/kg hmotnosti intravenózně. Studie je plánována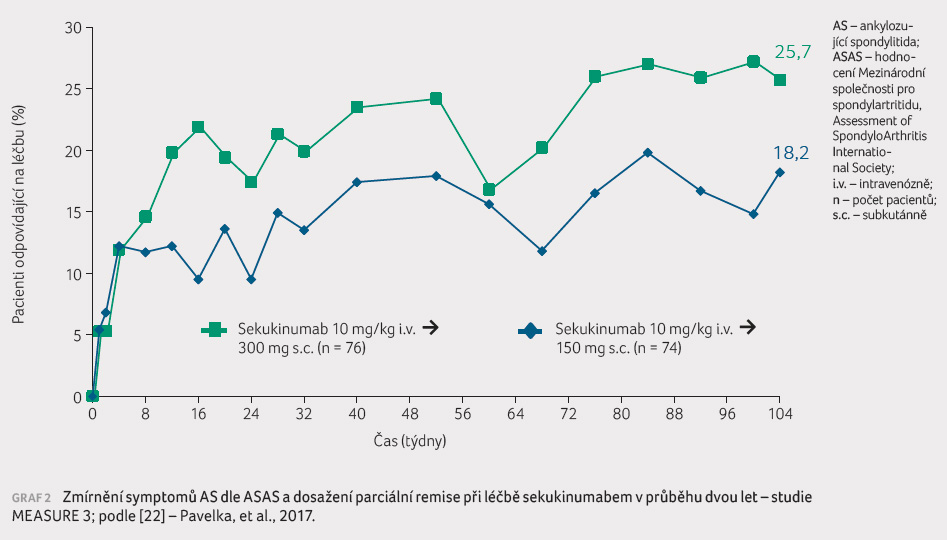 na tři roky, zatím byla formou přednášky prezentována
interim analýza po dvou letech klinického zkoušení [10]. Obě
dávky sekukinumabu byly účinnější v porovnání s placebem
v 16. týdnu sledování (graf 2). Lepších výsledků v případě dávky 300 mg
sekukinumabu bylo dosaženo u přísnějších ukazatelů
účinnosti léčby (ASAS parciální remise) a u pacientů,
u nichž již v minulosti došlo k selhání anti TNF
terapie. Uvedené výsledky však bude nutné potvrdit v dalších
studiích, zatím zůstává oficiální registrovanou dávkou pro AS
150 mg sekukinumabu subkutánně každé čtyři týdny.
na tři roky, zatím byla formou přednášky prezentována
interim analýza po dvou letech klinického zkoušení [10]. Obě
dávky sekukinumabu byly účinnější v porovnání s placebem
v 16. týdnu sledování (graf 2). Lepších výsledků v případě dávky 300 mg
sekukinumabu bylo dosaženo u přísnějších ukazatelů
účinnosti léčby (ASAS parciální remise) a u pacientů,
u nichž již v minulosti došlo k selhání anti TNF
terapie. Uvedené výsledky však bude nutné potvrdit v dalších
studiích, zatím zůstává oficiální registrovanou dávkou pro AS
150 mg sekukinumabu subkutánně každé čtyři týdny.
Otevřené extenze po čtyřech letech léčby
Pacienti ze studie MEASURE 1 byli
zařazeni do otevřeného sledování v délce čtyř let.
Z původních 371 pacientů bylo v extenzi sledováno 274
osob a 89,7 % (78/87) osob původně zařazených do skupiny
se sekukinumabem v dávce 150 mg subkutánně dokončilo dle
protokolu čtyřletou léčbu. Byla prokázána setrvalost výsledků
terapie v u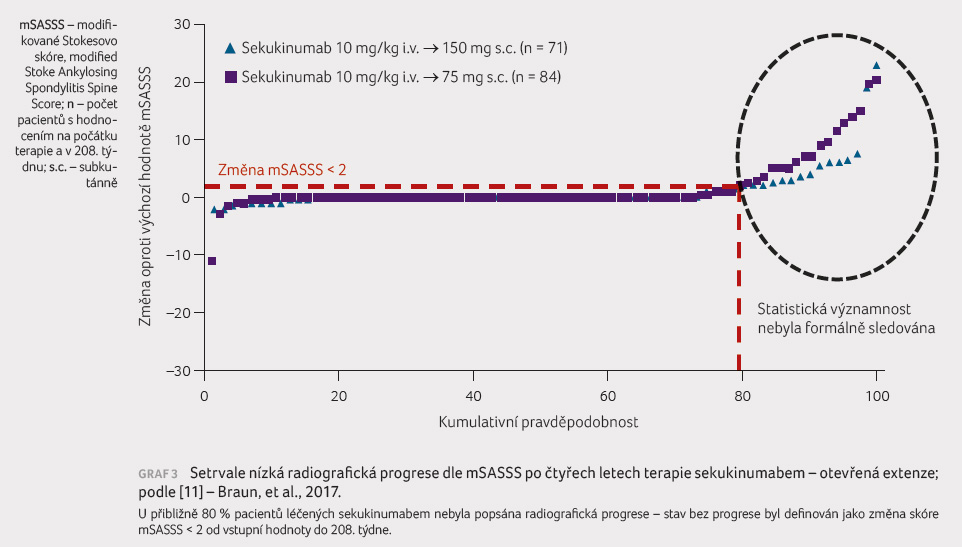 kazatelích ASAS 20/40, BASDAI, BASMI (Bath
Ankylosing Spondylitis Metrology Index) a ASDAS. Léčebné
výsledky byly numericky lepší v případě dávky 150 mg
sekukinumabu oproti dávce 75 mg [11]. Kromě klinických ukazatelů
byla sledována i radiografická progrese AS. Průměrná
hodnota tohoto ukazatele během čtyř let byla ve skóre mSASSS
při dávce 150 mg sekukinumabu pouze 1,2 + 3,9 a při
dávce 75 mg pak 1,6 + 4,7. Bez radiografické progrese
zůstalo 73 % pacientů (graf 3).
kazatelích ASAS 20/40, BASDAI, BASMI (Bath
Ankylosing Spondylitis Metrology Index) a ASDAS. Léčebné
výsledky byly numericky lepší v případě dávky 150 mg
sekukinumabu oproti dávce 75 mg [11]. Kromě klinických ukazatelů
byla sledována i radiografická progrese AS. Průměrná
hodnota tohoto ukazatele během čtyř let byla ve skóre mSASSS
při dávce 150 mg sekukinumabu pouze 1,2 + 3,9 a při
dávce 75 mg pak 1,6 + 4,7. Bez radiografické progrese
zůstalo 73 % pacientů (graf 3).
Dlouhodobá bezpečnostní data po čtyřech letech léčby
Pacienti ze studie MEASURE 1 (371), MEASURE 2 (219) a MEASURE 3 (226) byli souborně vyhodnoceni po čtyřech letech terapie sekukinumabem. Celkem bylo do studií zařazeno 794 pacientů průměrného věku 42 let, z toho 33,4 % žen.
Jako nejčastější nežádoucí účinky se vyskytly infekce horního respiračního traktu (9,8/100 pacientoroků), dále bolesti hlavy (5,2/100 pacientoroků) a průjmy (5,2/100 pacientoroků). Závažné infekce byly relativně vzácné (1,2/100 pacientoroků), infekce kandidou pak v incidenci 0,7/100 pacientoroků. Všechny případy kandidové infekce byly lokální, mírné intenzity, reagovaly na běžnou léčbu a nevedly k jejímu přerušení. Crohnova choroba se objevila celkem u osmi pacientů (0,7/100 pacientoroků), přičemž v pěti případech se jednalo o nové výskyty. Dále byly zaznamenány čtyři případy ulcerózní kolitidy (0,2/100 pacientoroků), z toho tři jako nový výskyt. Crohnova choroba ani ulcerózní kolitida nebyly vylučujícím kritériem pro zařazení do studie. Uvedené údaje nesvědčí o vyšším výskytu těchto zánětlivých onemocnění během terapie sekukinumabem [12]. Imunogenicita sekukinumabu byla velmi malá, protilátky proti léku byly zachyceny v méně než jednom procentu případů a neměly žádnou vazbu na účinnost a bezpečnost léčby.
Závěr
Inhibitor IL 17A sekukinumab je průkazně silně účinný v léčbě AS. Má rychlý nástup účinku a rovněž setrvalý efekt, který neklesá s časem, jak prokázaly nově dokončené čtyřleté studie. Tento fakt může být i následkem velmi malé imunogenicity přípravku. Sekukinumab má pravděpodobně též zpomalující účinek na radiografickou progresi, neboť po jeho aplikaci nedochází k progresi onemocnění až u 80 % pacientů. Nelze to však považovat za jasný důkaz strukturálního efektu, který bude nutné prokázat ve dvojitě zaslepené studii.
Bezpečnost sekukinumabu byla dlouhodobě dobrá a profilem odpovídala jiným biologickým lékům. Předmět zvláštního zájmu představovaly tři diskutované oblasti, a to výskyt idiopatických střevních zánětů, kandidových infekcí a neutropenií. Sekukinumab neprokázal účinnost u Crohnovy choroby a vznikla obava, zda naopak její výskyt nestoupá. Výše zmíněná souborná analýza tří hlavních studií fáze III však tuto domněnku nepotvrzuje. Byl zaznamenán mírně zvýšený výskyt kandidových infekcí, většinou však nezávažných a běžnou terapií zvládnutelných.
Podpořeno projektem (Ministerstva zdravotnictví ČR) koncepčního rozvoje výzkumné organizace 023728 (Revmatologický ústav).
Seznam použité literatury
- [2] Rudwaleit M, van der Heijde D, Landewé R. Development of ASAS for axial spondylarthritis, validation of final section. Ann Rheum Dis 2009; 68: 777‒783.
- [3] Van der Heijde D, Lie E, Kvien TK, et al. ASDAS, a highly discriminatory ASAS‑endorsed disease activity score in patients with ankylosing spondylitis. Ann Rheum Dis 2009; 68: 1811‒1818.
- [4] Van der Heijde D, Ramiro S, Landewé R, et al. 2016 update of the ASAS‑EULAR management recommendations for axial spondyloarthritis. Ann Rheum Dis 2017; 76: 978‒991.
- [5] Pavelka K. Doporučení České revmatologické společnosti pro léčbu ankylozující spondylitidy. Česká revmatologie 2012; 20: 4‒11.
- [6] Cheung PP. Anti‑IL17A in axial spondylarthritis ‒ where are we at? Front Med 2017; doi: 10.3389/fmed .2017.00001
- [7] Braun J, Baraliakos X, Deodhar A, et al. Effect of secukinumab on clinical and radiographic outcomes in ankylosing spondylitis: 2‑year results from the randomised phase III MEASURE 1 study. Ann Rheum Dis 2017; 76: 1070‒1077.
- [8] Baraliakos X, Borah B, Braun J, et al. Long‑term effects of secukinumab on MRI findings in relation to clinical efficacy in subjects with active ankylosing spondylitis: an observational study. Ann Rheum Dis 2016; 75: 408‒412.
- [9] Sieper J, Deodhar A, Marzo‑Ortega H, et al. Secukinumab efficacy in anti‑TNF‑naive and anti‑TNF‑experienced subjects with active ankylosing spondylitis: results from the MEASURE 2 Study. Ann Rheum Dis 2017; 76: 571‒592.
- [10] Pavelka K, Kivitz AJ, Dokoupilová E, et al. Secukinumab provides sustained improvements in the signs and symptoms of active ankylosing spondylitis: 2‑year results from a Phase 3 study. Arthritis Rheumatol 2017; 69(Suppl 10). Abstract 1828. Dostupné na: http://acrabstracts.org/abstract/secukinumab‑provides‑sustained‑improvements‑in‑the‑signs‑and‑symptoms‑of‑active‑ankylosing‑spondylitis‑2‑year‑results‑from‑a‑phase‑3‑study/ [navštíveno 22. 11. 2017]
- [11] Braun J, Baraliakos X, Deodhar A, et al. Secukinumab demonstrates low radiographic progression and sustained efficacy through 4 years in patients with active ankylosing spondylitis. Arthritis Rheumatol 2017; 69(Suppl 10). Abstract 3L. Dostupné na: http://acrabstracts.org/abstract/secukinumab‑demonstrates‑low‑radiographic‑progression‑and‑sustained‑efficacy‑through‑4‑years‑in‑patients‑with‑active‑ankylosing‑spondylitis/ [navštíveno 22. 11. 2017]
- [12] Deodhar A, Baraliakos X, Marzo‑Ortega H, et al. Secukinumab demonstrates consistent safety over long‑term exposure (up to 4 years) in patients with active ankylosing spondylitis: pooled analysis of three phase 3 trials. ACR 2017. Abstract 1529. Dostupné na: http://acrabstracts.org/abstract/secukinumab‑demonstrates‑consistent‑safety‑over‑long‑term‑exposure‑up‑to‑3‑years‑in‑patients‑with‑active‑ankylosing‑spondylitis‑pooled‑analysis‑of‑three‑phase‑3‑trials/ [navštíveno 22. 11. 2017]
- [13] Sepriano A, Regel A, van der Heijde D, et al. Efficacy and Safety of Biological Therapy and Target Synthetic Dmards: A Systematic Literature Review Informing the 2016 Update of the ASAS/EULAR Recommendations for the Management of Axial Spondyloarthritis. ACR 2016. Abstract 692. Dostupné na: http://acrabstracts.org/abstract/efficacy‑and‑safety‑of‑biological‑therapy‑and‑target‑synthetic‑dmards‑a‑systematic‑literature‑review‑informing‑the‑2016‑update‑of‑the‑asaseular‑recommendations‑for‑the‑management‑of‑axial‑spondyloar/ [navštíveno 22. 11. 2017]
- [14] Mease PJ, Gottlieb AB, Berman A, et al. The Efficacy and Safety of Clazakizumab, an Anti‑Interleukin‑6 Monoclonal Antibody, in a Phase IIb Study of Adults With Active Psoriatic Arthritis. Arthritis Rheum 2016; 68: 2163‒2173.
- [15] Sieper J, Porter‑Brown B, Thompson L, et al. Assessment of short‑term symptomatic efficacy of tocilizumab in ankylosing spondylitis: results of randomised, placebo‑controlled trials. Ann Rheum Dis 2014; 73: 95‒100.
- [16] Tahir H, Deodhar A, Genovese M, et al. Secukinumab in Active Rheumatoid Arthritis after Anti‑TNFα Therapy: A Randomized, Double‑Blind Placebo‑Controlled Phase 3 Study. Rheum Ther 2017; 4: 475‒488.
- [17] Smolen JS, Agarwal SK, Ilivanova E, et al. A randomised phase II study evaluating the efficacy and safety of subcutaneously administered ustekinumab and guselkumab in patients with active rheumatoid arthritis despite treatment with methotrexate. Ann Rheum Dis 2017; 76: 831‒839.
- [18] Poddubnyy D, Hermann KG, Callhoff J, et al. Ustekinumab for the treatment of patients with active ankylosing spondylitis: results of a 28‑week, prospective, open‑label, proof‑of‑concept study (TOPAS). Ann Rheum Dis 2014; 73: 817‒823.
- [19] Van der Heijde D, Deodhar A, Wei JC, et al. Tofacitinib in patients with ankylosing spondylitis: a phase II, 16‑week, randomised, placebo‑controlled, dose‑ranging study. Ann Rheum Dis 2017; 8: 1340‒1347.
- [20] Patel DD, Lee DM, Kolbinger F, et al. Effect of IL‑17A blockade with secukinumab in autoimmune diseases. Ann Rheum Dis 2013; 72: ii116–ii123.
- [21] Baeten D, Sieper J, Braun J, et al. Secukinumab, an Interleukin‑17A Inhibitor, in Ankylosing Spondylitis. New Engl J Med 2015; 373: 2534‒2550.
- [22] Pavelka K, Kivitz A, Dokoupilova E, et al. Efficacy, safety, and tolerability of secukinumab in patients with active ankylosing spondylitis: a randomized, double‑blind phase 3 study, MEASURE 3. Arthritis Res Ther 2017; 19: 285.