Dlouhodobě působící inzulinová analoga 2. generace a jejich místo v léčbě diabetu
Souhrn:
Haluzík M. Dlouhodobě působící inzulinová analoga 2. generace a jejich místo v léčbě diabetu. Remedia 2022; 32: 472–478.
Léčba inzulinem stále patří k důležitým terapeutickým přístupům u diabetiků 2. typu, a to zejména při delším trvání onemocnění. I přes dostupnost novějších lékových skupin typu gliflozinů a agonistů receptoru GLP‑1, které u mnohých pacientů mohou částečně zpomalit progresi diabetu, zůstává potřeba podávání inzulinu nezbytná u 20–40 % diabetiků 2. typu. V praxi je u mnoha pacientů s diabetem 2. typu podávání inzulinu často zahájeno později, než by bylo optimální, a to i přes dostupnost inzulinů s lepší predikovatelností účinku a výhodnějším terapeutickým profilem, než tomu bylo dříve. V tomto článku shrnujeme poznatky o účinnosti a bezpečnosti dlouhodobě působících inzulinových analog druhé generace – inzulinu degludek a inzulinu glargin s koncentrací 300 j./ml. Diskutujeme jejich výhody oproti starším typům dlouhodobě působících inzulinů, rozdíly mezi jednotlivými přípravky a jejich klinické důsledky. Stručně se věnujeme také možnosti jejich využití u nemocných s diabetem 1. typu.
Summary:
Haluzik M. Long‑acting insulin analogues of the second generation and their positioning in the treatment of diabetes. Remedia 2022; 32: 472–478.
Insulin therapy still belongs to the most important therapeutic approaches in the treatment of patients with type 2 diabetes, in particular those with longer diabetes duration. Despite the availability of novel therapeutic groups such as gliflozins and GLP‑1 receptor agonists that can partially slow down diabetes progression, long‑acting insulin therapy still remains necessary in 20–40% of patients with type 2 diabetes. In clinical practice, the insulin treatment is often initiated later than it should optimally be despite the availability of insulin with better predictability of the effect and more favorable therapeutic profile as compared to older insulins. In this paper, we summarize the current knowledge concerning efficacy and safety of long‑acting insulins analogues of the second generation – insulin degludec and insulin glargine in of 300 IU/ml concentration. We discuss their advantages over older types of long‑acting insulins, differences among particular insulins and their clinical consequences. We also briefly discuss their use in patients with type 2 diabetes.
Key words: diabetes mellitus, long acting insulin, insulin degludec, insulin glargine U300, hypoglycemia, body weight.
Úvod
Diabetes mellitus (DM) 2. typu je onemocnění s progresivním průběhem, který je dán zejména postupným poklesem počtu a funkce beta buněk pankreatu produkujících inzulin [1]. Před zavedením gliptinů, gliflozinů a zejména agonistů receptoru pro glukagonu podobný peptid 1 (GLP 1R) do léčby DM 2. typu bylo odhadováno, že do šesti let od stanovení diagnózy diabetu by k dosažení optimální kompenzace vyžadovalo inzulinovou léčbu až 50 % diabetiků 2. typu [2]. Díky využití agonistů GLP 1R i dalších účinných moderních antidiabetik je reálná potřeba inzulinoterapie v současné době o něco nižší, nicméně u řady nemocných zejména s delším trváním DM 2. typu je tento léčebný přístup stále nenahraditelný. Je zjevné, že v populaci nemocných s DM 2. typu stále existuje podskupina, kde je dominujícím patofyziologickým faktorem úbytek beta buněk, zatímco podíl inzulinové rezistence je o poznání menší [3]. Právě zde se relativně časnému podání inzulinu nevyhneme.
V reálné praxi je iniciace inzulinoterapie často opožděna v důsledku neochoty pacientů zahájit injekční léčbu spojenou s možným zvýšením rizika hypoglykemie a vzestupu tělesné hmotnosti a také kvůli určité váhavosti mnohých lékařů, pro které může být zahájení léčby inzulinem pracnější než jiné přístupy. Z pohledu pacientů je hlavním problémem obava z hypoglykemie [4,5], i proto jsou stále hledány inzuliny s predikovatelnějším efektem a snížením rizika nežádoucích účinků. Takovéto přípravky mohou v praxi usnadnit zahájení inzulinoterapie a zlepšit compliance pacientů s touto léčbou.
Tento článek je zaměřen na účinnost a bezpečnost dlouhodobě působících inzulinových analog druhé generace – inzulinu degludek a inzulinu glargin s koncentrací 300 j./ml (glargin U300). Věnujeme se především poznatkům u nemocných s DM 2. typu, ale stručně shrnujeme i výsledky u nemocných s DM 1. typu a diskutujeme výhody této novější generace dlouhodobě působících inzulinů oproti starším přípravkům.
Přehled dostupných dlouhodobě
působících inzulinů
Dříve hojně používaný humánní inzulin s prodlouženým působením, NPH (Neutral Protamine Hagedorn) inzulin, je dnes již v České republice předepisován spíše výjimečně s ohledem na vyšší intraindividuální variabilitu účinku spojenou s vyšším rizikem hypoglykemií, nutnost dobrého promíchání před aplikací, méně výhodný profil i kratší biologický poločas. Dlouhodobě působící inzulinová analoga první generace (inzulin detemir, inzulin glargin s koncentrací 100 j./ml, U100) mají oproti NPH inzulinu výhodu menší intra a interindividuální variability, delšího biologického poločasu a lepší predikovatelnosti účinku [6,7], což se projevuje nižším výskytem hypoglykemií a v některých studiích i menším vzestupem hmotnosti [8,9]. V posledních letech jsou navíc k dispozici dlouhodobě působící inzulinová analoga druhé generace – nová formulace inzulinu glargin s koncentrací 300 j./ml s plošším a prodlouženým profilem [10] a také inzulin degludek, který má nejdelší biologický poločas z dlouhodobě působících inzulinů, které jsou v současnosti dostupné [11]. Za zmínku stojí, že ve druhé, respektive třetí fázi klinického vývoje jsou inzuliny s velmi dlouhým biologickým poločasem umožňujícím aplikaci jednou týdně (inzulin icodec a inzulin BIF).
Mechanismus prodloužení účinku
dlouhodobě působících inzulinů
Humánní NPH inzulin je krystalickou suspenzí inzulinu s ionty zinku a polypeptidu protaminu [12]. Díky svému složení vytváří NPH inzulin po aplikaci do podkoží dimery a hexamery, které se z podkoží uvolňují postupně. Biologický poločas NPH inzulinu je 6 hodin, varibilita jeho účinku je poměrně vysoká a závislá mimo jiné na dobrém promíchání před aplikací. Důsledkem je poměrně vysoké riziko hypo i hyperglykemie [12].
Obě dlouhodobě působící inzulinová analoga první generace vytvořená modifikací molekuly lidského inzulinu (inzulin glargin U100, inzulin detemir) jsou před aplikací ve formě čirého roztoku, nikoliv suspenze. Mechanismem prodlouženého působení detemiru je tvorba dihexamerů díky vzájemné vazbě hydrofobních částí jeho molekuly (molekula obsahuje mastnou kyselinu – kyselinu myristovou) po aplikaci do podkoží [13]. Tyto dihexamery pozvolna disociují na monomery uvolňované do krevního oběhu. Na prodloužení biologického poločasu a snížení variability účinku se podílí také jeho vazba na albumin.
Inzulin glargin má
nízkou rozpustnost při neutrálním pH, avšak je plně solubilní
při kyselejším pH roztoku, v němž je rozpuštěn před
aplikací [14]. Po aplikaci do podkoží se pH aplikovaného
roztoku s glarginem postupně neutralizuje, což vede k tvorbě
mikroprecipitátů, z nichž je pak glargin zvolna kontinuálně
uvolňován do cirkulace [14].
Inzulinem s nejdelším biologickým poločasem je dlouhodobě působící inzulinový analog degludek s velmi stabilním a predikovatelným účinkem a biologickým poločasem 25 hodin (pro srovnání biologický poločas glarginu U100 je 12 hodin a detemiru 7 hodin), (viz též tab. 1) [15]. Degludek vytváří v roztoku hexamery, které jsou spojeny prostřednictvím acylovaných ligandů [16] tvořených zbytkem kyseliny glutamové plnící funkci spojovacího raménka („spacer linker“), na něž je navázán zbytek kyseliny hexadekandiové (16 uhlíkatá nasycená dikarboxylová kyselina) [17]. Po aplikaci inzulinu degludek do podkoží dochází k difuzi fenolu a vytvoření multihexamerových řetězců degludeku, z nichž se pak monomery postupně uvolňují do cirkulace. Degludek se podobně jako detemir silně váže na albumin, což stabilizuje jeho hladiny a snižuje variabilitu účinku. K dosažení rovnovážného stavu je nutné jeho denní podávání po dobu 2–3 dnů.
Posledním dlouhodobě působícím inzulinem s výhodnějšími vlastnostmi oproti inzulinu detemir a inzulinu glargin U100 je inzulin glargin U300. Tento inzulin má díky vyšší koncentraci menší objem aplikované dávky. Důsledkem menšího povrchu podkožního depa je pomalejší a rovnoměrnější uvolňování do cirkulace [10]. Z kompaktního depa inzulinu glargin U300 se tedy účinná látka uvolňuje pozvolněji, což vede k vyrovnanějšímu a více prodlouženému profilu ve srovnání s inzulinem glargin U100. Biologický poločas je oproti klasickému glarginu U100 delší (18 hodin vs. 12 hodin), což zajistí trvání účinku delší než 24 hodin [10].
Farmakokinetické a farmakodynamické
studie dlouhodobě působících analog 2. generace
K měření farmakokinetiky a farmakodynamiky inzulinů je standardně používána metoda glukózového clampu. Při této metodě je pacientům nebo zdravým subjektům podáno přesně definované množství inzulinu vypočítané na 1 kg tělesné hmotnosti. Zároveň je podávána infuze glukózy, jejíž rychlost je upravována s cílem udržet hodnotu glykemie v normálním rozmezí. Čím stabilnější je účinek dlouhodobě působícího inzulinu, tím je variabilita rychlosti infuze v čase nižší. Clampové studie prokázaly, že jak inzulin glargin U300, tak inzulin degludek mají oproti inzulinu glargin U100 výrazně nižší intra i interindividuální variabilitu, jak pokud jde o sérové koncentrace inzulinu, tak z hlediska efektu na glykemickou variabilitu měřeného pomocí rychlosti infuze glukózy nutné k udržení euglykemie [10,18,19].
Prvním přímým srovnáním farmakodynamiky inzulinu glargin U300 a inzulinu degludek u pacientů s DM 1. typu pomocí glukózového clampu se zabývaly dvě studie, z nichž každá byla sponzorována jedním z výrobců těchto inzulinů. Ve studii sponzorované výrobcem inzulinu glargin U300 [20] byla při dávce glarginu 0,4 j./kg 24hodinová variabilita inzulinu glargin U300 o 20 % nižší ve srovnání s inzulinem degludek a farmakokinetický profil (hladiny inzulinů v průběhu 24 hodin) a rozložení účinku v šestihodinových úsecích dne bylo stabilnější u inzulinu glargin U300 než u inzulinu degludek. Při podávání glarginu v dávce 0,6 j./kg nebyly rozdíly statisticky významné. Ve studii sponzorované výrobcem inzulinu degludek bylo rovněž v překříženém uspořádání provedeno srovnání inzulinu glargin U300 a degludek 200 j./ml, obojí v dávce 0,4 j./kg hmotnosti u 57 pacientů s DM 1. typu [21]. Zde byla variabilita v průběhu dne vyjádřená jako distribuce hypoglykemizujícího účinku jednotlivých inzulinů v šestihodinových intervalech během 24 hodin o 37 % nižší při podání inzulinu degludek než při podání inzulinu glargin U300. Variabilita mezi jednotlivými dny byla čtyřikrát nižší při podávání inzulinu degludek ve srovnání s inzulinem glargin U300. Pro srovnatelný účinek byla nutná o 30 % vyšší dávka inzulinu glargin U300.
Klinické studie s inzulinem
glargin a inzulinem degludek
Působení inzulinu glargin U300 bylo
u diabetiků 1. i 2. typu srovnáváno
s působením glarginu o koncentraci U100 v rámci
klinického programu EDITION. Použití glarginu U300 bylo spojeno
s nižším výskytem nočních a v některých
případech i celkových hypoglykemií u diabetiků 2. typu
[19] (viz též graf 1A, B), zatímco u diabetiků
1. typu byly rozdíly patrné spíše v titrační fázi.
Výhody glarginu U300 byly nejvíce vyjádřeny u pacientů již
léčených jinými typy inzulinu, a to jak v režimu
podávání pouze dlouhodobě působícího inzulinu, tak v režimu
intenzifikované inzulinoterapie [22]. Navíc byla u inzulinu
glargin U300 studiemi prokázána možnost flexibility doby aplikace
(při podávání o tři hodiny dříve nebo o tři hodiny
později) [23] ve srovnání s inzulinem glargin U100 bez
vlivu na účinnost a bezpečnost léčby.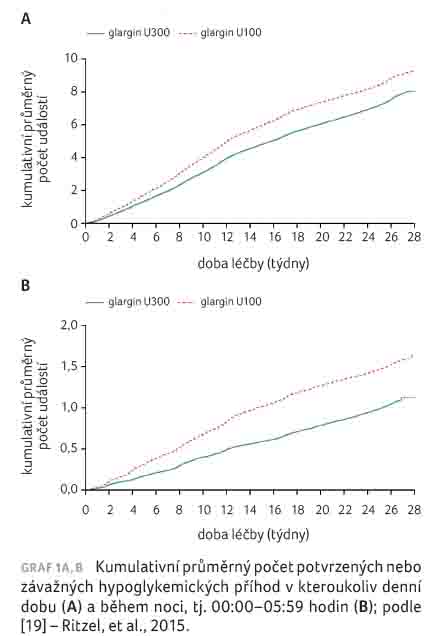
Inzulin degludek byl testován v rámci programu BEGIN, kde byla přímá srovnání prováděna převážně s inzulinem glargin U100. Podávání inzulinu degludek vedlo u diabetiků 1. i 2. typu k dosažení kompenzace srovnatelné s léčbou inzulinem glargin U100 při nižším výskytu zejména nočních hypoglykemií [24–27] (graf 2A–C). U diabetiků 1. i 2. typu bylo navíc možné dosáhnout srovnatelné kompenzace při podávání inzulinu degludek v tzv. flexibilním režimu (střídavé podávání v různých časových intervalech) při zachování účinnosti i bezpečnosti [28].
Další prací srovnávající inzulin
degludek a inzulin glargin U100 byla studie SWITCH PRO [29].
Jednalo se o studii s překříženým uspořádáním
s titrací dávky inzulinu na hodnotu ranní glykemie
nalačno 3,9–5,0 mmol/l. Primární cílový ukazatel –
čas v cílovém rozmezí 3,9–7,8 mmol/l – byl významně
delší při léčbě inzulinem degludek, zároveň došlo
ke zkrácení času pod cílovým rozmezím během noci.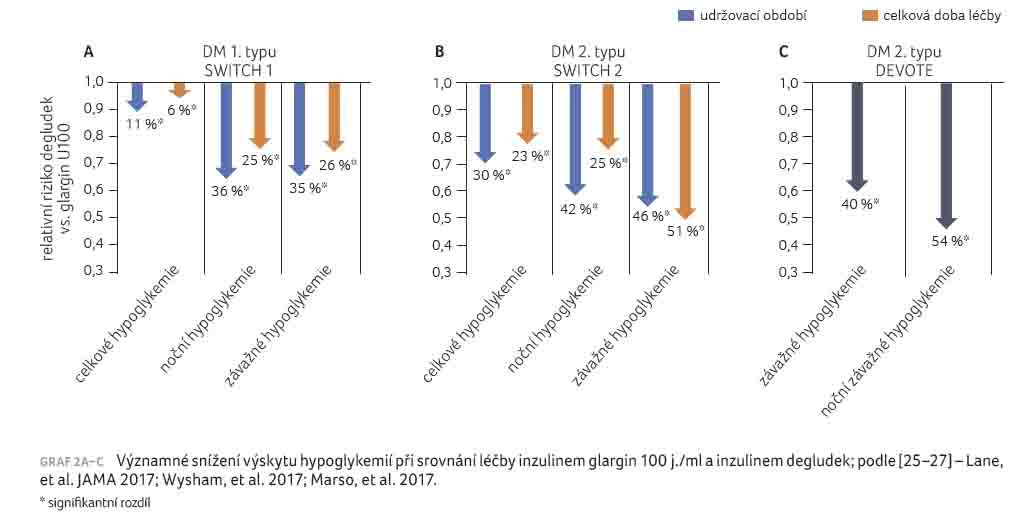
Z pohledu celkové bezpečnosti léčby je důležité, že glargin U100 a degludek jsou jedinými inzuliny s potvrzenou kardiovaskulární bezpečností. Ta byla v případě inzulinu glargin sledována ve studii ORIGIN, kde byl neutrální vliv na kardiovaskulární komplikace prokázán ve srovnání s léčbou bez použití inzulinu [30]. V případě inzulinu degludek byla kardiovaskulární bezpečnost prokázána ve studii DEVOTE, kde léčba inzulinem degludek neovlivnila výskyt kardiovaskulárních příhod ve srovnání s inzulinen glargin U100. Při léčbě inzulinem degludek byl ve srovnání s glarginem U100 snížen výskyt těžké hypoglykemie [27].
Přímé srovnání inzulinu glargin
U300 a inzulinu degludek v randomizovaných studiích
u diabetiků 2. typu
Prvním přímým srovnáním inzulinu degludek s inzulinem glargin U300 byla studie BRIGHT sponzorovaná výrobcem glarginu U300 [31]. Cílem této multicentrické otevřené studie trvající 24 týdnů bylo prokázat non inferioritu inzulinu glargin U300 vůči inzulinu degludek. Do studie byli zařazeni pacienti s DM 2. typu, hodnotou glykovaného hemoglobinu (HbA1c) v rozmezí 7,5–10,5 %, kteří byli léčeni perorálními diabetiky s agonisty GLP 1R nebo bez nich a dosud nebyli léčeni inzulinem. Studie se skládala z titračního období 0–12 týdnů a poté z 12týdenního udržovacího období. Cílová glykemie nalačno byla 4,4–5,6 mmol/l. Studie prokázala non inferioritu inzulinu glargin U300 při snížení hodnoty HbA1c a výskytu hypoglykemií po celé období studie a nižší výskyt hypoglykemií u pacientů léčených glarginem U300 v titračním období. Celková dávka inzulinu glargin U300 představovala na konci studie 50,6 j. a celková dávka inzulinu degludek 39,2 j. Kromě uvedeného rozdílu v titračním období byly ostatní parametry v obou větvích srovnatelné.
Studie CONCLUDE byla naopak sponzorována výrobcem inzulinu degludek. Cílová glykemie nalačno v rámci studie CONCLUDE činila 4–5 mmol/l, titrační fáze trvala 16 týdnů [32]. Zařazeni byli pacienti s průměrným trváním diabetu 15 let, průměrným indexem tělesné hmotnosti 31,5 kg/m2 a průměrnou hodnotou HbA1c 7,6 % již léčení dlouhodobě působícím inzulinem v kombinaci s perorálními antidiabetiky nebo samostatně. V rámci studie nastal technický problém s používanými glukometry, které musely být vzhledem k nepřesnému měření vyměněny za jiný typ. Proto došlo k prodloužení studie o 36 týdnů oproti původně plánované celkové době 55 týdnů. Primárním kombinovaným cílem studie byl průkaz superiority inzulinu degludek 200 j./ml vůči inzulinu glargin U300 v počtu těžkých nebo potvrzených symptomatických hypoglykemií během udržovací fáze studie. Studie nepotvrdila superioritu inzulinu degludek, protože nebyl pozorován statisticky významný rozdíl mezi primárními cílovými ukazateli, tedy ve snížení hodnot HbA1c a výskytu hypoglykemií. Sekundární cílové ukazatele této studie, které naznačují rozdíly ve výskytu těžkých či nočních hypoglykemií ve prospěch inzulinu degludek, musejí být vzhledem ke zvolené metodologii hierarchického testování považovány za pouze explorativní, a nelze tedy hovořit o statisticky signifikantním rozdílu, byť prakticky všechny vyšly výrazně numericky lépe pro inzulin degludek. Zvýšení hmotnosti pacientů ke konci studie bylo mírně více vyjádřeno pro inzulin degludek 200 j./ml ve srovnání s inzulinem glargin U300 (2,9 ± 5,2 kg vs. 1,7 ± 5,8 kg).
Cílem prespecifikované subanalýzy studie BRIGHT bylo sledování účinnosti a bezpečnosti obou inzulinů u pacientů stratifikovaných podle renální funkce [33]. Analýza ukázala statisticky významně vyšší účinnost inzulinu glargin U300 při snížení hodnot HbA1c (rozdíl zhruba 0,4 % u pacientů s odhadovanou glomerulární filtrací < 60 ml/min) při srovnatelném výskytu hypoglykemií. V současné době je připravována randomizovaná studie, která bude přímo srovnávat účinnost a bezpečnost inzulinu degludek a inzulinu glargin U300 u nemocných s diabetem 2. typu a sníženou renální funkcí.
Další zajímavé výsledky přímého srovnání dlouhodobě působících analog druhé generace přinesla post hoc analýza výše popsané studie CONCLUDE [34]. Tato analýza byla zaměřena na rozdíly mezi inzulinem glargin U300 a inzulinem degludek u pacientů ve studii CONCLUDE stratifikovaných podle renální funkce. Renální funkce dle této analýzy významně neovlivnily účinnost ani výskyt hypoglykemií. Popsán byl trend k nižším hodnotám HbA1c a dávky inzulinu ve prospěch inzulinu degludek, a to bez ohledu na pokles renální funkce.
Za zmínku stojí rovněž randomizovaná studie InRange, jejíž protokol byl publikován [35] a výsledky již byly letos prezentovány mimo jiné na kongresu ATTD (Advanced Technologies & Treatments for Diabetes) v Barceloně. Cílem této studie bylo porovnat čas v cílovém rozmezí (3,9–10 mmol/l) a glykemickou variabilitu pro degludek vs. inzulin glargin U300 u pacientů s DM 1. typu. Bylo prokázáno, že jak čas v cílovém rozmezí, tak i koeficient variace jako měřítko glykemické variability se významně nelišily, podobně byl srovnatelný i výskyt hypoglykemií.
Studie z reálné klinické praxe
Studie z reálné klinické praxe jsou díky dobré dostupnosti zdravotnických databází či registrů pojišťoven stále více využívány jako doplněk k výsledkům studií randomizovaných.
Retrospektivní analýza u diabetiků 1. typu s názvem OneCare hodnotila výsledky retrospektivního porovnání vlivu převedení diabetiků 1. typu z léčby jinými bazálními inzuliny na podávání buď inzulinu glargin U300, nebo inzulinu degludek [36]. Do studie bylo zařazeno celkem 199 pacientů. Primární cílový ukazatel – čas v cílovém rozmezí hodnocený pomocí kontinuální monitorace glykemie – byl srovnatelný při hodnocení celého období. Noční čas v cílovém rozmezí byl signifikantně delší pro inzulin glargin U300. U pacientů léčených inzulinem degludek byl rovněž mírně vyšší čas strávený v hyperglykemii během noci.
Studie CONFIRM analyzovala pomocí metody propensity score matching elektronické databáze zdravotních systémů ve Spojených státech amerických u 4 056 pacientů s diabetem 2. typu dosud neléčených inzulinem [37]. V této studii vedlo zahájení terapie inzulinem degludek ve srovnání s inzulinem glargin U300 k výraznějšímu poklesu HbA1c (rozdíl 0,27 %) a ke snížení pravděpodobnosti výskytu hypoglykemie. U pacientů léčených inzulinem degludek byla také nižší pravděpodobnost ukončení léčby inzulinem.
Italská studie RESTORE 2 srovnávala vliv převedení pacientů na inzulin glargin U300 či inzulin degludek 100 j./ml z podávání dlouhodobě působících analog 1. generace s využitím metody propensity score matching. Redukce hodnot HbA1c dosažená během šesti měsíců se významně nelišila. Srovnatelný byl i pokles glykemie nalačno, změny tělesné hmotnosti a výskyt hypoglykemie [38]. Podobné výsledky – tedy zcela srovnatelné změny ve výše uvedených parametrech – byly zaznamenány po iniciaci inzulinu glargin U300 nebo inzulinu degludek 100 j./ml v retrospektivní studii RESTORE 1 u pacientů dosud neléčených inzulinem [39].
Jaké jsou přínosy dlouhodobě
působících inzulinových analog druhé generace v klinické
praxi?
Jak inzulin degludek, tak inzulin glargin U300 vedou k dosažení srovnatelného snížení HbA1c jako glargin U100 při sníženém výskytu hypoglykemií. Tento rozdíl je dán jejich vylepšenými farmakokinetickými a farmakodynamickými vlastnostmi – delším biologickým poločasem, menší variabilitou účinku a nepochybně také možností flexibilnější aplikace. Oba tyto inzuliny tak mají potenciál nejen zlepšit kompenzaci diabetu při nižším riziku hypoglykemie, ale s ohledem na možnost flexibilnějšího podání také zvýšit dlouhodobou adherenci pacientů k léčbě. V případě inzulinu glargin U300 je dle souhrnu údajů o přípravku (SPC) možné podání až 3 hodiny před obvyklou dobou nebo 3 hodiny po obvyklé době aplikace. V případě inzulinu degludek je flexibilita aplikace ještě větší. Dle SPC musí být mezi dvěma injekcemi zachován interval alespoň 8 hodin, degludek lze tedy podat až 8 hodin před obvyklou dobou či 8 hodin po obvyklé době aplikace.
Prakticky ve všech přímých srovnávacích studiích se též ukazuje, že při podávání inzulinu glargin U300 je ve srovnání s inzulinem degludek třeba o 10–15 % vyšší dávka. U inzulinu degludek trvá v důsledku delšího biologického poločasu poněkud déle, než dojde k ustavení stabilních hladin – zde je uváděna doba tří dnů.
Celkově lze tedy konstatovat, že obě dlouhodobě působící analoga 2. generace – inzulin degludek i inzulin glargin U300 – významně vylepšují naše možnosti léčby DM 1. typu a zejména 2. typu a mohou zlepšit kompenzaci diabetu při nižším výskytu hypoglykemií. Uvedené vlastnosti odráží i nejnovější konsensus EASD/ADA (European Association for the Study of Diabetes/ American Diabetes Association), který konstatuje, že pro zahájení léčby bazálním inzulinem u DM 2. typu by měl být zvážen bazální inzulin s nižším rizikem rozvoje hypoglykemie, tedy degludek/glargin U300 < detemir/glargin U100 < NPH inzulin, a u pacientů s kardiovaskulárním rizikem zvážit inzulin s prokázanou kardiovaskulární bezpečností: degludek nebo glargin [40].
Zajímavou možností u inzulinu degludek je také využití digitálních „chytrých“ inzulinových per, která umožňují získání záznamů, v jaké dávce a kdy byl inzulin aplikován [41]. Z klinického pohledu je výborné, že dostupnost dvou bazálních inzulinů druhé generace umožňuje individualizaci léčby a výběr optimální možnosti pro konkrétního pacienta.
Seznam použité literatury
- [1] Chatterjee S, Khunti K, Davies MJ. Type 2 diabetes. Lancet 2017; 389: 2239–2251.
- [2] Wright A, Burden ACF, Paisey RB, et al. Sulfonylurea inadequacy: efficacy of addition of insulin over 6 years in patients with type 2 diabetes in the U.K. Prospective Diabetes Study (UKPDS 57). Diabetes Care 2002; 25: 330–336.
- [3] Ahlqvist E, Storm P, Käräjämäki A, et al. Novel subgroups of adult‑onset diabetes and their association with outcomes: a data‑driven cluster analysis of six variables. Lancet Diabetes Endocrinol 2018; 6: 361–369.
- [4] Khunti K, Vora J, Davies M. Results from the UK cohort of SOLVE: providing insights into the timing of insulin initiation in people with poorly controlled type 2 diabetes in routine clinical practice. Prim Care Diabetes 2014; 8: 57–63.
- [5] Khunti K, Alsifri S, Aronson R, et al. Rates and predictors of hypoglycaemia in 27 585 people from 24 countries with insulin‑treated type 1 and type 2 diabetes: the global HAT study. Diabetes Obes Metab 2016; 18: 907–915.
- [6] Haak T, Tiengo A, Draeger E, et al. Lower within‑subject variability of fasting blood glucose and reduced weight gain with insulin detemir compared to NPH insulin in patients with type 2 diabetes. Diabetes Obes Metab 2005; 7: 56–64.
- [7] Yki‑Jarvinen H, Dressler A, Ziemen M. Less nocturnal hypoglycemia and better post‑dinner glucose control with bedtime insulin glargine compared with bedtime NPH insulin during insulin combination therapy in type 2 diabetes. HOE 901/3002 Study Group. Diabetes Care 2000; 23: 1130–1136.
- [8] Evans M, Schumm‑Draeger PM, Vora J, King AB. A review of modern insulin analogue pharmacokinetic and pharmacodynamic profiles in type 2 diabetes: improvements and limitations. Diabetes Obes Metab 2011; 13: 677–684.
- [9] Zachariah S, Sheldon B, Shojaee‑Moradie F, et al. Insulin detemir reduces weight gain as a result of reduced food intake in patients with type 1 diabetes. Diabetes Care 2011; 34: 1487–1491.
- [10] Sutton G, Minguet J, Ferrero C, Bramlage P. U300, a novel long‑acting insulin formulation. Expert Opin Biol Ther 2014; 14: 1849–1860.
- [11] Khunti K, Cos X, Rutten G. Insulin degludec‑‑the impact of a new basal insulin on care in type 2 diabetes. Prim Care Diabetes 2014; 8: 119–125.
- [12] Heinemann L, Richter B. Clinical pharmacology of human insulin. Diabetes Care 1993; 16(Suppl 3): 90–100.
- [13] Mathieu C. Can we reduce hypoglycaemia with insulin detemir? Int J Obes Relat Metab Disord 2004; 28(Suppl 2): S35–40.
- [14] Dunn CJ, Plosker GL, Keating GM, et al. Insulin glargine: an updated review of its use in the management of diabetes mellitus. Drugs 2003; 63: 1743–1778.
- [15] Gough SC, Harris S, Woo V, Davies M. Insulin degludec: Overview of a novel ultra long‑acting basal insulin. Diabetes Obes Metab 2013; 15: 301–309.
- [16] Jonassen I, Havelund S, Hoeg‑Jensen T, et al. Design of the novel protraction mechanism of insulin degludec, an ultra‑long‑acting basal insulin. Pharm Res 2012; 29: 2104–2114.
- [17] Heise T, Nosek L, Bottcher SG, et al. Ultra‑long‑acting insulin degludec has a flat and stable glucose‑lowering effect in type 2 diabetes. Diabetes Obes Metab 2012; 14: 944–950.
- [18] Torres MM. Degludec, a new ultra‑long‑acting basal insulin for the treatment of diabetes mellitus type 1 and 2: Advances in clinical research. Endocrinol Nutr 2014; 61: 153–159.
- [19] Ritzel R, Roussel R, Bolli GB, et al. Patient‑level meta‑analysis of the EDITION 1, 2 and 3 studies: glycaemic control and hypoglycaemia with new insulin glargine 300 U/ml versus glargine 100 U/ml in people with type 2 diabetes. Diabetes Obes Metab 2015; 17: 859–867.
- [20] Bailey TS, Pettus J, Roussel R, et al. Morning administration of 0.4U/kg/day insulin glargine 300U/mL provides less fluctuating 24‑hour pharmacodynamics and more even pharmacokinetic profiles compared with insulin degludec 100U/mL in type 1 diabetes. Diabetes Metab 2018; 44: 15–21.
- [21] Heise T, Norskov M, Nosek L, et al. Insulin degludec: Lower day‑to‑day and within‑day variability in pharmacodynamic response compared with insulin glargine 300 U/mL in type 1 diabetes. Diabetes Obes Metab 2017; 19: 1032–1039.
- [22] Yki‑Jarvinen H, Bergenstal RM, Bolli GB, et al. Glycaemic control and hypoglycaemia with new insulin glargine 300 U/mL versus glargine 100 U/mL in people with type 2 diabetes using basal insulin and oral antihyperglycaemic drugs (EDITION 2 randomised 12‑month trial including 6‑month extension). Diabetes Obes Metab 2015; 17: 142–149.
- [23] Riddle MC, Bolli GB, Home PD, et al. Efficacy and Safety of Flexible Versus Fixed Dosing Intervals of Insulin Glargine 300 U/mL in People with Type 2 Diabetes. Diabetes Technol Ther 2016; 18: 252–257.
- [24] Goldman‑Levine JD, Patel DK, Schnee DM. Insulin degludec: a novel basal insulin analogue. Ann Pharmacother 2013; 47: 269–277.
- [25] Lane W, Bailey TS, Gerety G, et al. Effect of Insulin Degludec vs Insulin Glargine U100 on Hypoglycemia in Patients With Type 1 Diabetes: The SWITCH 1 Randomized Clinical Trial. JAMA 2017; 318: 33–44.
- [26] Washam C, Bhargava A, Chaykin L, et al. Effect of Insulin Degludec vs Insulin Glargine U100 on Hypoglycemia in Patients With Type 2 Diabetes: The SWITCH 2 Randomized Clinical Trial. JAMA 2017; 318: 45–56.
- [27] Marso SP, McGuire DK, Zinman B, et al. Efficacy and Safety of Degludec versus Glargine in Type 2 Diabetes. N Engl J Med 2017; 377: 723–732.
- [28] Mathieu C, Hollander P, Miranda‑Palma B, et al. Efficacy and safety of insulin degludec in a flexible dosing regimen vs insulin glargine in patients with type 1 diabetes (BEGIN: Flex T1): a 26‑week randomized, treat‑to‑target trial with a 26‑week extension. J Clin Endocrinol Metab 2013; 98: 1154–1162.
- [29] Goldenberg RM, Aroda VR, Billings LK, et al. Effect of insulin degludec versus insulin glargine U100 on time in range: SWITCH PRO, a crossover study of basal insulin‑treated adults with type 2 diabetes and risk factors for hypoglycaemia. Diabetes Obes Metab 2021; 23: 2572–2581.
- [30] ORIGIN Trial Investigators; Gerstein HC, Bosch J, Dagenais GR, et al. Basal insulin and cardiovascular and other outcomes in dysglycemia. N Engl J Med 2012; 367: 319–328.
- [31] Rosenstock J, Cheng A, Ritzel R, et al. More Similarities Than Differences Testing Insulin Glargine 300 Units/mL Versus Insulin Degludec 100 Units/mL in Insulin‑Naive Type 2 Diabetes: The Randomized Head‑to‑Head BRIGHT Trial. Diabetes Care 2018; 41: 2147–2154.
- [32] Philis‑Tsimikas A, Klonoff DC, Khunti K, et al. Risk of hypoglycaemia with insulin degludec versus insulin glargine U300 in insulin‑treated patients with type 2 diabetes: the randomised, head‑to‑head CONCLUDE trial. Diabetologia 2020; 63: 698–710.
- [33] Haluzik M, Cheng A, Müller‑Wieland D, et al. Differential glycaemic control with basal insulin glargine 300 U/mL versus degludec 100 U/mL according to kidney function in type 2 diabetes: A subanalysis from the BRIGHT trial. Diabetes Obes Metab 2020; 22: 1369–1377.
- [34] Pieber TR, Bajaj HS, Heller SR, et al. Impact of kidney function on the safety and efficacy of insulin degludec versus insulin glargine U300 in people with type 2 diabetes: A post hoc analysis of the CONCLUDE trial. Diabetes Obes Metab 2022; 24: 332–336.
- [35] Battelino T, Bosnyak Z, Danne T, et al. InRange: Comparison of the Second‑Generation Basal Insulin Analogues Glargine 300 U/mL and Degludec 100 U/mL in Persons with Type 1 Diabetes Using Continuous Glucose Monitoring‑Study Design. Diabetes Ther 2020; 11: 1017–1027.
- [36] Conget I, Mangas MÁ, Morales C, et al. Effectiveness and Safety of Insulin Glargine 300 U/ml in Comparison with Insulin Degludec 100 U/ml Evaluated with Continuous Glucose Monitoring in Adults with Type 1 Diabetes and Suboptimal Glycemic Control in Routine Clinical Practice: The OneCARE Study. Diabetes Ther 2021; 12: 2993–3009.
- [37] Tibaldi J, Hadley‑Brown M, Liebl A, et al. A comparative effectiveness study of degludec and insulin glargine 300 U/mL in insulin‑naive patients with type 2 diabetes. Diabetes Obes Metab 2019; 21: 1001–1009.
- [38] Fadini GP, Buzzetti R, Nicolucci A, et al. Comparative Effectiveness of Insulin Glargine 300 U/mL (Gla‑300) and Insulin Degludec 100 U/mL (iDeg‑100) in Insulin‑Naïve Type 2 Diabetes Adults: RESTORE‑2 Real‑World Study. Diabetes 2021; 70(Supplement_1): 109‑LB.
- [39] Fadini GP, Buzetti R, Nicolucci A, et al. Comparative effectiveness and safety of glargine 300 U/mL versus degludec 100 U/mL in insulin‑naive patients with type 2 diabetes. A multicenter retrospective real‑world study (RESTORE‑2 NAIVE STUDY). Acta Diabetol 2022; 59: 1317–1330.
- [40] Davies MJ, Aroda VR, Collins BS, et al. Management of Hyperglycemia in Type 2 Diabetes, 2022. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2022; doi: 10.2337/dci22‑0034 [online ahead of print].
- [41] Adolfsson P, Björnsson V, Hartvig NV, et al. Improved Glycemic Control Observed in Children with Type 1 Diabetes Following the Introduction of Smart Insulin Pens: A Real‑World Study. Diabetes Ther 2022; 13: 43–56.