Dlouhodobý účinek sekukinumabu u aktivní ankylozující spondylitidy: tříletá data o účinnosti a bezpečnosti z pokračování studie fáze III MEASURE 1
Souhrn:
Časopis Clinical and Experimental Rheumatology uveřejnil 15. května 2017 výsledky pokračování klinické studie fáze III se sekukinumabem u ankylozující spondylitidy – MEASURE 1. Předložená data svědčí o stabilním dobrém účinku i ve třetím roce léčby. Sekukinumab je plně humánní monoklonální protilátka, která neutralizuje interleukin 17A.
Key words: secukinumab – ankylosing spondylitis – interleukin 17A.
Summary:
On May 15th, 2017, the journal Clinical and Experimental Rheumatology published results concerning extension of the clinical phase III trial using secukinumab in ankylosing spondylitis – MEASURE 1. The published data confirm stable and good effectiveness of this drug through the third year of treatment. Secukinumab is a fully human monoclonal antibody neutralizing interleukin 17A.
Úvod
Ankylozující spondylitida (AS) je chronické zánětlivé onemocnění, které vede k ireverzibilním změnám axiálního skeletu. Pacienti s AS vyžadují dlouhodobou léčbu ke zmírnění příznaků a k zachování funkce páteře. Inhibitory tumor nekrotizujícího faktoru (TNF) zlepšují stav nemocných s AS, ale neúčinkují u všech pacientů a po určité době léčby mohou ztratit svůj terapeutický efekt. Proto je nutné stále hledat a vyvíjet léčivé přípravky, které jsou zacíleny na další složky zánětlivé kaskády. Interleukin 17A (IL 17A) je klíčovým cytokinem v rozvoji zánětlivých změn v patogenezi AS. Již v prosinci 2015 byly zveřejněny výsledky klinických studií s inhibitorem IL 17A sekukinumabem [1].
Význam inhibice IL 17A
Sekukinumab je plně humánní monoklonální protilátka IgG1κ, která se selektivně váže na prozánětlivý cytokin IL 17A a neutralizuje ho. Brání tak interakci s receptorem pro IL 17A, který je exprimován mnoha typy buněk, čímž je blokována produkce dalších prozánětlivých cytokinů, chemokinů a mediátorů tkáňového poškození. Interleukin 17A hraje klíčovou roli v patogenezi ložiskové psoriázy, psoriatické artritidy a ankylozující spondylitidy. Jeho blokádou se ruší jeho patogenní působení u autoimunitních a zánětlivých onemocnění [2]. Interleukin 17A je přirozeně se vyskytující cytokin, který se účastní normální zánětlivé a imunitní odpovědi. Jeho množství je zvýšeno v psoriatických lézích a v synoviální tekutině pacientů s psoriatickou artritidou. Četnost výskytu buněk produkujících IL 17 je též významně vyšší v subchondrální kostní dřeni intervertebrálních kloubů u pacientů s AS [2].
Studie fáze III
The New England Journal of Medicine uveřejnil v lednu 2015 výsledky počáteční šestnáctitýdenní etapy klinických studií fáze III ‒ MEASURE 1 a MEASURE 2 ‒, jež ověřovaly bezpečnost a účinnost sekukinumabu u pacientů s aktivní AS, kteří buď nebyli ještě léčeni inhibitory TNF, anebo byli léčeni jedním inhibitorem TNF po selhání léčby nebo po ukončení léčby pro intoleranci. Šlo o dvojitě zaslepené randomizované studie, kde bylo komparátorem placebo. Ve studii MEASURE 1 bylo sledováno 371 pacientů, kteří dostali v indukční fázi intravenózně sekukinumab (10 mg/kg hmotnosti) nebo placebo na počátku a pak ve 2. a 4. týdnu. Následovalo subkutánní podání sekukinumabu (150 mg nebo 75 mg), nebo placeba každé čtyři týdny (od 8. týdne). Ve studii MEASURE 2 byla provedena úvodní indukční léčba, ale subkutánně. Zúčastnilo se jí 219 pacientů, kteří byli randomizováni k terapii subkutánním sekukinumabem (150 mg nebo 75 mg) a k podávání placeba na začátku léčby a pak v 1., 2. a 3. týdnu a dále od 4. týdne v čtyřtýdenních intervalech. V 16. týdnu byli pacienti ve skupině placeba randomizováni k aplikaci buď 150 mg, nebo 75 mg sekukinumabu.
Primárním cílovým ukazatelem obou studií byl podíl pacientů, kteří dosáhli zlepšení alespoň o 20 % v kritériích ASAS (Assessment of Spondyloarthritis International Society) v 16. týdnu. Pacienti mohli v průběhu studií nadále užívat kortikosteroidy, nesteroidní antirevmatika a chorobu modifikující léky (sulfasalazin a metotrexát) do určité, předem stanovené dávky [1].
Ve studii MEASURE 1 dosáhlo ASAS 20 celkem 61 %, resp. 60 % pacientů léčených 150 mg a 75 mg sekukinumabu (po úvodní intravenózní léčbě), ale pouze 29 % nemocných v placebové skupině (p < 0,001) [1]. Sledování až do 156. týdne je předmětem sdělení v článku uveřejněném uprostřed května 2017 v časopise Clinical and Experimental Rheumatology. Ve studii MEASURE 2 dosáhlo ASAS 20 celkem 61 % pacientů léčených 150 mg sekukinumabu, 41 % nemocných, kteří dostávali 75 mg sekukinumabu, a 28 % pacientů s aplikací placeba. Statisticky významný je rozdíl mezi procenty pacientů léčených sekukinumabem v dávce 150 mg a placebem. V průběhu léčby sekukinumabem se vyskytly spíše ojedinělé případy neutropenie, infekce kandidou a Crohnovy choroby. Závěrem autoři shrnují, že sekukinumab v subkutánní dávce 150 mg je účinný i bez indukční intravenózní terapie (postačuje subkutánní indukční fáze), zatímco v dávce 75 mg jen po úvodní intravenózní indukci [1].
Účinnost a bezpečnost sekukinumabu v tříletém horizontu
Pacienti s aktivní AS, kteří byli zařazeni do studie MEASURE 1 (viz výše), byli dále sledováni a hodnoceni v 52. týdnu, po dvou letech a poslední zveřejněná data dokazují setrvalou léčebnou odpověď po třech letech léčby sekukinumabem. Aktivita onemocnění při vstupu do studie byla stanovena podle modifikovaných newyorských klasifikačních kritérií s hodnotou BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) ≥ 4 a se skóre bolesti páteře ≥ 40 mm (na stupnici 0–100 mm) bez ohledu na terapii nesteroidními antirevmatiky. Po dobu tří let pokračovali pacienti (po úvodní intravenózní terapii) v aplikaci 150 mg nebo 75 mg sekukinumabu každé čtyři týdny. Jejich stav byl hodnocen podle dosažení kritérií ASAS 20/40, ASAS 5/6, BASDAI, BASDAI 50, BASMI (Bath Ankylosing Spondylitis Metrology Index), BASFI (Bath Ankylosing Spondylitis Functional Index), SF36 PCS (physical component summary), ASAS partial remission, ASDAS CRP (Ankylosing Spondylitis Disease Activity Score with C reactive protein).
Do studie MEASURE 1 bylo původně randomizováno 371 pacientů, z nichž dvouleté sledování dokončilo 290 a tříleté 274 nemocných (tj. 94,5 % z počtu nemocných sledovaných po dva roky). Průměrná doba expozice činila 964,3 dne, tj. 137,8 týdne; celková doba expozice sekukinumabu byla 950,4 pacientoroků.
Výsledky po třech letech sledování: ASAS 20/40 dosahovalo 80,2 %/61,6 % pacientů léčených 150 mg sekukinumabu a 75,5 %/50,0 % pacientů s terapií 75 mg sekukinumabu každé čtyři týdny (po úvodní intravenózní terapii). Léčebná odpověď vykazovala vysokou míru stability a po dosažení efektu v 16. týdnu neklesala.
Z pacientů, kteří nebyli předléčeni anti TNF přípravky, dosáhlo ASAS 20/40 celkem 80,0 %/61,4 % a v případech, kdy nemocní již byli léčeni anti TNF léky, dosáhlo ASAS 20/40 celkem 81,3 %/62,5 % pacientů s dávkováním 150 mg sekukinumabu. U nižšího dávkování (75 mg) činil podíl ASAS 20/40 celkem 76,0 %/48,0 % u nepředléčených nemocných a 73,9 %/56,5 % u pacientů nově zařazených z placebové skupiny (po 16 týdnech) mezi aktivně léčené ‒ ASAS 20/40 dosáhlo 67,5 %/55,0 % nemocných s dávkou 150 mg sekukinumabu a 76,1 %/54,3 % pacientů léčených 75 mg sekukinumabu každé čtyři týdny. Výskyt nežádoucích účinků byl konzistentní po celou dobu sledování a s dobou léčby nedocházelo k významné progresi jejich četnosti [3].
Výsledky u skupiny pacientů,
kteří zahájili léčbu intravenózním podáváním sekukinumabu
v tříletém horizontu, jsou shrnuty v tabulce 1.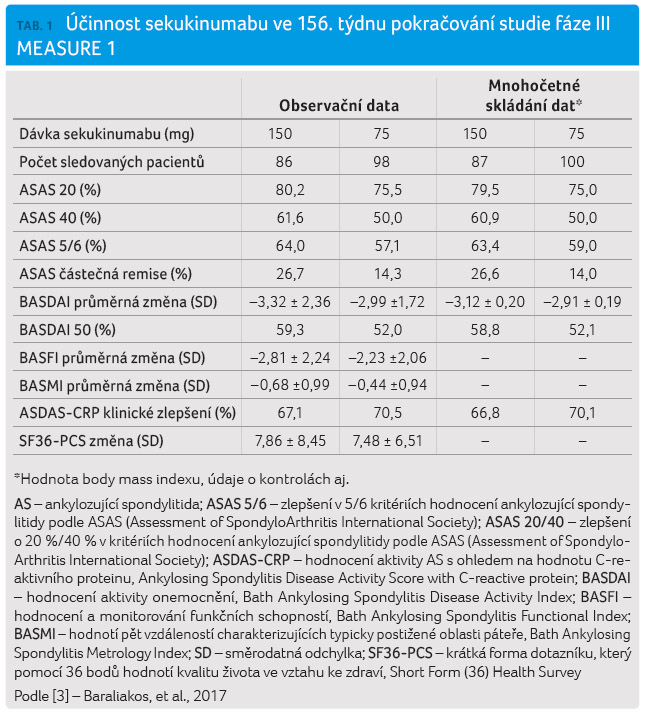
V diskusi autoři uvádějí, že zlepšení klinického stavu a výskyt nežádoucích účinků byly konzistentní ve všech skupinách léčených sekukinumabem. Limitací dlouhodobého sledování může být absence placebové kontrolní skupiny, ale tomuto požadavku nelze z etických důvodů vyhovět.
Závěr
Sekukinumab vykázal i v tříletém sledování významnou klinickou účinnost, která je setrvalá v čase, a vyhovující bezpečnostní profil u nemocných s AS. Sekukinumab představuje nový účinný biologický lék pro léčbu s jiným mechanismem účinku, který rozšíří naše terapeutické možnosti u tohoto heterogenního onemocnění.
Seznam použité literatury
- [1] Baeten D, Sieper J, Braun J, et al. Secukinumab, an interleukin 17A inhibitor in ankylosing spondylitis. N Engl J Med 2015; 373: 2534–2548.
- [2] SPC Cosentyx (secukinumab). European Medicines Agency, leden 2015. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/003729/WC500183129.pdf.
- [3] Baraliakos X, Kivitz AJ, Deodhar AA, et al. Long term effects of interleukin 17A inhibition with secukinumab in active ankylosing spondylitis: 3 year efficacy and safety results from an extension of the Phase 3 MEASURE 1 trial. Clin Exp Rheumatol 2017, May 15. [Epub ahead of print]