Fingolimod v rámci eskalace terapie roztroušené sklerózy a zlepšení compliance pacienta
Souhrn:
Škutová M. Fingolimod v rámci eskalace terapie roztroušené sklerózy a zlepšení compliance pacienta. Remedia 2020; 30: 623–627.
Kazuistika popisuje případ mladého pacienta s relabující‑remitující formou roztroušené sklerózy s původně nedostatečnou compliance s léčbou injekčně podávaným přípravkem a s úpravou přechodné polékové hepatopatie po zahájení léčby fingolimodem.
Summary:
Skutova M. Fingolimod in the context of therapy escalation for multiple sclerosis and increasing patient compliance. Remedia 2020; 30: 623–627.
The case report describes a young patient with relapsing‑remitting multiple sclerosis with inadequate compliance to injection therapy and with an adjustment of transient drug‑induced hepatopathy after the initiation of therapy with fingolimod.
Key words: multiple sclerosis, attack, EDSS, drug‑induced hepatopathy, liver tests, ALT, AST, fingolimod
Úvod
Roztroušená skleróza (RS) je multifaktoriální onemocnění, které se řadí mezi autoimunitní progredující chronické choroby centrálního nervového systému (CNS). Poprvé byla popsána jako samostatná choroba v roce 1868 francouzským neurologem Jeanem Martinem Charcotem [1]. Celosvětově postihuje více než 2,5 milionu osob a v České republice je její prevalence přibližně 160/100 000 obyvatel. Vyskytuje se zejména na severní polokouli v mírném podnebném pásu. Nejčastěji se manifestuje mezi 20.‒40. rokem života. Vyšší výskyt je zaznamenán u žen oproti mužům ‒ v poměru 2 : 1 [2].
V patogenezi se předpokládá multifaktoriální vliv jak genetických a epigenetických, tak i environmentálních faktorů. Uplatňuje se asociace s haplotypy HLA DRB1+1501, DRB5+0101 a DQB1+0602 [3]. Primární roli hraje pravděpodobně geneticky determinovaná imunitní odpověď, kde cílovými strukturami jsou antigeny CNS. Nemoc je charakterizována infiltrací leukocytů do CNS [4,5].
Za prokázané rizikové faktory se považují interkurentní virové infekce, zejména infekce virem Epsteina‒Barrové (EBV), opakované vakcinace, kouření, dlouhotrvající stres a nedostatek vitaminu D. Nově zjištěnými rizikovými faktory jsou rovněž obezita, nižší inteligenční kvocient a poruchy paměťových funkcí v časném věku [1,2].
Role imunitního systému v patogenezi RS je komplexní a v průběhu choroby se mění. Zahrnuje prozánětlivé i protizánětlivé pochody. Velmi významnou úlohu hrají T lymfocyty, které jsou schopny rozeznat epitopy molekul, jež jsou součástí struktur myelinových pochev nervových vláken. K aktivaci těchto lymfocytů, jež se po prostupu hematoencefalickou bariérou podílejí na aktivaci mikroglie a makrofágů, dochází v periferních lymfatických orgánech. V plakách nastává poškození přímo působením cytotoxických T lymfocytů. B lymfocyty se pravděpodobně uplatňují v mechanismech poskytujících signály pro aktivaci T lymfocytů [6,7]. Onemocnění vede k demyelinizaci, axonální a neuronální ztrátě. Stupeň axonálního poškození odpovídá tíži trvalého klinického nálezu a míře invalidizace nemocného [8]. K úbytku mozkové tkáně dochází rychleji než při přirozeném procesu stárnutí organismu [5].
K nejčastějším příznakům RS se řadí parestezie, dysestezie, poruchy hybnosti a porucha funkce sfinkterů, dále také třes, poruchy zraku, diplopie a zejména únava. Variabilita symptomů je dána lokalizací léze v různých etážích mozku a míchy.
Přibližně 85‒90 % pacientů má relabující remitující průběh nemoci (RR RS), což znamená, že jednotlivé ataky (zhoršení klinických potíží) se objevují v různých časových intervalech a v mezidobí těchto atak je choroba víceméně stabilní. Nicméně s určitým odstupem se posléze stav u velké části pacientů pozvolna zhoršuje a nastává přechod do tzv. sekundárně progresivní fáze (SP RS). Menší část nemocných mívá průběh primárně progresivní (PP RS) s postupným rozvojem nových a se zhoršováním stávajících příznaků již od počátku vzniku choroby [1,2,6].
Diagnóza RS je založena na průkazu roztroušenosti v čase a v prostoru, která se projevuje klinickými zhoršeními (atakami) nebo nálezy lézí na zobrazení magnetickou rezonancí (MRI) mozku či míchy splňujícími kritéria diseminace v prostoru a v čase. V diagnostice má vyšetření pomocí MRI své nezastupitelné místo, jsou zde patrna ložiska zvýšeného signálu v T2 váženém obraze či modu FLAIR s nálezem v typicky daných lokalitách mozku a potažmo míchy (periventrikulárně, juxtakortikálně, kortikálně, v zadní jámě či intramedulárně). Kromě vyšetření zobrazovacího je neméně důležité vyšetření likvorologické, kdy u více než 95 % nemocných nacházíme tzv. oligoklonální pásy (imunoglobuliny G či M, IgG, IgM), které jsou nově akceptovány jako důkaz diseminace v čase [1,2,6].
Při včasné diagnostice a razantní léčbě lze výrazně snížit aktivitu onemocnění a zpomalit progresi neurologické disability. Od poloviny devadesátých let 20. století jsou k dispozici tzv. disease modifying drugs (DMDs), což jsou léky schopné ovlivnit průběh choroby. Terapie DMDs první linie je indikována již po první atace onemocnění (klinicky izolovaný syndrom, CIS), samozřejmě po splnění diagnostických kritérií [9]. Za méně než 10 let se doba mezi stanovením diagnózy a zahájením léčby zkrátila téměř patnáctinásobně [5].
Současná léčba RS spočívá zejména v imunomodulačním efektu se zaměřením na ovlivnění autoimunitních dějů. Jedná se o komplexní unikátní mechanismus působení [10].
Kazuistika
Mladý muž, ročník 1993, bez závažné přidružené komorbidity začal v dubnu 2013 pozorovat sníženou citlivost (hypestezii) na zevní straně levé horní končetiny (LHK), posléze se přidala lehká neobratnost akra LHK a hypestezie I.‒III. prstu. Cítil se více unavený. Navštívil svého neurologa, který jej odeslal na MRI vyšetření mozku a krční míchy, na němž byl v té době již viditelný supratentoriální nález demyelinizačních změn mozku, a rovněž v oblasti míchy se objevila dvě demyelinizační ložiska ve výši 5. a 6. krčního obratle. Na základě klinického obrazu a tohoto vyšetření bylo indikováno provedení lumbální punkce s nálezem lehké pleiocytózy (12 buněk) a následně s potvrzenými pozitivními oligoklonálními pásy ve třídě IgG v počtu 18. V séru se tyto pásy objevily v počtu 9, byla tedy prokázána významná zvýšená intratekální syntéza těchto pásů korelující s onemocněním RS. Vyšetření likvoru (čítající komplexní virologický panel, borrelie i cytologii) bylo v normě. Klient byl přeléčen bolem intravenózně podávaných kortikoidů, konkrétně metylprednisolonem v dávce 3,5 g.
V červnu 2013 pacient poprvé navštívil RS centrum, kde mu na základě výše uvedených nálezů a objektivního vyšetření byl diagnostikován CIS s možným vysokým rizikem přechodu do klinicky definitivní RS. Jelikož v rámci této diagnózy splňoval kritéria k zahájení léčby DMDs, byl mu nabídnut interferon beta 1a v aplikaci jednou týdně intramuskulárně, neboť pacient dával přednost co nejméně frekventované parenterálně podávané léčbě. Neurologicky tehdy subjektivně reziduálně přetrvávaly hypestezie LHK, objektivně pak pacient vykazoval kvadrupyramidový syndrom s centrální lehkou monoparézou LHK s dystaxií, navíc byl pozitivní Lhermitteův příznak. Na Kurtzkeho škále při hodnocení neurologické disability (Expanded Disability Status Scale, EDSS) bylo zaznamenáno skóre 2,0 bodu.
Nicméně pacient přípravek v injekční formě subjektivně příliš netoleroval, následně byla jeho compliance s touto terapií velmi nízká a záhy přestal užívat lék zcela a nedostavil se k plánovaným kontrolám ani po aktivní opakované výzvě. Rovněž se nedostavil na kontrolní MRI vyšetření. Později toto období komentoval slovy, že hledal jiné možnosti léčby.
Neléčené onemocnění se projevilo v podobě další ataky v září 2014. Pacient si stěžoval na zhoršení únavy a závratě, pozoroval omezení zejména v běhu a v koordinaci končetin. Objektivně jevil známky paleocerebelárního i neocerebelárního syndromu. Stav byl přeléčen intravenózně podávaným metylprednisolonem v dávce 3 g. Stav se zlepšil, hodnota EDSS zůstala nedotčena, ale tentokrát již pacient nesplňoval tehdejší kritéria k pokračování léčby DMDs a byla u něj zahájena terapie kortikoidem v tabletové formě (metylprednisolon 4 mg denně) spolu s podávanou suplementací kalia a gastroprotektiva. Takto celkem dobře fungoval až do podzimu roku 2015, v září a následně v prosinci 2015 však prodělal dvě ataky choroby. Obě byly řádně přeléčeny intravenózně podávaným metylprednisolonem v celkové dávce 3 g a 4 g, klinicky se ale pacientův stav po těchto epizodách lehce zhoršil a EDSS skóre se zvýšilo na hodnotu 3,0. Nálezy na MRI mozku z listopadu 2015 vykazovaly jen minimální změny od předchozího vyšetření, ale progrese demyelinizací se prokázala na MRI míchy, kde byla nalezena celkem čtyři ložiska demyelinizací v oblasti krční míchy (C míchy), a to od výše C2 po C6, tedy o dvě ložiska více než v roce 2013. V oblasti hrudní míchy (Th míchy) byla také zaznamenána demyelinizace ve výši Th6 a Th11/12. Všechna ložiska byla bez známek aktivity.
Protože pacient opět splňoval
kritéria k zahájení léčby DMDs a silně preferoval
jinou než parenterálně podávanou formu, bylo mu vyhověno
i vzhledem k dostupnosti nového přípravku na trhu
podávaného v rámci první linie. Od února 2016 začal
nemocný užívat perorálně teriflunomid v dávce 14 mg
denně. Tuto léčbu toleroval a byl spokojen. Klinicky došlo
zpočátku rovněž k úpravě stavu, a to na hodnotu
EDSS 2,5 bodu, nález na MRI mozku byl stacionární.
Nedlouho po začátku léčby pacient v prosinci 2016
prodělal lehkou ataku ve formě centrálního vestibulár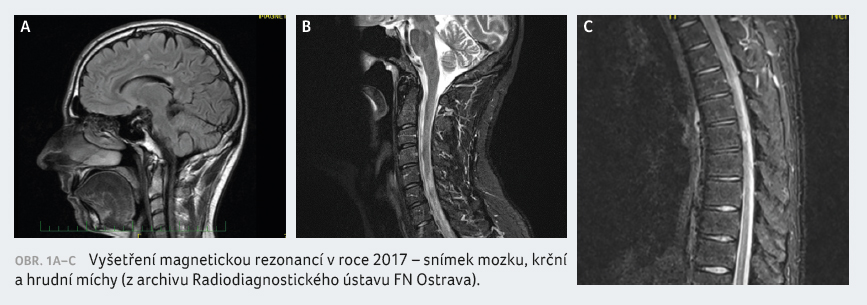 ního
syndromu, kdy po zaléčení intravenózně podávaným
metylprednisolonem v celkové dávce 4 g se jeho stav brzy
vrátil do předchozí normy. Na jaře 2017 po vyléčené
viróze prodělává další, tentokrát již protrahovanou středně
těžkou ataku, se symptomatikou paleocerebelární a s rozvojem
centrální paraparézy dolních končetin s nárůstem EDSS
na 3,5 bodu. Po přeléčení intravenózním
metylprednisolonem v dávce 4 g se jeho stav jen velmi
pozvolna upravoval, ale na škále EDSS skóre stagnovalo
na hodnotě 3,5. Vyšetření MRI mozku potvrdilo také progresi
drobných demyelinizačních změn v oblasti mezencefalu vlevo
s lehkým sycením a ložisko v oblasti předního
okraje pontu vpravo, které již nevykazovalo známky aktivity.
V oblasti krční míchy rovněž došlo k lehké progresi
nálezu (obr. 1A‒C). Tehdy bylo provedeno také sérologické
vyšetření na protilátky proti akvaporinu 4 (AQP4 IgG)
a na protilátky neuromyelitis optica IgG (NMO IgG), vše
s negativními nálezy.
ního
syndromu, kdy po zaléčení intravenózně podávaným
metylprednisolonem v celkové dávce 4 g se jeho stav brzy
vrátil do předchozí normy. Na jaře 2017 po vyléčené
viróze prodělává další, tentokrát již protrahovanou středně
těžkou ataku, se symptomatikou paleocerebelární a s rozvojem
centrální paraparézy dolních končetin s nárůstem EDSS
na 3,5 bodu. Po přeléčení intravenózním
metylprednisolonem v dávce 4 g se jeho stav jen velmi
pozvolna upravoval, ale na škále EDSS skóre stagnovalo
na hodnotě 3,5. Vyšetření MRI mozku potvrdilo také progresi
drobných demyelinizačních změn v oblasti mezencefalu vlevo
s lehkým sycením a ložisko v oblasti předního
okraje pontu vpravo, které již nevykazovalo známky aktivity.
V oblasti krční míchy rovněž došlo k lehké progresi
nálezu (obr. 1A‒C). Tehdy bylo provedeno také sérologické
vyšetření na protilátky proti akvaporinu 4 (AQP4 IgG)
a na protilátky neuromyelitis optica IgG (NMO IgG), vše
s negativními nálezy.
Pacient byl indikován k eskalaci
terapie DMDs, původní léčba přípravkem první linie byla
ukončena. Vzhledem k preferencím pacienta ohledně tabletové
formy léku byla po splnění všech potřebných vyšetření
včetně přeléčení kolestyraminem zahájena od srpna 2017
léčba fingolimodem v dávce 0,5 mg jednou denně. Klient
léčbu subjektivně hodnotil velmi pozitivně, nicméně po dvou
měsících od začátku terapie se u něj objevil jeden
z nežádoucích účinků v podobě lehké hepatopatie.
Laboratorní vyšetření krve kromě očekávané a v podstatě
žádoucí leukopenie (3,58 × 109/l) a lymfopenie
(0,76 × 109/l) doložilo nežádoucí vyšší
hodnoty jaterních testů. Aktivita alaninaminotransferázy (ALT)
vystoupala k hodnotě 1,98 μkat/l, aktivita
aspartátaminotransferázy (AST) na 1,23 μkat/l
a glutamyltransferázy (GMT) na 0,93 μkat/l. Laboratorní
normy činí pro ALT 0,17‒1,13 μkat/l, pro AST 0,25‒0,75 μkat/l
a pro GMT 0,17‒1,67 μkat/l. Po dalším měsíci léčby,
v listopadu 2017, již hodnoty ALT překročily povolenou mez
možné elevace stran bezpečnosti léčivého přípravku
a pohybovaly se okolo 5,2 μkat/l. Proto jsme terapii
fingolimodem dočasně přerušili, i když subjektivně pacient
nevykazoval žádné klinické obtíže (obr. 2A‒C). Mezitím
nemocný užíval hepatoprotektiva, dodržoval nízkotučnou jaterní
dietu a absolvoval vyšetření hepatologem, který neshledal
žádnou jinou patologii a uzavřel stav diagnózou polékové
hepatopatie bez zvláštních opatření.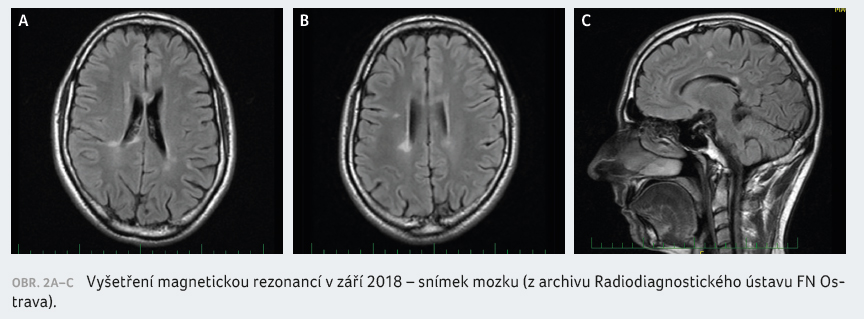
Od konce prosince 2018 se hodnoty jaterních testů upravovaly téměř do normy. Dne 10. ledna 2019 byla aktivita ALT pouze lehce vyšší (1,39 μkat/l) a ostatní jaterní testy byly zcela v normě, tudíž byla u pacienta opět zahájena léčba fingolimodem. Ačkoliv se později hodnoty jaterních transamináz opět zvýšily, nepřesáhly již trojnásobek normy (ULN, upper limit of normal), aktivita ALT se v období 3.‒8. měsíce po obnovení terapie pohybovala maximálně okolo 2,5‒3,0 μkat/l a posléze pozvolna klesala. Nemocný přechodně pokračoval v užívání hepatoprotektiv. Od prosince 2018 byly jaterní testy opakovaně zcela v normě. Pacient terapii přijal, subjektivně ji vnímá jako velmi příznivou, a to jak formou užívání, tak léčebným efektem. Nadále dodržuje lehce nízkotučnou stravu, jelikož mu plně vyhovuje a redukoval díky ní v přijatelných mezích svoji hmotnost. Podle svých slov se snaží žít zdravěji, více sportuje a snaží se dbát na správnou spánkovou hygienu. Hepatoprotektiva již neužívá.
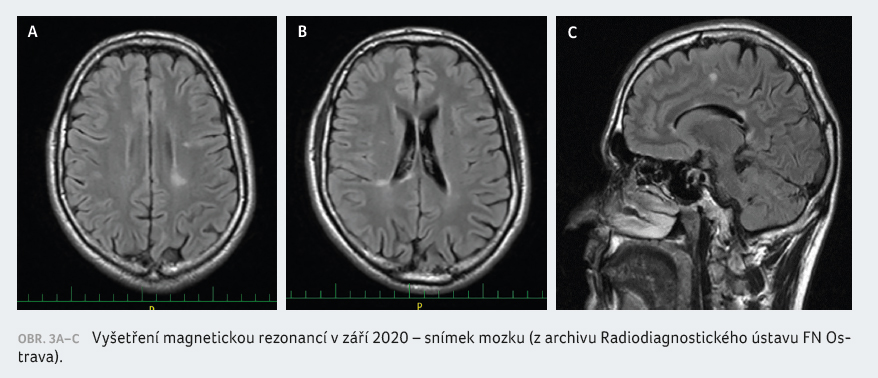 Klinicky je pacient od zahájení
léčby fingolimodem zcela stabilní, bez nových neurologických
příznaků a atak. Vyšetření MRI mozku vykazovalo od té
doby pouze v srpnu 2019 jednu drobnou novou lézi
dorzotemporálně vpravo, bez známek aktivity. Na MRI krční
míchy se předchozí demyelinizace nezměnily a v oblasti
hrudní míchy lehce regredovaly. Poslední MRI mozku v září
2020 se jeví stacionární, beze změn (obr. 3A‒C). Titry
John Cunningham viru jsou opakovaně negativní.
Klinicky je pacient od zahájení
léčby fingolimodem zcela stabilní, bez nových neurologických
příznaků a atak. Vyšetření MRI mozku vykazovalo od té
doby pouze v srpnu 2019 jednu drobnou novou lézi
dorzotemporálně vpravo, bez známek aktivity. Na MRI krční
míchy se předchozí demyelinizace nezměnily a v oblasti
hrudní míchy lehce regredovaly. Poslední MRI mozku v září
2020 se jeví stacionární, beze změn (obr. 3A‒C). Titry
John Cunningham viru jsou opakovaně negativní.
Závěr
Fingolimod je syntetický derivát myriocinu a po fosforylaci funguje jako silný antagonista receptorů sfingosin 1 fosfátu (S1P 1, 4, 5) a slabší antagonista S1P 3 [6,11,12]. Zajišťuje retenci lymfocytů v lymfatických uzlinách, které tak nemohou pronikat v rámci patofyziologických dějů RS do CNS, ale zůstávají nadále funkční [11‒13]. V periferní krvi tedy klesá počet lymfocytů na 20‒30 % [11]. Fingolimod je schopen modulovat nejen buňky imunitního systému, ale také buňky CNS, včetně astrocytů a mikroglie. Prostupuje přes hematoencefalickou bariéru [5,11]. Jeho léčebný účinek spočívá v zabránění přestupu autoreaktivních lymfocytů, včetně T lymfocytů, hematoencefalickou bariérou do cílového orgánu – CNS [10]. Byl prokázán efekt fingolimodu na redukci počtu relapsů a aktivity na MRI mozku včetně zpomalení atrofie mozku [6,14]. Léčba tímto přípravkem je většinou velmi dobře tolerována, ačkoliv se u pacientů vyskytují některé nežádoucí účinky. Nejzávažnějším je bradykardizující efekt, a zahájení terapie se z tohoto důvodu provádí při minimálně šestihodinové monitoraci EKG. Pacienty s nízkou hodnotou protilátek proti viru varicella zoster je třeba před léčbou očkovat, jelikož se u této terapie četněji vyskytují herpetické infekce, včetně encefalitid. Během léčby je nutné kontrolovat oční pozadí kvůli riziku rozvoje makulárního edému. Pro možný vyšší výskyt vzniku bazaliomu je také doporučeno pravidelné kožní vyšetření. Pacientky v reprodukčním věku by měly užívat účinnou antikoncepci z důvodu vysokého rizika teratogenity. V laboratoři pravidelně monitorujeme výsledky jaterních testů a krevního obrazu kvůli případné elevaci hodnot jaterních testů a rozvoji leukopenie a lymfopenie. Přerušení léčby se doporučuje u opakovaného zvýšení aktivity transamináz, při poklesu počtu lymfocytů pod hodnotu 0,2 × 109/l a během závažných infekcí [3,5].
Námi popisovaný pacient léčbu fingolimodem od počátku velmi dobře subjektivně snáší. I přes prvotní lehké nesnáze v podobě elevace hodnot jaterních testů se po krátkodobém přerušení léčby a jejím znovuzahájení nežádoucí účinky zredukovaly a dosud se neobjevily nové. Klinicky i v radiologických nálezech je nemocný nadále stabilní.
Léčba jakéhokoliv onemocnění by měla být co možná nejvíce individualizovaná a laicky řečeno „šitá na míru“. Právě z důvodu jedinečnosti každého živého organismu nejen vlivem odlišné genetické výbavy každého z nás, ale také vlivem odlišného vnímání, chápání a jednání v určitých situacích bychom měli naše pacienty hodnotit komplexně, aby se léčba neminula účinkem. V tomto případě je spokojenost na straně lékaře i pacienta. Právě možnost nastavit léčbu konkrétnímu pacientovi podle jeho potřeb a představ vedla k maximální dobré spolupráci a výraznému zlepšení compliance, jež je významná pro očekávaný efekt terapie.
Ačkoliv uvedené onemocnění zatím zcela vyléčit neumíme, jisté je, že včasné zahájení léčby či včasná eskalace DMDs může u valné většiny pacientů zmírnit průběh nemoci a zlepšit jejich prognózu do budoucna. Je potřeba sledovat nežádoucí účinky zejména u DMDs vyšší linie, aktivně je monitorovat a správně a včas na ně reagovat. Zároveň je důležité nenechat se odradit od pokračování v terapii, pokud se nám v případě výskytu nežádoucích reakcí podaří dosáhnout jejich redukce a účinek dané léčby je pro pacienta nesporně pozitivní.
Seznam použité literatury
- [1] Havrdová E, a kol. Roztroušená skleróza. Praha: Mladá fronta, 2013: 102‒113, 368‒417.
- [2] Vališ M, Pavelek Z, a kol. Roztroušená skleróza pro praxi. Praha: Maxdorf, 2018: 12‒58, 69‒126.
- [3] Ayzenberg I, Hoepner R, Kleiter I. Fingolimod for multiple sclerosis and emerging indications: appopriate patient selection, safety precautions, and special considerations. Ther Clin Risk Manag 2016; 12: 261‒272.
- [4] Piper W. Innere Medizin. Heidelberg 2007: 406.
- [5] Halúsková S, Pavelek Z, Vališ M. Farmakovigilance nových léčebných přípravků pro roztroušenou sklerózu. Farmakoterapie 2019; 15: 809‒976.
- [6] Nytrová P, Bláhová Dušánková J, Horáková D. Roztroušená skleróza – včasná diagnostika a možnosti léčby. Farmakoter Revue 2019; 4: 108‒120.
- [7] Reich DS, Lucchinetti CF, Calabresi PA. Multiple sclerosis. N Engl J Med 2018; 378: 169‒180.
- [8] Krejsek J, Andrýs C, Krčmová I. Imunologie člověka. Hradec Králové: Garamon, 2016: 326‒341.
- [9] Zadražil J, Horák P, Karásek D, a kol. Moderní farmakoterapie automunitních chorob. Praha: Maxdorf, 2019: 399‒400.
- [10] Krejsek J. Ocrelizumab účinně tlumí poškozující zánět u nemocných s roztroušenou sklerózou mozkomíšní a neovlivňuje významně protektivní imunitu. Neurol praxi 2020; 21: 214‒220.
- [11] Thon V. Imunologický pohled na mechanismus účinku fingolimodu v kontextu současné DMD terapie roztroušené sklerózy. Remedia 2019; 29: 351‒354.
- [12] Hla T, Brinkmann V. Sphingosine 1‑phosphate (S1P): Physiology and the effects of S1P receptor modulation. Neurology 2011; 76: 3‒8.
- [13] Cohen JA, Chun J. Mechanisms of fingolimods efficacy and adverse effects in multiple scleosis. Ann Neurol 2011; 69: 759‒777.
- [14] Kappos L, Radue E‑M, OʼConnor P, et al. A placebo controlled trial of oral fingolimod in relapsing multiple sclerosis. N Engl J Med 2010; 362: 387‒401.