Glatiramer acetát má v současné léčbě roztroušené sklerózy své místo
Prevalence roztroušené sklerózy (RS) v posledních desetiletích stoupá, což může být i důsledkem přesnějších diagnostických metod a exaktně definovaných kritérií. Hlubší poznatky o patofyziologii nemoci umožňují vyvíjet léčebné postupy cílené na patologické děje. Armamentarium léčiv indikovaných k terapii tohoto invalidizujícího onemocnění se významně rozšířilo a orientace v paletě dostupných léčiv je pro předepisující lékaře zásadní.
Prevalence roztroušené sklerózy (RS)
v posledních desetiletích stoupá, což může být
i důsledkem přesnějších diagnostických metod a exaktně
definovaných kritérií. Hlubší poznatky o patofyziologii
nemoci umožňují vyvíjet léčebné postupy cílené
na patologické děje. Armamentarium léčiv indikovaných
k terapii tohoto invalidizujícího onemocnění se významně
rozšířilo a orientace v paletě dostupných léčiv je
pro předepisující lékaře zásadní.
Podstatou roztroušené sklerózy (RS) je demyelinizace, axonální degenerace a glióza. Ložisková zánětlivá aktivita obvykle převládá ve fázi relabující remitující, difuzní zánět a neurodegenerace dominují ve fázi progresivní. Navzdory rozlišování těchto forem se jedná spíše o kvantitativní rozdíl a oba mechanismy jsou v různé míře přítomny po celou dobu RS.
Včasnější diagnostika, přístup k terapiím modifikujícím onemocnění (disease modifying therapy, DMT) a lepší podpůrná péče významně zlepšily průběh RS. S rostoucím počtem nově schválených přípravků představuje ale zároveň výběr optimálního léku pro jednotlivce a léčebná strategie výzvu pro předepisujícího lékaře [1] – zahájení léčby v časné fázi RS, sekvence v dalším průběhu onemocnění. Mezinárodní doporučení poskytují pouze omezený návod. Intenzivně se hledají biomarkery, které by umožnily monitorovat aktivitu nemoci a odpověď na léčbu. Při terapeutickém rozhodování je třeba vzít v potaz charakteristiky nemoci i nemocného.
Existují dva základní přístupy k léčbě RS. Časné použití vysoce účinné DMT s maximálním protizánětlivým efektem ve fázi nemoci, kdy se předpokládá její nejvyšší přínos, ale se zvýšeným rizikem závažných nežádoucích účinků pro pacienta (infekce, kardiální dysfunkce, poškození jater nebo zvýšené riziko rozvoje autoimunitních onemocnění aj.).
Druhý, tradiční přístup s nižšími riziky spočívá v postupné eskalaci terapie se zahájením léčby středně účinným přípravkem s případnou úpravou léčby (switch, eskalace) při nedostatečné odpovědi na léčbu. Dostupná data ukazují, že tento přístup více sleduje aktuální stav nemoci, přechodná zhoršení a má menší vliv na progresi v dlouhodobém horizontu.
Glatiramer v léčbě roztroušené
sklerózy
Glatiramer acetát (GA) představuje imunomodulační lék, který se aplikuje subkutánní injekcí. Je tvořen směsí syntetických polypeptidů, které obsahují L aminokyseliny, kyselinu glutamovou, alanin, lysin a tyrosin. Mechanismus účinku GA není zcela objasněn, nicméně je možné ho definovat jako protizánětlivý a neuroprotektivní s působením na pochody vrozené i adaptivní imunity [1].
Terapie GA představuje zavedenou
středně účinnou DMT. K léčbě RS byl GA schválen v roce
1996 ve Spojených státech amerických a v roce
2001 v Evropě. Navzdory novým přípravkům je GA podávaný
injekčně stále hojně předepisován, pro jeho použití svědčí
bezpečnost podložená miliony pacientoroků expozice. Výhody GA je
možné spatřovat v minimální interakci s komorbiditami
pacienta a medikací. Z těchto důvodů může být
vhodnou léčebnou volbou pro pacienty vyššího věku, nemocné
trpící dalšími onemocněními (např. jaterními, renálními
či onkologickými). Jeho potenciál je možné využít rovněž
v případě plánování rodičovství. Výhody GA, které
mohou hrát roli při volbě léčby, uvádí přehledně tabulka 1 [1].
Populace pacientů, pro něž může
být léčba GA přínosem
Pacienti s komorbiditami
Nemocní s RS mají tendenci mít více komorbidit než běžná populace. Ty mohou být překážkou při výběru léčebné modality. Zvyšují riziko interakcí mezi léčivy i mezi léčivem a vlastním onemocněním. Mezi nejběžnější komorbidity řadíme hyperlipidemii, hypertenzi, diabetes mellitus, onemocnění štítné žlázy a trávicího traktu. Množství komorbidit obvykle s věkem narůstá.
Bylo doloženo, že přítomnost cévních komorbidit je u pacientů s RS spojena s horšími kognitivními schopnostmi a objemem mozku [2]. Diabetes mellitus, hypertenze a chronická obstrukční plicní nemoc zase se zvýšenou progresí disability [3].
U pacientů s RS často vidíme polyfarmacii, vedle léků k ovlivnění průběhu onemocnění užívají často také přípravky k ovlivnění symptomů, jako jsou bolest, spasticita, poruchy spánku, únava, deprese, poruchy sexuálních či urogenitálních funkcí. Počet užívaných léků narůstá s věkem, počtem komorbidit, kognitivním deficitem a s aktivitou nemoci. Navíc tito pacienti bývají jen zřídka zařazováni do klinických studií, čímž se nedostatek dokladů o vhodnosti terapeutických rozhodnutí prohlubuje. Poznatky v této oblasti spoléhají zejména na empirii [1].
Pacienti ohrožení zvýšeným rizikem infekce a reaktivace viru
U pacientů s RS představují infekce hlavní příčinu morbidity a mortality [4,5]. Nemocní jsou v důsledku imunosupresivní léčby náchylnější například k sekundárním infekcím močových cest na podkladě neurogenního močového měchýře. Navíc většina léčiv pro ovlivnění roztroušené sklerózy kromě GA a interferonů určitým způsobem zasahuje do imunitního dozoru organismu. Je třeba rozlišovat mezi imunosupresivní léčbou, která narušuje funkci imunitního systému obecně a zvyšuje riziko výskytu široké škály infekcí, a imunomodulačně působícími léčivy, jež selektivně inhibují specifické oblasti imunitního systému a predisponují tak pacienty k určitému okruhu patogenů. Velmi sledovaná je progresivní multifokální leukoencefalopatie (PML) vznikající na podkladě neurovirulentního poolu JCV (John Cunningham virus), který prochází u imunokompromitovaných jedinců sekvenčním přeskupením genomu [1]. Nejvyšší riziko PML bylo doloženo u natalizumabu, vzácně bylo také hlášeno při podávání okrelizumabu, fingolimodu a dimetylfumarátu.
V rozporu s tím se u onemocnění covid 19, které bylo nyní v centru zájmu, náchylnost k infekci SARS CoV 2 zdá být u nemocných s RS obdobná jako v celkové populaci [6].
Hodnocení rizika infekce se stalo jedním z nejdůležitějších faktorů při volbě terapie nebo při pře
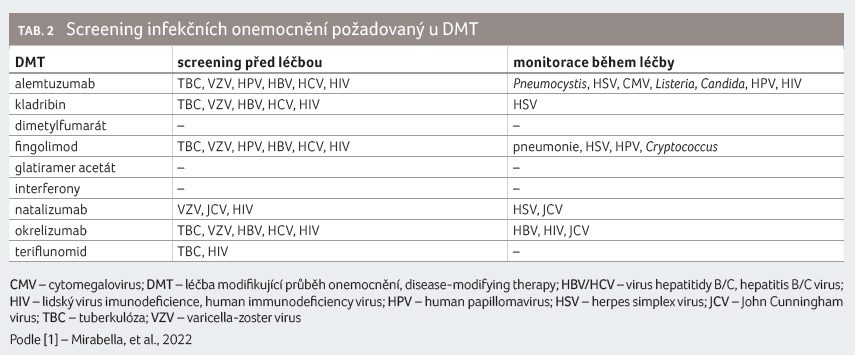
chodu na jinou léčbu (switch). Monitoring infekcí je u některých DMT obvyklou praxí. Z tohoto pohledu je GA vítanou modalitou léčby. Před zahájením terapie není vyžadován ani screening latentní tuberkulózy (tab. 2). Bylo dokumentováno, že riziko reaktivace viru hepatitidy B je u léčených GA a celkové populace srovnatelné [7].
Pacienti s onemocněním jater nebo s polékovým poškozením jater v anamnéze
Riziko poškození jater může limitovat možnosti výběru léčby. Některé DMT jsou asociovány s rizikem jaterního poškození (alemtuzumab, fingolimod, interferony, mitoxantron, teriflunomid) nebo se během léčby může vyskytnout autoimunitní hepatiti
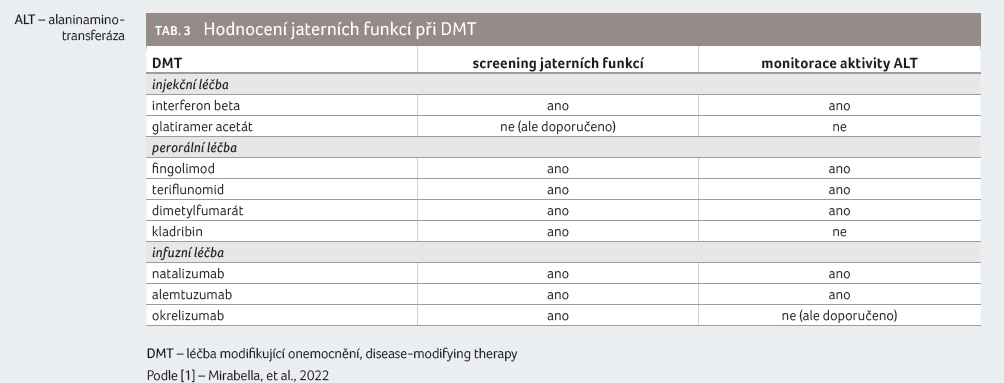
da či dojít k reaktivaci chronické virové infekce [8,9]. U většiny DMT je proto požadováno vyšetření jaterních funkcí, případně monitorace v určitých intervalech během léčby (tab. 3). Glatiramer acetát má z hlediska jaterní bezpečnosti příznivý profil. Screening jaterních funkcí není před zahájením léčby potřeba.
Pacienti vyššího věku
Roztroušená skleróza je onemocněním
postihujícím primárně mladší dospělé, nicméně v důsledku
přístupu k DMT a dobré podpůrné léčbě narůstá
její prevalence ve starší populaci a v současnosti
je nejvyšší ve věkové skupině 50–60 let, ve věku
vyšším, než jsou obvykle pacienti zařazení v klinických
studiích. Asi u 5 % pacientů je navíc dokladován pozdní
nástup RS (s počátkem ve věku ≥ 50 let),
často s motorickou dysfunkcí a relativně špatnou
prognózou [10–12].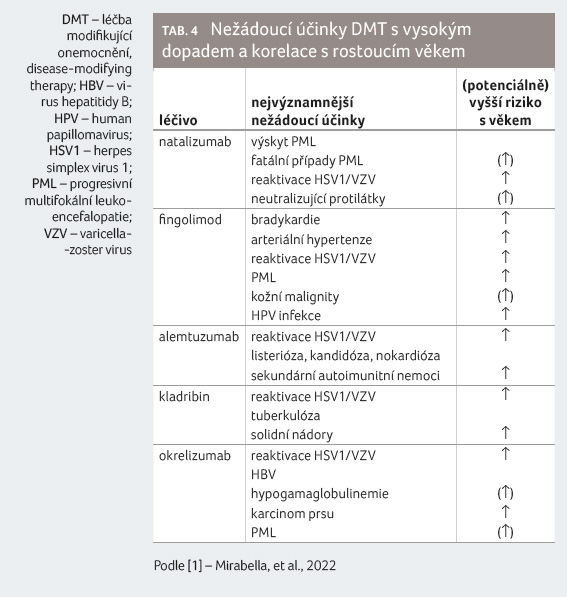
U starších pacientů je dokladována nižší zánětlivá lezionální aktivita [13] a nižší účinnost DMT. Na druhé straně naopak narůstá s věkem počet komorbidit, užívaných léků a imunitní senescence. Při výběru optimálního přípravku či vysoce účinné DMT bude hrát roli vyšší riziko výskytu závažných nežádoucích účinků v této věkové populaci pacientů (tab. 4). U pacienta je třeba vždy zvážit poměr rizik a přínosu dané léčby. Některé práce [14,15] řeší otázku možné deeskalace léčby či její ukončení u starších, stabilních pacientů bez klinické a radiologické aktivity nemoci.
Pacienti plánující rodinu
Roztroušená skleróza se objevuje často v době, kdy nemocní plánují založení rodiny. Těhotenství je obecně spojeno s nižší aktivitou RS [16], a může tak poskytnout určitou přirozenou ochranu při vysazení DMT. Narůstá počet těhotenství zjištěných u pacientek užívajících DMT. Ideálně kromě GA a interferonů byla měla být všechna ostatní léčiva před snahou o početí vysazena. Přerušení DMT během těhotenství může vést k relapsu onemocnění, na druhé straně máme zatím omezená data o bezpečnosti léčby během gravidity, ta jsou navíc zaměřena hlavně na teratogenní účinky v počátku gravidity, méně na pozdní účinky a komplikace spojené s imunologickým efektem léčby.
Vždy je třeba zvážit poměr rizika a přínosu pro pacientku. Obecně je vždy preferováno se expozici přípravku během těhotenství vyhnout, pokud nepřeváží přínos léčby pro matku. Příznivá data svědčící o bezpečnosti GA vedla americkou i evropskou lékovou agenturu k odstranění omezení jeho použití během těhotenství. Pokud je léčba v období plánování těhotenství a během gravidity žádoucí, mluvíme často o tzv. překlenovací léčbě (bridging therapy), která je bezpečná a schopna udržet kontrolu nad nemocí. Změna léčby při plánování početí a těhotenství u klinicky stabilních pacientek je běžnou praxí [17]; překlenovací terapie však musí být zahájena v dostatečném předstihu, aby byla účinná během prvního trimestru, kdy je riziko relapsu nejvyšší.
Další možnou strategií je podávání vysoce účinné terapie s dlouhým trváním účinku (např. okrelizumab, alemtuzumab, kladribin) před těhotenstvím za dodržení vhodných vymývacích period nebo využití skutečnosti, že monoklonální protilátky neprocházejí placentou až do druhého trimestru [18].
Nejnovější údaje z německého registru RS a těhotenství neprokázaly žádné nepříznivé účinky expozice GA během kojení na vývoj dítěte a umožnily opět odstranit omezení užívání GA při kojení [19].
Očkování
Zdá se, že vakcinace nemá vliv na zvýšení aktivity RS. Na druhou stranu řada infekcí, kde působí očkování preventabilně, může vést k exacerbaci nemoci a být spouštěcím faktorem relapsu. Z tohoto důvodu vakcinace může předcházením daným nemocem nepřímo zlepšit kontrolu nemoci. Guidelines American Academy of Neurology (AAN) doporučují postupovat podle místních očkovacích kalendářů, pokud není očkování kontraindikováno (např. u pacientů již léčených imunosupresivní terapií nebo u nemocných v relapsu) [1]. Potřeba a možnosti vakcinace by měly být již v čase diagnózy RS pečlivě zhodnoceny, dříve než pacient začne užívat DMT. U pacientů užívajících anti CD20 terapii je sérokonverze a odpověď na nové antigenní podněty snížená. To se týká i mRNA vakcíny proti covidu 19. Vakcíny jsou obecně méně účinné u starších osob a imunodepleční terapie může dále snížit odpověď na vakcíny v této populaci.
Co se týče GA, na základě hodnocení sérokonverze po očkování proti chřipce v letech 2009 a 2010 bylo u terapie GA v doporučených postupech AAN uváděno možné snížení odpovědi na očkování. Odpověď na vakcínu proti sezonní chřipce v letech 2010/2011 a 2012/2013 byla u nemocných léčených GA srovnatelná s běžnou populací, stejně jako sérokonverze po vakcinaci proti infekci SARS CoV 2 [1].
Vyjma GA jsou živé očkovací látky u pacientů léčených DMT kontraindikovány. Faustino a kol. ve své práci uvádějí, že většina perorálních DMT interferuje s odpovědí na očkování proti viru hepatitidy B, zatímco injekční terapie nikoliv [20].
Závěr
Dlouhodobý průběh RS je v čase diagnózy obtížné předpovídat. Nasazení vysoce účinné DMT může předejít rozvoji disability v dlouhodobém horizontu, zejména u pacientů s vysokou aktivitou nemoci, nicméně v případech, kdy by tato léčba pro pacienta byla zatížena vysokým rizikem, je vhodné zvážit terapii GA. Léčbu GA lze s výhodou využít v pozdějším průběhu onemocnění v reakci na stav pacienta (přítomné komorbidity, vyšší věk, dlouhodobá léčba kortikoidy) a jako překlenovací terapii při plánovaném rodičovství v době početí, v těhotenství a při kojení. Užitečná může být rovněž v rámci vakcinační strategie.
Redakčně zpracovala PharmDr. Kateřina Viktorová
Seznam použité literatury
- [1] Mirabella M, Annovazzi P, Brownlee W, et al. Treatment Challenges in Multiple Sclerosis – A Continued Role for Glatiramer Acetate? Front Neurol 2022; 13: 844873.
- [2] Fitzgerald KC, Damian A, Conway D, Mowry EM. Vascular comorbidity is associated with lower brain volumes and lower neuroperformance in a large multiple sclerosis cohort. Mult Scler 2021; 27: 1914–1923.
- [3] Magyari M, Sorensen PS. Comorbidity in Multiple Sclerosis. Front Neurol 2020; 851; doi: 10.3389/fneur.2020.00851.
- [4] Manouchehrinia A, Tanasescu R, Tench CR, Constantinescu CS. Mortality in multiple sclerosis: meta‑analysis of standardised mortality ratios. J Neurol Neurosurg Psychiatry 2016; 87: 324–331.
- [5] Kingwell E, Zhu F, Evans C, et al. Causes that Contribute to the Excess Mortality Risk in Multiple Sclerosis: A Population‑Based Study. Neuroepidemiology 2020; 54: 131–139.
- [6] Richter D, Faissner S, Bartig D, et al. Multiple sclerosis is not associated with an increased risk for severe COVID‑19: a nationwide retrospective cross‑sectional study from Germany. Neurol Res Pract 2021; 42; doi: 10.1186/s42466‑021‑00143‑y.
- [7] Perrillo RP, Gish R, Falck‑Ytter YT. American Gastroenterological Association Institute technical review on prevention and treatment of hepatitis B virus reactivation during immunosuppressive drug therapy. Gastroenterology 2015; 148: 221–244.
- [8] Antonazzo IC, Poluzzi E, Forcesi E, et al. Liver injury with drugs used for multiple sclerosis: A contemporary analysis of the FDA Adverse Event Reporting System. Mult Scler 2019; 25: 1633–1640.
- [9] Biolato M, Bianco A, Lucchini M, et al. The Disease‑Modifying Therapies of Relapsing‑Remitting Multiple Sclerosis and Liver Injury: a narrative review. CNS Drugs 2021; 35: 861–880.
- [10] Martinelli V, Rodegher M, Moiola L, Comi G. Late onset multiple sclerosis: clinical characteristics, prognostic factors and differential diagnosis. Neurol Sci 2004; 25(Suppl 4): S350–S355.
- [11] Guillemin F, Baumann C, Epstein J, et al. Older Age at Multiple Sclerosis Onset Is an Independent Factor of Poor Prognosis: a population‑based cohort study. Neuroepidemiology 2017; 48: 179–187.
- [12] Naseri A, Nasiri E, Sahraian MA, et al. Clinical Features of Late‑Onset Multiple Sclerosis: a Systematic Review and Meta‑analysis. Mult Scler Relat Disord 2021; 50: 102816.
- [13] Scalfari A, Lederer C, Daumer M, et al. The relationship of age with the clinical phenotype in multiple sclerosis. Mult Scler 2016; 22: 1750–1758.
- [14] Ostolaza A, Corroza J, Ayuso T. Multiple sclerosis and aging: comorbidity and treatment challenges. Mult Scler Relat Disord 2021; 50: 102815.
- [15] Hartung HP, Meuth SG, Miller DM, Comi G. Stopping disease‑modifying therapy in relapsing and progressive multiple sclerosis. Curr Opin Neurol 2021; 34: 598–603.
- [16] Confavreux C, Hutchinson M, Hours MM, et al. Rate of pregnancy‑related relapse in multiple sclerosis. Pregnancy in Multiple Sclerosis Group. N Engl J Med 1998; 339: 285–291.
- [17] Almouzain L, Stevenson F, Chard D, et al. Switching treatments in clinically stable relapsing remitting multiple sclerosis patients planning for pregnancy. Mult Scler J Exp Transl Clin 2021; 7: 20552173211001571.
- [18] DeSesso JM, Williams AL, Ahuja A, et al. The placenta, transfer of immunoglobulins, and safety assessment of biopharmaceuticals in pregnancy. Crit Rev Toxicol 2012; 42: 185–210.
- [19] Copaxone Prescribing Information 2022. Dostupné na: https://www.copaxone.com/globalassets/copaxone/prescribinginformation.pdf
- [20] Faustino P, Coutinho M, Leitão L, et al. Seroconversion rate following HBV vaccination in clinical practice: The role of age and DMT treatment. Mult Scler Relat Disord 2021; 50: 102859.