Kladribin tablety a roztroušená skleróza – nová data o účinnosti a bezpečnosti
Souhrn:
Potužník P. Kladribin tablety a roztroušená skleróza – nová data o účinnosti a bezpečnosti. Remedia 2019; 29: 359–364.
Kladribin je léčivem původně indikovaným k intravenózní léčbě trichocelulární leukemie. Dnes ho můžeme v perorální formě používat i v léčbě relabující‑remitující roztroušené sklerózy. V České republice je indikován v léčbě vysoce aktivní relabující‑remitující roztroušené sklerózy. Ve Spojených státech amerických indikace zahrnuje i aktivní sekundárně progresivní formu nemoci. Kladribin se podává v opakovaných pulzech s přetrvávajícím dlouhodobým účinkem – jedná se o selektivní imunorekonstituční terapii (SIRT). Dlouhodobá účinnost a bezpečnost kladribinu byla prokázána ve studiích CLARITY, CLARITY Extension, ORACLE MS a nadále je sledována v registru PREMIERE. Cílem tohoto článku je seznámit s recentními daty publikovanými na kongrese American Academy of Neurology ve Filadelfii v roce 2019.
Summary:
Potuznik P. Oral cladribine and multiple sclerosis – efficacy and safety data update. Remedia 2019; 29: 359–364.
Originaly, intravenous cladribine was indicated to treat hairy cell leukemia. Nowadays, we can use oral cladribine to treat relapsing‑remmitting multiple sclerosis. In the Czech Republic, it is indicated for a treatment of highly active relapsing‑remmitting multiple sclerosis. In the USA, its indication includes treatment of active secondary progressive disease too. Cladribine is administered in short‑term courses followed by the long term efficacy period. It is a selective immune reconstitution therapy (SIRT). Long‑term efficacy and safety of cladribine was demonstrated in the CLARITY, CLARITY Extension and ORACLE MS studies and has been followed in the long‑term PREMIERE registry. A purpose of this article is to present the latest data published at the 2019 American Academy of Neurology (AAN) Annual Meeting in Philadelphia.
Key words: multiple sclerosis, cladribine, selective immune reconstitution
therapy – SIRT.
Úvod
Roztroušená skleróza je chronické zánětlivé autoimunitní onemocnění centrálního nervového systému. Na zánětu se podílejí autoreaktivní lymfocyty, které aktivují kaskádu imunitních reakcí, jejímž výsledkem je demyelinizační postižení a také axonální ztráta mozkové a míšní tkáně. Kladribin je nukleosidový analog deoxyadenosinu, který přes svou aktivní fosforylovanou formu redukuje počet autoagresivních T a B lymfocytů, jež mají klíčovou úlohu v patogenezi roztroušené sklerózy.
Dávkování
Kladribin se užívá ve formě tablet v celkové dávce 3,5 mg/kg tělesné hmotnosti. Aplikuje se ve dvou pulzech v prvních dvou letech léčby, v jednotlivých letech se podává v prvních pěti dnech prvního a druhého měsíce. Ve třetím a čtvrtém roce se nepodává.
Mechanismus účinku
Kladribin je proléčivo, které se na účinnou formu mění fosforylací. Využitý mechanismus účinku léčiva byl odvozen od pozorování deficitu enzymu adenosindeaminázy u těžkého kombinovaného imunodeficitu. Kladribin je nukleosidový analog deoxyadenosinu, představuje jeho antimetabolit, díky odchylce ve struktuře je rezistentní vůči adenosindeamináze. Intracelulárně se v důsledku odlišnosti v enzymatické výbavě kumuluje preferenčně v B a T buňkách, což vede k jejich apoptóze, aniž dochází k celulární lýze a k následné depleci buněk přirozené imunity. Kladribin tak tlumí buněčnou i humorální složku získané imunity, ale má jen minimální vliv na buňky imunity vrozené – monocyty, neutrofily, NK buňky a trombocyty, které obsahují nízkou koncentraci kináz. Po obnovení původního počtu lymfocytů dochází k trvalým změnám imunitního systému a ke snížení počtu autoreaktivních lymfocytů. Jedná se tedy o nový mechanismus účinku v léčbě roztroušené sklerózy, tzv. selektivní imunorekonstituční terapii (SIRT), která má minimální dopad na přirozenou imunitu a dlouhodobě ovlivňuje autoreaktivní T a B lymfocyty.
Účinnost
Míra deplece imunitních buněk je
závislá na dávce kladribinu. V poslední době se klade
důraz na dosažení remise onemocnění, hodnocené pomocí
tzv. konceptu NEDA (No Evidence of Disease Activity), kdy se posuzuje
klinicky souhrnná nepřítomnost relapsů, absence progrese
disability měřená na Kurtzkeho stupnici postižení (EDSS,
Expanded Disability Status Scale) a chybění nových gadolinium
vychytávajících (Gd+) T1 lézí a aktivních T2 lézí
na zobrazení magnetickou rezonancí (MR). Ve studii
CLARITY ve skupině léčené kladribinem 3,5 mg/kg dosáhlo
po 96 týdnech stavu NEDA 46,8 % pacientů [1]. Nová data
ze studie CLARITY Extension nám potvrzují přetrvávající
účinnost i v následujících letech, kdy stavu NEDA
ve 3.−4. roce dosahovalo nadále 46 % pacientů
léčených kladribinem v dávce 3,5 mg/kg a 48 %
pacientů léčených dávkou 7 mg/kg. Ve 4.−5. roce
byl pozorován trend poklesu v dosažení NEDA u skupiny
léčené dávkou 3,5 mg/kg (35 %) a stabilní nález
u pacientů léčených kladribinem v dávce 7 mg/kg
(48 %) (graf 1) [2].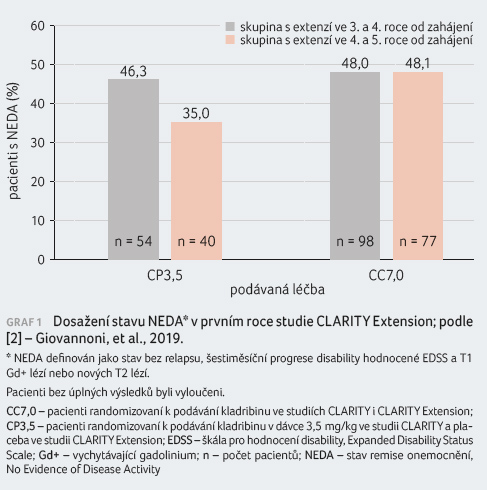
Tyto výsledky nám tedy potvrzují stabilitu NEDA prokázanou již ve studii CLARITY a udržení stejné míry stavu NEDA i po 3−4 letech léčby, nicméně nebyla zkoumána individuální kontinuita NEDA mezi studiemi CLARITY a CLARITY Extension. Dosažení NEDA ve 4.−5. roce u skupiny s dávkou kladribinu 3,5 mg/kg bylo numericky nižší, což bylo dáno především aktivitou na MR (nové T1 Gd+ a T2 léze).
Ve studii ORACLE MS fáze III
byl hodnocen v 96. týdnu efekt kladribinu u pacientů
s klinicky izolovaným syndromem (CIS) na konverzi
do klinicky definitivní roztroušené sklerózy dle
McDonaldových kritérií 2005. Kladribin vykazuje příznivý efekt
na prodloužení času do této konverze (u pacientů
léčených kladribinem v dávce 5,25 mg/kg v podskupinách
s rozmezím poměru rizik [hazard ratio, HR] 0,197−0,587
a v dávce 3,5 mg/kg s rozmezím HR 0,201−0,573
oproti placebu) [3], nicméně v současnosti není perorální
kladribin pro léčbu CIS indikován. Obecně riziko konverze
do klinicky definitivní roztroušené sklerózy stoupá
u mladých pacientů s multifokálním CIS a/nebo s Gd+ T1
lézemi a vyšším počtem T2 lézí (9 a více) dle MR
na začátku onemocnění, a samozřejmě u pacientů
léčených placebem.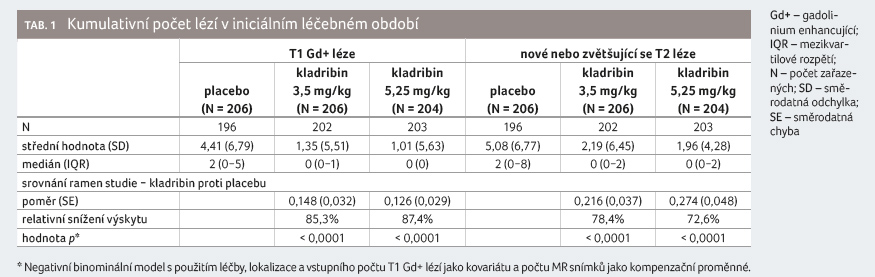
Zajímavá jsou nově publikovaná data o brzkém nástupu účinku kladribinu v této studii, která byla hodnocena pomocí MR výsledků. U pacientů bez konverze do klinicky definitivní roztroušené sklerózy byl průměrný kumulativní počet Gd+ T1 lézí během 96 týdnů sledování 1,35 ve skupině s léčbou kladribinem v dávce 3,5 mg/kg a 1,01 ve skupině s dávkou 5,25 mg/kg, oboje signifikantně nižší oproti placebu (4,41), což představuje 85,3%, respektive 87,4% relativní redukci oproti placebu (p < 0,0001), tabulka 1. Průměrný počet Gd+ T1 lézí ve 13. týdnu byl 0,37 u pacientů léčených kladribinem v dávce 3,5 mg/kg a 0,86 u pacientů s dávkou kladribinu 5,25 mg/kg oproti placebu (1,0) a tento efekt přetrvával během celých 96 týdnů sledování (graf 2A). Průměrný kumulativní počet nových nebo zvětšujících se T2 lézí byl 2,19 v rameni s léčbou kladribinem v dávce 3,5 mg/kg a 1,96 při podávání kladribinu v dávce 5,25 mg/kg; tato signifikantně nižší hodnota oproti placebu (5,08) reprezentuje v
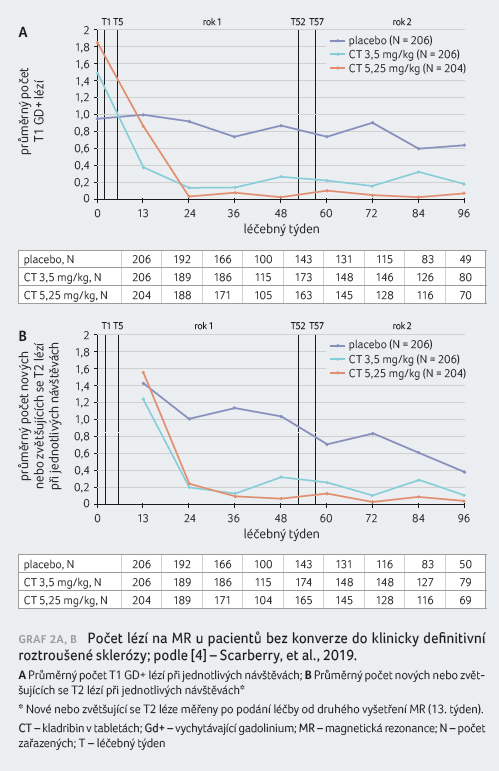
e srovnání s ním 78,4% a 72,6% relativní redukci (p < 0,0001), tabulka 1. Graf 2B znázorňuje pokles počtu nových nebo zvětšujících se T2 lézí trvající od 24. týdne léčby. Průměrná redukce objemu Gd+ T1 lézíod začátku léčby do 96. týdne byla vyšší u pacientů léčených kladribinem (3,5 mg/kg a 5,25 mg/kg) oproti placebu (p < 0,0001) [4].
Tato MR data u pacientů s CIS a s vysokým rizikem konverze do klinicky definitivní roztroušené sklerózy nám tak ukazují, že kladribin má rychlý nástup účinku s redukcí aktivních Gd+ T1 a T2 lézí, který je pozorovatelný již během prvních 13 týdnů léčby, což koresponduje s pozorovaným prodloužením času do stanovení klinicky definitivní roztroušené sklerózy.
Bezpečnost
Data o bezpečnosti
a snášenlivosti kladribinu byla sbírána ve studiích
CLARITY, CLARITY Extension, ORACLE MS a v dlouhodobém
registru PREMIERE. Integrovaná analýza sdílených společných dat
nás komplexně informuje o bezpečnostním profilu terapie.
Tato data představují do doby, než budou nashromážděna
reálná komplexní data z celosvětových bezpečnostních
databází schváleného léku, nejlepší zdroj informací. Nicméně
jedná se o analýzu, která má své limity. Bylo srovnáváno
923 pacientů léčených kladribinem v dávce 3,5 mg/kg a 641
pacientů ve skupině placeba a byla přepočítána
incidence nežádoucích účinků na 100 pacientoroků (tab. 2). Hlášený výskyt nežádoucích účinků léčby
byl lehce vyšší u pacientů léčených kladribinem než
ve skupině s placebem [5].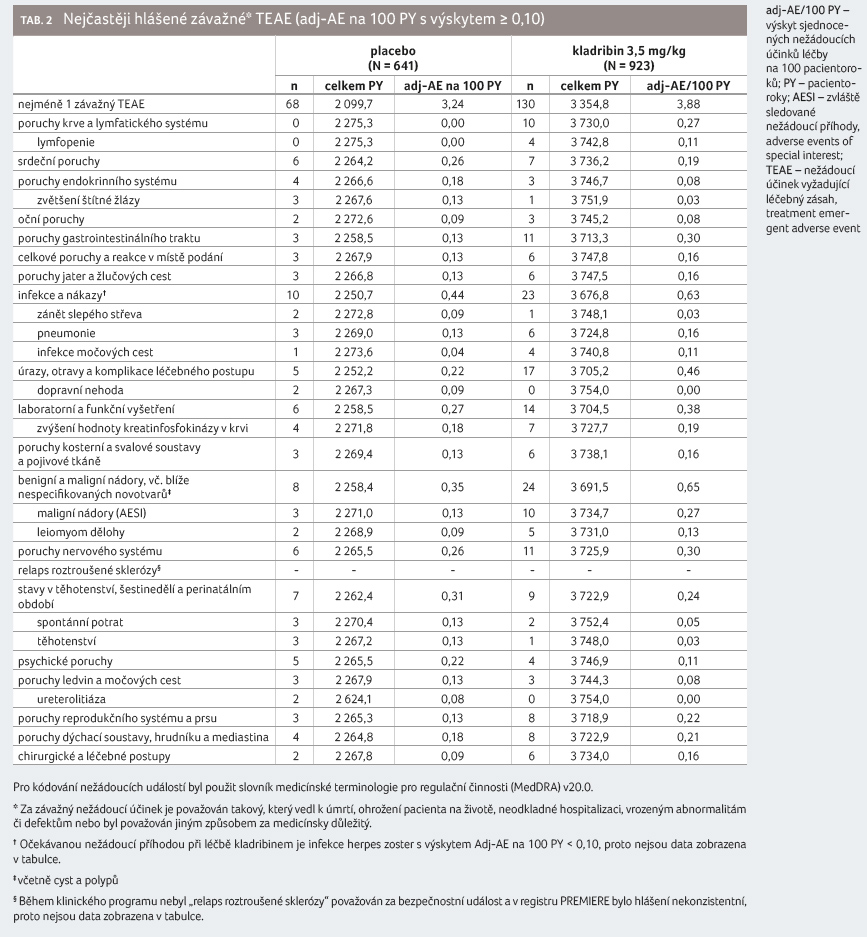
Vzhledem k mechanismu účinku byla očekávána a potvrzena jako nežádoucí účinek lymfopenie. Ve studiích CLARITY/CLARITY Extension u pacientů s vysokou aktivitou onemocnění na jeho začátku nebo u pacientů bez této počáteční vysoké aktivity nemoci nebyl prokázán relevantní rozdíl incidence lymfopenie, včetně absolutního počtu lymfocytů. A také nebyl zjištěn relevantní rozdíl lymfopenie u pacientů s vysokou aktivitou nemoci a s předchozí jinou terapií chorobu modifikujícími léky, což ukazuje, že předchozí terapie nezvyšuje riziko závažnosti lymfopenie, nicméně tato skupina pacientů byla malá. Riziko lymfopenie je závislé na dávce kladribinu, je vyšší u pacientů léčených dávkou kladribinu 7 mg/kg než u pacientů s dávkou 3,5 mg/kg [6]. Ve studii CLARITY nepřesáhla většina pacientů (74,4 %) lymfopenii 2. stupně (nedošlo k poklesu pod 500 buněk/mm3), lymfopenie 4. stupně (< 200 buněk/mm3) při léčbě dávkou kladribinu 3,5 mg/kg byla zaznamenána pouze u 0,7 % pacientů a ve studii CLARITY Extension se již nevyskytla [7].
Celkově nebylo podávání kladribinu spojeno s významnějším podílem závažných infekcí, respektive bylo zaznamenáno zvýšení výskytu infekcí pouze u herpes zoster, a to o 0,05/100 pacientoroků, ale žádný případ systémové nebo diseminované infekce tímto virem [5]. U nemocných s lymfopenií 4. stupně je doporučeno preventivní podávání acykloviru [8]. Dosud nebyl hlášen žádný případ progresivní multifokální leukoencefalopatie v souvislosti s podáváním perorálního kladribinu.
Pokud jde o výskyt novotvarů, při léčbě kladribinem byla incidence maligních tumorů 0,27/100 pacientoroků a při podávání placeba 0,13/100 pacientoroků, což by mohlo ukazovat na zvýšené riziko malignit u nemocných léčených kladribinem. Proto byl počet malignit srovnáván s referenční populací z registru GLOBOCAN 2012 (Pozn.: bez nemelanomových nádorů kůže). Standardní incidence v tomto registru byla 0,91 (při podávání placeba 0,44) [9], což ukazuje, že léčba kladribinem není ve srovnání s referenční populací provázena vyšším výskytem malignit.
Tyto výsledky nám tedy potvrzují dobrý bezpečnostní profil kladribinu, který je konzistentní s předešlými analýzami.
Závěr
Působením na patogenní populaci lymfocytů omezuje perorální kladribin klinické projevy i aktivitu na MR u pacientů s roztroušenou sklerózou. Se svým ojedinělým mechanismem účinku, jako tzv. selektivní imunorekonstituční terapie (SIRT), a způsobem podávání v krátkých pulzech ve formě tablet si kladribin našel své místo v léčbě vysoce aktivní relabující remitující roztroušené sklerózy. Poslední analýzy potvrzují jeho vysokou účinnost, bezpečnost, rychlý nástup účinku a dlouhodobý efekt. Nicméně i nadále bude nutné sbírat klinické zkušenosti a data, a to především o možné budoucí reaktivaci onemocnění, možnostech opakovaného podání pulzů kladribinu a o dlouhodobé bezpečnosti tohoto přípravku.
Seznam použité literatury
- [1] Giovannoni G, Cook S, Rammohan K, et al. CLARITY study group. Sustained disease‑activity‑free status in patients with relapsing‑remitting multiple sclerosis treated with cladribine tablets in the CLARITY study: a post‑hoc and subgroup analysis. Lancet Neurol 2011; 10: 329‒337.
- [2] Giovannoni G, Keller B, Jack D. Durability of NEDA Status in Patients with Relapsing Multiple Sclerosis Receiving Cladribine Tablets: CLARITY Extension. AAN 2019: Abstract P2‑100.
- [3] Bowen J, Damian D, Hyvert Y, et al. The Effect of Cladribine Tablets on Delaying the Time to Conversion to CDMSor McDonald MS is Consistent across Subgroups in the ORACLE‑MS Study. AAN 2019: Abstract P2‑101.
- [4] Scarberry S, Damian D, Hyvert Y, et al. Cladribine Tablets was Associated with Rapid Onset of Improvements in MRI Outcomes in the ORACLE‑MS Trial. AAN 2019: Abstract P2‑61.
- [5] Cook S, Giovannoni G, Leist TP, et al. Updated Safety Analysis of Cladribine Tablets in the Treatment of Patients with Multiple Sclerosis. AAN 2019: Abstract P2‑046.
- [6] Cook S, Giovannoni G, Vermersch P, et al. Lymphopenia Rates in CLARITY/CLARITY Extension are Consistent in Patients with or without High Disease Activity at Baseline. AAN 2019: Abstract P2‑062.
- [7] Cook S, Vermersch P, Comi G, et al. Safety and tolerability of cladribine tablets in multiple sclerosis: the CLARITY (CLAdRibine Tablets treating multiple sclerosis orallY) study. Mult Scler J 2011; 17: 578–593.
- [8] Mavenclad (kladribin). Souhrn údajů o přípravku. Státní ústav pro kontrolu léčiv. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_Product_Information/human/004230/WC500234561.pdf
- [9] World Health Organization International Agency for Research on Cancer (IARC). GLOBOCAN 2012: estimated cancer incidence, mortality and prevalence worldwide in 2012. Dostupné na: https://globocan.iarc.fr/default.aspx