Léčba mepolizumabem u pacientky s těžkým eozinofilním astmatem
Souhrn:
Voláková E, Kociánová J. Léčba mepolizumabem u pacientky s těžkým eozinofilním astmatem. Remedia 2021; 31: 423–426.
Asthma bronchiale je definováno jako chronické zánětlivé onemocnění dolních cest dýchacích spojené s jejich hyperreaktivitou a variabilní obstrukcí, které se klinicky projevuje stavy záchvatovité dušnosti, pískotů a kašle. Z imunopatologického hlediska rozlišujeme u pacientů s bronchiálním astmatem dvě základní cesty rozvoje zánětu, tzv. T2‑high a T2‑low typ zánětu. Biologickou léčbou můžeme v současnosti regulovat pouze T2‑high typ zánětu. Cílové molekuly této terapie jsou IgE a interleukiny 4, 5 a 13. Terapie má dobrý bezpečnostní profil, vykazuje vysokou účinnost a stává se celosvětově zlatým standardem léčby těžkého nekontrolovaného astmatu s dominantním T2‑high typem zánětu. Léčba je v České republice centralizována a její dostupnost pro širší skupinu astmatiků je závislá na úzké spolupráci alergologů či pneumologů z periferních ambulancí s lékaři Národního centra pro těžké astma (NCTA).
Summary:
Volakova E, Kocianova J. Treatment with mepolizumab in a patient with severe eosinophilic asthma. Remedia 2021; 31: 423–426.
Bronchial asthma is defined as a chronic inflammatory disease of the lower respiratory tract associated with their hyperreactivity and variable obstruction, clinically significant states of paroxysmal shortness of breath, wheezing, and cough. From the immunopathological perspective, we differentiate two basic ways of progressive inflammation in patients with bronchial asthma, so‑called T2‑high and T2‑low. Only the T2‑high inflammation type can be currently regulated with biologic treatment. The target molecules of this therapy are IgE and interleukin 4, 5, and 13. The treatment has a good safety profile, demonstrates high efficacy, and is becoming the worldwide gold standard of severe uncontrollable asthma. The treatment in the Czech Republic is centralized. Its availability to a broader group of patients with asthma depends on the close cooperation of allergologists or pulmonologists from peripheral outpatient departments with doctors from the National Centre for Severe Asthma.
Key words: bronchial asthma, T2‑high inflammation type, biologic treatment, mepolizumab
Úvod
Asthma bronchiale je definováno jako chronické zánětlivé onemocnění dolních cest dýchacích, které je spojeno s jejich hyperreaktivitou a variabilní obstrukcí a klinicky se projevuje stavy záchvatovité dušnosti, pískotů a kašle. Z imunopatologického hlediska rozlišujeme dvě základní cesty rozvoje zánětu, tzv. T2 high a T2 low typ zánětu. Biologickou léčbou pomocí rekombinantních monoklonálních protilátek můžeme v současnosti regulovat pouze T2 high typ zánětu. Cílové molekuly této terapie představují interleukiny (IL) 5, IL 4 a IL 13, které jsou základními mediátory T2 high zánětu, a IgE (imunoglobulin E) jako produkt této zánětlivé reakce. Jeden ze základních terčů cílené biologické léčby těžkého eozinofilního astmatu – IL 5 – hraje klíčovou roli v migraci, proliferaci, diferenciaci a aktivaci eozinofilů. Podle poznatků poslední doby se na T2 high typu zánětu podílejí kromě pomocných Th2 lymfocytů aktivovaných alergeny také vrozené lymfoidní buňky typu 2 (innate lymphoid cells 2, ILC2). Buňky ILC2 produkují více IL 5 a IL 13 než Th2 lymfocyty a T2 zánět zprostředkovaný ILC2 je dominantní u eozinofilního nealergického fenotypu astmatu, který vzniká především v dospělém věku a bývá často spojen s nosní polypózou a intolerancí nesteroidních antiflogistik, tzv. aspirinovou senzitivitou [1]. Monoklonální protilátky navázáním na IgE či IL 5 znemožní jejich vazbu na receptory na povrchu efektorových buněk (pro IgE mastocyty, pro IL 5 eozinofily) a blokují tím jejich biologický účinek na tyto buňky. Jiné typy monoklonálních protilátek blokují účinky interleukinů přímo vazbou na receptory na povrchu efektorových buněk. Obě cesty narušují zánětlivé imunitní kaskády.
Aktualizace Globální iniciativy pro astma (GINA) 2021 pro obtížně léčitelné a těžké astma doporučuje při výběru cílené terapie astmatu přihlížet k fenotypu astmatu a markerům T2 zánětu, mezi něž patří hodnota celkového IgE v periferní krvi, počet eozinofilů v periferní krvi a hodnota frakce exhalovaného oxidu dusnatého ve vydechovaném vzduchu (FeNO). Dalším z faktorů, které doporučuje při výběru vhodného biologika zohlednit, jsou národní kritéria pro úhradu léčby a komorbidity úzce svázané s T2 high typem zánětu, mezi něž patří zejména atopická dermatitida a chronická rinosinusitida s nosní polypózou [2].
V České republice je biologická léčba cílená na IL 5 hrazena dospělým pacientům s diagnózou těžkého eozinofilního astmatu, kteří dodržují zákaz kouření, prodělali a mají řádně dokumentované v posledních 12 měsících před zahájením této terapie nejméně čtyři těžké exacerbace astmatu navzdory vysokým denním dávkám inhalačních kortikosteroidů (IKS) a přidané udržovací léčbě (dlouhodobě působící β2 mimetikum [long acting beta agonist, LABA], dlouhodobě působící anticholinergikum [long acting antimuscarinic, LAMA], antileukotrien, teofylin), případně užívají perorální kortikosteroid (OKS) v dávce ekvivalentní nejméně 5 mg prednisonu denně po dobu alespoň šesti měsíců před zahájením léčby. V rámci průkazu eozinofilního typu zánětu je požadována dokumentace periferní eozinofilie v průběhu 12 měsíců před zahájením léčby v hodnotě nejméně 300 eozinofilů/µl periferní krve pro mepolizumab a benralizumab a nejméně 400 eozinofilů/µl periferní krve pro reslizumab. U pacientů užívajících dlouhodobě OKS je nutný průkaz výše uvedené eozinofilie v periferní krvi v průběhu 12 měsíců před zahájením biologické léčby [3]. Těžká exacerbace astmatu je definována zhoršením astmatu, které si vyžádá podání systémové kortikoterapie po dobu nejméně tří po sobě jdoucích dnů. Biologická léčba těžkého astmatu je v ČR centralizována a její dostupnost pro širší skupinu astmatiků závisí na úzké spolupráci alergologů či pneumologů z periferních ambulancí s lékaři Národního centra pro těžké astma (NCTA) při fakultních a krajských nemocnicích, což demonstruje i předkládaná kazuistika.
Kazuistika
Pacientka narozená v roce 1942 byla poprvé vyšetřena na plicní ambulanci v roce 2001, tedy ve věku 59 let. Vyšetření pneumologem bylo doporučeno pro výraznější plicní kresbu na prostém snímku hrudníku v rámci vyšetření jiným lékařem a tento nález nevyžadoval další sledování. Při prvním vyšetření byly hodnoty ventilace v rozmezí normy, i když křivka průtok objem měla lehce obstrukční tvar a hodnota FEV1 (objem vzduchu vydechnutý za první sekundu usilovného výdechu) se blížila spíš k dolní hranici normy; převažovala obstrukce v periferních dýchacích cestách. Bronchodilatační test ipratropiem byl negativní. Z dokumentace vyplývá, že byl proveden také odběr periferní krve na zhodnocení diferenciálního rozpočtu, jeho výsledek však není znám. Pacientka se jinak léčila pouze s arteriální hypertenzí a chronickou venózní insuficienci při varixech dolních končetin, v minulosti absolvovala dva menší zákroky – apendektomii a cholecystektomii. Až do roku 2009 pravidelně kouřila průměrně 10 cigaret denně, celkem 30 let. Pracovala jako kadeřnice. Její dcera byla alergička a sama uváděla alergii na Biseptol.
Pacientka, která odešla z ordinace při prvním vyšetření s diagnózou chronické bronchitidy, se k druhému vyšetření pneumologem dostavila až v roce 2010 (9 let po prvním vyšetření). Důvodem návštěvy byly již respirační obtíže charakteru pískotů a dušnosti, které se často objevovaly i v noci, měla celoroční rýmu. Potíže pravidelně několikrát ročně zhoršovaly respirační infekty. Nález byl uzavřen jako bronchiální astma a alergická rinitida a byla zahájena terapie fixním přípravkem IKS/LABA (inhalační kortikosteroid, IKS ve střední dávce) a nazálním kortikoidem.
V průběhu dalších tří let stav pacientky nebyl uspokojivý. Dávka IKS byla postupně navyšována na maximální denní dávku, několikrát ročně pacientka užívala antibiotika a až čtyřikrát ročně jí byly nárazově podávány OKS v dávce 20 mg prednisonu denně. Terapie byla dále rozšířena o LAMA, antileukotrien, antihistaminikum. Na HRCT (výpočetní tomografie s vysokým prostorovým rozlišením) plic byly popsány nevýrazné bronchiektazie a diskrétní emfyzémové změny. Hodnota celkového IgE byla v normě, hodnota eozinofilů v periferní krvi byla také v normě, hodnota FeNO byla lehce zvýšená (40 ppb). Pro neuspokojivý stav v dalších letech vyzkoušela pacientka rovněž roflumilast
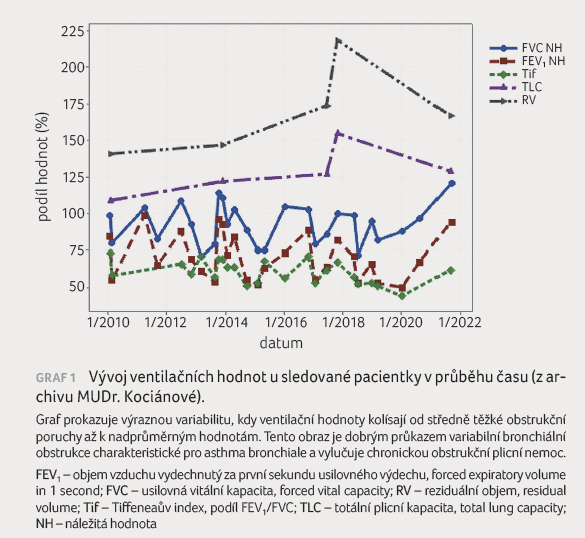
(zvažována možnost překryvného syndromu s chronickou obstrukční plicní nemocí [CHOPN] u bývalé kuřačky), azitromycin dlouhodobě, opakovaně byla podávána další imunomodulancia, teofyliny, několikrát absolvovala dechovou rehabilitaci - vše bez efektu na zmírnění klinických obtíží a četnost exacerbací astmatu. V roce 2018 pacientka prodělala čtyři těžké exacerbace astmatu stejně jako v roce 2010. Měla nově prokázanou refluxní nemoc jícnu, nově se v terapii objevuje také antidepresivum. Ventilační hodnoty po celou dobu vykazovaly značnou nestabilitu, z normálních hodnot opakovaně při exacerbaci poklesly na úroveň středně těžké obstrukční poruchy (graf 1). V letech 2013 a 2018 byla opakovaně zachycena významná periferní eozinofilie (800 a 870 eozinofilů/µl periferní krve).
Poprvé byla do NCTA (mimo naše
pracoviště) referována v roce 2019 a biologická léčba
byla zamítnuta z důvodu komorbidit – CHOPN,
bronchiektazií a emfyzému. Pro trvající neuspokojivý stav
bylo NCTA kontaktováno opakovaně počátkem roku 2020. Při prvním
vyšetření v poradně pro těžké astma na našem
pracovišti byla pacientka asi týden po ukončené terapii
systémovými kortikosteroidy (SKS) pro opakovanou exacerbaci a její
stav působil na první dojem vcelku stabilně. Hodnota FEV1
byla na horní hranici náležitých hodnot (120 % NH),
klinické obtíže minimální. Komorbidity (zejména refluxní nemoc
jícnu) byly zaléčeny adekvátně, terapie astmatu suficientní
(IKS ve vysoké dávce v kombinaci s LABA, LAMA,
teofylinem a antileukotrienem). Hodnota eozinofilů v periferní
krvi byla nízká (60/μl). Pacientka neměla žádné alergické
projevy a hodnota celkového IgE byla zvýšená jen lehce.
Nález na prostém snímku hrudníku byl věku přiměřený,
pouze bylo vysloveno podezření na ložiskové zastínění
promítající se do srdečního stínu (obr. 1), pro
které bylo provedeno kontrolní HRCT plic, jež ložiskové plicní
postižení vyloučilo. Na HRCT plic nebyly prokázány ani
bronchiektazie, jen několik drobných projasnění charakteru
drobných emfyzémových bul a nevýrazná axiální hiátová
hernie. Nález se ve srovnání s nálezem z roku 2013
nijak významně nezměnil. Cílená anti IL 5 terapie
nemohla být v té době započata pro nedoloženou eozinofilii
v posledních 12 měsících, jak to vyžadují úhradová
kritéria pro zahájení léčby. Poslední dokumentovaná
eozinofilie byla z roku 2018.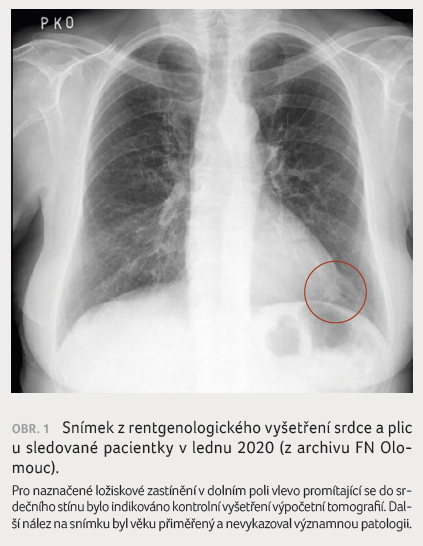
Další kontrola proběhla až na podzim 2020. Důvodem delší přestávky byla první vlna koronavirové pandemie počátkem roku 2020. V rámci nestabilního stavu pacientky s dalšími exacerbacemi onemocnění byla znovu zachycena významná eozinofilie (660/µl periferní krve) v srpnu 2020. V doložených zprávách z mezidobí byla opakovaně zaznamenána také středně těžká obstrukční ventilační porucha. Periferní eozinofilie starší 12 měsíců byla jedinou překážkou nezahájení terapie při prvním vyšetření. V říjnu 2020 byla tedy splněna všechna úhradová kritéria a nic nebránilo tomu, abychom cílenou anti IL 5 terapii zahájili. Z monoklonálních protilátek dostupných k léčbě byl zvolen mepolizumab a při druhé návštěvě byla aplikována jeho první dávka subkutánně.
Již v průběhu prvních čtyř týdnů pacientka zaznamenala významné zmírnění klinických obtíží. V testu kontroly astmatu bylo po čtyřech týdnech léčby dosaženo dvojnásobného počtu bodů (vzestup z 9 na 18 bodů), po třech měsících léčby to bylo 24 bodů. Od zahájení terapie mepolizumabem neprodělala pacientka žádnou exacerbaci astmatu a nepotřebovala SKS. Hodnota eozinofilů v periferní krvi je od zahájení léčby nízká, ventilační hodnoty jsou stabilní a ani jednou nepoklesly pod hranici 80 % náležitých hodnot. Pacientka od čtvrtého měsíce léčby aplikuje mepolizumab subkutánně doma sama pomocí předplněného pera a na kontrolu do NCTA dojíždí jednou za 3-4 měsíce. I ve svém pokročilém věku vede aktivní život.
Diskuse
Mepolizumab je humanizovaná monoklonální IgG1 protilátka vyráběná rekombinantní DNA technologií. Vazbou na IL 5 snižuje frakci IL 5 dostupnou pro eozinofil, a blokuje tak jeho účinek na dozrávání a diferenciaci eozinofilu. Jako přídatná terapie těžkého eozinofilního astmatu je indikován k léčbě pacientů, u nichž nelze dosáhnout dostatečné kontroly astmatu ani maximální konvenční terapií, tj. na 4. stupni pětistupňového schématu léčby podle GINA [4].
Nejrozsáhlejší studií hodnotící účinnost a bezpečnost mepolizumabu v reálné klinické praxi je prospektivní observační multicentrická studie REALITI A. Na kompletní výsledky 24měsíčního sledování celého souboru pacientů si ještě budeme muset počkat. V roce 2020 byly prezentovány předběžné výsledky 12měsíčního sledování u 368 ze zařazených pacientů [5], na letošním virtuálním kongresu Evropské respirační společnosti v září to byly ve formě posterového sdělení první výsledky 12měsíčního sledování v kompletním souboru 822 pacientů [6]. Do studie REALITI A byli na rozdíl od randomizovaných klinických studií (randomized clinical trial, RCT) MENSA, MUSCA, SIRIUS [7-9] zařazeni také pacienti s jinými plicními komorbiditami (15 % osob) včetně CHOPN (10 % osob), 3 % pacientů tvořili aktivní kuřáci. V celém souboru pacientů byl počet exacerbací v posledních 12 měsících před zařazením do studie vyšší než u pacientů z RCT (průměrně 4,4 těžké exacerbace versus 3,6 a 2,8 exacerbace ve studiích MUSCA a MENSA) [6-8]. Stejně tak byla u pacientů ze studie REALITI A zachycena vyšší periferní eozinofilie (průměrně 353 eozinofilů/µl periferní krve versus 290 a 320 eozinofilů/µl periferní krve ve studiích MENSA a MUSCA) [6-8]. Ve 12měsíčním prospektivním sledování došlo v kompletním souboru pacientů k poklesu počtu klinicky významných exacerbací o 71 % [6]. Tento pokles byl ještě výraznější než ve studiích MENSA (53 %) a MUSCA (58 %) [7,8]. Perorální kortikosteroidy se podařilo vysadit u 43 % pacientů, hodnota eozinofilů v periferní krvi byla redukována o 83 % (na průměrných 60 eozinofilů/µl periferní krve) [6]. Výskyt nežádoucích příhod byl nízký. Jakákoliv nežádoucí příhoda se vyskytla celkem u 10 % pacientů, přičemž bezpečnost byla hodnocena celkem u 823 pacientů, do souboru byl zahrnut také jeden pacient léčený mepolizumabem ve vyšší dávce z důvodu eozinofilní granulomatózy s polyangiitidou. Nejčastěji udávanou nežádoucí příhodou byla bolest hlavy (u 4 % pacientů). Výskyt nežádoucích příhod byl srovnatelně nízký s výskytem nežádoucích příhod v rámci RCT [6].
Závěr
Cílená biologická terapie těžkého astmatu představuje dostupnou, účinnou a bezpečnou metodu léčby a stále hodně pacientů s těžkým astmatem na ni čeká. Její dostupnost pro širokou skupinu pacientů závisí na dobré informovanosti o možnostech této terapie a na dobré spolupráci ambulantních odborníků s lékaři NCTA. Standardní součástí péče o těžkého astmatika by se mělo stát hodnocení T2 typu zánětu, a to opakovaně. Je potřeba pamatovat na to, že léčba kortikosteroidy významně ovlivňuje (zhoršuje) možnosti průkazu eozinofilního zánětu a že komorbidity mohou ovlivnit kontrolu astmatu a být vodítkem při výběru vhodné biologické léčby. Rovněž je nutné zdůraznit, že věk ani komorbidity nejsou kontraindikací k zahájení biologické léčby astmatu. Z léčby mají prospěch také nemocní ve vyšším věku a účinnost léčby u komorbidních pacientů může být i výraznější než u pacientů bez komorbidit.
Seznam použité literatury
- [1] Brusselle GG, Maes T, Bracke KR. Eosinophils in the spotlight: Eosinophilic airway inflammation in nonallergic asthma. Nat Med 2013; 19: 977−979.
- [2] Pocket Guide for Asthma Prevention and Management 2021. Dostupné na: https://ginasthma.org/pocket‑guide‑for‑asthma‑management‑and‑prevention/
- [3] Databáze léků, Státní ústav pro kontrolu léčiv. Dostupné na: https://www.sukl.cz/modules/medication/search.php
- [4] 2021 GINA Main Report. Dostupné na: https://ginasthma.org/gina‑reports/
- [5] Harrison T, Canonica GW, Chupp G, et al. Real‑world mepolizumab in the prospective severe asthma REALITI‑A study: initial analysis. Eur Respir J 2020; 56: 2000151.
- [6] Pilette C, et al. ERS 2021: Poster#3539. Data připravována k publikaci.
- [7] Ortega HG, Liu MC, Pavord ID, et al.; MENSA Investigators. Mepolizumab treatment in patients with severe eosinophilic asthma. N Engl J Med 2014; 371: 1198−1207.
- [8] Chupp GL, Bradford ES, Albers FC, et al. Efficacy of mepolizumab add‑on therapy on health‑related quality of life and markers of asthma control in severe eosinophilic asthma (MUSCA): a randomised, double‑blind, placebo‑controlled, parallel‑group, multicentre, phase 3b trial. Lancet Respir Med 2017; 5: 390−400.
- [9] Bel EH, Wenzel SE, Thompson PJ, et al.; SIRIUS Investigators. Oral glucocorticoid‑sparing effect of mepolizumab in eosinophilic asthma. N Engl J Med 2014; 371: 1189−1197.