Mnohočetné pozitivní účinky erdosteinu
Erdostein je lék schválený k terapii akutního a chronického onemocnění horních a dolních dýchacích cest, který byl původně vyvinut jako mukolytický agens. Patří do skupiny thiolů, jež jsou mimo jiné významné svými antioxidačními a protizánětlivými vlastnostmi a je u nich prokázána antibakteriální aktivita vůči řadě bakteriálních kmenů. RESTORE byla jedinou studií, která hodnotila efekt thiolů v léčbě chronické obstrukční plicní nemoci (CHOPN) a prokázala, že erdostein signifikantně snižuje riziko vzniku akutních exacerbací a také riziko hospitalizací u pacientů s CHOPN. Preventivní působení erdosteinu na akutní exacerbace nebylo ovlivněno přidáním inhalačních kortikosteroidů (IKS) či počtem eozinofilů v krvi. Pozitivními účinky erdosteinu v léčbě plicních onemocnění se zabývala nedávno publikovaná práce Cazzola M, Page C, Rogliani P, et al., Multifaceted Beneficial Effects of Erdosteine: More than a Mucolytic Agent (Drugs 2020; 80: 1‒11).
Erdostein je proléčivo, které je na hepatální úrovni metabolizováno na minimálně tři aktivní metabolity, z nichž nejvíce zastoupen je N thiodiglykolyl homocystein (Met 1) s mukolytickými vlastnostmi. Experimentální studie doložily, že užívání erdosteinu potlačuje poškození plicní tkáně způsobené oxidativním stresem; Met 1 rovněž reguluje reaktivní formy kyslíku (ROS).
Klinické studie
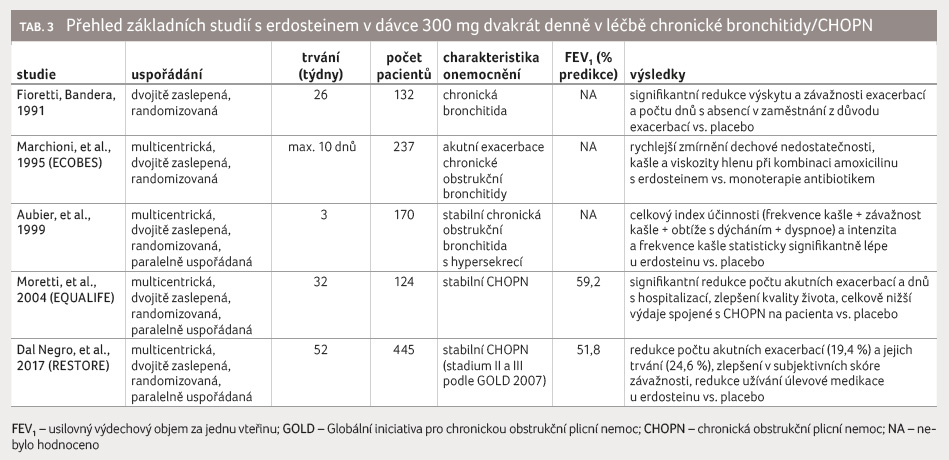
Po průkazu mukolytických vlastností erdosteinu (review několika klinických studií z roku 1996) se pozornost soustředila na jeho antioxidační a protizánětlivou aktivitu [1]. Zpráva Americké společnosti hrudních lékařů (ACCP) z roku 1998 na základě konsenzu uvedla erdostein jako adekvátně otestovaný lék pro mukociliární clearance u pacientů trpících bronchitidou [2]. Následně byl erdostein v roce 2006 uveden v doporučeních ACCP jako lék pro krátkodobé zvýšení clearance kašle u nemocných s bronchitidou [3]. Už v roce 1996 však byla rozpoznána na základě mnohonásobné farmakologické aktivity erdosteinu jeho vhodnost pro léčbu stabilní CHOPN a schopnost redukovat riziko vzniku akutních exacerbací.
Ve studii ECOBES bylo 237 pacientů s infekční exacerbací chronické bronchitidy randomizováno k podávání erdosteinu (v dávce 300 mg dvakrát denně) v kombinaci s amoxicilinem (1 500 mg/den) nebo placeba v kombinaci s amoxicilinem po dobu maximálně 10 dnů. Klinické symptomy jako dechová nedostatečnost, kašel nebo viskozita hlenu se rychleji zmírnily u skupiny pacientů užívajících kombinaci amoxicilinu a erdosteinu [4].
Studie EQUALIFE hodnotila účinnost podávání perorálního erdosteinu v dávce 300 mg dvakrát denně během osmi měsíců u 155 pacientů s mírně závažnou CHOPN během zimní sezony. Ve srovnání s placebem erdostein signifikantně redukoval počet akutních exacerbací a dnů s hospitalizací a zlepšil kvalitu života [5].
Bylo rovněž zdokumentováno, že
režim perorálního erdosteinu v dávce 225 mg dvakrát denně
přidaný k běžné hrudní fyzioterapii znamená určitý
fyziologický a klinický přínos v porovnání se
samotnou fyzioterapií během patnáctidenního sledování u 30
starších pacientů s CHOPN s bronchiektaziemi
a chronickou mukózní hypersekrecí [6]. Jiná studie hodnotila
účinek erdosteinu na peroxidaci lipidů vyvolanou kouřením
u zdravých kuřáků a doložila po jednom měsíci
léčby signifikantní snížení koncentrace reaktivních sloučenin
kyseliny thiobarbiturové po expozici kouři [7]. Efekt
erdosteinu (600 mg/den) nebo placeba během desetidenní léčby
byl zkoušen u 24 pacientů se závažnou CHOPN s oxidativním
stresem vyvolaným cvičením. Po 10 dnech léčby byly hodnoty
ROS a plazmatické koncentrace 8 isoprostanu srovnatelné
s hodnotami naměřenými před cvičením v obou
sledovaných skupinách, po šestiminutovém testu chůze byl
však vzestup koncentrací nižší ve skupině léčené
erdosteinem [8].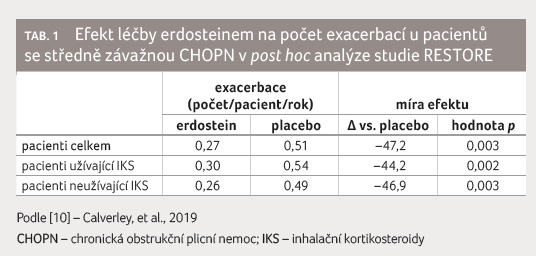
RESTORE (Reducing Exacerbations and
Symptoms by Treatment with ORal Erdosteine in COPD), jejíž výsledky
byly publikovány v roce 2017, znamenala přelomovou studii
v hodnocení efektu thiolů u pacientů s CHOPN.
Celkem 467 nemocných zařazených do studie mělo dvě
nebo více akutních exacerbací vyžadujících lékařský zásah
v předchozích 12 měsících, ne však v posledních dvou
měsících. Po dvoutýdenní run in periodě byla u 228
pacientů zahájena léčba erdosteinem ve schválené dávce
300 mg dvakrát denně a 239 pacientů bylo léčeno placebem
během 12 měsíců, v nichž nemocní užívali také běžnou
udržovací medikaci na CHOPN. Erdostein snížil počet
akutních exacerbací v 19,4 % (0,91 vs. 1,13
exacerbace/pacient/rok pro erdostein, resp. placebo), především
v podobě efektu na mírné exacerbace (0,23 vs. 0,54
exacerbace/pacient/rok pro erdostein, resp. placebo). Počet akutních
exacerbací činil 0,93 vs. 1,16 u pacientů užívajících IKS
(‒19,5 %) a 0,89 vs. 1,10 (‒19,3 %) u pacientů,
kteří IKS neužívali. Významná odlišnost nebyla zjištěna
v počtu středně závažných a závažných exacerbací.
Avšak erdostein snížil o 24,6 % dobu trvání všech
exacerbací (9,5 ± 7,2 dne ve skupině s erdosteinem
vs. 12,6 ± 9,7 dne ve skupině s placebem)
nezávisle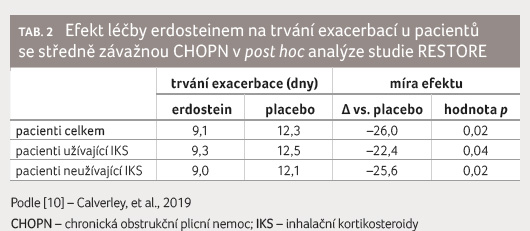 na závažnosti příhody. Erdostein rovněž
významně zredukoval hodnotu v subjektivních skóre závažnosti
a spotřebu úlevové medikace [9]. Post hoc analýza
studie RESTORE pracovala s 254 pacienty se středně závažnou
CHOPN definovanou spirometricky (postbronchodilatační hodnota
usilovného výdechu za jednu sekundu [FEV1]
50‒79 %); 126 z nich bylo randomizováno k podávání
erdosteinu 300 mg dvakrát denně a 128 k podávání
placeba. Analýza potvrdila 47% redukci průměrného počtu
exacerbací u erdosteinu ve srovnání s placebem
(0,27 vs. 0,51 exacerbace/pacient/rok) a 58,3% redukci
v počtu mírných exacerbací (0,23 vs. 0,53
exacerbace/pacient/rok) a též kratší průměrnou dobu trvání
exacerbace u pacientů léčených erdosteinem (9,1 dne pro
erdostein vs. 12,3 dne pro placebo), se signifikantní redukcí
u mírných a středně závažných až závažných
exacerbací. Navíc byla léčba erdosteinem spojena s prodlouženou
dobou do první exacerbace (182 dnů pro erdostein vs.
169 dnů pro placebo) a s průměrnou dobou bez
exacerbací (279 dnů pro erdostein versus 228 dnů
pro placebo). Nebyl zaznamenán žádný rozdíl v efektu léčby
z hlediska počtu eozinofilů a rovněž nebyl rozdíl
ve frekvenci a trvání exacerbací mezi pacienty se
středně závažnou CHOPN, kteří užívali, resp. neužívali IKS,
účinek erdosteinu na čas do první exa
na závažnosti příhody. Erdostein rovněž
významně zredukoval hodnotu v subjektivních skóre závažnosti
a spotřebu úlevové medikace [9]. Post hoc analýza
studie RESTORE pracovala s 254 pacienty se středně závažnou
CHOPN definovanou spirometricky (postbronchodilatační hodnota
usilovného výdechu za jednu sekundu [FEV1]
50‒79 %); 126 z nich bylo randomizováno k podávání
erdosteinu 300 mg dvakrát denně a 128 k podávání
placeba. Analýza potvrdila 47% redukci průměrného počtu
exacerbací u erdosteinu ve srovnání s placebem
(0,27 vs. 0,51 exacerbace/pacient/rok) a 58,3% redukci
v počtu mírných exacerbací (0,23 vs. 0,53
exacerbace/pacient/rok) a též kratší průměrnou dobu trvání
exacerbace u pacientů léčených erdosteinem (9,1 dne pro
erdostein vs. 12,3 dne pro placebo), se signifikantní redukcí
u mírných a středně závažných až závažných
exacerbací. Navíc byla léčba erdosteinem spojena s prodlouženou
dobou do první exacerbace (182 dnů pro erdostein vs.
169 dnů pro placebo) a s průměrnou dobou bez
exacerbací (279 dnů pro erdostein versus 228 dnů
pro placebo). Nebyl zaznamenán žádný rozdíl v efektu léčby
z hlediska počtu eozinofilů a rovněž nebyl rozdíl
ve frekvenci a trvání exacerbací mezi pacienty se
středně závažnou CHOPN, kteří užívali, resp. neužívali IKS,
účinek erdosteinu na čas do první exa
cerbace nebyl ovlivněn konkomitantním podáváním IKS [10], tabulka 1, 2.
Základní studie s erdosteinem shrnuje tabulka 3.
Metaanalýzy – léčba pacientů s chronickou bronchitidou a CHOPN
V roce 2010 byla provedena systematická review s metaanalýzou ke zjištění evidence o účinnosti erdosteinu v léčbě dospělých pacientů se stabilní chronickou bronchitidou/CHOPN nebo chronickou bronchitidou/CHOPN s exacerbacemi [11]. V celkem 15 vybraných randomizovaných kontrolovaných klinických studiích, které zahrnuly 1 046 pacientů, byla léčba erdosteinem spojena se signifikantním prospěchem ve zmírnění symptomů, a to jak u hodnocení srovnávajících lék s placebem, tak u hodnocení oproti jinému mukolytiku. Metaanalýza doložila, že erdostein v kombinaci s antibiotiky je účinnější v porovnání s monoterapií antibiotiky u pacientů s chronickou bronchitidou/CHOPN, především v léčbě akutních infekčních exacerbací.
Další systematická review s metaanalýzou relevantních studií proběhla v roce 2017 [12]. Metaanalýza zahrnula celkem 1 278 pacientů trpících chronickou bronchitidou a/nebo CHOPN. Léčba erdosteinem významně zlepšila klinická skóre pacientů a snížila celkové riziko vzniku exacerbací chronické bronchitidy/CHOPN. U pacientů s CHOPN užívajících erdostein bylo prokázáno prodloužení doby do první exacerbace oproti neléčeným nemocným. Erdostein rovněž prokázal lepší výsledky oproti kontrolám v ovlivnění doby trvání akutní exacerbace a v redukci rizika hospitalizace pro CHOPN.
Globální iniciativa pro CHOPN (GOLD) uvádí, že mukolytické/antioxidační přípravky jako erdostein, S karboxymethylcystein a N acetylcystein (NAC) mají být užívány pacienty bez terapie IKS, protože uvedené látky mohou snižovat riziko vzniku akutních exacerbací CHOPN a zlepšovat zdravotní stav [13]. Uvedený dokument nenaznačil mezi těmito účinnými látkami na bázi thiolů rozdíly. Metaanalýza sedmi randomizovaných klinických studií se 2 753 pacienty (11,15 % léčených erdosteinem, 18,27 % S karboxymethylcysteinem, 20,41 % NAC a 50,16 % placebem) se pokusila odlišnost prokázat [14]. Všechny tři léky signifikantně snížily riziko vzniku akutních exacerbací, ale metaanalýza také naznačila, že erdostein byl nejúčinnějším agens v prevenci rizika vzniku akutních exacerbací. Analýza number needed to treat (NNT) potvrdila, že počet pacientů, kteří mají být léčeni erdosteinem v průběhu jednoho roku, aby bylo zabráněno jedné akutní exacerbaci – v porovnání s placebem – představuje hodnotu 10,11. Hodnota NNT pro S karboxymethylcystein činila 30,92 a pro NAC 15,69, neprokázal se tedy signifikantní rozdíl oproti placebu. Všechny tři léky byly pacienty velmi dobře snášeny.
Další potencionální indikace erdosteinu v plicním lékařství
Ačkoliv nejsou k dispozici klinické studie hodnotící přidání erdosteinu ke standardní medikaci na astma, data z experimentálního výzkumu na prasečím modelu alergického zánětu ukázala, že výsledkem desetidenní léčby erdosteinem byla bronchodilatace a stimulace frekvence ciliárních kmitů, ale terapie neovlivnila dráždivý kašlací reflex. To znamená pozitivní zjištění, že erdostein nepotlačuje vylučování hlenu z respiračního traktu při kašli [15]. Erdostein mírně snižuje koncentraci zánětlivých cytokinů (interleukinu [IL] 3 a IL 5) a zvyšuje koncentraci IL 10, potenciálního regulátora alergické zánětlivé odpovědi. Uvedená zjištění znamenají, že erdostein by mohl mít přínos také v léčbě astmatu jako přídatná terapie.
Thioly mohou být rovněž užitečné v léčbě idiopatické plicní fibrózy (IPF) z důvodu zapojení kyslíkových radikálů a snížení koncentrace glutathionu v patogenezi a progresi IPF [16].
Několik experimentálních studií na krysách ukázalo, že erdostein je účinný v prevenci bleomycinem indukované plicní fibrózy prostřednictvím potlačení akumulace neutrofilů, inhibice lipidové peroxidace a působení jako antioxidantu a vychytávače volných radikálů [17‒19]. Erdostein, zvláště v kombinaci s S methyl isothiourea sulfátem, inhibuje plicní zánět, snižuje produkci IL 6, TNFα a NFκB a oslabuje bleomycinem indukovanou plicní fibrózu [20].
Závěr
V případě erdosteinu je k dispozici dostatek solidních dat o jeho účinnosti v redukci rizika vzniku akutních exacerbací, není však zatím možné přesně určit, zda tento efekt souvisí spíše s mukolytickým působením, nebo s aktivitou antioxidační, protizánětlivou a antimikrobiální, či se všemi těmito vlivy. Mnohočetné účinky erdosteinu kromě mukolytického působení mohou souviset také s odlišnostmi etiologie akutní exacerbace, jež je infekční (virová nebo bakteriální či obojí) nebo neinfekční, a s odlišnostmi biologického substrátu [21]. Bafadhel se spolupracovníky identifikovali čtyři biologické populační clustery pro exacerbace [22]. Tři clustery byly označeny jako bakteriálně predominantní, eozinofilově predominantní, virově predominantní. Čtvrtý cluster, který se vyznačoval nízkými koncentracemi mediátorů sputa a u něhož bylo méně exacerbací spojeno se známou etiologií, byl označen jako pauci zánětlivý. U každého pacienta s CHOPN, který vykazuje frekventní exacerbace, by měl být převládající biologický substrát akutních exacerbací rozpoznán, aby bylo možné preventivně působit proti těmto příhodám [23]. Například pacienti s eozinofilním zánětem by mohli mít největší prospěch z podávání IKS [24].
Antioxidační, protizánětlivé a antibakteriální vlastnosti stavějí erdostein v reálné praxi do role preventivního léčivého přípravku pro potlačení rozvoje akutních exacerbací. U erdosteinu nejsou k dispozici data o jeho preventivním účinku v případě virových onemocnění, ale je známo, že thioly představují efektivní strategii proti infekci virem chřipky, protože virem vyvolaný oxidativní stres je důležitý v regulaci hostitelského imunitního systému [25]. Ve studii RESTORE byl potvrzen preventivní účinek erdosteinu na redukci rizika vzniku akutních exacerbací bez ohledu na to, zda byly, nebo nebyly pacientům současně podávány IKS [9]. Naproti tomu strategie GOLD 2020 doporučuje používat erdostein pouze u pacientů s CHOPN bez simultánního užívání IKS [13]. Tento přístup v léčbě CHOPN je charakterizovaný odnětím IKS [26]. To u pacientů pravidelně užívajících erdostein nebylo příčinou zvýšeného počtu exacerbací [9,10], ačkoliv klinicky je riziko exacerbací při přerušení léčby IKS stále uváděno [27]. Přidání erdosteinu pravděpodobně toto riziko minimalizuje, k potvrzení jsou však zapotřebí další data z klinických studií.
Redakčně zpracovala PhDr. Nikola Homolová Richtrová
Seznam použité literatury
- [1] Dechant KL, Noble S. Erdosteine. Drugs 1996; 52: 875–882.
- [2] Irwin RS, Boulet LP, Cloutier MM, et al. Managing cough as a defense mechanism and as a symptom. A consensus panel report of the American College of Chest Physicians. Chest 1998; 114(2 Suppl Managing): 133S–181S.
- [3] Bolser DC. Cough suppressant and pharmacologic protussive therapy: ACCP evidence‑based clinical practice guidelines. Chest 2006; 129(1 Suppl): 238S–249S.
- [4] Marchioni CF, Polu JM, Taytard A, et al. Evaluation of efficacy and safety of erdosteine in patients affected by chronic bronchitis during an infective exacerbation phase and receiving amoxycillin as basic treatment (ECOBES, European Chronic Obstructive Bronchitis Erdosteine Study). Int J Clin Pharmacol Ther 1995; 33: 612–618.
- [5] Moretti M, Bottrighi P, Dallari R, et al. The effect of longterm treatment with erdosteine on chronic obstructive pulmonary disease: the EQUALIFE Study. Drugs Exp Clin Res 2004; 30: 143–152.
- [6] Crisafulli E, Coletti O, Costi S, et al. Effectiveness of erdosteine in elderly patients with bronchiectasis and hypersecretion: a 15‑day, prospective, parallel, open‑label, pilot study. Clin Ther 2007; 29: 2001–2009.
- [7] Basyigit I, Yildiz F, Cekmen M, et al. Effects of erdosteine on smoking‑induced lipid peroxidation in healthy smokers. Drugs R D 2005; 6: 83–89.
- [8] Dal Negro RW, Visconti M. Erdosteine reduces the exerciseinduced oxidative stress in patients with severe COPD: results of a placebo‑controlled trial. Pulm Pharmacol Ther 2016; 41: 48–51.
- [9] Dal Negro RW, Wedzicha JA, Iversen M, et al. Effect of erdosteine on the rate and duration of COPD exacerbations: the RESTORE study. Eur Respir J 2017; 50: 1700711.
- [10] Calverley PM, Page C, Dal Negro RW, et al. Effect of erdosteine on COPD exacerbations in COPD patients with moderate airflow limitation. Int J Chron Obstruct Pulmon Dis 2019; 14: 2733–2744.
- [11] Cazzola M, Floriani I, Page CP. The therapeutic efficacy of erdosteine in the treatment of chronic obstructive bronchitis: a meta‑analysis of individual patient data. Pulm Pharmacol Ther 2010; 23: 135–144.
- [12] Cazzola M, Calzetta L, Page C, et al. Impact of erdosteine on chronic bronchitis and COPD: a meta‑analysis. Pulm Pharmacol Ther 2018; 48: 185–194.
- [13] GOLD. Global strategy for the diagnosis, management and prevention of COPD, Global Initiative for Chronic Obstructive Lung Disease (GOLD). 2020 report. Dostupné na: https://www.goldc oped.org/. [Accessed 28 May 2020.]
- [14] Rogliani P, Matera MG, Page C, et al. Efficacy and safety profile of mucolytic/antioxidant agents in chronic obstructive pulmonary disease: a comparative analysis across erdosteine, carbocysteine, and N‑acetylcysteine. Respir Res 2019; 20: 104.
- [15] Fraňová S, Kazimierová I, Pappová L, et al. The effect of erdosteine on airway defence mechanisms and inflammatory cytokines in the settings of allergic inflammation. Pulm Pharmacol Ther 2019; 54: 60–67.
- [16] Cazzola M, Calzetta L, Page C, et al. Thiolbased drugs in pulmonary medicine: much more than mucolytics. Trends Pharmacol Sci 2019; 40: 452–463.
- [17] Boyaci H, Maral H, Turan G, et al. Effects of erdosteine on bleomycin‑induced lung fibrosis in rats. Mol Cell Biochem 2006; 281: 129–137.
- [18] Sogut S, Ozyurt H, Armutcu F, et al. Erdosteine prevents bleomycin‑induced pulmonary fibrosis in rats. Eur J Pharmacol 2004; 494: 213–220.
- [19] Yildirim Z, Kotuk M, Iraz M, et al. Attenuation of bleomycin induced lung fibrosis by oral sulfhydryl containing antioxidants in rats: erdosteine and N‑acetylcysteine. Pulm Pharmacol Ther 2005; 18: 367–373.
- [20] Guzel A, Kayhan S, Tutuncu S, et al. Attenuation of bleomycin induced lung fibrosis by erdosteine and inhibition of the inducible nitric oxide synthase. Bratisl Lek Listy 2015; 116: 196–202.
- [21] Cazzola M, Calzetta L, Rogliani P, Matera MG. The challenges of precision medicine in COPD. Mol Diagn Ther 2017; 21: 345–355.
- [22] Bafadhel M, McKenna S, Terry S, et al. Acute exacerbations of chronic obstructive pulmonary disease: identification of biologic clusters and their biomarkers. Am J Respir Crit Care Med 2011; 184: 662–671.
- [23] Tantucci C, Pini L. Inhaled corticosteroids in COPD: trying to make a long story short. Int J Chron Obstruct Pulmon Dis 2020; 15: 821–829.
- [24] Pavord ID, Lettis S, Locantore N, et al. Blood eosinophils and inhaled corticosteroid/long‑acting β‑2 agonist efficacy in COPD. Thorax 2016; 71: 118–125.
- [25] Liu M, Chen F, Liu T, et al. The role of oxidative stress in influenza virus infection. Microbes Infect 2017; 19: 580–586.
- [26] Cazzola M, Rogliani P, Matera MG. Escalation and de‑escalation of therapy in COPD: myths, realities and perspectives. Drugs 2015; 75: 1575–1585.
- [27] Calzetta L, Matera MG, Braido F, et al. Withdrawal of inhaled corticosteroids in COPD: a meta‑analysis. Pulm Pharmacol Ther 2017; 45: 148–158.