Na způsobu podání monoklonální protilátky v léčbě roztroušené sklerózy záleží?
Historicky se přípravky biologické léčby podávaly intravenózně. V posledních letech se objevuje trend podávat je subkutánně. Co přináší tento způsob aplikace, vysvětlil na loňském edukačním semináři Prime Time – Život v hlavní roli profesor RNDr. Jan Krejsek, CSc., z Ústavu klinické imunologie a alergologie FN a LF UK Hradec Králové.
Imunitní systém – základní charakteristika
V úvodu své prezentace připomněl profesor Krejsek základní imunopatologické děje u roztroušené sklerózy (RS). Profesor Krejsek prohlásil, že v imunologii postrádáme jednoduché kauzální souvislosti a kontext určuje iniciaci, průběh a ukončení imunitní reakce jako součásti obranného/poškozujícího zánětu podle hesla „vše je možné“. U RS jde o poškozující zánět zprostředkovaný abnormálně polarizovanými subsety Th1/Th17 lymfocytů, v němž však zaujímají významné místo také B lymfocyty. Imunitní systém neodpovídá jen za ochranu, ale zajišťuje i podporu reparačním procesům nervové tkáně, což zapadá do konceptu, že RS je kontinuální proces zánětlivých a degenerativních změn.
Imunitní trojici tvoří B lymfocyty, dendritické buňky a T lymfocyty, které v součinnosti iniciují a udržují ochranný/poškozující zánět. Poškozující zánět u RS je spuštěn na periferii v reakci na přítomnost autoantigenů původem z mozkové tkáně, které vznikly alterací a jsou lymfatickými cévami drénovány do krčních lymfatických uzlin. Zde jsou identifikovány B lymfocyty, které představují efektivní buňky zpracovávající a prezentující antigeny T lymfocytům. B lymfocyty jsou dobře vybaveny receptory rozpoznávajícími vzory (pattern recognition receptor, PRR – například toll‑like receptory), jimiž identifikují celé spektrum vzorů vnitřního poškození (damage‑associated molecular patterns, DAMPs) uvolněných z poškozených buněk. Po zpracování je v plném kostimulačním kontextu předkládají specifickým autoreaktivním T lymfocytům Th0, které za aktivní účasti B lymfocytů a ve spolupráci s dendritickými buňkami jako dalšími antigen prezentujícími buňkami klonálně expandují a polarizují se do subsetů Th1 a Th17. B lymfocyty, Th1 a Th17 lymfocyty přestupují hematoencefalickou bariéru, vstupují do CNS, kde dochází k rozvoji poškozujícího zánětu s produkcí prozánětlivých cytokinů.
B lymfocyty – jejich zralé stadium – plazmatické buňky, které se v CNS vyvinou ze zralých B lymfocytů po antigenní stimulaci a kostimulaci T lymfocyty, produkují protilátky (oligoklonální pásy), jež pravděpodobně přispívají k prozánětlivému prostředí. Tento poškozující zánět ničí myelinové obaly i samotné axony a od samého začátku je provázen neurodegenerací. Součástí patologického procesu je ztráta trofické a kontaktní podpory (aktivace mikroglie a astrocytu do prozánětlivých M1 a A1 forem). Výsledkem je kompartmentalizace zánětu za hematoencefalickou bariérou, vznik sekundárních folikulů B lymfocytů na meningách a zánik myelinových obalů a následně i axonů.
Diferenciace B lymfocytů, exprese membránových molekul
Vývoj B lymfocytů je v počáteční fázi nezávislý na přítomnosti antigenu. Jejich vývoj může pokračovat nezávisle na antigenní stimulaci, ale na konci je zralý B lymfocyt, který je charakterizován přítomností receptoru pro antigen (BcR). Velmi důležitá je membránová molekula CD20, která představuje cíl biologické terapie a je exprimována na zralých B lymfocytech, nikoliv na prekurzorových buňkách a na plazmatických buňkách. To znamená, že CD20 depleční terapie ponechá rezervu prekurzorových B lymfocytů pro doplnění B lymfocytární populace. Je zachována také schopnost tvorby protilátek.
Léčebné cíle u roztroušené sklerózy – zacíleno na B lymfocyty
V terapii můžeme použít malé molekuly (například kladribin), biologika – monoklonální protilátky se zacílením na povrchový antigen B lymfocytů CD20 – rituximab, okrelizumab a ofatumumab.
Molekula CD20 tvoří dvě smyčky, které se zanořují do cytoplazmy, a podle místa, kde léčba anti‑CD20 působí (kde se naváže), dochází k buněčné smrti – k apoptóze, k lýze závislé na komplementu či cestou cytotoxicity závislé na protilátkách. Cest, které vedou k depleci B lymfocytů, je více a mohou se kombinovat.
Aplikace anti‑CD20 monoklonálních protilátek
První anti‑CD20 monoklonální protilátky se podávaly intravenózně, současný trend, a to nejen v terapii RS, směřuje k subkutánní aplikaci. Zásadní rozdíly mezi těmito dvěma způsoby jsou v dávkování, farmakokinetice i farmakodynamice. Dávky podávané intravenózně jsou řádově vyšší.
Subkutánní aplikace monoklonálních protilátek
Existují různé proměnné, které ovlivňuji farmakokinetiku: pomocné látky, aplikovaný objem, agregabilita podané látky, vliv sníženého lokálního pH či zvýšený fyzikální tlak, mezibuněčná hmota, která je velmi komplexní, co se týče molekulárního složení. Farmakokinetiku ovlivňují intersticiální tekutina, lokální metabolické poměry a postaplikační změna influxu jak tekutin, tak imunocytů do místa podání.
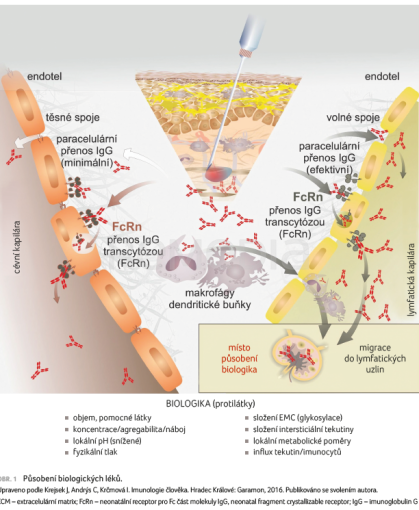 V místě podání hrají klíčovou úlohu receptory, které byly poprvé popsány na membránách na rozhraní mezi matkou a plodem a které označujeme jako neonatální receptory pro Fc část imunoglobulinů (FcRn). Jsou odpovědné za přenos protilátek třídy IgG1 na konci těhotenství od matky k ochraně plodu. Tyto neonatální receptory, které byly popsány před zhruba 20 lety, slouží nejen pro transport IgG1 od matky k plodu, ale jsou přítomny i na endoteliálních buňkách. Část monoklonálních protilátek se může pomocí FcRn dostávat do krevního řečiště. Převážné množství monoklonálních protilátek však přestupuje do lymfatických cév transcytózou, paracelulárními či volnými spoji, a tak se s lymfou dostává do lymfatických uzlin, tedy do místa, kde primárně probíhají patologické děje u RS jak iniciační, tak efektorové. Monoklonální protilátka se tak efektivně dostává do míst, kde k patologickým procesům dochází (obr. 1).
V místě podání hrají klíčovou úlohu receptory, které byly poprvé popsány na membránách na rozhraní mezi matkou a plodem a které označujeme jako neonatální receptory pro Fc část imunoglobulinů (FcRn). Jsou odpovědné za přenos protilátek třídy IgG1 na konci těhotenství od matky k ochraně plodu. Tyto neonatální receptory, které byly popsány před zhruba 20 lety, slouží nejen pro transport IgG1 od matky k plodu, ale jsou přítomny i na endoteliálních buňkách. Část monoklonálních protilátek se může pomocí FcRn dostávat do krevního řečiště. Převážné množství monoklonálních protilátek však přestupuje do lymfatických cév transcytózou, paracelulárními či volnými spoji, a tak se s lymfou dostává do lymfatických uzlin, tedy do místa, kde primárně probíhají patologické děje u RS jak iniciační, tak efektorové. Monoklonální protilátka se tak efektivně dostává do míst, kde k patologickým procesům dochází (obr. 1).
„Jediný problém, který u subkutánního podání vidím, je ztráta kontroly nad pravidelnou aplikací. Chroničtí pacienti mnohdy nevnímají nutnost aplikovat si doma léky, když nepociťují příznaky nemoci a úlevu po aplikaci. Přeji vám, neurologům, abyste uměli motivovat své pacienty k udržení adherence u subkutánně podávané léčby,“ uzavřel svou prezentaci profesor Krejsek.