Ofatumumab – nová a odlišná monoklonální protilátka proti CD20 v léčbě roztroušené sklerózy
Souhrn:
Elišák M. Ofatumumab – nová a odlišná monoklonální protilátka proti CD20 v léčbě roztroušené sklerózy. Remedia 2021; 31: 540–543.
Ofatumumab představuje novou, vysoce účinnou léčbu roztroušené sklerózy (RS). Jde o plně humánní monoklonální protilátku zaměřenou proti povrchovému znaku CD20 exprimovanému na většině buněk linie B lymfocytů a v malé míře i T lymfocytů. Od dosud používaných depletorů CD20 se liší v řadě farmakokinetických i farmakodynamických vlastností. Odlišné charakteristiky umožňují bezpečnou subkutánní aplikaci s minimem nežádoucích účinků při podání nižší dávky oproti jiným depletorům CD20 – iniciální dávka 20 mg subkutánní injekcí samoaplikací pacientem se podává v týdnech 0, 1, 2 a od týdne 4 dále v měsíčních intervalech. Vzhledem k relativně rychlejší repopulaci B lymfocytů je ofatumumab výhodný pro možnost rychlejšího přerušení léčby. Byť byla prokázána obdobná deplece buněk na periferii i v lymfatických uzlinách jako u ostatních depletorů CD20 podávaných ve vyšších dávkách intravenózně, efekt ofatumumabu, ale i dalších depletorů CD20 na B lymfocyty v centrálním nervovém systému je předmětem dalších studií.
Summary:
Elisak M. Ofatumumab – new and different monoclonal anti‑CD20 antibody in the treatment of multiple sclerosis. Remedia 2021; 31: 540–543.
Ofatumumab represents a new, highly effective treatment for multiple sclerosis. It is a human monoclonal antibody targeted at CD20 surface antigen expressed on most cells of the B cell lineage and, to a small extent, T cells. It differs from previously used CD20 depletors in several pharmacokinetic and pharmacodynamic properties. These allow safe subcutaneous administration with minimal adverse effects at a lower dose than other CD20 depletors – an initial dose of 20 mg by subcutaneous injection by patient self‑administration at weeks 0, 1, 2, and from week 4 onwards at monthly intervals. Due to the relatively faster repopulation of B cells, ofatumumab advantageously allows for faster discontinuation of therapy. Although similar depletion of cells in the periphery and lymph nodes has been demonstrated with other CD20 depletors administered at higher doses intravenously, the effect of ofatumumab and other CD20 depletors on B lymphocytes in the central nervous system is the subject of further studies.
Key words: ofatumumab, CD20, lymphocytes, multiple sclerosis, subcutaneous delivery.
Terapie roztroušené sklerózy cílená
na B buněčnou linii lymfocytů
Na základě studia původních zvířecích modelů (experimentální autoimunitní encefalitida) a histopatologických nálezů roztroušené sklerózy (RS), kdy T lymfocyty jsou v plakách zastoupeny s vyšší četností než B lymfocyty, byla považována úloha B lymfocytární linie za okrajovou. Novější modely však ukázaly, že pro experimentálně navozený histopatologický obraz ve zvířecích modelech, který je podobný obrazu pacientů s RS, je nutná přítomnost protilátek a B lymfocytů působících v synergii s T buňkami [1]. Dalšími důkazy úlohy B lymfocytární linie jsou nálezy akumulace B lymfocytů a folikulů v meningách i v samotném parenchymu centrálního nervového systému (CNS). Infiltrace B lymfocyty není rovnoměrně rozložena. CD20+ B lymfocyty mají tendenci se hromadit v perivaskulárních prostorech a v subarachnoidálním prostoru leptomening více než v tkáňovém parenchymu [2]. Terciární lymfatická centra obohacená o B lymfocyty v subarachnoidálním prostoru jsou zvláště patrná u pacientů se sekundárně progresivní RS a tyto struktury bohaté na B lymfocyty bývají typicky lokalizovány subpiálně. Je však obtížné zjistit, zda jsou tato lymfatická centra zasažena terapií, protože jejich malá velikost komplikuje jejich zobrazení pomocí magnetické rezonance (MR). Sekvenování variabilní oblasti těžkého řetězce imunoglobulinů (Ig) za účelem zjištění klonálních vztahů mezi periferními B lymfocyty a B lymfocyty pocházejícími z CNS odhalilo klonální vztahy mezi B lymfocyty v CNS a B lymfocyty v krčních lymfatických uzlinách [3].
Roli B lymfocytární linie signalizovaly i oligoklonální pásy (oligoclonal bands, OCB) používané již několik dekád jako jeden z biomarkerů RS. Navzdory mnoha pracím dosud nebyly jasně identifikovány antigenní cíle OCB. Ačkoliv bylo zjištěno, že některé OCB rozpoznávají známé myelinové proteiny, zdá se, že představují spíše výjimku než pravidlo. V jedné z prací bylo publikováno, že část z protilátek rozpoznává všudypřítomné buněčné zbytky, což naznačuje, že představují spíše sekundární jev v reakci na poškození tkáně než přímou patogenní roli [4]. Protože se však protilátky a komplement běžně nacházejí uložené podél myelinových pochev a na povrchu makrofágů v aktivních lézích, pátrání po antigenech nadále pokračuje [5]. B lymfocyty ale nejsou „pouze“ producenty protilátek. Jsou velmi účinnými a vysoce selektivními antigen prezentujícími buňkami zejména pro Th1 a Th17 lymfocyty. Dále uvolňují celou řadu prozánětlivých cytokinů (tumor nekrotizující faktor alfa, lymfotoxin, faktor stimulující kolonie granulocytů a makrofágů). Regulační B lymfocyty mohou naopak tlumit nadměrné zánětlivé reakce např. prostřednictvím interleukinu 10. Byly také identifikovány další funkce B lymfocytů v procesech růstu, remodelace a reparace [6].
Deplece B lymfocytů tedy představuje možnost terapeutického ovlivnění RS. V léčbě jsou v současné době nejčastěji používány monoklonální protilátky proti povrchovém znaku CD20. Klinické studie dále probíhají u inhibitorů Brutonovy tyrozinkinázy a blokátorů aktivačních faktorů B lymfocytů (B cell activating factor, BAFF).
Depletory CD20+ lymfocytů v léčbě
roztroušené sklerózy
CD20 je transmembránový neglykosylovaný fosfoprotein, který je exprimován v tetramerech spojených s lipidovými rafty. Jde o pevně navázaný fosfoprotein, jehož funkce není dosud známa. Vyskytuje se na povrchu pre B lymfocytů, zralých naivních B lymfocytů, zralých aktivovaných paměťových B lymfocytů a většiny plazmablastů. Z B lymfocytární linie nemá znak CD20 část plazmablastů a terminálně diferencované plazmatické buňky produkující protilátky. B lymfocyty, které neexprimují CD20, však mohou být ovlivněny nepřímo – během léčby dochází také k mírnému poklesu počtu plazmatických buněk v cirkulaci [7]. Znak CD20 exprimuje i přibližně 6 % CD3+, CD4+ a CD8+ T lymfocytů, které jsou fenotypově a funkčně heterogenní a o něco častěji CD8 pozitivní. Po léčbě rituximabem dochází po dobu 3–6 měsíců k přechodnému poklesu počtu CD4+ a CD8+ lymfocytů, což pravděpodobně souvisí s odstraněním CD20+ T lymfocytů [8].
Navzdory společnému cíli nelze na monoklonální protilátky anti CD20 pohlížet jako na biosimilars, jelikož se liší v molekulární struktuře, cílovém epitopu, mechanismu deplece B lymfocytů a způsobu podání, které vedou k odlišné kinetice deplece a repopulace B lymfocytů, imunogenicitě, k reakcím souvisejícím s podáním či riziky infekce. V léčbě RS byly a/nebo jsou užívány rituximab (který ale není v současné době v České republice v této indikaci schválen), okrelizumab a nejnověji ofatumumab.
Molekulární struktura,
farmakodynamika
Ofatumumab je na rozdíl
od rituximabu (chimérická myší) a okrelizumabu
(humanizovaná) plně humánní monoklonální protilátka, což se
odráží v míře imunogenicity. Ofatumumab má také unikátní
vazbu na nesouvisející sekvence malé i velké
extracelulární kličky CD20. Rituximab i okrelizumab mají
prakticky identickou vazbu na velkou extracelulární kličku,
ale v odlišném epitopu na velké kličce než ofatumumab
(obr. 1A, B). Vazba ofatumumabu na CD20 je silnější,
s nižší mírou disociace než v případě rituximabu –
ofatumumab potřebuje k navázání 10× menší hustotu
CD20 než rituximab [9].
Po navázání na cílový epitop se liší dominantním
mechanismem deplece cílové buňky – u ofatumumabu
dominuje cytotoxicita závislá na komplementu (complement
dependent cytotoxicity, CDC) a v menší míře i buněčná
cytotoxicita závislá na protilátkách (antibody dependent
cellular cytotoxicity, ADCC), což má společné s rituximabem,
ale liší se tím od okrelizumabu. Předpokládá se, že tato
zvýšená účinnost CDC je hlavní příčinou prokázané
účinnosti ofatumumabu při významně nižší dávce ve srovnání
s dávkami potřebnými pro rituximab a okrelizumab 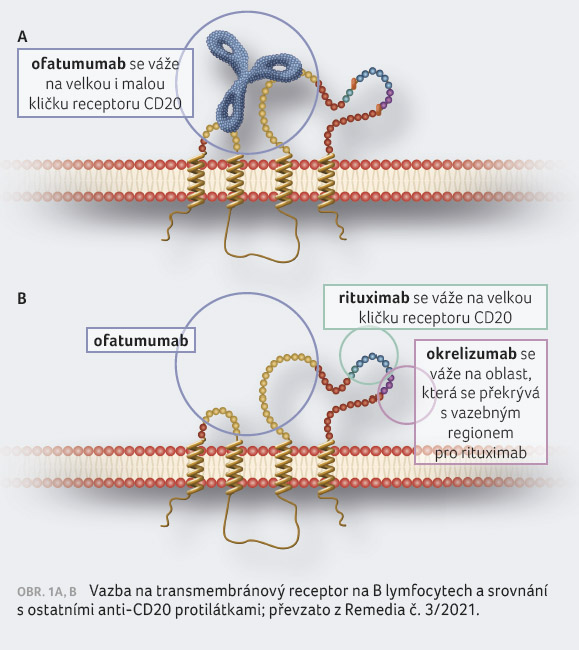
Dávkování, farmakokinetika
Byť byla klinickými studiemi fáze II prokázána bezpečnost intravenózní aplikace ofatumumabu používané v hematoonkologii (v dávkách 100 mg, 300 mg nebo 700 mg v intervalu dvou týdnů) [11], další studie byly zaměřeny na subkutánní aplikaci [12] a v současné době je ofatumumab prozatím jedinou schválenou léčbou zaměřenou na CD20+ lymfocyty se subkutánní formou podávání s možností aplikace pacientem.
Subkutánní aplikace se farmakokinetikou liší od aplikace intravenózní. Míra absorpce subkutánně podávaných léčiv závisí mimo jiné na řadě fyziologických faktorů pacienta (tělesná hmotnost, věk, pohlaví, fyzická aktivita). Biofarmaka větší než 16 kDa, jako jsou monoklonální protilátky (~150 kDa), nemohou projít přímou absorpcí do krve a předtím, než se dostanou do systémového krevního oběhu, musejí být transportována přes intersticium do lymfatického systému [13]. Efekt ofatumumabu v uzlinách a dalších tkáních byl popsán na modelu makaka, kdy byly po subkutánní aplikaci ofatumumabu B lymfocyty v perifolikulárních a interfolikulárních prostorech zcela vyčerpány, a to i včetně mízních uzlin, které přímo nedrénovaly místo injekce. Naopak žádné molekulární změny nebyly nalezeny ve slezině a pouze mírné změny byly pozorovány v oblasti marginální zóny lymfatických uzlin [14].
Deplece B lymfocytů spojené s léčbou ofatumumabem bylo navíc dosaženo při nízkých koncentracích systémové expozice léku, které zůstaly mezi jednotlivými dávkami relativně stabilní. Naproti tomu u vysokodávkovaného intravenózního depletoru CD20 podávaného každých šest měsíců se projevilo větší celkové kolísání plazmatických koncentrací léčiva, přičemž zpočátku vysoké koncentrace se v průběhu času snižovaly, což potenciálně umožnilo částečné doplnění B lymfocytů mezi jednotlivými pulzy [15].
Na rozdíl od malých molekul, kterými jsou např. inhibitory Brutonovy tyrozinkinázy, se dávka monoklonálních protilátek nemusí nutně týkat koncentrace léku/protilátky, ale toho, jak velká část cíle je inhibována nebo depletována a jak dlouho tyto účinky trvají – farmakokinetický účinek po aplikaci léčiva se tedy může lišit od farmakodynamického efektu léčby. Poločas cirkulace monoklonálních protilátek je částečně určen cirkulující koncentrací, částečně „eliminačním“ účinkem po navázání protilátky na cílový antigen – čím více je cílového antigenu, tj. CD20+ B lymfocytů, tím kratší je poločas rozpadu protilátky, protože antigen se na ni váže, čímž ji odstraňuje z oběhu. Dalším způsobem eliminace je na epitopu nezávislá cesta zprostředkovaná nespecifickou endocytózou následovanou intracelulárním katabolismem jako u jiných volných molekul IgG. Po vyčerpání B lymfocytů se eliminační poločas ofatumumabu v ustáleném stavu odhaduje na přibližně 16 dní [16] ve srovnání s 26 dny u okrelizumabu [17].
Deplece a repopulace B lymfocytů
Posouzení skutečné hloubky a rozsahu deplece B buněk pomocí anti CD20 terapie je náročné, protože měření v krvi nemusí nutně odrážet rozsah deplece B buněk v tkáních. Dostupné důkazy naznačují, že anti CD20 režimy používané u RS vedou k rychlé a téměř úplné depleci cirkulujících B lymfocytů s různou mírou jejich obnovy. Dosud není z velké části známo, do jaké míry jsou kompartmenty bohaté na B lymfocyty (kostní dřeň, slezina a lymfatické uzliny a také struktury podobné folikulům B lymfocytů v CNS) vyčerpány léčbou anti CD20 a jak jsou znovu osídleny B lymfocyty po ukončení léčby anti CD20. Kromě toho je zásadní objasnit, v jakém funkčním stavu se B lymfocyty znovu objevují po svém přechodném vymizení zprostředkovaném anti CD20, a zjistit, které faktory formují znovuobjevující se fenotyp B buněk.
Studie fáze III ASCLEPIOS a studie bioekvivalence fáze II APLIOS, které používaly stejné dávkovací schéma subkutánního ofatumumabu 20 mg (počáteční dávky podávané v týdnu 0, 1 a 2 následované měsíčními udržovacími dávkami počínaje týdnem 4 u pacientů s relabující remitující RS), zaznamenaly rychlou a téměř úplnou depleci B lymfocytů (≤ 10 buněk/μl) u přibližně 82–85 % pacientů do druhého týdne.
Počet B lymfocytů se obnovil nad dolní hranici normy u nejméně 50 % pacientů po 24–36 týdnech od ukončení léčby [16]. U pacientů, kteří dostali ofatumumab ve formě intravenózní infuze v dávce 100, 300 a 700 mg v intervalu dvou týdnů, byla doba potřebná k repopulaci 48–104 týdnů [11].
Účinnost
Studie ASCLEPIOS I a II prokázala vysokou účinnost ofatumumabu v léčbě relabující remitující RS. Léčba vedla k 95,5% snížení počtu T1 lézí vychytávajících gadolinium a roční míra potvrzených relapsů byla o 54,5 % snížena ve srovnání s aktivním komparátorem (teriflunomid). Ofatumumab v porovnání s teriflunomidem významně redukoval riziko tříměsíční potvrzené progrese disability (o 34,4 %) a riziko šestiměsíční potvrzené progrese disability (o 32,5 %), ale nepřinesl významné snížení úbytku objemu mozku ve srovnání s teriflunomidem (hodnoty představují průměrné snížení při kombinaci studií) [12].
Nežádoucí účinky
Reakce související s injekcí byly ve větvi s ofatumumabem hlášeny u 20,6 % pacientů (oproti větvi s teriflunomidem, kde byly zaznamenány u 15,5 % pacientů, kterým bylo aplikováno subkutánně placebo), ale v 99,8 % byly mírné až středně závažné a u žádného pacienta nebyly život ohrožující. Reakce se objevovaly nejčastěji po první dávce. Byť je léčba ofatumumabem spjata s vysokou mírou deplece CD20+ lymfocytů zprostředkované mechanismem CDC, která je považována za spouštěč této reakce, subkutánní forma aplikace [18], nižší aplikovaná dávka [19] a plně humánní struktura protilátky zřejmě snižují závažnost i frekvenci nežádoucích účinků, a před aplikací ofatumumabu tedy není nutná premedikace.
Plně humánní struktura ofatumumabu významně snižuje jeho potenciální imunogenicitu. Ve studiích ASCLEPIOS se subkutánní injekcí 20 mg ofatumumabu byl výskyt protilátek proti ofatumumabu 0,2 % (2/946), a to bez neutralizačního efektu. Nízkou imunogenicitu molekuly podporuje i výskyt protilátek proti ofatumumabu u méně než 1 % pacientů léčených intravenózním ofatumumabem v jednotlivých dávkách až 2 000 mg pro chronickou lymfatickou leukemii [20].
Dlouhodobá deplece CD20+ B lymfocytů je rizikovým faktorem rozvoje infekce. V klinickém hodnocení byly koncentrace IgM sníženy více než koncentrace IgG a IgA, přičemž léčba nebyla v krátkodobém horizontu (do 2,5 roku) spojena s významně zvýšeným rizikem infekce – celková míra infekcí a závažných infekcí u pacientů léčených ofatumumabem byla podobná jako u pacientů léčených teriflunomidem (51,6 % vs. 52,7 %, resp. 2,5 % vs. 1,8 %) a jednalo se většinou o mírné až středně závažné infekty dýchacích cest [12]. Ačkoliv byly hlášeny případy progresivní multifokální leukoencefalopatie u pacientů léčených intravenózně podávaným ofatumumabem pro chronickou lymfatickou leukemii, dávkování používané v této indikaci je násobně vyšší (300 mg 1. den a 1 000 mg 8. den, s následnými 28denními cykly s dávkou 1 000 mg po dobu minimálně tří nebo maximálně dvanácti cyklů v závislosti na odpovědi na léčbu). U pacientů léčených ofatumumabem v dávkách užívaných v léčbě RS nebyl dosud publikován případ progresivní multifokální leukoencefalopatie, a riziko jejího vzniku v souvislosti s danou léčbou se tedy zdá být minimální.
Specifika ofatumumabu v porovnání
s dalšími depletory CD20
Ofatumumab se od ostatních depletorů CD20 užívaných v léčbě RS odlišuje v několika zásadních charakteristikách. Jedná se o plně humánní protilátku, která se pevně váže na svůj epitop a efektivně, zejména prostřednictvím CDC, ničí cílové lymfocyty. Tyto vlastnosti umožňují prokázanou vysokou účinnost i nízké dávky ofatumumabu, jeho nízkou imunogenicitu a nízký výskyt nežádoucích účinků souvisejících s infekcí.
Dalším specifikem je subkutánní aplikace, která způsobuje depleci CD20+ lymfocytů v uzlinách, ale nezpůsobuje rozsáhlou depleci B lymfocytů ve slezině, která je pozorována při intravenózní terapii depletorů CD20. Ve zvířecích modelech napodobujících protokol dávkování rituximabu, resp. ofatumumabu u pacientů s RS vedla léčba ofatumumabem a rituximabem po 21 dnech ke srovnatelné, prakticky maximální depleci B lymfocytů v krvi a lymfatických uzlinách. Zachování B lymfocytů ve slezině spolu s rychlejší repopulací B lymfocytů při podávání ofatumumabu může vést k nižšímu výskytu infekcí [21]. Rychlejší vylučování a repopulace B lymfocytů při léčbě ofatumumabem budou výhodné pro pacienty, kteří potřebují přerušit terapii z bezpečnostních důvodů.
Potenciálně efektivnější průnik do lymfatického systému v menších dávkách by mohl zvyšovat efektivitu léčby. Ačkoliv je deplece B lymfocytů z cirkulace téměř úplná, v periferní krvi se nacházejí pouze 2 % celkového množství lymfocytů v těle a deplece hlavních zásob B lymfocytů v lymfoidních orgánech je pouze částečná [22]. V současné době probíhá také otevřená multicentrická studie fáze Ib zaměřená na farmakokinetiku, bezpečnost a snášenlivost subkutánního podávání okrelizumabu u pacientů s RS v kohortách s dávkováním 40–1 200 mg okrelizumabu subkutánně (NCT03972306).
Ofatumumab je některými autory označován jako „nízkodávková anti-CD20 terapie“. Po vyčerpání B lymfocytů se poločas ofatumumabu v ustáleném stavu odhaduje na přibližně 16 dní [16], zatímco poločas okrelizumabu na 26 dní [17]; k dosažení mediánu doby do obnovy B lymfocytů na dolní hranici normy dochází po ukončení léčby ofatumumabem za 40 týdnů oproti 72 týdnům po léčbě okrelizumabem. Tyto farmakokinetické faktory by se mohly odrazit v průniku přes hematoencefalickou bariéru, kam prostupuje pouze 0,1–0,5 % sérových imunoglobulinů [23]. Právě malé ovlivnění B lymfocytů v CNS je jedním z možných mechanismů selhání depletorů CD20. Na druhou stranu význam ovlivnění B lymfocytů v CNS nebyl doposud jednoznačně určen a nízká dávka i kratší působení ofatumumabu se jeví jako příznivé stran tolerance a nežádoucích účinků.
Seznam použité literatury
- [1] Genain CP, Hauser SL. Allergic Encephalomyelitis in Common Marmosets: Pathogenesis of a Multiple Sclerosis‑like Lesion. Methods 1996;10: 420–434.
- [2] Machado‑Santos J, Saji E, Tröscher AR, et al. The compartmentalized inflammatory response in the multiple sclerosis brain is composed of tissue‑resident CD8 T lymphocytes and B cells. Brain 2018; 141: 2066–2082.
- [3] Stern JNH, Yaari G, Vander Heiden JA, et al. B cells populating the multiple sclerosis brain mature in the draining cervical lymph nodes. Sci Transl Med 2014; 6: 248ra107.
- [4] Brändle SM, Obermeier B, Senel M, et al. Distinct oligoclonal band antibodies in multiple sclerosis recognize ubiquitous self‑proteins. Proc Natl Acad Sci U S A 2016; 113: 7864–7869.
- [5] Barnett MH, Prineas JW. Relapsing and remitting multiple sclerosis: pathology of the newly forming lesion. Ann Neurol 2004; 55: 458–468.
- [6] Greenfield AL, Hauser SL. B‑cell Therapy for Multiple Sclerosis: Entering an era. Ann Neurol 2018; 83: 13–26.
- [7] Roll P, Palanichamy A, Kneitz C, et al. Regeneration of B cell subsets after transient B cell depletion using anti‑CD20 antibodies in rheumatoid arthritis. Arthritis Rheum 2006; 54: 2377–2386.
- [8] Graves J, Vinayagasundaram U, Mowry EM, et al. Effects of rituximab on lymphocytes in multiple sclerosis and neuromyelitis optica. Mult Scler Relat Disord 2014; 3: 244–252.
- [9] Teeling JL, Mackus WJM, Wiegman LJJM, et al. The biological activity of human CD20 monoclonal antibodies is linked to unique epitopes on CD20. J Immunol 2006; 177: 362–371.
- [10] Touil I, Perrot C, Elain G, Weckbecker G. Ofatumumab and Ocrelizumab Differentially Induce Human Primary B‑Cell Lysis By Complement‑Dependent Cytotoxicity. ACTRIMS Forum 2019. ACTRIMS; 2019. Available: https://actrims.confex.com/actrims/2019/meetingapp.cgi/Paper/4164
- [11] Sorensen PS, Lisby S, Grove R, et al. Safety and efficacy of ofatumumab in relapsing‑remitting multiple sclerosis: a phase 2 study. Neurology 2014; 82: 573–581.
- [12] Hauser SL, Bar‑Or A, Cohen JA, et al. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med 2020; 383: 546–557.
- [13] Viola M, Sequeira J, Seiça R, et al. Subcutaneous delivery of monoclonal antibodies: How do we get there? J Control Release 2018; 286: 301–314.
- [14] Theil D, Smith P, Huck C, et al. Imaging Mass Cytometry and Single‑Cell Genomics Reveal Differential Depletion and Repletion of B‑Cell Populations Following Ofatumumab Treatment in Cynomolgus Monkeys. Front Immunol 2019; 10: 1340.
- [15] Bar‑Or A, Wiendl H, Montalban X, et al. Rapid and sustained B‑cell depletion with subcutaneous ofatumumab in relapsing multiple sclerosis: APLIOS, a randomized phase‑2 study. Mult Scler 2021; doi: DOI:10.1177/13524585211044479.
- [16] Souhrn údajů o přípravku Kesimpta. Dostupné na: https:/www.sukl.cz
- [17] Souhrn údajů o přípravku Ocrevus. Dostupné na: https:/www.sukl.cz
- [18] Du FH, Mills EA, Mao‑Draayer Y. Next‑generation anti‑CD20 monoclonal antibodies in autoimmune disease treatment. Auto Immun Highlights 2017; 8: 12.
- [19] Bar‑Or A, Grove RA, Austin DJ, et al. Subcutaneous ofatumumab in patients with relapsing‑remitting multiple sclerosis: The MIRROR study. Neurology 2018; 90: e1805–e1814.
- [20] Souhrn údajů o přípravku Arzerra. Dostupné na: https:/www.sukl.cz
- [21] Cotchett KR, Dittel BN, Obeidat AZ. Comparison of the Efficacy and Safety of Anti‑CD20 B Cells Depleting Drugs in Multiple Sclerosis. Mult Scler Relat Disord 2021; 49: 102787.
- [22] Dock J, Hultin L, Hultin P, et al. Human immune compartment comparisons: Optimization of proliferative assays for blood and gut T lymphocytes. J Immunol Methods 2017; 445: 77–87.
- [23] Cross AH, Stark JL, Lauber J, et al. Rituximab reduces B cells and T cells in cerebrospinal fluid of multiple sclerosis patients. J Neuroimmunol 2006; 180: 63–70.