Ofatumumab versus teriflunomid v léčbě roztroušené sklerózy
Studie ASCLEPIOS I a II hodnotily léčbu ofatumumabem a teriflunomidem u pacientů s relabující roztroušenou sklerózou v průběhu třiceti měsíců [1]. Léčba ofatumumabem byla ve dvojitě zaslepených, aktivně kontrolovaných studiích spojena s nižším ročním počtem relapsů ve srovnání s teriflunomidem. Zároveň byly zaznamenány pokles výskytu lézí na magnetické rezonanci a oddálení potvrzené progrese disability. Klinická hodnocení rovněž potvrdila příznivý bezpečnostní profil ofatumumabu.
Ofatumumab představuje novou možnost
v léčbě pacientů s aktivní relabující remitující
formou roztroušené sklerózy (RS). Jde o subkutánně
podávanou plně humánní anti CD20 monoklonální
protilátku, která působí selektivní depleci B lymfocytů.
Teriflunomid je perorálním imunomodulačním léčivem, jež
inhibuje aktivitu T a B lymfocytů.
Charakteristika
pacientů
Mezi zařazovací kritéria studií
ASCLEPIOS I a II patřily věk mezi 18 a 55 lety,
diagnóza relabující formy RS, míra postižení při screeningu
měřená podle rozšířené škály disability EDSS (Expanded
Disability Status Scale) 0–5,5. Dále pacienti museli prodělat
minimálně jeden zdokumentovaný relaps během předchozího roku
nebo dva relapsy během předchozích dvou let nebo museli mít
alespoň jednu gadolinium (Gd) enhancující lézi na zobrazení
magnetickou rezonancí (MRI) během roku před randomizací. Rovněž
byl nutný neurologicky stabilní stav minimálně jeden měsíc před
randomizací. Do studií byli zařazeni nově diagnostikovaní
pacienti i nemocní přecházející z aktuální léčby
(tab. 1).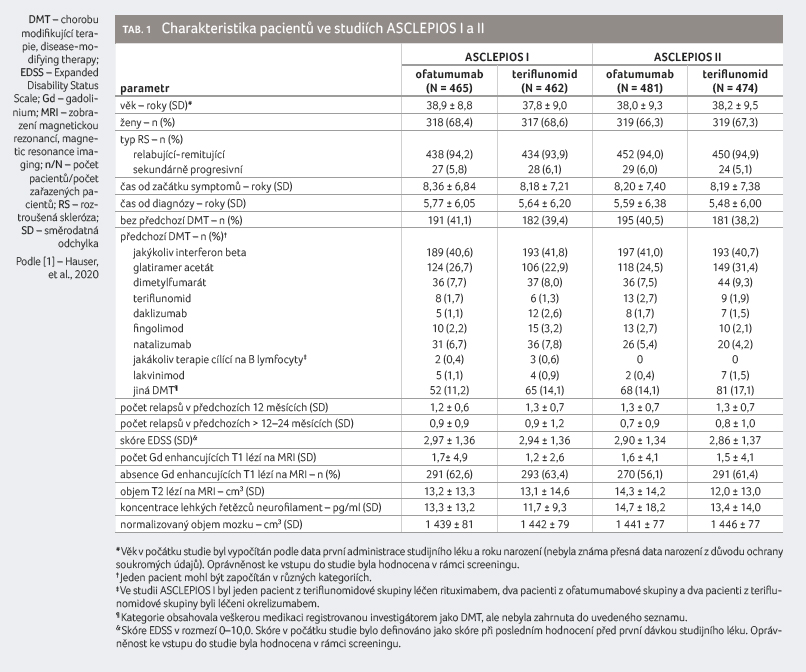
Uspořádání
studií
ASCLEPIOS I a II byly randomizované, dvojitě zaslepené, aktivně kontrolované multicentrické studie fáze III se stejným uspořádáním. Primárním cílovým ukazatelem studií byl roční počet relapsů (annual relapse rate, ARR). Pacienti byli randomizováni v poměru 1 : 1 do skupiny s ofatumumabem v dávce 20 mg podávané subkutánně každé čtyři týdny po úvodních 20mg dávkách ve dnech 1, 7 a 14 (927 osob) a do skupiny s perorálním teriflunomidem v dávce 14 mg jednou denně (955 osob), a to po dobu 30 měsíců. Pacienti v ofatumumabové větvi dostávali rovněž perorální placebo a pacienti v teriflunomidové větvi subkutánní placebo z důvodu zajištění zaslepení (tzv. double dummy uspořádání). První subkutánní injekce byla pacientům aplikována odpovědným zdravotnickým pracovníkem, injekce ve dnech 7 a 14 už si nemocní aplikovali sami pod odborným dohledem. Randomizace byla stratifikována podle geografického regionu a subtypu RS.
Roční počet relapsů byl definován jako počet relapsů onemocnění za rok podle předem specifikovaných kritérií. K sekundárním cílovým ukazatelům patřily potvrzené zhoršení disability za tři měsíce, potvrzené zhoršení disability za šest měsíců a zmírnění disability během šesti měsíců. Pro předem specifikované metaanalýzy těchto parametrů byla použita data z obou studií. Sekundární cílové ukazatele týkající se MRI zahrnovaly počet Gd enhancujících T1 lézí na MRI, počet nových nebo rozšiřujících se T2 lézí na MRI za rok a roční míru ztráty mozkové tkáně. Hodnoceným biomarkerem (rovněž sekundární ukazatel) byla koncentrace lehkých řetězců neurofilament v séru ve třetím měsíci. Průzkumné sekundární parametry zahrnovaly souvislost mezi koncentracemi lehkých řetězců neurofilament v séru na počátku studie a tvorbou nových nebo rozšiřujících se T2 lézí nebo ztrátou mozkové tkáně.
Výsledky
Od října 2016 do března 2018 bylo do studií zahrnuto celkem 1 882 pacientů z 385 míst v 37 zemích. Medián času setrvání ve studiích činil 1,6 roku, přibližně 30 % pacientů zůstalo déle než dva roky. Demografické charakteristiky a charakteristiky onemocnění byly podobné v obou studiích i studijních skupinách. Studii ASCLEPIOS I dokončilo 89,5 % pacientů ve větvi s ofatumumabem a 81,4 % pacientů ve větvi s teriflunomidem. Ve studii ASCLEPIOS II to bylo 82,5 %, resp. 82,1 % pacientů.
Roční počet relapsů ve studii ASCLEPIOS I činil u ofatumumabu 0,11 a u teriflunomidu 0,22 (rozdíl –0,11; 95% interval spolehlivosti [CI] –0,16 až –0,06; p < 0,001). Ve druhé studii byly hodnoty 0,10 a 0,25 (rozdíl –0,15; 95% CI –0,20 až –0,09; p < 0,001).
V metaanalýze obou studií byl
podíl pacientů (odhad podle Kaplanovy–Meierovy analýzy
ve 24. měsíci) s potvrzeným zhoršením disability
za tři měsíce 10,9 % pro skupinu s ofatumumabem a 15 %
pro teriflunomid (poměr rizik [HR] 0,66; 95% CI 0,50–0,86;
p = 0,002).
Podíl pacientů s potvrzeným zhoršením disability za šest
měsíců činil 8,1 % pro ofatumumab a 12 % pro
teriflunomid (HR 0,68; 95% CI 0,50–0,92; p = 0,01).
Odpovídající podíl pacientů se zmírněnou disabilitou v šestém
měsíci v obou studiích byl 11 % ve skupině
s ofatumumabem a 8,1 % ve skupině s teriflunomidem
(HR 1,35; 95% CI 0,95–1,92; p = 0,09),
graf 1A–C. Efekt
ofatumumabu na potvrzenou zhoršenou disabilitu byl konzistentní
napříč oběma studiemi, stejně tak nebyl zaznamenán
signifikantní rozdíl mezi skupinami v případě potvrzeného
zmírnění disability.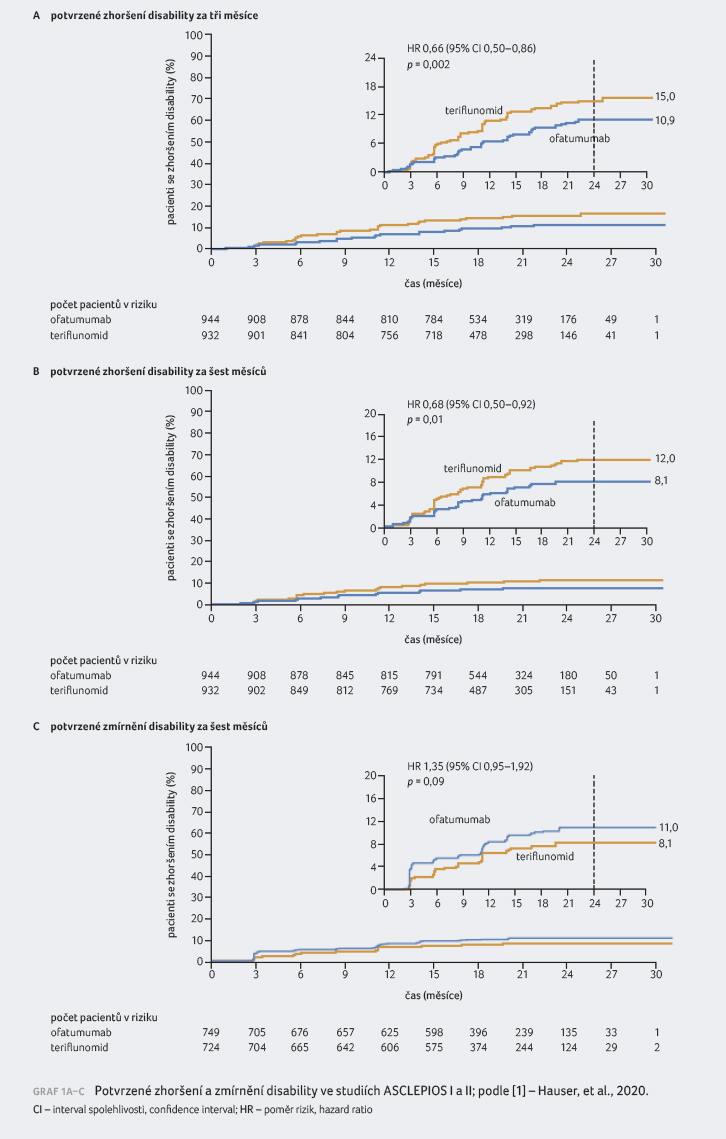
Ve studii ASCLEPIOS I činil průměrný počet Gd enhancujících T1 lézí 0,01 pro ofatumumab a 0,45 pro teriflunomid (97% pokles počtu lézí pro ofatumumab; p < 0,001). Ve studii ASCLEPIOS II byly odpovídající hodnoty 0,03, resp. 0,51 (94% pokles pro ofatumumab; p < 0,001). Průměrný počet nových nebo rozšiřujících se T2 lézí byl v první studii 0,72 v ofatumumabové větvi a 4,00 v teriflunomidové větvi (82% pokles počtu lézí pro ofatumumab; p < 0,001); korespondující hodnoty ve druhé studii byly 0,64, resp. 4,15 (85% pokles pro ofatumumab; p < 0,001). U sekundárního parametru roční míry ztráty mozkové tkáně nebyl zaznamenán signifikantní rozdíl mezi ofatumumabovou a teriflunomidovou skupinou (–0,28 % pro ofatumumab a –0,35 % pro teriflunomid ve studii ASCLEPIOS I; –0,29 % pro ofatumumab a –0,35 % pro teriflunomid ve studii ASCLEPIOS II).
Koncentrace lehkých řetězců neurofilament v séru byla ve studii ASCLEPIOS I snížena u ofatumumabu oproti teriflunomidu o 7 % ve třetím měsíci (p = 0,01), o 27 % ve 12. měsíci a o 23 % ve 24. měsíci. Odpovídající rozdíly ve studii ASCLEPIOS II byly 11 % (p < 0,001), 26 % a 24 %.
Bezpečnostní
profil
Nežádoucí účinky objevivší se
do 100 dnů po podání poslední dávky studijní
medikace, závažné nežádoucí účinky zaznamenané do poslední
návštěvy posledního pacienta ve studii, nežádoucí reakce
vedoucí k přerušení léčby a úmrtí shrnuje tabulka 2. V kombinované analýze hlásilo nežádoucí
účinek v ofatumumabové skupině 791 z 946 pacientů
(83,6 %) v porovnání se 788 z 936 pacientů (84,2 %)
v teriflunomidové skupině. Mezi nežádoucí účinky, které
se objevily alespoň u 10 % pacientů léčených
ofatumumabem, patřily reakce spojené s injekčním podáním,
nazofaryngitida, bolest hlavy, reakce v místě vpichu, infekce
horních cest dýchacích, infekce močových cest. Nežádoucími
účinky, které se objevily u minimálně 10 % pacientů
léčených teriflunomidem, byly nazofaryngitida, reakce spojené
s injekčním podáním, alopecie, infekce horních cest
dýchacích, bolest hlavy, diarea. Závažné nežádoucí reakce
byly hlášeny u 9,1 % pacientů léčených ofatumumabem
a u 7,9 % pacientů léčených teriflunomidem. Jedno
úmrtí bylo zaznamenáno ve skupině s teriflunomidem
(disekce aorty) během poléčebného follow up období.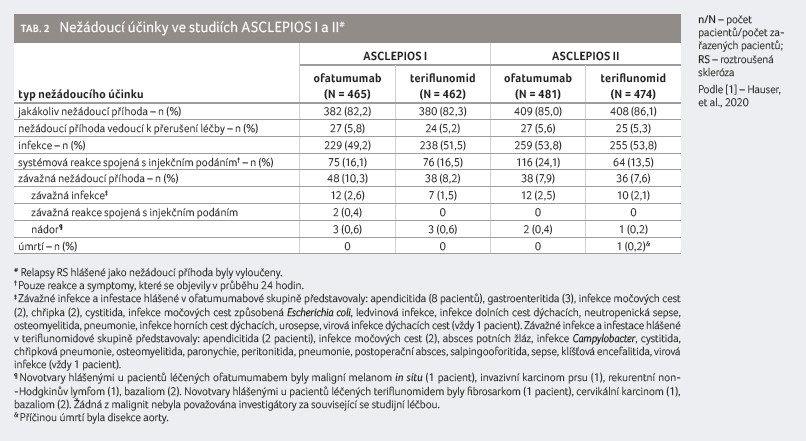
Závěr
V obou souběžně vedených aktivně kontrolovaných studiích ASCLEPIOS I a II s pacienty s relabující RS byla léčba ofatumumabem a teriflunomidem spojena se snížením počtu relapsů. Počet relapsů byl však signifikantně nižší u ofatumumabu v porovnání s teriflunomidem, a to v obou studiích. V předem specifikované analýze obou klinických hodnocení byl podíl se zhoršením disability za tři, resp. za šest měsíců nižší při léčbě ofatumumabem oproti teriflunomidu, v kritériu zmírnění disability za šest měsíců však nebyl zaznamenán signifikantní rozdíl mezi oběma skupinami.
Ofatumumab rovněž prokázal superioritu v případě lezionální aktivity na MRI a snížil koncentrace lehkých řetězců neurofilament v séru. Mezi léčbou ofatumumabem a teriflunomidem nebyl doložen signifikantní rozdíl ve zmírnění ztráty mozkové tkáně, v této oblasti jsou třeba další analýzy.
Při podání ofatumumabu byla zaznamenána vyšší frekvence systémových reakcí spojených s injekční aplikací, především u úvodní injekce, v porovnání s placebem. Ke zhodnocení dlouhodobého efektu léčby ofatumumabem jsou třeba další rozsáhlejší studie porovnávající tento lék také s jinou chorobu modifikující terapií.
Redakčně zpracovala PhDr. Nikola Homolová Richtrová
Seznam použité literatury
- [1] Hauser SL, Bar‑Or A, Cohen JA, et al. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med 2020; 383: 546–557.