Okrelizumab – přínos pětileté léčby
Okrelizumab, humanizovaná monoklonální protilátka, která cílí na CD20+ B lymfocyty a způsobuje jejich selektivní depleci, již prokázala v terapii roztroušené sklerózy (RS) svoji efektivitu. Léčba okrelizumabem má k dispozici data prokazující její dlouhodobou účinnost a bezpečnost. Na posledním kongresu AAN (American Academy of Neurology), který hostila ve dnech 4.–10. května 2019 Filadelfie, byly v posterové sekci shrnuty výsledky follow‑up studií fáze III jak v léčbě relabující‑remitující RS, tak primárně progresivní RS.
Okrelizumab v léčbě relabující remitující roztroušené sklerózy
Ve dvou randomizovaných dvojitě zaslepených klinických hodnoceních fáze III OPERA I a II (NCT01247324, NCT01412333) prokázal okrelizumab superioritu v prevenci progrese disability v porovnání s interferonem β 1a u pacientů s relabující remitující RS. Snížení rizika potvrzené progrese (confirmed disability progression, CDP) jak ve 12. týdnu, tak ve 24. týdnu sledování dosahovalo 40 % (p < 0,001, resp. p = 0,003).
Hauser a kol. prezentovali
na kongresu data z následného tříletého sledování
pacientů ze studií OPERA I a II [1]. Po ukončení
dvojitě zaslepené fáze hodnocení mohli pacienti vstoupit
do otevřené extenze (obr. 1). Jejím cílem bylo sledovat dlouhodobou účinnost,
bezpečnost a snášenlivost okrelizumabu v léčbě
relabující remitující RS a dále zhodnotit efektivitu
u pacientů s časným zahájením terapie, tj. od počátku
dvojitě zaslepeného období (skupina OCR/OCR) oproti pacientům,
kteří byli léčeni okrelizumabem až po přechodu do otevřené
extenze (switch, skupina IFN/OCR).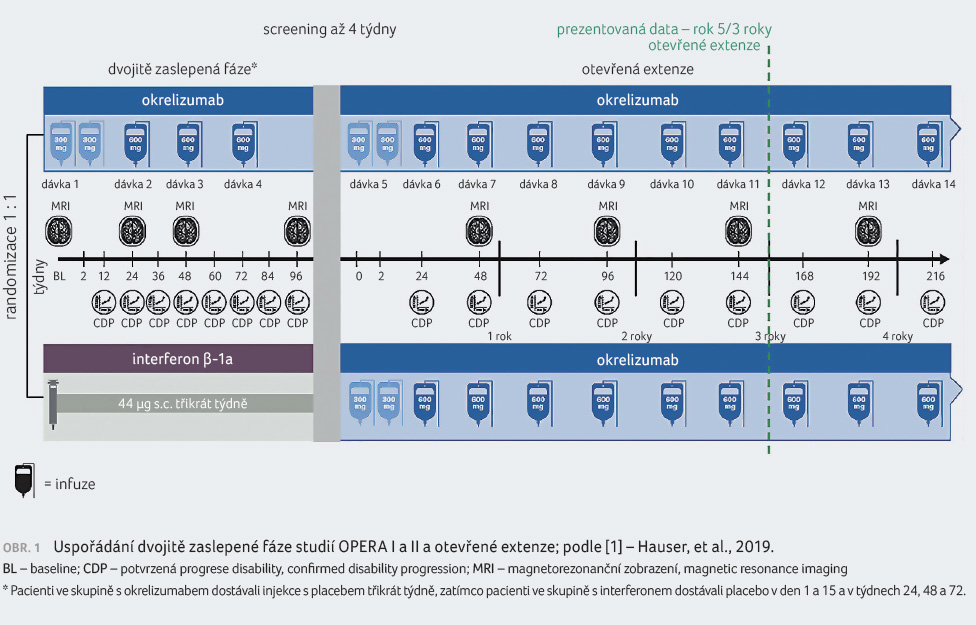
Celkem 94,4 % (623/660) pacientů ze skupiny IFN/OCR a 96,7 % (702/726) ze skupiny OCR/OCR, kteří dokončili počáteční dvojitě zaslepenou fázi, vstoupilo do otevřené extenze.
Jako cílové ukazatele byly stanoveny doba do 48týdenní CDP a složené CDP oproti počátku (baseline) trvající alespoň 48 týdnů. Potvrzená progrese disability byla definována jako vzestup skóre EDSS (Expanded Disability Status Scale), a to o ≥ 1 bod při počáteční hodnotě EDSS ≤ 5,5, nebo vzestup o ≥ 0,5 bodu v případě počáteční hodnoty EDSS > 5,5. Jako složená CDP byl označen vzestup skóre EDSS a minimálně 20% vzestup v testu jemné motoriky horních končetin (9 Hole Peg Test, 9HPT) nebo 20% vzestup v testu chůze na 25 stop (Timed 25 Foot Walk, T25FW).
Z pacientů, kteří vstoupili do otevřené extenze, dokončilo celkem pět let sledování 88,4 % (551/623) ve skupině IFN/OCR a 88,7 % (623/702) ve skupině OCR/OCR. V rámci dvojitě zaslepené fáze snížila léčba okrelizumabem riziko CDP při sledování skóre EDSS (48. týden) o 57 % (p < 0,001), v parametrech minimálně 20% nárůstu hodnot 9HPT (p = 0,07) a T25FW o 58 %, resp. 49 % (p < 0,01). V případě složené CDP redukoval okrelizumab riziko o 52 % (p < 0,001).
Přínos okrelizumabu hodnocený pomocí
potvrzené progrese a dokumentovaný ve dvojitě zaslepené
fázi byl v rámci tříleté otevřené extenze zachován. Bylo
zjištěno, že u pacientů, kteří byli okrelizumabem léčeni
od počátku sledování, tedy v porovnání s pacienty,
kteří přešli na léčbu okrelizumabem až po dvou
letech (switch při vstupu do otevřené extenze), byl přínos
léčby u této skupiny zachován i po dobu dalších
tří let otevřené fáze sledování (graf 1).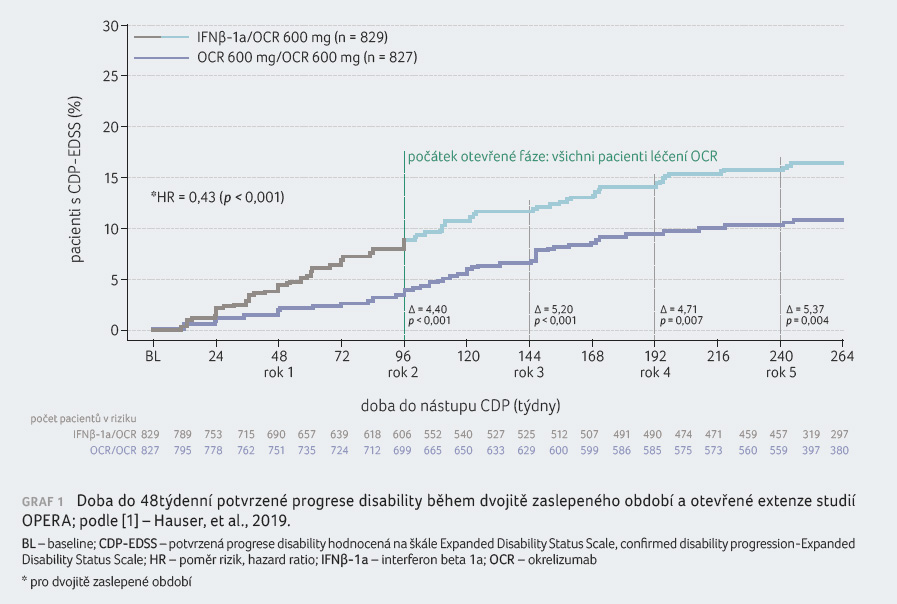
Okrelizumab v léčbě primárně progresivní roztroušené sklerózy
Účinnost a bezpečnost léčby okrelizumabem u pacientů s primárně progresivní RS hodnotila ve třetí fázi klinického hodnocení studie ORATORIO (NCT01194570). V rámci dvojitě zaslepeného uspořádání redukoval okrelizumab riziko 48týdenní CDP o 29 % (p = 0,018), 48týdenní CDP v parametru 9HPT o 50 % (p < 0,001), u T25FW o 27 % (p = 0,010) a v případě složené CDP o 29 % (p = 0,002).
Cílem follow up s celkovou
délkou sledování 5,5 roku [2] bylo zhodnotit efekt na progresi
disability při přechodu na léčbu okrelizumabem (switch
po dvojitě zaslepené fázi) nebo při jejím časném zahájení
(obr. 2).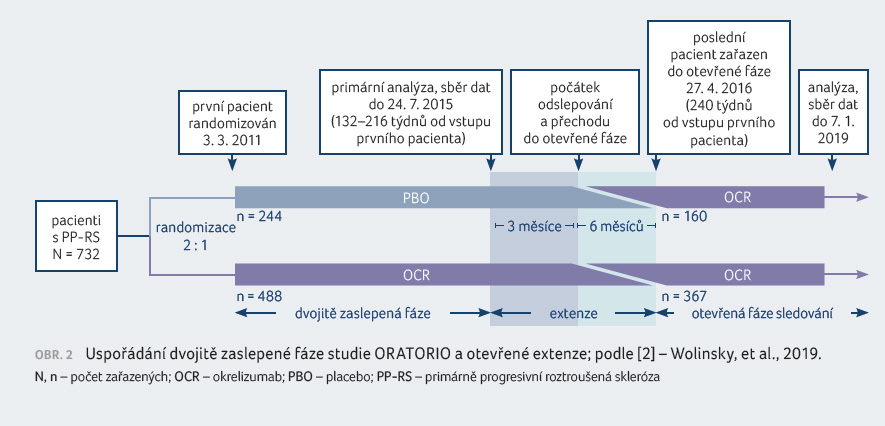
Celkem 72 % (527/732) pacientů vstoupilo do otevřené extenze studie. K hodnocení účinnosti byly opět zavzaty 48týdenní doba do nástupu CDP a složené CDP zachované po dobu alespoň 48 týdnů. Sledovanými ukazateli byly podobně jako ve studiích OPERA zhoršení EDSS (o ≥ 1 bod při počáteční hodnotě EDSS ≤ 5,5, nebo o ≥ 0,5 bodu v případě počáteční hodnoty EDSS > 5,5), 9HPT a T25FW (alespoň 20% vzestup oproti baseline).
Dvanáct týdnů poté, co první pacienti vstoupili do otevřené extenze (týden 168), a až po 5,5 roku follow up (týden 264) si pacienti ve skupině placebo–okrelizumab, resp. okrelizumab od počátku sledování, vedli takto:
48týdenní CDP v parametru EDSS byla zaznamenána u 44,4 % vs. 30,5 % a u 53,1, % vs. 43,7 % pacientů;
48týdenní CDP v parametru 9HPT byla zachycena u 27,9 % vs. 15,8 % a u 34,2 % vs. 22,7 % pacientů;
48týdenní CDP v parametru T25FW byla potvrzena u 55,4 % vs. 42,7 % a u 62,6 % vs. 51,5 % pacientů;
48týdenní
složené CDP dosáhlo 68,0 % vs. 50,4 % a 73,8 % vs.
61,2 % pacientů (graf 2).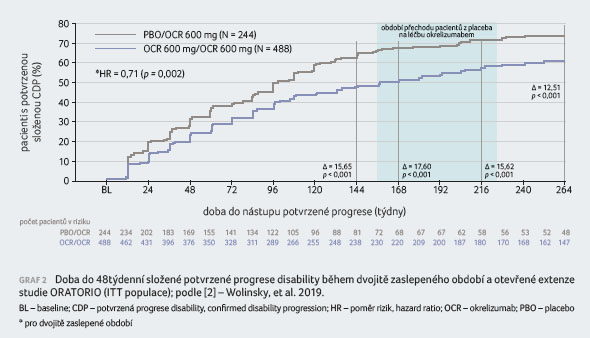
ORATORIO představuje první klinickou studii u pacientů s primárně progresivní RS, která doložila trvalý přínos léčby okrelizumabem po dobu 5,5 roku z hlediska měřené progrese disability. Přínos léčby v otevřené extenzi byl konzistentní s daty z dvojitě zaslepeného období. Analýzy naznačují, že efekt okrelizumabu na 48týdenní CDP byl výraznější než na 12týdenní a 24týdenní CDP, pravděpodobně v důsledku vyšší specificity potvrzení kumulace disability. V souladu s dalšími výsledky se rovněž ukazuje v míře postižení výhoda pro pacienty s časnou a kontinuální léčbou okrelizumabem.
Redakčně zpracovala PharmDr. Kateřina Viktorová
Komentář: Okrelizumab – přínos pětileté léčby
Doc. MUDr. Radomír Taláb, CSc.
MS Centrum Teplice, K.Z., a.s.; Neurologická klinika LF UK a FN v Plzni
Na kongresu AAN (American Academy of Neurology) 2019 byly poprvé prezentovány dlouhodobé ‒ 5,5leté ‒ výsledky účinnosti a bezpečnosti léčby okrelizumabem.
Výjimečnost postavení okrelizumabu v léčbě roztroušené sklerózy (RS) prokázaly již výsledky fáze III klinických studií OPERA I a II a ORATORIO. Citované studie doložily signifikantní účinnost nejen u relabující remitující formy RS (RR RS), ale poprvé také u pacientů s primárně progresivní formou RS (PP RS). V dlouhodobém profilu hodnocení účinnosti léčby byl vybrán zásadní parametr, tj. ovlivnění stupně disability, posuzovaný v definovaném časovém období 48 týdnů, a to jak v případě RR RS, tak PP RS. V tomto kontextu je však nutno připomenout, že primárním cílovým ukazatelem studií OPERA I a II byl roční počet relapsů (annual relapse rate, ARR), sekundární cílové ukazatele představovaly hodnocení podílu pacientů s progresí disability, s kumulativním počtem gadolinium enhancujících lézí, počet nových nebo zvětšujících se lézí na magnetické rezonanci (MRI) mozku a procentní změna mozkového objemu v definovaném intervalu.
Hodnota ARR činila v obou fázích studií OPERA I a II ve skupině pacientů léčených okrelizumabem 0,16 oproti 0,29 u pacientů léčených IFNβ 1a. Podíl pacientů s hodnotou nejméně 2,0 na škále EDSS (Expanded Disability Status Scale) na počátku, kteří dosáhli parametrů NEDA 3 (No Evidence of Disease Activity) a následně NEPAD (No Evidence of Progression or Active Disease), tj. bez progrese disability hodnocené po 12 nebo 24 týdnech, byl ve skupině osob léčených okrelizumabem 47,9 % (OPERA I) a 47,5 % (OPERA II) oproti nemocným ve skupině léčené IFNβ 1a: 29,2 % (OPERA I) a 25,1 % (OPERA II) [1,2].
Většina pacientů ze studií OPERA I a II (94,4 % a 96,7 %) vstoupila do otevřené fáze, kde jeden z cílových ukazatelů hodnocení účinnosti léčby v dlouhodobém profilu více než pěti let představovala potvrzená míra disability (confirmed disability progression, CDP) ve 48týdenním intervalu. Potvrzená progrese disability byla již všeobecně standardizována v klinických studiích jako parametr hodnocení klinické účinnosti léčby. CDP je definována jako zvýšení EDDS o 1 bod a více při počáteční hodnotě EDSS do 5,5 anebo zvýšení o 0,5 bodu v případě počátečního EDSS 5,5. Zásadní je hodnocení v definovaném intervalu 12 nebo 24 nebo 48 týdnů ve dvojitě zaslepené i otevřené extenzní fázi klinické studie. Metodou přesnějšího posouzení progrese disability bylo hodnocení stupně disability EDSS v kombinaci s testem jemné motoriky ruky (9 Hole Peg Test, 9HPT) a testem chůze na vzdálenost 25 stop (Timed 25-Foot Walk, T25FW). Aplikace této tzv. složené CDP hodnotí CDP v kombinaci s minimálně 20% vzestupem v testu 9HPT nebo s 20% vzestupem hodnoty v testu T25FW. Kombinace vyšetření významně zvyšuje senzitivitu hodnocení míry disability velmi blízké klinické praxi. Zejména v případě testu chůze na 25 stop, který je snadno použitelný v běžné klinické praxi.
V tomto kontextu je nutno podtrhnout hodnocení CDP i složené CDP již v zaslepené fázi studií OPERA I a II. Bylo zaznamenáno signifikantní snížení CDP ve skupině pacientů léčených okrelizumabem o 57 % (p < 0,001) a v parametrech složené CDP redukoval okrelizumab riziko CDP o 52 % (p < 0,001). V případě léčby RR RS je historicky převratná míra účinnosti okrelizumabu na stupeň disability v rámci porovnání účinnosti jednotlivých léčivých přípravků na RS. Výsledky dalších pěti let monitorování v rámci otevřené fáze klinické studie podtrhují dlouhodobý profil účinnosti okrelizumabu prezentovaný v grafu 1 komentovaného článku. Účinnost okrelizumabu nejen ve zmíněném parametru progrese disability, ale i konzistentní bezpečnostní profil byly potvrzeny vyhodnocením dat z pětiletého sledování v rámci extenze studií OPERA I a OPERA II.
V klinické studii ORATORIO byli randomizováni v poměru 2 : 1 pacienti s PP RS k léčbě okrelizumabem nebo placebem. Dvojitě zaslepená fáze studie byla naplánována na 120 týdnů, tj. celkem pětkrát aplikace 600 mg okrelizumabu.
Primárním cílovým ukazatelem studie ORATORIO bylo hodnocení CDP po 12 týdnech. Mezi další cílové ukazatele této studie patřily: podíl pacientů s progresí disability potvrzenou po 24 týdnech, vývoj v testu T25FW, dále na MRI mozku změna objemu T2 lézí, změna objemu mozku, dále změna skóre fyzické komponenty dotazníku SF 36 (36 Item Short Form Survey). Vše bylo hodnoceno na začátku studie a ve 120. týdnu, a to jen v případě, že statistická významnost byla vyšší než 0,05 [3].
Riziko progrese disability bylo ve studii ORATORIO po 12 nebo 24 týdnech ve skupině léčené okrelizumabem sníženo o 24 a 29,6 % oproti skupině léčené placebem. V klinickém testu chůze T25FW bylo riziko zhoršení o 29,3 % nižší u skupiny léčené okrelizumabem oproti skupině léčené placebem.
V následných analýzách byly opět aplikovány přesnější parametry hodnotící riziko progrese pacientů léčených tímto přípravkem, a to složenou CDP po 48 týdnech. Již v rámci dvojitě zaslepené fáze studie, jak je uvedeno v článku, redukoval okrelizumab trvale složenou CDP o 29 % (p = 0,002), 48týdenní složenou CDP v parametru 9HPT o 50 % (p < 0,001) a v parametru T25FW o 27 % (p = 0,010). Tento přesnější parametr by měl lépe zachytit a odlišit od sebe krátkodobou a skutečně trvalou progresi, což dokumentují data z hodnocení po 5,5 roku, tedy společně s otevřenou fází klinické studie, kde byli také pacienti, jimž bylo původně podáváno placebo, léčeni okrelizumabem. Tento switch a další tři roky monitorování umožnily u PP RS posoudit míru CDP ve vztahu k časnému nebo pozdnímu zahájení léčby okrelizumabem. Z prezentovaných výsledků vyplývá, že časné zahájení léčby jistě predikuje příznivější vývoj PP RS v základním parametru CDP. Dlouhodobá data však potvrzují nejen dlouhodobě pozitivní stabilní účinnost léčby okrelizumabem při jejím časném zahájení, ale rovněž u definované klinicky manifestní formy PP RS. Podíly pacientů, kteří dosáhli parametru 48týdenní CDP, se k sobě přiblížily při porovnání 168. týdne (44,4 % vs. 30,5 %) s 264. týdnem (53,1 % vs. 43,7 %), rovněž tak ve 48týdenní složené CDP (68 % vs. 50,4 %; 73,8 % vs. 61,2 %). Lze konstatovat, že switch na léčbu okrelizumabem u pacientů s placebem v dlouhodobém výsledku redukoval podíl nemocných, kteří dosáhli parametrů 48týdenní CDP i složené CDP. Tato skutečnost by mohla být nepochybně argumentem pro regulatorní orgány při formulování kritérií úhrady okrelizumabu pro pacienty s PP RS, zejména v prvních letech od registrace tohoto léčivého přípravku.
Okrelizumab je prvním léčivým přípravkem v Evropské unii (EU) určeným k léčbě pacientů s PP RS. Registrace v EU odpovídá zařazení do skupiny léčivých přípravků modifikujících onemocnění (disease modifying drugs, DMDs) u RS. Zařazení okrelizumabu do klinické praxe představuje novou dimenzi v léčbě RS, zejména vzhledem k indikaci okrelizumabu k léčbě RR i PP formy RS. Nezbytná je rovněž správná identifikace fáze PP RS podle McDonaldových kritérií z roku 2017 [4] zohledňující účinnost nejen v časné fázi PP RS. Možnost rozšířeného užití okrelizumabu jak pro naivní pacienty s RS, tak například v případě přechodu z jiného léčivého přípravku na okrelizumab vychází z klinické praxe.
Literatura
[1] Hauser SL, Bar Or A, Comi G, et al, for the OPERA I and OPERA II Clinical Investigators. Ocrelizumab versus Interferon Beta 1a in Relapsing Multiple Sclerosis. N Engl J Med 2017; 376: 221‒234.
[2] Kubala Havrdová E. Ocrelizumab v léčbě roztroušené sklerózy. Neurol praxi 2017; 18: 287‒290.
[3] Montalban X, Hauser SL, Kappos L, for the ORATORIO Clinical Investigators. Ocrelizumab versus Placebo in primary progressive Multiple Sclerosis. N Engl J Med 2017; 376: 209‒220.
[4] Thompson AJ, Banwell BL, Barkhof F, et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald kriteria. Lancet Neurol 2018; 17: 162‒173.
Seznam použité literatury
- [1] Hauser SL, Kappos K, Montalban X, et al. Long‑Term Reduction in 48‑Week Confirmed Disability Progression After 5 Years of Ocrelizumab Treatment in Patients With Relapsing Multiple Sclerosis. 71st AAN Annual Meeting May 4‑10 2019 Philadelphia, Poster No. P3,2‑054.
- [2] Wolinsky JS, Kappos L, Montalban X, et al. Reduction in 48‑Week Confirmed Disability Progression After 5.5 Years of Ocrelizumab Treatment in Patients With Primary Progressive Multiple Sclerosis. 71st AAN Annual Meeting May 4‑10 2019 Philadelphia, Poster No. P3,2‑031.