Okrelizumab v léčbě roztroušené sklerózy – pohled neurologa a imunologa
Souhrn:
Roztroušená skleróza představuje nejčastější imunopatologické onemocnění centrálního nervového systému a zároveň nejčastější neurologickou příčinu invalidity mladých osob v našem regionu. První lék se schopností modifikovat průběh atakovité (relabující‑remitující) formy choroby – interferon beta ‒ byl uveden do praxe v roce 1993. V současnosti zahrnuje skupina těchto léčiv více než deset přípravků a jejich řada se stále rozrůstá. Dosud posledním registrovaným přípravkem je monoklonální protilátka okrelizumab (Ocrevus), který jako první lék prokázal jednoznačný efekt také u primárně progresivní formy roztroušené sklerózy. Článek podává základní informace o účinnosti, bezpečnosti a indikacích k léčbě okrelizumabem u roztroušené sklerózy, včetně prvních zkušeností a důležitých otázek z klinické praxe.
Key words: multiple sclerosis, relapse, primary progressive form, treatment, ocrelizumab
Summary:
Multiple sclerosis is the most frequent immunopathological disease of the central nervous system and also the most frequent neurological condition leading to the disability of young people in our region. First disease‑modifying drug treating the relapsing‑remitting form of the disease – interferon beta ‒ was introduced in 1993. Currently, the group of these drugs comprises more than ten medications and is still growing. The last registered drug is a monoclonal antibody ocrelizumab (Ocrevus) that, for the first time, proved to be effective also in the primary progressive form of multiple sclerosis. The article provides fundamental information about the efficacy, safety and indications of ocrelizumab treatment in multiple sclerosis, including initial experiences and important questions from the clinical practice.
Úvod
Roztroušená skleróza (RS) představuje autoimunitní imunopatologický proces v centrálním nervovém systému (CNS) charakterizovaný přítomností zánětu se zastoupením většiny složek přirozené i získané imunity a neoddělitelně také trvalým poškozením nervových vláken – neurodegenerací. Onemocnění se klinicky rozvíjí prvními příznaky nejčastěji mezi 20.‒40. rokem života, nicméně lze předpokládat, že autoimunitní proces probíhá v CNS již delší dobu před samotnými klinickými příznaky. To naznačují sledování pacientů s náhodně odhalenými magnetickorezonančními (MR) a likvorologickými nálezy typickými pro RS bez přítomnosti klinických příznaků. U těchto pacientů lze očekávat rozvoj symptomatického onemocnění zhruba ve třetině případů v následujících pěti letech [1].
U 85 % pacientů se RS projevuje nejprve výskytem akutních, řádově v hodinách až dnech se vyvíjejících příznaků, které označujeme jako relaps (ataka) onemocnění. Jeho ekvivalentem je akutní zánětlivé ložisko v CNS s odpovídajícími klinickými příznaky – poruchou vizu, poruchou hybnosti, poruchou citlivosti nebo brněním, poruchou rovnováhy a jinými. Relaps je následován různě dlouhým obdobím remise. Jedná se o typickou úvodní formu nemoci nazývanou relabující remitující RS (RR RS). Menšina pacientů (10 %) nezaznamená výskyt akutních příznaků, ale postupně si řádově v měsících až letech začíná uvědomovat narůstající neurologické omezení zejména ve smyslu poruchy chůze, stability a sfinkterových obtíží. V tomto případě se jedná o primárně progresivní formu RS (PP RS). Postupné zhoršování neurologické invalidity bez přítomnosti relapsů se může individuálně po různě dlouhé době a v závislosti na včasnosti a správné volbě léčby objevit také u RR RS. V tomto případě však hovoříme o sekundárně progresivní RS (SP RS), ke které dochází u 60‒70 % pacientů s původně RR RS v horizontu 10‒25 let [2].
Imunopatologické procesy, které jsou příčinou PP RS, nejsou zatím uceleně popsány. Je zvažována chronická aktivace mikroglií. Ve hře je pravděpodobně i zvýšený oxidační stres jak v neuronech, tak v dalších buněčných strukturách CNS. Mitochondrie lokalizované v axonálních výběžcích neuronů jsou ve zvýšené míře poškozeny v procesu demyelinizace, nedokáží zajistit zvýšenou potřebu energie v takto poškozených okrscích CNS a dochází k rychlejší ztrátě axonů. Pro formu PP RS je v porovnání s RR RS charakteristická difuzní neuropatologie. Častěji se v ní objevují kortikální léze a známky zánětu na meningách, včetně tvorby ektopických lymfatických folikulů [3].
B lymfocyty jako integrální součást poškozujícího zánětu u nemocných s RS
Roztroušená skleróza je jednoznačně multifaktoriální onemocnění s určitou genetickou predispozicí, která není příliš výrazná. Z neznámých příčin, pravděpodobně pod vlivem faktorů vnějšího světa, mezi něž patří zřejmě některé virové infekce, dochází k prolomení homeostatických regulací imunitní soustavy. Výsledkem je poškozující zánět, jehož cílem jsou především obalové struktury nervových vláken. Jsou definovány hlavní terče této autoreaktivity, mezi něž patří např. myelinový bazický protein (myelin basic protein, MBP). Na základě rozsáhlých experimentálních i klinických výzkumů je v současné době obecně přijímáno, že ústřední úlohu v poškozujícím zánětu u nemocných s RS sehrávají abnormálně funkčně polarizované subsety T lymfocytů Th1 a Th17, které podle stávajícího konceptu považujeme za klíčovou součást poškozujícího zánětu. Ztráta homeostatických regulací je charakterizována nižší aktivitou subsetu regulačních T lymfocytů (Treg). Tento koncept je nepochybně alespoň zčásti pravdivý. Důkazem jsou účinné léčebné zásahy používané již řadu let k léčbě RR RS, které jsou založeny především na modulaci T lymfocytární imunity. Bylo překvapením, když před několika lety klinické experimenty prokázaly výbornou účinnost léčebných zásahů zprostředkovaných biologickou terapií cílící na B lymfocyty. Konkrétně se jedná o použití monoklonálních protilátek reagujících s molekulou CD20 B lymfocytů. Tyto nové poznatky přinesly zcela nový pohled na imunopatogenetické mechanismy podílející se na vzniku a rozvoji RS [4].
Již desítky let je známo, že v likvoru nemocných s RS je možné detekovat tzv. oligoklonální pásy imunoglobulinů. Průkaz těchto oligoklonálních imunoglobulinů v likvoru je považován za dobrý pomocný diagnostický ukazatel u nemocných s RS. Jejich přítomnost v likvoru a další nálezy, jako je např. transkriptom B lymfocytů, jasně ukazují na intratekální syntézu těchto protilátek. Přes dlouholeté úsilí nebyly nalezeny interpretačně významné terče těchto oligoklonálních protilátek. Většina z nich reaguje s různými strukturami CNS. To je interpretováno buď jako epifenomén, který ukazuje na imunitní odpověď na poškozené struktury mozku, nebo je přítomnost těchto protilátek vykládána jako jeden z mechanismů, jakými se imunitní systém podílí na „úklidu“ v kompartmentu CNS. Nyní by bylo chybné tvrdit, že protilátková aktivita v CNS u nemocných s RS je pouhý epifenomén. Jsou jasné důkazy o tom, že autoprotilátky se váží na strukturní elementy v mozku, např. na myelinové pochvy, oligodendrocyty, astrocyty. Byla prokázána kolokalizace protilátek a aktivovaných složek komplementového systému a také cytotoxických buněk. Oba tyto mechanismy jsou prokazatelně zapojeny do efektorových fází poškozujícího zánětu u nemocných s RS. Je pravděpodobnější, že aktivní zapojení B lymfocytů do poškozujícího zánětu u nemocných s RS je komplexnější a B lymfocyty se nepochybně podílejí i na iniciačních fázích poškozujícího zánětu. B lymfocyty totiž prokazatelně slouží jako mimořádně efektivní buňky, které jsou schopny identifikovat vzory DAMP/PAMP (signály vnitřního poškození/signály vnějšího poškození, damage associated molecular patterns/pathogen associated molecular patterns) prostřednictvím receptorů PRR (pattern recognition receptors), např. TLR (toll like receptors), internalizovat je a nitrobuněčně zpracovat. Vzniklé antigenní peptidy prezentují v kontextu molekul HLA (human leukocyte antigens) T lymfocytárnímu systému. Mohou se tedy jednoznačně podílet na aktivaci, klonální expanzi a funkční polarizaci autoreaktivních T lymfocytů ve strukturách CNS. B lymfocyty jsou vydatným zdrojem prozánětlivých cytokinů a chemokinů. Jejich prostřednictvím jsou zapojeny do samotné buněčné organizace poškozujícího zánětu u nemocných s RS. Poskytují také růstové faktory a antiapoptotické podněty nutné pro přežívání imunitních buněk, které jsou součástí poškozujícího zánětu u nemocných s RS.
U primárně progresivní formy RS byly post mortem prokázány zorganizované tzv. terciární lymfatické struktury na meningách těchto pacientů. Terciární lymfatické struktury jsou typicky přítomny u všech zkoumaných imunopatologických onemocnění, např. u revmatoidní artritidy, aterosklerózy, různých vaskulitid, máme li jmenovat pouze některá z nich. Přesto v případě RS, považované za T lymfocytární imunopatologii s klíčovým podílem subsetů Th1 a Th17, byl nález těchto struktur překvapením. Je otázkou, zda terciární lymfatické struktury nejsou rovněž přítomny v CNS nemocných s RR RS. Důkazy je však pro tuto formu obtížné přinést. Terciární lymfatické struktury jsou místem lokální odpovědi B lymfocytů na antigenní podněty. V těchto strukturách jsou přítomny folikulární dendritické buňky a také folikulární T lymfocyty Tfh, poskytující nejúčinnější regulační podporu B lymfocytům stimulovaným antigenem. B lymfocyty v nich po antigenní stimulaci klonálně expandují a terminálně diferencují do buněk, které tvoří imunoglobuliny. Absolutní důkazy o zapojení B lymfocytů do patogeneze RS získáváme z klinicky prokázaného pozitivního efektu biologické terapie cílící specificky na B lymfocyty reprezentované zejména protilátkami zamířenými na molekulu CD20, ale také z použití alemtuzumabu (anti CD52). Molekula CD52 je vyjádřena na řadě buněčných elementů imunitní soustavy, včetně B lymfocytů. Aplikace anti CD52 velmi výrazně ovlivňuje právě B lymfocytární systém [5].
Diferenciace B lymfocytů odráží změny membránové výbavy
Zatímco vývoj T lymfocytů probíhá v thymu, vývoj B lymfocytů se celý uskutečňuje v kostní dřeni. Velmi brzy v průběhu diferenciace exprimují prekurzory B lymfocytů membránový znak CD19, který je specifický pro B lymfocytární větev. V postupných dalších krocích, které probíhají bez přítomnosti antigenu, dochází ke komplexním změnám vyzrávajícího B lymfocytu. To se odráží na jeho imunobiologických vlastnostech. Postupně ztrácí znaky nezralosti a získává další B lymfocytární znaky, které si podrží až do stadia zralého B lymfocytu. Z těchto znaků můžeme zdůraznit především molekulu CD20, která bude předmětem bližší informace dále. Připomínáme však, že zralé B lymfocyty nesou řadu dalších specifických znaků pro B lymfocyty, jakými je např. CD21, CD22, CD23, CD24, CD37, CD40 a další.
Podstatné pro vývoj B lymfocytů je
uskutečnění tzv. přeskupení genových segmentů, které kódují
receptory pro antigen na B lymfocytech. Úspěšné přeskupení
genových segmentů vede k vyjádření receptoru pro antigen
BcR na B lymfocytu na povrchu buňky. Přítomnost receptorů
BcR definuje zralý B lymfocyt. Na této úrovni končí
na antigenu nezávislý vývoj B lymfocytů, který vede
k vytvoření ohromného repertoáru různých B lymfocytů
s různými specificitami receptorů BcR, jimiž budou
rozpoznávat antigenní podněty. Všechny zralé B lymfocyty
nesou panB lymfocytární znaky, mezi nimi také molekulu CD20.
Další vývoj probíhá pouze u těch B lymfocytů, které
rozpoznaly antigen, obdržely všechny další nutné podněty
od kooperujících buněk, především od T lymfocytu
subsetů Tfh a Th2. Výsledkem je klonální expanze antigenem
stimulovaných B lymfocytů, jejich další diferenciace, somatická
mutace a izotopové přepnutí, na jejichž konci je vznik
plazmatických buněk. K těmto procesům stimulovaným
antigenem dochází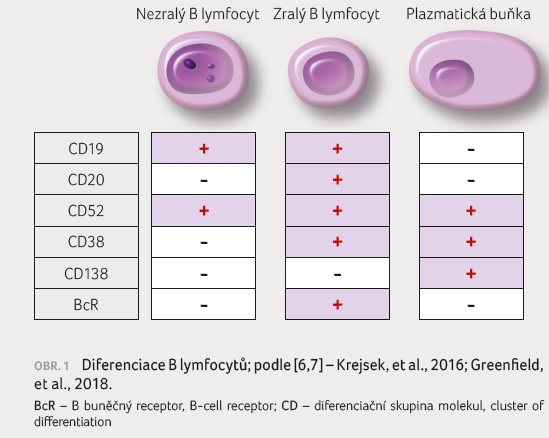 v sekundárních lymfatických orgánech,
především v lymfatických uzlinách, slezině a jistě
také v lymfoidní tkáni spojené se sliznicemi. V průběhu
této terminální diferenciace dochází k rozsáhlým změnám
imunobiologických vlastností B lymfocytů, které můžeme
sledovat např. prostřednictvím změny membránových molekul.
Velmi zjednodušeně lze konstatovat, že panB lymfocytární
znaky vyjádřené na zralých B lymfocytech, včetně CD20,
jsou postupně ztráceny a na plně diferencovaných
plazmatických buňkách se již tyto membránové struktury
nevyskytují. Plazmatické buňky naopak získávají jinou
membránovou výbavu, která je pro ně typická. K primární
protilátkové odpovědi dochází i v terciárních
lymfatických strukturách imunitní soustavy lokalizovaných
u nemocných s RS na meningách [6,7] (obr. 1).
v sekundárních lymfatických orgánech,
především v lymfatických uzlinách, slezině a jistě
také v lymfoidní tkáni spojené se sliznicemi. V průběhu
této terminální diferenciace dochází k rozsáhlým změnám
imunobiologických vlastností B lymfocytů, které můžeme
sledovat např. prostřednictvím změny membránových molekul.
Velmi zjednodušeně lze konstatovat, že panB lymfocytární
znaky vyjádřené na zralých B lymfocytech, včetně CD20,
jsou postupně ztráceny a na plně diferencovaných
plazmatických buňkách se již tyto membránové struktury
nevyskytují. Plazmatické buňky naopak získávají jinou
membránovou výbavu, která je pro ně typická. K primární
protilátkové odpovědi dochází i v terciárních
lymfatických strukturách imunitní soustavy lokalizovaných
u nemocných s RS na meningách [6,7] (obr. 1).
Mechanismus účinku okrelizumabu
Okrelizumab (Ocrevus) je humanizovaná
monoklonální protilátka namířená proti antigenu CD20 [8]. Jedná
se o dosud poslední registrovaný přípravek v léčbě
RR RS a vůbec první lék s jednoznačně prokázanou
účinností u PP RS. Okrelizumab je rekombinantní
humanizovaná monoklonální protilátka podtřídy IgG1
[7]. Má v porovnání s chimérickými protilátkami,
např. s rituximabem, výhodné vlastnosti, které se projevují
např. ve snížené tvorbě neutralizujících protilátek
(obr. 2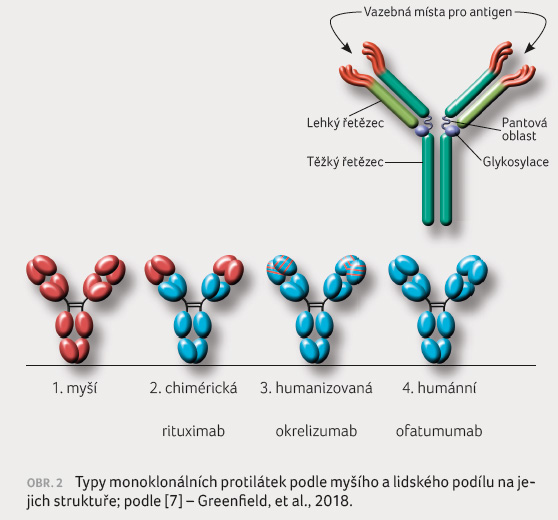 ).
V experimentech in
vitro i v klinických studiích bylo prokázáno,
že srovnatelné a možná i výhodnější vlastnosti
získávají monoklonální protilátky na základě manipulace
se složením aminokyselin v tzv. pantové oblasti a manipulací
s glykosylací v Fc části molekuly. Glykosylace je
proces, kdy je protein záměrně upravován vazbou cukerných
struktur (tzv. zbytků), které mohou významným způsobem
ovlivňovat jeho vlastnosti. Pantová oblast je část těžkého
řetězce imunoglobulinů, kde se rozvírá k Fab části a je
klíčová pro sterické (prostorové) uspořádání molekuly, která
určuje vazebné vlastnosti protilátky s antigenními epitopy.
Vhodnou úpravou cukerných zbytků na Fc části jsou cíleně
ovlivněny interakce navázané protilátky s receptory pro Fc
část IgG na cytotoxických buňkách, fagocytujících buňkách
a také určují aktivaci komplementu. Okrelizumab byl cíleně
konstruován tak, aby glykosylace molekuly byla v tomto ohledu
optimalizována [9].
).
V experimentech in
vitro i v klinických studiích bylo prokázáno,
že srovnatelné a možná i výhodnější vlastnosti
získávají monoklonální protilátky na základě manipulace
se složením aminokyselin v tzv. pantové oblasti a manipulací
s glykosylací v Fc části molekuly. Glykosylace je
proces, kdy je protein záměrně upravován vazbou cukerných
struktur (tzv. zbytků), které mohou významným způsobem
ovlivňovat jeho vlastnosti. Pantová oblast je část těžkého
řetězce imunoglobulinů, kde se rozvírá k Fab části a je
klíčová pro sterické (prostorové) uspořádání molekuly, která
určuje vazebné vlastnosti protilátky s antigenními epitopy.
Vhodnou úpravou cukerných zbytků na Fc části jsou cíleně
ovlivněny interakce navázané protilátky s receptory pro Fc
část IgG na cytotoxických buňkách, fagocytujících buňkách
a také určují aktivaci komplementu. Okrelizumab byl cíleně
konstruován tak, aby glykosylace molekuly byla v tomto ohledu
optimalizována [9].
Molekula CD20 je vyjádřena v průběhu diferenciace B lymfocytů již na nezralých stadiích těchto buněk. Exprese molekuly CD20 se v průběhu vyzrávání zvyšuje a dosahuje nejvyšší denzity na úrovni zralého, plně imunokompetentního B lymfocytu. Nevyskytuje se ani na kmenových buňkách krvetvorby, ani na plazmatických buňkách. Molekula CD20 je membránový fosfoprotein, který čtyřikrát prochází cytoplazmatickou membránou B lymfocytu. Patří strukturně mezi tzv. tetraspanové molekuly. Její přesná fyziologická úloha není známa. Nejsou známy ani ligandy této molekuly. Předpokládá se účast CD20 v aktivaci B lymfocytů, pravděpodobně v souvislosti s hospodařením s vápníkem. Membránová exprese molekuly CD20 je stabilní. Nedochází k jejímu uvolňování do tělních tekutin v podobě solubilních forem tak, jak je to velmi běžné u jiných membránových molekul leukocytů. Okrelizumab je řazen mezi monoklonální protilátky II. třídy, protože po jeho navázání na cílový antigen CD20 dochází především k silné vazbě NK (tzv. natural killers) buněk, které následně zničí B lymfocyt mechanismem na protilátkách závislé buněčné cytotoxicity (antibody dependent cellular cytotoxicity, ADCC). Je výhodou, že k zapojení komplementu (complement dependent cytotoxicity, CDC) rovněž s cytotoxickým efektem na B lymfocyt dochází po vazbě okrelizumabu v menší míře. Je tak omezena tvorba prozánětlivých štěpných produktů aktivace komplementu, které by u léčené osoby mohly vyvolat nežádoucí reakci. V neposlední řadě je po vazbě okrelizumabu aktivována přímá apoptóza B lymfocytů. Vzniklá apoptotická tělíska jsou šetrně odstraňována makrofágy atrahovanými lokálně tvořenými chemoatraktanty [10].
Po podání okrelizumabu dochází během dvou týdnů k zásadnímu snížení počtu B lymfocytů v periferní krvi až na hranici detekovatelnosti [11]. Velikost molekuly okrelizumabu (148 kDa) neumožňuje ve větší míře její prostup hematoencefalickou bariérou do CNS. Bylo prokázáno, že koncentrace podobně působícího léku rituximabu odpovídající molekulové hmotnosti dosahují u neporušené hematoencefalické bariéry přibližně 10× nižších hodnot v mozkomíšním moku oproti séru [12]. Přesto dochází po podání těchto léčiv rovněž ke snížení počtu B lymfocytů v mozkomíšním moku i v perivaskulárních prostorech CNS, kde se vyvíjejí zánětlivá ložiska u RS. Vzhledem k absenci antigenu CD20 na povrchu plazmatických buněk zůstává při léčbě monoklonálními protilátkami proti CD20 zachována produkce imunoglobulinů, nicméně často nastává snížení hodnot zejména ve třídě IgM [13]. V mozkomíšním moku nedochází k vymizení oligoklonálních pásů diagnostických pro RS dokonce ani při intratekálním podání jiné protilátky anti CD20, rituximabu [14].
Deplece B lymfocytů v periferní krvi po podání anti CD20 léčiv trvá řádově měsíce až několik let (u rituximabu je popsána trvající deplece po třech letech od podání jediné dávky léčiva ještě u 4 % pacientů). Podle výsledku studie s okrelizumabem podávaným u revmatoidní artritidy zřejmě bude mít i tento lék podobný profil stran délky vlivu na B lymfocyty [15]. Pro potřeby klinických studií s okrelizumabem v léčbě RS byl zvolen fixní interval podávání každých šest měsíců.
V rámci deplece B lymfocytů při léčbě okrelizumabem předpokládáme rovněž odstranění paměťových B lymfocytů infikovaných virem Epsteina‒Barrové (EBV). Naprostá většina pacientů s RS je EBV pozitivní a anamnesticky prodělaná infekční mononukleóza způsobená virem EBV představuje prokázaný rizikový faktor pro budoucí rozvoj RS [16]. B lymfocyty infikované virem EBV byly navíc ve větší míře zachyceny ve folikulech formovaných na meningách a také v kortikálních lézích u PP RS [10,17].
Klinické studie s okrelizumabem u RS
Ve třetí fázi klinického výzkumu byly u RR RS provedeny dvě podobně naplánované studie OPERA I a OPERA II. Zahrnuly 821 a 835 pacientů zařazených vždy do dvou větví s léčbou okrelizumabem podávaným v dávce 600 mg nitrožilně každých 24 týdnů nebo s léčbou interferonem beta 1a (IFNβ 1a) v dávce 44 µg aplikované podkožně třikrát týdně po dobu 96 týdnů [11].
Primárním výstupem studie byl roční
výskyt relapsů, který byl statisticky významně snížen po dobu
dvouletého sledování o 46 % (resp. o 47 %
ve studii OPERA II) u pacientů léčených
okrelizumabem oproti pacientům léčeným IFNβ 1a (p < 0,001),
graf 1. Rovněž bylo dosaženo ve větvi s okrelizumabem
menšího podílu pacientů bez nárůstu trvalé (alespoň tři
měsíce trvající) invalidity po 24 týdnech sledování
(6,9 % vs. 10,5 %; p = 0,003). Při terapii
okrelizumabem došlo k redukci počtu nových aktivních lézí
na MR o 94 % (resp. 95 % ve studii OPERA II)
oproti IFNβ 1a (p < 0,001).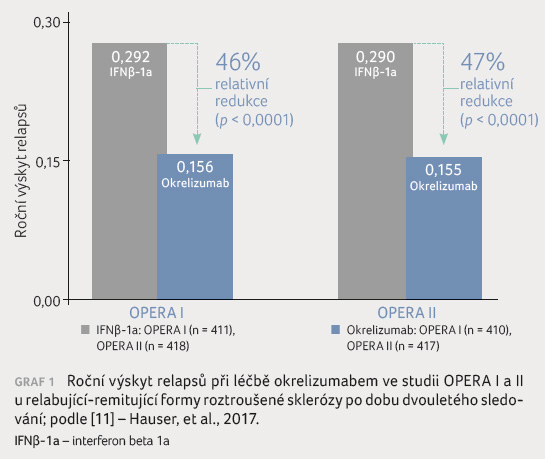
Po dobu dvouletého pozorování ve studii dosahovalo podle současných kritérií optimální účinnosti léčby bez známek klinické aktivity (bez relapsů, bez trvalé progrese) i MR aktivity (žádné nové a/nebo aktivní ložisko na MR) onemocnění – tzv. koncept NEDA (no evidence of disease activity) ‒ vždy významně více pacientů v okrelizumabové větvi (o 75 %) oproti pacientům léčeným IFNβ 1a (graf 2A, B) [18]. Podíl pacientů léčených okrelizumabem, kteří naplňují koncept NEDA, je nejvyšší ze všech dosud užívaných léků v léčbě RR RS včetně natalizumabu a alemtuzumabu.
Do klinické studie fáze III
s názvem ORATORIO bylo zařazeno celkem 732 pacientů s PP RS
[19]. Pacienti byli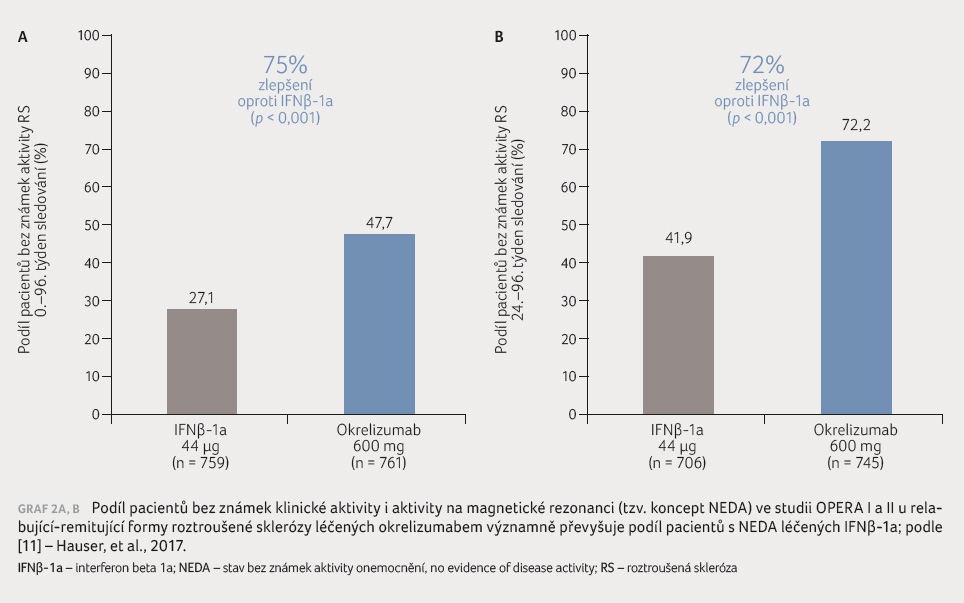 randomizováni v poměru 2 : 1 k léčbě
okrelizumabem v dávce 600 mg nitrožilně každých 24 týdnů
nebo k léčbě placebem po dobu alespoň 120 týdnů
a do doby, než dojde u předem určeného podílu
pacientů k potvrzené, trvalé (tři nebo šest měsíců
trvající) progresi (graf 3A, B). U nemocných léčených okrelizumabem byla
pozorována trvalá progrese neurologického deficitu po dobu
tří měsíců v 32,9 % oproti 39,3 % v placebové
větvi (p = 0,03),
resp. po dobu šesti měsíců v 29,6 % oproti 35,7 %
v placebové skupině (p = 0,04).
Z parametrů vyšetření na MR byla důležitá
statisticky významně nižší procentuální ztráta mozkového
parenchymu mezi 24. a 120. týdnem studie u pacientů
léčených okrelizumabem (0,9 % vs. 1,09 % u placeba;
p = 0,02).
randomizováni v poměru 2 : 1 k léčbě
okrelizumabem v dávce 600 mg nitrožilně každých 24 týdnů
nebo k léčbě placebem po dobu alespoň 120 týdnů
a do doby, než dojde u předem určeného podílu
pacientů k potvrzené, trvalé (tři nebo šest měsíců
trvající) progresi (graf 3A, B). U nemocných léčených okrelizumabem byla
pozorována trvalá progrese neurologického deficitu po dobu
tří měsíců v 32,9 % oproti 39,3 % v placebové
větvi (p = 0,03),
resp. po dobu šesti měsíců v 29,6 % oproti 35,7 %
v placebové skupině (p = 0,04).
Z parametrů vyšetření na MR byla důležitá
statisticky významně nižší procentuální ztráta mozkového
parenchymu mezi 24. a 120. týdnem studie u pacientů
léčených okrelizumabem (0,9 % vs. 1,09 % u placeba;
p = 0,02).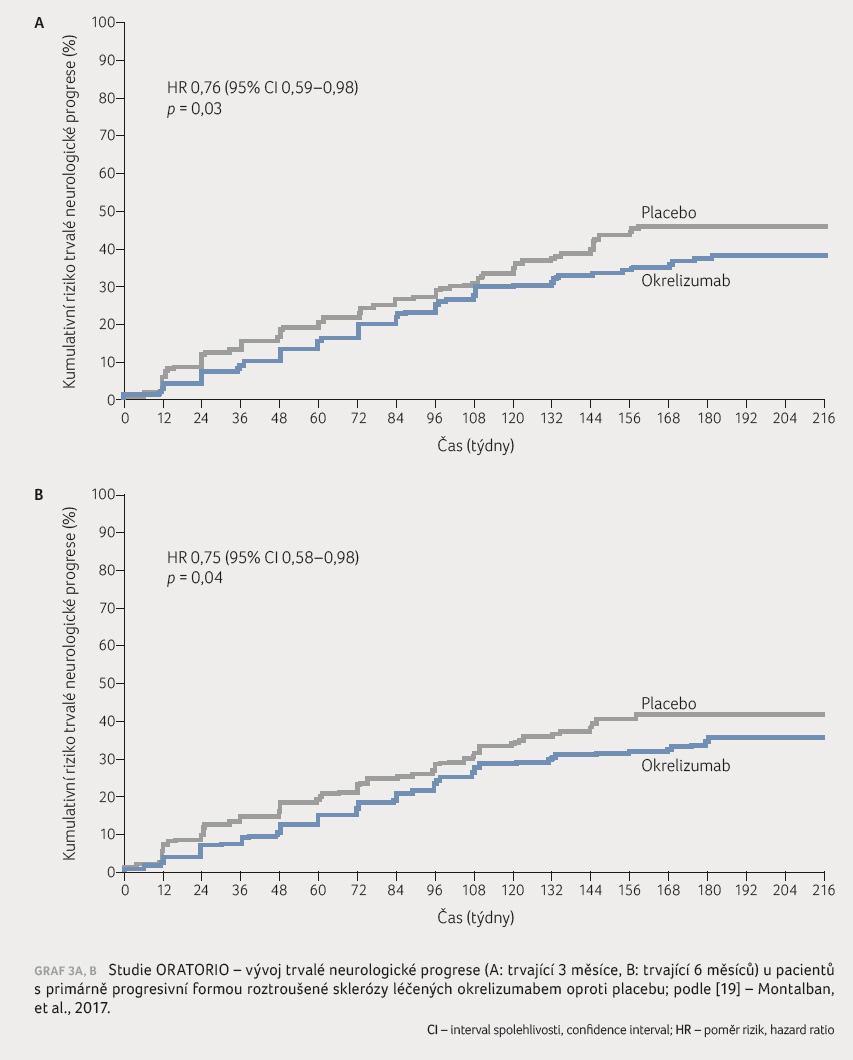
Klinické studie všech fází tedy prokázaly schopnost okrelizumabu jednak významně snižovat počet relapsů u RR RS, jednak redukovat u RR RS i PP RS riziko trvalé invalidity ve shodě s pozitivními vlivy na vývoj onemocnění na MR. Okrelizumab (přípravek Ocrevus) podávaný v dávce 600 mg nitrožilně každých 24 týdnů byl proto v roce 2017 schválen Evropskou lékovou agenturou (European Medicines Agency, EMA) k léčbě RR RS a rovněž jako první lék indikovaný k léčbě PP RS v rámci standardních postupů medicíny založené na důkazech.
Tolerance a bezpečnost okrelizumabu
Nežádoucí účinky okrelizumabu v klinických studiích fází II a III u obou forem RS lze rozdělit na infuzní reakce a dále na infekce a nádorová onemocnění [11,19,20].
Infuzní reakce byly pozorovány v mírné až střední intenzitě celkem asi u třetiny pacientů léčených okrelizumabem (oproti asi 9 % léčených IFNβ 1a, resp. 25 % léčených placebem). Jednalo se o pruritus, kožní exantém, škrábání v krku a pocit horkosti především v návaznosti na první podání léčiva. Pouze jediná reakce byla hodnocena jako život ohrožující pro epizodu bronchospasmu.
Frekvence výskytu běžných infekcí zejména močových cest a respiračního traktu dosahovala obdobných hodnot u pacientů s placebem, u léčených IFNβ 1a i okrelizumabem.
U okrelizumabu dominovaly infekce nosohltanu a horních cest dýchacích a celkem bylo 1,3 % infekcí hodnoceno jako závažné (versus 2,9 % u IFNβ 1a).
Výskyt herpetických infekcí byl lehce vyšší u pacientů léčených okrelizumabem (5,9 % vs. 3,4 % u IFNβ 1a) s jedinou závažnou infekcí tohoto typu v podobě rozsáhlého genitálního výsevu ve studii OPERA I s úpravou po antivirotické léčbě.
U okrelizumabu nebylo pozorováno zvýšené riziko aktivace latentní tuberkulózy tak, jak je známe například u biologických léčiv zaměřených proti tumor nekrotizujícímu faktoru alfa.
Vzhledem ke známému riziku závažné oportunní infekce ‒ progresivní multifokální leukoencefalopatie (PML) – při léčbě RS jinou monoklonální protilátkou, a to natalizumabem, byl průběh všech studií s okrelizumabem pečlivě monitorován rovněž stran možného výskytu této infekční komplikace způsobené John Cunninghamovým virem (JCV). Podle dat dostupných k dubnu 2018 (poskytnuto firmou Roche) bylo celosvětově léčeno okrelizumabem již přes 40 000 pacientů a výskyt PML byl hlášen pouze u pěti pacientů, a to po předchozí léčbě natalizumabem (4 osoby), resp. fingolimodem (1 osoba). Tyto případy jsou tedy hodnoceny jako tzv. carry over PML v souvislosti s předchozí terapií RS.
Pokud jde o nádorová onemocnění, vyplývá z dlouhodobějších dat získaných ze všech dosavadních studií s léčbou okrelizumabem riziko výskytu maligních onemocnění vyjádřené jako 0,4 na 100 pacientoroků (oproti běžnému výskytu 0,2 u pacientů léčených ve studiích s IFNβ 1a nebo s placebem).
Protilátky proti okrelizumabu (human anti human antibodies, HAHA) byly prokázány u méně než 0,4 % pacientů léčených okrelizumabem, což odpovídá předpokládané menší imunogenicitě humanizované monoklonální protilátky v porovnání s chimérickými protilátkami (rituximab) [11].
Gravidita, laktace a okrelizumab
Podle Souhrnu údajů o přípravku (SPC) schváleného v České republice je pacientkám v reprodukčním období doporučeno dodržovat účinnou kontracepci po dobu 12 měsíců od podání okrelizumabu, „je třeba vyvarovat se podávání přípravku v těhotenství, pokud potenciální prospěch pro matku nepřevažuje nad potenciálními riziky pro plod.“ Doporučení amerického Úřadu pro kontrolu potravin a léčiv (FDA) zmiňuje jako bezpečný interval šest měsíců mezi poslední dávkou léčiva a početím, což lépe odpovídá poločasu eliminace okrelizumabu z organismu i faktu, že IgG1 monoklonální protilátky neprostupují placentou v prvním trimestru gravidity [21]. Množství relevantních dat o graviditě při léčbě okrelizumabem je zatím velmi malé v souboru 15 pacientek s RS, 22 pacientek s revmatoidní artritidou a 11 pacientek se systémovým lupus erythematodes [22]. Ačkoliv v této skupině nedošlo v průběhu těhotenství a vývoje plodu k významné odchylce oproti běžné populaci, nelze se zatím k vlivu okrelizumabu definitivně vyjádřit.
V případě podobného léčiva rituximabu byla již publikována data u více než 150 gravidit pacientek s různými autoimunitními chorobami či malignitami s naznačenou vyšší frekvencí předčasných porodů (19 % vs. 10‒12 % v běžné populaci), ale s mírou spontánních potratů v prvním trimestru vcelku srovnatelnou s běžnou populací (21 %) [23].
Je nutno počítat s tím, že monoklonální protilátka prochází od druhého trimestru přes placentární bariéru a může vést ke snížení počtu B lymfocytů a k lymfopenii u plodu a novorozence, což bylo rovněž dokumentováno u matek léčených rituximabem [24]. Ve výše uvedené skupině 150 gravidit byly pozorovány čtyři infekce u plodu/novorozence – akutní chorioamniitida, bronchiolitida, cytomegalovirová hepatitida a nespecifikované febrilie.
Údaje ohledně kojení máme zatím pouze díky pozorování u rituximabu. Jeho koncentrace dosahují v mateřském mléce asi 240× nižších hodnot než v séru léčené matky. Navíc lze předpokládat degradaci monoklonální protilátky trávicími enzymy kojence, tedy se neočekává významný vliv na plod, ačkoliv bohužel sérové koncentrace rituximabu ani počty B lymfocytů u kojenců sledovány nebyly [25].
Očkování a okrelizumab
Vzhledem k depleci části buněčné populace tvořící imunoglobuliny při léčbě okrelizumabem je namístě jednak zvažovat možnou nedostatečnou odpověď na vakcínu, jednak riziko reakce na očkovací látku (zejména živou vakcínu) u imunokompromitovaného pacienta. Očkování živou vakcínou je proto doporučeno zásadně až po obnovení populace B lymfocytů. Obnovu B lymfocytární větve můžeme sledovat v periferní krvi. Pomocí vhodně volených kombinací membránových znaků prokazovaných průtokovou cytometrií lze dokonce rozlišit i funkčně odlišné subpopulace B lymfocytů (např. naivní, paměťové ad.). Musíme však mít na mysli, že situace v periferní krvi je pouze vzdáleným odrazem skutečné obnovy B lymfocytů, která se uskutečňuje v kostní dřeni a v sekundárních lymfatických orgánech. Pro klinické hodnocení v periferní krvi je jako normální používáno rozmezí 5‒15 % B lymfocytů z lymfocytární populace. Za důkaz znovuobnovení populace B lymfocytů u nemocných léčených okrelizumabem lze považovat prokázanou přítomnost přibližně 1 % CD19+ B lymfocytů v periferní krvi. Upozorňujeme, že pro průkaz B lymfocytů u nemocných léčených anti CD20 protilátkami nelze ke stanovení B lymfocytů používat doložení znaku CD20. I podle našich zkušeností je obsazen terapeutickou protilátkou anti CD20, která neumožní vazbu diagnostické protilátky anti CD20. Získávali bychom falešně negativní výsledky.
Zařazení okrelizumabu do současných možností léčby RS
V současné době jsme svědky neustále se rozšiřujících možností léčby RR RS. Je velice pozitivní, že jsme nyní schopni o to účinněji zlepšovat prognózu pacientů s RS ihned od stanovení diagnózy a rozšířením palety léčiv u většího počtu nemocných oddálit trvalou invaliditu. Na druhou stranu se zároveň rozhodovací proces výběru správného léku pro konkrétního pacienta stává o poznání složitějším ve srovnání s dobou například před dvaceti lety. Navíc stále není k dispozici lék kurabilní. Na tento fakt reagovali odborníci z Americké neurologické akademie (AAN) v roce 2018 vytvořením rozsáhlého souhrnu dosavadních znalostí k jednotlivým možnostem léčby a k praktickým doporučením postupu v léčbě dospělých pacientů s RS včetně podávání okrelizumabu [26].
Při výběru konkrétní léčby pro pacienta je nutno vzít v úvahu aktivitu RS a její dosavadní terapii, přidružená onemocnění včetně alergií, mechanismus účinku léčiva, možné nežádoucí účinky, u žen v produktivním věku případné plánované těhotenství a v neposlední řadě také názor pacienta na navrhovanou léčbu, který předurčuje jeho adherenci. Bohužel, je nutno brát v potaz také úhradová kritéria pro jednotlivé přípravky.
Okrelizumab je s ohledem na účinnost prokázanou v klinických studiích zařazen mezi tzv. léky druhé volby se signifikantně vyšší účinností oproti lékům první volby (IFNβ 1a, glatiramer acetát, teriflunomid a dimetylfumarát). Úhradová kritéria v ČR zatím nejsou stanovena, nicméně lze předpokládat podobný indikační profil jako u natalizumabu a alemtuzumabu, tedy především eskalační monoterapii pro pacienty s pokračující aktivitou RR RS i přes léky první volby, případně jako první volba pro vysoce aktivní RR RS. V případě změny léčby na úrovni druhé volby okrelizumab představuje vhodnou variantu pro JCV pozitivní pacienty v riziku PML. Jako jediný lék s prokázanou účinností bude okrelizumab figurovat v léčbě PP RS.
Z hlediska bezpečnosti je doporučeno před zahájením léčby kromě základního laboratorního vyšetření (krevní obraz, jaterní testy, močovina, kreatinin, C reaktivní protein, moč včetně kultivace) provést screening na hepatitidy. Z klinické zkušenosti doporučujeme zkontrolovat před zahájením léčby rovněž hodnoty imunoglobulinů (IgG včetně podtříd a IgM), titr protilátek proti JCV a zajistit pneumoftizeologické vyšetření (RTG plic, QuantiFERON TB Gold test). Samozřejmostí by mělo být dodržování onkologické prevence u pacientů léčených dlouhodobě imunomodulační terapií (důraz na nekuřáctví, pravidelné gynekologické a mamografické kontroly atd.). Před zahájením léčby je vhodné zkontrolovat také platnost očkování proti tetanu, při delším časovém odstupu od posledního přeočkování s výhodou pomocí určení koncentrace specifických protilátek IgG tetanus v séru. Veškerá plánovaná, nezbytná očkování je nutno provést ještě před první aplikací okrelizumabu s časovým odstupem zhruba tří měsíců.
Okrelizumab nesmí být podán pacientovi s aktivní infekcí. Z našich zkušeností upozorňujeme na možnost atypických lokalizací infekcí (např. ORL oblast včetně mastoiditidy), kde důrazně doporučujeme trvat na jednoznačném vyloučení a doléčení jakékoliv infekce specialistou daného oboru před podáním okrelizumabu.
Samotné aplikaci okrelizumabu předchází podání premedikace jako prevence nežádoucích infuzních reakcí. V probíhajících klinických studiích se osvědčila kombinace metylprednisolonu v dávce 100 mg nitrožilně s paracetamolem 1 000 mg a s cetirizinem 10 mg perorálně. V případě jakýchkoliv příznaků infuzní reakce lze postupovat podle SPC, tedy přerušit podávání léku, podat kortikoidy či antihistaminika a při ústupu reakce znovu zahájit podávání okrelizumabu nižší rychlostí. V naší skupině 40 pacientů v klinických studiích OPERA I a ORATORIO jsme nezaznamenali jediný případ nutnosti ukončit definitivně podávání okrelizumabu z důvodu infuzní reakce.
U pacientů léčených okrelizumabem doporučujeme následně kontrolovat základní laboratorní parametry v séru a v moči každé tři měsíce, imunoglobuliny v séru dvakrát ročně, ostatní screening na hepatitidy a tuberkulózu jedenkrát ročně. Neváháme spolupracovat se specialisty jiných oborů (imunologie, ORL, urologie, gynekologie) ve snaze podchytit včas a dostatečně možné infekční komplikace.
Závěr
Okrelizumab představuje dosud poslední registrovaný lék v léčbě RR RS a zatím jediný lék s prokázanou účinností v léčbě PP RS. Svou vysokou účinností se zařazuje společně s natalizumabem a alemtuzumabem do skupiny eskalačních léků druhé volby pro pacienta s pohodlnou aplikací nitrožilně dvakrát ročně. Bezpečnostní profil je podle dosavadních pozorování příznivý, nicméně je nutno dbát na důsledné preventivní vyloučení aktivních infektů. V různých klinických indikacích jsou zkoušeny další postupy, jak terapeuticky ovlivnit B lymfocytární systém. To, že zásah do regulačních interakcí zprostředkovaných molekulami BAFF/BAFFR (B cell activating factor/B cell activating factor receptor) nepřinesl při ověřování u nemocných s RS pozitivní výsledky, neznamená, že pozitivních výsledků nebude dosaženo při ovlivňování jiných interakcí v rámci regulace B lymfocytární odpovědi. Jako perspektivní se jeví depleční monoklonální protilátky namířené proti vysoce specifickému znaku B lymfocytů CD19. Tento znak má jinou diferenciační dynamiku, pokud ji porovnáme s molekulou CD20. V léčbě mnohočetného myelomu, který je výsledkem maligní transformace terminálně diferencovaného B lymfocytu, plazmatické buňky, je s úspěchem používáno biologikum anti CD38. Jako účinné v jiných indikacích byly ověřeny malé molekuly, které cílí na nitrobuněčné signální dráhy (kinázy) B lymfocytů. V případě okrelizumabu bude zajímavé sledovat konkrétní dopad na jednotlivé kompartmenty B lymfocytů. Lze očekávat nestejnou „citlivost“ různých subsetů B lymfocytů a také velmi pravděpodobně nerovnoměrnou „rekonstituci“ těchto subsetů po aplikaci okrelizumabu. Zcela neznámé jsou dopady léčby anti CD20 na menší frakci T lymfocytů, které v nízké denzitě exprimují tento „specifický“ znak pro B lymfocyty [27].
Seznam použité literatury
- [1] Lebrun C, Bensa C, Debouverie M, et al. Association between clinical conversion to multiple sclerosis in radiologically isolated syndrome and magnetic resonance imaging, cerebrospinal fluid, and visual evoked potential: follow‑up of 70 patients. Arch Neurol 2009; 66: 841‒846.
- [2] Compston A, McDonald I, Noseworthy J, et al. McAlpine’s Multiple Sclerosis. Elsevier Inc. 2006; 491‒555.
- [3] Ciotti JR, Cross AH. Disease‑modifying treatment in progressive multiple sclerosis. Curr Treat Options Neurol 2018; 20: 12.
- [4] Skaper SD, Facci L, Zusso M, et al. An inflammation‑centric view of neurological diseases: beyond the neuron. Front Cell Neurosci 2018; 12: 1‒16.
- [5] Gelfand JM, Cree BAC, Hauser SL. Ocrelizumab and other CD20+ B‑cell‑depleting therapies in multiple sclerosis. Neurotherapeutics 2017; 14: 835‒841.
- [6] Krejsek J, Andrýs C, Krčmová I. Imunologie člověka. Hradec Králové: Garamon, 2016, 496 s. Více informací na: http://www.imunologie‑cloveka‑krejsek.cz
- [7] Greenfield AL, Hauser SL. B‑cell therapy for multiple sclerosis: entering an era. Ann Neurol 2018; 83: 13‒26.
- [8] Stashenko P, Nadler LM, Hardy R, Schlossman SF. Characterization of a human B lymphocyte‑specific antigen. J Immunol 1980; 125: 1678‒1685.
- [9] Yang Ch, Gao X, Gong R. Engineering of Fc fragments with optimized physicochemical properties implying improvement of clinical potentials for Fc‑based therapeutics. Front Immunol 2018; 8: 1‒14.
- [10] Lehmann‑Horn K, Kinzel S, Weber MS. Deciphering the Role of B Cells in Multiple Sclerosis‑Towards Specific Targeting of Pathogenic Function. Int J Mol Sci 2017; 18: 2048.
- [11] Hauser SL, Bar‑Or A, Comi G, et al. Ocrelizumab versus Interferon Beta‑1a in Relapsing Multiple Sclerosis. N Engl J Med 2017; 376: 221‒234.
- [12] Ruhstaller T, Amsler U, Cerny T. Rituximab: active treatment of central nervous system involvement by non‑Hodgkin’s lymphoma? Ann Oncol 2000; 11: 374–375.
- [13] Buch MH, Smolen JS, Betteridge N, et al. Updated consensus statement on the use of rituximab in patients with rheumatoid arthritis. Ann Rheum Dis 2011; 70: 909‒920.
- [14] Studer V, Rossi S, Motta C, et al. Peripheral B cell depletion and central proinflammatory cytokine reduction following repeated intrathecal administration of rituximab in progressive Multiple Sclerosis. J Neuroimmunol 2014; 276: 229‒231.
- [15] Avasarala J. Anti‑CD20 Cell Therapies in Multiple Sclerosis‑A Fixed Dosing Schedule for Ocrelizumab is Overkill. Drug Target Insights 2017; 11: 1‒3.
- [16] Ascherio A, Munger KL, Lennette ET, et al. Epstein‑Barr virus antibodies and risk of multiple sclerosis: A prospective study. JAMA 2001; 286: 3083–3088.
- [17] Magliozzi R, Serafini B, Rosicarelli B, et al. B‑cell enrichment and Epstein‑Barr virus infection in inflammatory cortical lesions in secondary progressive multiple sclerosis. J Neuropathol Exp Neurol 2013; 72: 29‒41.
- [18] Havrdová E, Arnold DL, Bar‑Or A, et al. No evidence of disease activity (NEDA) analysis by epochs in patients with relapsing multiple sclerosis treated with ocrelizumab vs interferon beta‑1a. Mult Scler J Exp Transl Clin 2018; 4: 1‒11.
- [19] Montalban X, Hauser SL, Kappos L, et al. Ocrelizumab versus Placebo in Primary Progressive Multiple Sclerosis. N Engl J Med 2017; 376: 209‒220.
- [20] Kappos L, Li D, Calabresi PA, et al. Ocrelizumab in relapsing‑remitting multiple sclerosis: a phase 2, randomised, placebo‑controlled, multicentre trial. Lancet 2011; 378: 1779‒1787.
- [21] Kane SV, Acquah LA. Placental transport of immunoglobulins: a clinical review for gastroenterologists who prescribe therapeutic monoclonal antibodies to women during conception and pregnancy. Am J Gastroenterol 2009; 104: 228‒233.
- [22] Vukusic S. An update on pregnancy outcomes following ocrelizumab treatment in patients with multiple sclerosis and other autoimmune diseases. ECTRIMS Online Library 2017; P710.
- [23] Chakravarty EF, Murray ER, Kelman A, Farmer P. Pregnancy outcomes after maternal exposure to rituximab. Blood 2011; 117: 1499‒1506.
- [24] Klink DT, van Elburg RM, Schreurs MW, et al. Rituximab administration in third trimester of pregnancy suppresses neonatal B‑cell development. Clin Dev Immunol 2008; 2008: 1‒6.
- [25] Bragnes Y, Boshuizen R, de Vries A, et al. Low level of Rituximab in human breast milk in a patient treated during lactation. Rheumatology (Oxford) 2017; 56: 1047‒1048.
- [26] Rae‑Grant A, Day GS, Marrie RA, et al. Practice guideline: Disease‑modifying therapies for adults with multiple sclerosis. American Academy of Neurology 2018; doi:10.1212/WNL.0000000000005347.
- [27] Sabatino JJ, Zamvil SS, Hauser SL. B‑cell therapies in multiple sclerosis. Col Spring Harb Perspect Med 2018; doi:10.1101/cshperspect.a032037.