Post hoc analýza studie CLARITY – účinnost perorálně podávaného kladribinu u pacientů s vysokou aktivitou relabující-remitující RS
Účinnost perorálně podávaného kladribinu (Mavenclad) byla potvrzena randomizovanou, dvojitě zaslepenou, placebem kontrolovanou studií CLARITY. Primárním cílem této studie bylo vyhodnocení účinnosti kladribinu oproti placebu ve snížení roční míry relapsů onemocnění (annualised relapse rate, ARR), sekundárními cílovými ukazateli byly zpomalení progrese invalidity a redukce počtu aktivních lézí měřených pomocí magnetické rezonance (MR). Jako složený cílový ukazatel byl stanoven tzv. stav bez známek aktivity onemocnění (no evidence of disease activity, NEDA). Následná extenze studie CLARITY ukázala, že klinický efekt kladribinu v dávce 3,5 mg/kg užívané v prvních dvou letech přetrvává nejméně po dobu čtyř let. Vzhledem k heterogenitě onemocnění roztroušenou sklerózou (RS) a nejednotné identifikaci pacientů s vysokou aktivitou choroby (high disease activity, HDA) vycházeli autoři aktuální analýzy účinnosti kladribinu z informací o prodělaných relapsech v období 12 měsíců před začátkem studie a z počátečního MR vyšetření. V analýze tedy byly užity dvě definice HDA: první – založená na počtu relapsů bez ohledu na léčbu ‒ a druhá, kdy k první skupině byli ještě připočítáni pacienti s nedostatečnou odpovědí na dosavadní léčbu.
Tyto dva přístupy založené na důkazech z klinického hodnocení, že počet relapsů a zobrazené léze na MR korelují s disabilitou nemocných, byly užity k retrospektivnímu výběru pacientů s HDA a ke zhodnocení jejich odpovědi na léčbu perorálním kladribinem. Protože studie CLARITY prokázala lepší poměr prospěchu a rizika terapie v případě nižší dávky léčivé látky, byla nová post hoc analýza na základě dvou definicí HDA provedena na datech od nemocných, kteří byli randomizováni do skupiny užívající 3,5 mg/kg kladribinu (n = 433) a do skupiny s placebem (n = 437).
Podskupinová analýza
Post hoc analýza rozdělila pacienty na základě charakteristiky onemocnění do dvou podskupin. První – označená jako podskupina s vysokou aktivitou relapsů (high relapse activity, HRA) – zahrnula nemocné se dvěma nebo více relapsy prodělanými během roku předcházejícího vstupu do studie bez ohledu na to, zda byli, či nebyli léčeni dalším lékem ovlivňujícím průběh choroby (disease modifying drug, DMD). Do druhé podskupiny, která byla označena jako HRA + DAT (aktivita nemoci při léčbě, disease activity on treatment), byli zařazeni pacienti se dvěma nebo více relapsy prodělanými během roku předcházejícího vstupu do studie, ať byli, či nebyli léčeni dalším DMD, a pacienti s jedním nebo více relapsy, kteří byli v roce předcházejícím vstupu do studie léčeni dalším DMD a vyskytla se u nich jedna nebo více gadolinium enhancujících (Gd+) T1 lézí či devět nebo více T2 lézí.
Stanovení aktivity choroby u pacientů léčených placebem
K ověření využitelnosti stanovených kritérií pro retrospektivní určení nemocných s HDA provedli autoři analýzu hodnot ARR, doby do prvního relapsu a doby do šestiměsíčního potvrzeného zhoršení na Kurtzkeho stupnici postižení (Expanded Disability Status Scale, EDSS) u pacientů randomizovaných do placebové skupiny.
Výsledky
V tomto případě byla v podskupinách HRA a HRA + DAT
zaznamenána vyšší hodnota ARR oproti celkové populaci nemocných
s placebem a oproti skupinám nemocných léčených
placebem, kteří nesplňovali daná kritéria analýzy. U dalších
cílových ukazatelů byla doba do prvního relapsu a doba
do šestiměsíčního potvrzeného zhoršení na EDSS
kratší v podskupinách HRA a HRA + DAT (tab. 1). Tím byla potvrzena využitelnost stanovených
kritérií pro vysokou aktivitu onemocnění.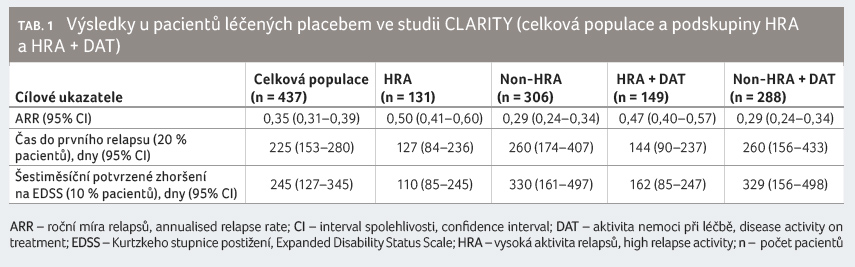
V celé populaci studie CLARITY (n = 870) snížil
perorální kladribin v dávce 3,5 mg/kg riziko šestiměsíčního
potvrzeného zhoršení na EDSS o 47 % (hazard ratio [HR]
0,53; 95% interval spolehlivosti [CI] 0,36‒0,79; p = 0,0016)
oproti placebu. Významnější redukce rizika doby do šestiměsíčního
potvrzeného zhoršení na EDSS (82 %) ve srovnání
kladribinu v dávce 3,5 mg/kg a placeba byla zaznamenána
v podskupinách pacientů s HRA a HRA + DAT.
Tento výsledek byl statisticky signifikantní (p = 0,0036
pro HRA vs. non HRA; p = 0,0037
pro HRA + DAT vs. non HRA + DAT), graf 1.
Účinek perorálního kladribinu v dávce 3,5 mg/kg
u nemocných splňujících kritéria pro HDA byl potvrzen
rovněž dobou do tříměsíčního potvrzeného zhoršení
na EDSS (72% snížení rizika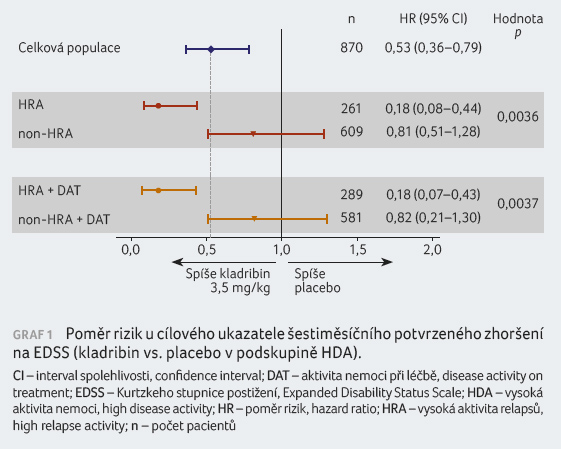 v obou podskupinách s HDA
vs. 20% snížení rizika v obou podskupinách non HDA).
v obou podskupinách s HDA
vs. 20% snížení rizika v obou podskupinách non HDA).
V případě ukazatele ARR byla hodnota relativního rizika (RR) příznivá pro perorální kladribin v dávce 3,5 mg/kg v celkové populaci studie (RR 0,42; 95% CI 0,33‒0,52; p < 0,0001), graf 2. Hodnoty RR byly též příznivé pro perorálně užívaný kladribin v uvedené dávce pro všechny podskupiny s HDA a jejich pokles byl větší u pacientů splňujících kritéria HRA a HRA + DAT ve srovnání s celkovou populací, tento výsledek však nedosáhl statistické významnosti.
Relativní riziko výskytu nových Gd+ T1 lézí u nemocných
z obou podskupin s HDA léčených kladribinem v dávce
3,5 mg/kg bylo nízké, podstatný účinek byl zaznamenán
ve všech podskupinách (graf 3). Podobné výsledky doložily analýzy výskytu
aktivních T2 lézí a kombinovaných unikátních lézí.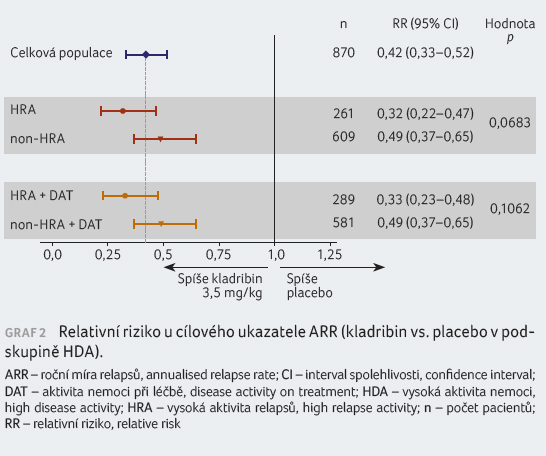
Ukazatel NEDA byl definován jako stav bez relapsů, bez
tříměsíčního potvrzeného zhoršení na EDSS, bez
Gd+ T1 lézí a bez aktivních T2 lézí. Hodnota OR
(odds ratio) byla v podskupinách HRA a HRA + DAT
8,02, 95% CI 3,93‒16,35, p < 0,0001,
resp. 7,82, 95% CI 4,03‒15,19, p < 0,0001
(graf 4). Hodnocení
sledovaného ukazatele vycházelo vždy příznivěji pro podskupiny
s HDA v porovnání s non HDA, ačkoliv kromě
podskupiny HRA + DAT (p = 0,0435)
nebylo dosaženo statistické významnosti.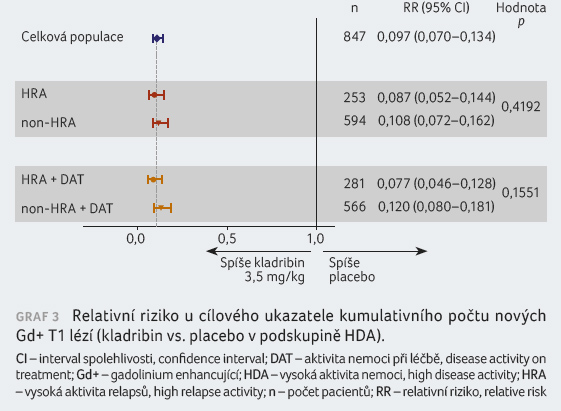
Závěr
Prostřednictvím post hoc
analýzy studie CLARITY byl u pacientů určených na základě
dvou definicí HDA a užívajících perorální kladribin
v dávce 3,5 mg/kg prokázán lepší klinický efekt oproti
celkové populaci tohoto klinického hodnocení. Statisticky
signifikantní zlepšení bylo zaznamenáno v případě
parametru šestiměsíčního potvrzeného zhoršení invalidity
ve všech skupinách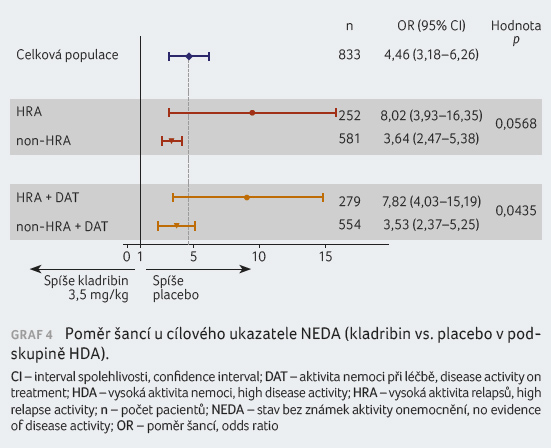 s HDA ve srovnání s nemocnými,
u nichž se neobjevila vyšší aktivita onemocnění.
Bezpečnostní profil kladribinu v dávce 3,5 mg/kg u skupiny
pacientů s HDA je shodný s profilem popsaným u celkové
populace studie. Ve sledované populaci terapie perorálním
kladribinem v dávce 3,5 mg/kg prokázala bez ohledu na výši
aktivity choroby významnou účinnost na všechny cílové
ukazatele ‒ ARR, doba do prvního relapsu, podíl pacientů
s NEDA, tříměsíční potvrzené zhoršení invalidity a MR
parametry. Výsledky podporují pozitivní poměr přínosu a rizika
léčby perorálním kladribinem u pacientů s vysokou
aktivitou onemocnění.
s HDA ve srovnání s nemocnými,
u nichž se neobjevila vyšší aktivita onemocnění.
Bezpečnostní profil kladribinu v dávce 3,5 mg/kg u skupiny
pacientů s HDA je shodný s profilem popsaným u celkové
populace studie. Ve sledované populaci terapie perorálním
kladribinem v dávce 3,5 mg/kg prokázala bez ohledu na výši
aktivity choroby významnou účinnost na všechny cílové
ukazatele ‒ ARR, doba do prvního relapsu, podíl pacientů
s NEDA, tříměsíční potvrzené zhoršení invalidity a MR
parametry. Výsledky podporují pozitivní poměr přínosu a rizika
léčby perorálním kladribinem u pacientů s vysokou
aktivitou onemocnění.
Zdroj: Giovanonni G, Sorensen PS, Cook S, et al. Efficacy of Cladribine Tablets in high disease activity subgroups of patients with relapsing multiple sclerosis: A post hoc analysis of the CLARITY study. Mult Scler J 2018 Apr 1; doi: 10.1177/1352458518771875. [Epub ahead of print]