Ribociklib v klinické praxi
Souhrn
Palácová M. Ribociklib v klinické praxi. Remedia 2023; 33: 201–204.
Karcinom prsu s pozitivitou hormonálních receptorů a HER2 negativitou je nejčastějším fenotypem nádoru, až ve 25 % dochází k relapsu onemocnění po pěti letech. Zásadní léčebnou metodou je hormonoterapie, která však u více než 30 % žen selhává z důvodu primární nebo sekundární hormonální rezistence. Ve snaze překonat tuto rezistenci jsou využívány léčebné kombinace – nyní v úvodní linii léčby pro metastatické onemocnění s inhibitorem cyklin‑dependentních kináz 4/6. Efekt ribociklibu byl prokázán v klinických hodnoceních fáze III – v první linii s letrozolem ve studii MONALEESA‑2, ve druhé linii v kombinaci s fulvestrantem ve studii MONALEESA‑3. Jedinou studií, která prokázala prospěch z léčby i u premenopauzálních a perimenopauzálních pacientek, byla MONALEESA‑7. Ve všech těchto studiích byl léčebný přínos doložen nejen v přežití bez progrese, ale i v celkovém přežití. Bezpečnost a účinnost léčby u mužů potvrdila studie CompLEEment. Doposud jedinou situací, kdy by měla být volena chemoterapie i v úvodu léčby u luminálních nádorů, je viscerální krize. Nově byly prezentovány výsledky studie RIGHT Choice, do níž byly zařazeny pacientky s hrozící viscerální krizí. Efekt ribociklibu byl srovnáván s kombinovanou chemoterapií a také zde ribociklib potvrdil svoji superioritu.
Klíčová slova: HR+/HER2– karcinom prsu – metastatické onemocnění – ribociklib – hormonoterapie.
Summary
Palacova M. Ribociclib in the clinical practice. Remedia 2023; 33: 201–204.
Breast cancer with hormonal receptor positivity and HER2 negativity represents the most common phenotype of this tumor, relapsing in up to 25% of cases within 5 years. Hormonal therapy is the mainstay of its treatment which, however, fails in more than 30% of women because of primary or secondary hormonal resistance. In order to overcome this resistance, therapeutic combinations are used – with an inhibitor of cyclin‑dependent kinases 4/6 in the first line of metastatic disease treatment. The effect of ribociclib has been shown in phase III clinical assessments – with letrozole in the first line (MONALEESA‑2 trial) and with fulvestrant in the second line (MONALEESA‑3 trial). The only trial demonstrating effectiveness of treatment in both pre‑ and perimenopausal patients was MONALEESA‑7. In all of these trials, positive effect was clear with respect to both progression‑free survival and overall survival. The safety and effectiveness in men have been demonstrated in the CompLEEment trial. So far, the only situation requiring chemotherapy even at the beginning of the treatment of luminal tumors is the visceral crisis. Results of the RIGHT Choice trial, enrolling patients with an imminent visceral crisis, have been presented for the first time. The effectiveness of ribociclib was compared to the combined chemotherapy, demonstrating again the superiority of the former.
Key words: HR+/HER2 – breast cancer – metastatic disease – ribociclib – hormonal therapy.
Úvod
Karcinom prsu představuje nejčastěji se vyskytující malignitu u žen a nádor s pozitivitou hormonálních receptorů (HR) a negativitou HER2 (humánní receptor epidermálního růstového faktoru 2) je nejčastěji se vyskytujícím fenotypem. Objevuje se až v 70 % případů karcinomu prsu. U více než čtvrtiny pacientek dojde k relapsu onemocnění po pěti letech a s metastatickým onemocněním žije přibližně 25 % nemocných déle než pět let. Příčinou relapsu nemoci nebo progrese onemocnění při stávající hormonální léčbě (HT) je hormonální rezistence – primární nebo sekundární. Snahou posledních desetiletí je zabránit vzniku této rezistence, nebo její vznik alespoň oddálit. Na příkladu dvou kazuistik demonstrujeme rozdíl mezi dřívější terapií a současnou léčbou již s využitím kombinace HT s cílenou terapií inhibitorem cyklin‑dependentních kináz 4/6 (CDK 4/6), který je jedním z léků vyvinutých k překonání hormonální rezistence.
Kazuistika 1
Pacientka onemocněla karcinomem prsu v roce 2005 ve věku 43 let. Onemocnění bylo diagnostikováno již v lokálně pokročilém stadiu (žena si sama nahmatala nález v prsu). Nemocná podstoupila standardní vyšetření a diagnostikován byl karcinom prsu velikosti 6 cm s metastatickým postižením axilárních uzlin, bez vzdálené diseminace, s pozitivitou HR a negativitou HER2. V úvodu pacientka absolvovala neoadjuvantní chemoterapii (CHT) na bázi antracyklinů a taxanů, následně operační řešení v rozsahu parciální mastektomie s disekcí axily. Došlo ke zmenšení nádoru, ale i po podání neoadjuvantní CHT byla zjištěna přítomnost čtyř pozitivních uzlin v axile. Následovala adjuvantní radioterapie a adjuvantní HT – tamoxifen s následnou změnou na inhibitor aromatázy. Adjuvantní HT byla ukončena po pěti letech (podle tehdejšího standardu léčby) v roce 2010. Bolesti zad se u pacientky objevily v roce 2013, tři roky od zahájení adjuvantní HT. Po dvou měsících terapie a vyšetřování byly zjištěny vícečetné osteolytické kostní metastázy. Zahájena byla analgetická medikace, podávání bisfosfonátů a kauzální onkologická léčba – inhibitor aromatázy v monoterapii. Efekt léčby trval 12 měsíců, bylo dosaženo parciální remise, po této době však došlo k progresi nemoci – kromě kostních metastáz byly nově popsány i metastázy jaterní. S ohledem na tehdejší léčebná doporučení a horší prognózu viscerálních metastáz byla u pacientky zahájena paliativní CHT – paklitaxel jednou týdně s efektem parciální remise. Po šesti měsících byla vzhledem k progredujícím projevům periferní polyneuropatie CHT ukončena a léčba pokračovala podáváním HT – fulvestrantu. K progresi nemoci došlo za pět měsíců, kdy pacientka přišla s bolestmi pod pravým žeberním obloukem, všimla si také žlutého zbarvení kůže. Při přešetření byla konstatována masivní progrese nemoci, zjištěna hepatomegalie (zvětšení jater o 8 cm pod pravý žeberní oblouk), více než desetinásobná elevace hodnot jaterních testů včetně bilirubinu. Indikována byla i s ohledem na špatný výkonnostní stav pacientky pouze symptomatická léčba a žena zemřela po 24 měsících od zjištěné progrese nemoci.
Kazuistika 2
U této pacientky byl diagnostikován karcinom prsu v rámci pravidelného mamografického vyšetření – mammárního screeningu ve věku 52 let. I přes drobné ložisko v oblasti prsu byl zjištěn rovněž nález v oblasti axily. Jednalo se o luminální fenotyp nádoru – s vysokou pozitivitou HR, kdy nelze očekávat zásadní prospěch z neoadjuvantní CHT s cílem downstagingu onemocnění, proto bylo v úvodu indikováno operační řešení. Provedena byla parciální mastektomie s disekcí axily s nálezem 15milimetrového tumoru v prsu a jedné pozitivní uzliny v axile. Provedeno bylo multigenomické testování s výsledkem vysokého rizika relapsu nemoci, a byla proto indikována adjuvantní CHT na bázi antracyklinů a taxanů, adjuvantní HT – inhibitor aromatázy – a adjuvantní radioterapie. Podávání adjuvantní HT bylo plánováno na dobu 10 let vzhledem k pozitivitě uzlin. Po osmi letech pacientka sama adjuvantní HT vysadila. Důvodem podle ní byly zhoršující se artralgie, které však s ošetřujícím onkologem nediskutovala. Po 10 letech od diagnózy a po 2,5 roku od ukončení HT se u pacientky při pravidelné onkologické kontrole objevily mírně vyšší hodnoty jaterních testů (2,5×). Byl proveden kontrolní odběr s časovým odstupem dvou týdnů, kdy byla doložena zhruba stejně zvýšená hodnota. Doplnili jsme tedy ultrazvuk jater s nálezem vícečetných jaterních metastatických ložisek. Biopsie jednoho ložiska potvrdila relaps onemocnění a stejný fenotyp nádoru – HR+/HER2–. Z důvodu relapsu onemocnění HR+/HER2– byla indikována kombinace HT (letrozolu) a inhibitoru CDK 4/6 (ribociklibu). Standardně dle Souhrnu údajů o přípravku (SPC) byly první dva měsíce prováděny kontroly laboratorních hodnot v intervalu dvou týdnů. Při první kontrole po dvou týdnech od zahájení léčby byla zjištěna neutropenie stupně 4 – hodnota neutrofilů činila 0,4 × 109/l, ale došlo již k mírnému poklesu hodnot jaterních testů. Od druhého cyklu byla dávka ribociklibu dle SPC redukována na 400 mg denně ve dnech 1–21 v intervalu 28 dní, tuto dávku pacientka tolerovala již velmi dobře. Po dvou měsících došlo k normalizaci hodnot jaterních testů. Po třech cyklech léčby při plánovaném přešetření bylo na ultrazvuku jater popsáno zmenšení všech jaterních metastáz, konstatována tedy byla parciální remise onemocnění. Opakované vyšetření bylo posléze prováděno vždy po čtyřech cyklech léčby a parciální remise trvala 34 měsíců, poté opět došlo k progresi nemoci. Znovu byly popsány pouze jaterní metastázy bez zjištěné elevace hodnot jaterních testů. Bylo doplněno vyšetření PIK3CA a genetické testování s cílem zjistit ev. přítomnost mutace v genu BRCA1/2. Obě vyšetření byla negativní – nebyla nalezena mutace v genu BRCA1/2 ani mutace v genu PIK3CA. Přítomnost těchto dvou mutací by ovlivnila volbu dalších linií onkologické léčby. Z tohoto důvodu bylo ve druhé linii pro metastatické onemocnění a vzhledem k délce trvání léčebné odpovědi, klinicky asymptomatickému nálezu a normálním hodnotám jaterních testů indikováno podávání fulvestrantu v monoterapii. Pacientka byla léčena fulvestrantem šest měsíců s efektem stabilizace nemoci, s velmi dobrou tolerancí, prakticky bez výskytu nežádoucích účinků. Při progresi po šesti měsících a přítomnosti onemocnění stále pouze v oblasti jater i vzhledem k jeho přetrvávajícímu hormonsenzitivnímu charakteru jsme zvolili pokračování v léčbě založené na HT – kombinaci exemestanu a everolimu. Terapie probíhala s nevýraznými nežádoucími účinky dalších šest měsíců s efektem stabilizace onemocnění a posléze s jeho další progresí. Při vyčerpání léčebných možností HT následovala CHT. Pacientka žije i nadále, 50 měsíců od zjištěné progrese nemoci.
Možnosti léčby – výsledky studií a praktické zkušenosti
V současné době je kombinace HT – inhibitoru aromatázy nebo fulvestrantu s inhibitorem CDK 4/6 – standardní léčebnou modalitou v úvodních liniích terapie HR+/HER2– metastatického karcinomu prsu. K dispozici máme tři přípravky – ribociklib, abemaciklib a palbociklib. Dle výsledků studií fáze III s těmito přípravky dochází u kombinované léčby inhibitorem CDK 4/6 a inhibitorem aromatázy k prodloužení přežití bez progrese (progression‑free survival, PFS) o zhruba 13 měsíců ve srovnání s monoterapií inhibitorem aromatázy. Po selhání inhibitorů aromatázy dochází v kombinaci s fulvestrantem k prodloužení PFS zhruba o sedm měsíců ve srovnání s léčbou samotným fulvestrantem.
Ve výše popsaném případu jsme zvolili ribociklib, neboť jsme s léčbou tímto lékem měli praktické zkušenosti z klinických studií MONALEESA‑2 a MONALEESA‑3. Rovněž v současné době bychom zvolili ribociklib opětovně na základě dat z klinických studií týkajících se především parametru celkového přežití (overall survival, OS). V případě všech tří studií fáze III již byly publikovány finální výsledky OS. Jedná se o studie MONALEESA‑7 (kombinace ribociklibu s inhibitory aromatázy u premenopauzálních žen), MONALEESA‑3 (kombinace ribociklibu s fulvestrantem) a MONALEESA‑2 (kombinace ribociklibu s letrozolem).
Do registrační studie MONALEESA‑3 bylo zařazeno celkem 726 pacientek. Pacientky byly randomizovány do dvou léčebných ramen – fulvestrant + placebo vs. fulvestrant + ribociklib. Primárním cílovým ukazatelem studie bylo PFS. Na základě dat publikovaných v roce 2018 byl prokázán prospěch z léčby v parametru PFS pro léčebnou kombinaci 20,5 měsíce vs. 12,8 měsíce pro monoterapii fulvestrantem; došlo k prodloužení PFS o 7,7 měsíce. Efekt byl konzistentní ve všech podskupinách na základě věku, exprese HR, kostních vs. viscerálních metastáz, předchozího předléčení HT. Sekundárními cílovými ukazateli studie byly celková odpověď (objective response rate, ORR), OS a bezpečnost. Data OS byla publikována v roce 2021. V kombinačním rameni s ribociklibem byl medián OS 53,7 měsíce vs. 41,5 měsíce v rameni s fulvestrantem + placebo (poměr rizik [HR] 0,73; 95% interval spolehlivosti [CI] 0,59–0,90). Ve druhé linii terapie většina pacientek léčených ribociklibem žila déle o šest měsíců – medián OS byl ve skupině s ribociklibem 39,7 měsíce oproti 33,7 měsíce ve skupině s fulvestrantem a placebem [1,2].
Studie MONALEESA‑2 zahrnovala 668 postmenopauzálních pacientek, které byly léčeny kombinací ribociklibu a letrozolu nebo kombinací letrozolu a placeba. Dosaženo bylo mediánu PFS 25,3 měsíce vs. 16,0 měsíců. Kombinace letrozol a ribociklib prokázala významný přínos v OS – medián dosáhl 63,9 měsíce ve srovnání s 51,4 měsíce u pacientek léčených kombinací letrozol + placebo. Poprvé v historii luminálních nádorů bylo dosaženo OS více než pět let [3–4].
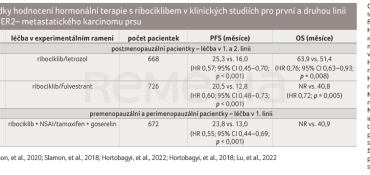 Jedinou studií, v níž byl zkoumán efekt inhibitorů CDK 4/6 s HT u premenopauzálních pacientek, byla MONALEESA‑7. Zařazovány do ní byly premenopauzální nebo perimenopauzální pacientky, které byly randomizovány do ramene s kombinací ribociklibu a tamoxifenu nebo nesteroidního inhibitoru aromatázy a goserelinu nebo do ramene s tamoxifenem/nesteroidním inhibitorem aromatázy + goserelinem. Část pacientek (14 %) byla předléčena CHT. Medián PFS dosáhl 23,8 měsíce ve skupině s ribociklibem a 13,0 měsíců ve skupině pouze s HT. Prospěch z léčby byl zaznamenán i v OS, které dosáhlo 48 měsíců v rameni s HT a 58,7 měsíce v rameni s ribociklibem. Skupinová analýza byla konzistentní s celkovými výsledky včetně skupiny pacientek léčených nesteroidním inhibitorem aromatázy a pacientek mladších 40 let (tab. 1) [5].
Jedinou studií, v níž byl zkoumán efekt inhibitorů CDK 4/6 s HT u premenopauzálních pacientek, byla MONALEESA‑7. Zařazovány do ní byly premenopauzální nebo perimenopauzální pacientky, které byly randomizovány do ramene s kombinací ribociklibu a tamoxifenu nebo nesteroidního inhibitoru aromatázy a goserelinu nebo do ramene s tamoxifenem/nesteroidním inhibitorem aromatázy + goserelinem. Část pacientek (14 %) byla předléčena CHT. Medián PFS dosáhl 23,8 měsíce ve skupině s ribociklibem a 13,0 měsíců ve skupině pouze s HT. Prospěch z léčby byl zaznamenán i v OS, které dosáhlo 48 měsíců v rameni s HT a 58,7 měsíce v rameni s ribociklibem. Skupinová analýza byla konzistentní s celkovými výsledky včetně skupiny pacientek léčených nesteroidním inhibitorem aromatázy a pacientek mladších 40 let (tab. 1) [5].
Karcinom prsu je onemocněním žen, nicméně 1 % z celkového počtu vzniká i u mužů. Minimálně posledních 10 let jsou i muži zařazováni do klinických studií pro karcinom prsu. V případě ribociklibu byl prokázán efekt u pacientů ve studii CompLEEment, kam bylo zařazeno 39 mužů z celkem 3 246 pacientů. Léčeni byli kombinací letrozol + ribociklib + goserelin/leuprorelin. Primárními cílovými ukazateli byly bezpečnost a tolerance, sekundárním cílovým ukazatelem efektivita léčby. Při mediánu sledování 25,4 měsíce nebylo dosaženo progrese onemocnění ve srovnání s 27,1 měsíce u celkové populace. V mužské populaci byl zaznamenán nižší výskyt nežádoucích účinků včetně těch, které vedly k přerušení nebo ukončení studijní terapie. Nejčastějším nežádoucím účinkem byla neutropenie, která u mužů dosahovala stupně 3 a více ve 41,0 % ve srovnání s 57,2 % u celkové populace [6].
Prognosticky méně příznivé je onemocnění s viscerálními metastázami ve srovnání s metastatickým postižením skeletu nebo měkkých tkání. Do objevení se HT kombinované s cílenou terapií bylo velmi častou léčebnou variantou podání CHT. V současnosti podáváme kombinaci HT s inhibitory CDK 4/6 i v případě viscerálních metastáz. Jedinou výjimkou byla tzv. viscerální krize, kdy bylo doporučeno podání CHT. Ale i toto doporučení dnes neplatí jednoznačně, a to na základě výsledků klinické studie RIGHT Choice, kam byly zařazovány premenopauzální a perimenopauzální pacientky s hrozící viscerální krizí [7]. Tato byla definována jako symptomatické viscerální metastázy, rychlá progrese onemocnění nebo viscerální krize, popř. výrazné symptomatické non‑viscerální onemocnění. Z celkem 222 pacientek s agresivním onemocněním, které byly léčeny ve studii, prodělalo více než 50 % viscerální krizi. V jednom rameni byly nemocné léčeny kombinací ribociklib + letrozol/anastrozol + goserelin, ve druhém rameni CHT podle výběru lékaře (docetaxel + kapecitabin, paklitaxel + gemcitabin nebo kapecitabin + vinorelbin). Podáním kombinace ribociklibu s HT bylo dosaženo téměř dvojnásobného prodloužení PFS ve srovnání s paliativní CHT (24,0 měsíce vs. 12,3 měsíce). Léčebná kombinace ribociklibu s HT prokázala stejně rychlý nástup účinku jako kombinovaná CHT při lepší toleranci léčby.
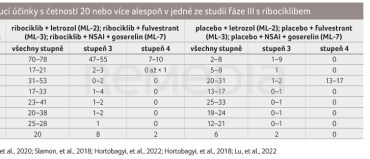 V klinické praxi není důležitá pouze účinnost léku, ale také jeho tolerance – výskyt nežádoucích účinků, které mohou zásadně zhoršovat kvalitu života pacientů. U ribociklibu je nejčastěji se vyskytujícím nežádoucím účinkem neutropenie. Kromě neutropenie je vhodné z dalších nežádoucích účinků všech stupňů zmínit nevolnost, únavu, průjem a zvracení, dále jsou popisovány výskyt elevace hodnot transamináz nebo prodloužení QTc intervalu. Nežádoucí účinky jsou řešeny přerušením terapie nebo redukcí dávky léku. Všechny nežádoucí účinky se nejčastěji objevují v úvodních dvou cyklech terapie, proto je pravidelná monitorace možných nežádoucích účinků dle doporučení v SPC nutností. Redukce dávky nevede ke snížení efektivity terapie (tab. 2).
V klinické praxi není důležitá pouze účinnost léku, ale také jeho tolerance – výskyt nežádoucích účinků, které mohou zásadně zhoršovat kvalitu života pacientů. U ribociklibu je nejčastěji se vyskytujícím nežádoucím účinkem neutropenie. Kromě neutropenie je vhodné z dalších nežádoucích účinků všech stupňů zmínit nevolnost, únavu, průjem a zvracení, dále jsou popisovány výskyt elevace hodnot transamináz nebo prodloužení QTc intervalu. Nežádoucí účinky jsou řešeny přerušením terapie nebo redukcí dávky léku. Všechny nežádoucí účinky se nejčastěji objevují v úvodních dvou cyklech terapie, proto je pravidelná monitorace možných nežádoucích účinků dle doporučení v SPC nutností. Redukce dávky nevede ke snížení efektivity terapie (tab. 2).
Závěr
Kombinace hormonoterapie s inhibitory CDK 4/6 se stala standardní léčebnou modalitou v první nebo druhé linii léčby u pacientek s HR+/HER2– metastatickým karcinomem prsu. Léčba je dobře tolerována, nejčastějšími nežádoucími účinky terapie ribociklibem jsou neutropenie, nevolnost, únava a průjem. Nežádoucí účinky se řeší odkladem nového cyklu terapie nebo redukcí dávky léku. Opakovaně ve studiích MONALEESA‑2, ‑3 a ‑7 nebyl prokázán nižší léčebný efekt při redukované dávce ribociklibu. Léčebnou kombinaci lze podat nejen u žen, ale jsou doklady pro její účinnost, bezpečnost a dobrou toleranci rovněž u mužů. Nedávno prezentovaná data ze studie RIGHT Choice ukazují, že ribociklib v kombinaci s hormonoterapií lze podat i pacientkám s rychle progredujícím onemocněním nebo s hrozící viscerální krizí.
Literatura
[1] Slamon DJ, Neven P, Chia S, et al. Overall survival with ribociclib and fulvestrant in advanced breast cancer. N Engl J Med 2020; 382: 514–524.
[2] Slamon DJ, Neven P, Chia S, et al. Phase III randomized study of ribociclib and fulvestrant in hormone receptor‑positive, HER2‑negative advanced breast cancer: MONALEESA‑3. J Clin Oncol 2018; 36: 2465–2472.
[3] Hortobagyi GN, Stemmer SM, Burris HA, et al. Overall survival with ribociclib and letrozole in advanced breast cancer. N Engl J Med 2022; 386: 942–950.
[4] Hortobagyi GN, Stemmer SM, Burris HA, et al. Updated results from MONALEESA‑2, a phase III trial of first‑line ribociclib plus letrozole versus placebo plus letrozole in hormone‑receptor‑positive, HER2‑negative advanced breast cancer. Ann Oncol 2018; 29: 1541–1547.
[5] Lu YS, Im SA, Colleoni M, et al. Updated overall survival of ribociclib plus endocrine therapy versus endocrine therapy alone in pre‑ and perimenopausal pacients with HR+/HER2– advanced breast cancer in MONALEESA‑7: A phase III randomized clinical trial. Clin Cancer Res 2022; 28: 851–859.
[6] Campone M, De Laurentiis M, Zamagni C, et al. Ribociclib plus letrozole in male patients with hormone receptor‑positive, human epidermal growth factor receptor‑negative advanced breast cancer: subgroup analysis of the phase IIIb CompLEEment‑1 trial. Breast Cancer Res Treat 2022; 193: 95–103.
[7] Lu YS, Bin Mohd Mahidin EI, Azim H, et al. Primary results from the randomized phase II RIGHT Choice trial of premenopausal patients with aggressive HR+/HER2– advanced breast cancer treated with ribociclib + endocrine therapy vs physician’s choice combination chemotherapy. Cancer Res 2023; 83(5 Suppl): GS1–10.