Sekukinumab v terapii psoriatické artritidy – bezpečnost a kvalita života pacientů
Souhrn:
Psoriatická artritida (PsA) je chronické zánětlivé autoimunitní onemocnění postihující muskuloskeletální aparát a kůži, které podle své závažnosti ovlivňuje výrazně kvalitu života nemocných. Dvě rozsáhlé studie FUTURE 1 a FUTURE 2 prokázaly dobrou účinnost sekukinumabu, včetně dobrého bezpečnostního profilu a ukazatelů hodnocení efektu léčby pacientem prostřednictvím standardizovaných dotazníků. Sekukinumab se stal první monoklonální protilátkou proti interleukinu 17A zavedenou do klinické praxe v terapii PsA.
Key words: psoriatic arthritis – biological therapy – interleukin 17A – secukinumab.
Summary:
Psoriatic arthritis (PsA) is a chronic autoimmune disease affecting musculoskeletal system and skin that markedly influences the quality of life in patients according to its severity. Two large trials, FUTURE 1 and FUTURE 2, showed adequate efficacy of secukinumab, including satisfactory safety profile and self‑reported efficacy end points of the therapy using standardized questionnaires. Secukinumab became the first monoclonal antibody against interleukin 17A introduced into clinical practice in the setting of PsA.
Úvod
Psoriatická artritida (PsA) je chronické zánětlivé autoimunitní onemocnění postihující pohybový aparát (axiální skelet, klouby a enteze), které bývá ve většině případů doprovázeno typickými kožními projevy psoriázy. Psoriatická artritida patří mezi tzv. séronegativní spondyloartritidy, které jsou charakterizovány nepřítomností autoprotilátek typických pro revmatoidní artritidu (revmatoidní faktor, protilátky proti citrulinovanému peptidu). Přesná patogeneze tohoto onemocnění není dosud plně objasněna, ale jako u většiny autoimunitních zánětlivých revmatických chorob se předpokládá multifaktoriální podíl celé řady vlivů (genetická predispozice, infekce, vlivy zevního prostředí, trauma, léky) [1,2].
U nemocných s PsA dochází postupem času k rozvoji různých systémových komorbidit, stoupá zde riziko kardiovaskulárních chorob, malignit a větší náchylnosti k oportunním infekcím. Dalším faktorem přispívajícím k vyšší mortalitě a morbiditě pacientů je dlouhodobé užívání systémové terapie s její kumulativní toxicitou. Nástup biologické terapie (biological disease modifying antirheumatic drugs, bDMARDs) výrazně ovlivnil prognózu a projevy choroby. Psoriatická artritida je onemocnění, které je potencionálně invalidizující ve svých obzvláště závažných formách. Pohybové omezení a postižení kůže výrazně ovlivňuje kvalitu života nemocných ve všech psychosociálních rovinách existence. Cílem úspěšné léčby PsA je dosažení jak kloubní, tak kožní remise za co možná nejkratší dobu od zahájení podávání terapie [3].
Sekukinumab je monoklonální protilátka selektivně zaměřená proti interleukinu 17A (IL 17A), která prokázala svou účinnost v léčbě středně těžké a těžké psoriázy nereagující na konvenční terapeutické prostředky. Analýzou výsledků studií fáze II a III zaměřených na populaci pacientů s psoriázou byl kromě dobrého efektu na zvládnutí postižení kůže prokázán rovněž účinek na muskuloskeletální aparát. Studie FUTURE 1 a FUTURE 2 již zaměřené na nemocné s PsA sledovaly nejen účinnost a bezpečnost, ale i ukazatele kvality života hodnocené pacientem pomocí standardizovaných dotazníků [4].
Sekukinumab – farmakologické vlastnosti a způsob podávání
Sekukinumab je monoklonální plně humánní IgG1κ protilátka se schopností selektivní vazby IL 17A inhibující jeho interakce s příslušným receptorem pro IL 17 (rIL 17), který je exprimován na keratinocytech, endoteliálních buňkách, chondrocytech a osteoblastech. Touto cestou je zabraňováno uvolňování prozánětlivých cytokinů a chemokinů aktivovaných interakcí IL 17A/rIL 17 u zánětlivých a autoimunitních onemocnění. Inhibice IL 17A vede k potlačení kožních projevů psoriázy (erytém, deskvamace pokožky). Mechanismus účinku sekukinumabu na pohybový aparát u pacientů s PsA vychází z předpokladu negativního ovlivnění zvýšené exprese IL 17A v subchondrální kostní dřeni intervertebrálních kloubů a tím k zabránění vzniku lokálního zánětu [4‒6].
Sérové koncentrace IL 17A rostou zpočátku zahájení terapie, jedná se jak o volnou frakci, tak i o IL 17A navázaný na molekulu sekukinumabu. Maximální plazmatické koncentrace sekukinumabu s dosažením rovnovážného stavu bylo docíleno po 31‒34 dnech podávání. Rovnovážného stavu s maximální dosaženou koncentrací 55,2 µg/ml a 27,6 µg/ml pro subkutánní podání 300 mg nebo 150 mg sekukinumabu bylo docíleno po 20 týdnech. Biologická dostupnost sekukinumabu byla odhadována na 73 % a distribuční objem pak na 7,1 l a 8,6 l. Clearance sekukinumabu je 0,19 l/den a není ovlivněna dávkou, distribučním objemem a časem. Průměrný poločas eliminace sekukinumabu u pacientů s psoriázou je 27 dní.
Nemocní s PsA se středně těžkou až těžkou ložiskovou psoriázou nebo ti, u nichž selhala předchozí terapie využívající inhibitorů tumor nekrotizujícího faktoru alfa (TNFα), mají doporučenou indukční dávku 300 mg ve formě subkutánní injekce v týdnu 0, 1, 2, 3 a 4, následovanou měsíční udržovací dávkou. U ostatních indikací je doporučeno podat subkutánně 150 mg sekukinumabu ve schématu týden 0, 1, 2, 3 a 4 a následně pokračovat měsíční udržovací dávkou 150 mg.
Sekukinumab je kontraindikován při známé alergické reakci na některé složky podávaného přípravku a dále u závažné infekce včetně aktivní tuberkulózy. Přípravek není dosud určen těhotným ženám. V průběhu léčby se nedoporučuje podávat živé vakcíny a pacienti by měli být očkováni před zahájením biologické terapie [4,7,8].
Studie fáze III
Studie fáze III FUTURE 1 a FUTURE 2 sledovaly efekt a bezpečnost sekukinumabu v terapii PsA. V těchto studiích a v jejich následných extenzích byl také kladen důraz na ukazatele hodnotící psychosociální aspekty PsA v rámci terapie.
FUTURE 1
Dvojitě zaslepená, placebem kontrolovaná studie fáze III byla zaměřena na pacienty s PsA v celkovém počtu 606 osob, u nichž se i přes podanou terapii nepodařilo dosáhnout remise onemocnění. Randomizace byla stanovena podle schématu 1 : 1 : 1, ve skupině bylo 71 % anti TNF naivních nemocných. Terapie byla zahájena intravenózním podáváním sekukinumabu v dávce 10 mg/kg v týdnu 0, 2 a 4 a byla následována subkutánním užíváním studijní medikace každé 4 týdny podle skupin (sekukinumab v dávce 150 mg nebo 75 mg nebo placebo). V týdnu 16 nebo 24 byli pacienti v placebové skupině rerandomizováni dle klinické odpovědi do dvou skupin nemocných, jimž byl podáván sekukinumab v dávce 150 mg nebo 75 mg.
Mezi primární cílové ukazatele
studie patřilo dosažení klinické odpovědi ACR 20 (kritérium 20%
zlepšení podle American College of Rheumatology) ve 24. týdnu,
dále snížení hodnot reaktantů akutní fáze (hodnota
C reaktivního proteinu [CRP], sedimentace erytrocytů)
a zlepšení výsledků v rámci dotazníku aktivity
hodnocené podle skóre HAQ DI (Health Assessment
Questionnaire Disability Index).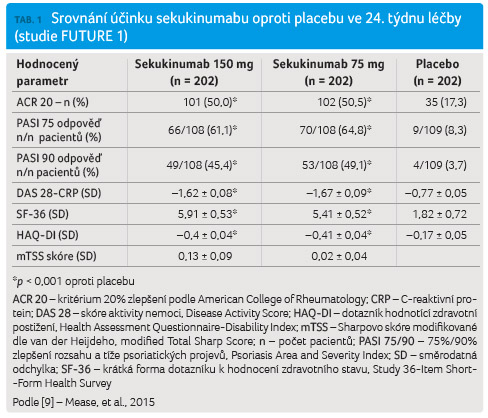
Sekundární cílové ukazatele zahrnovaly dosažení terapeutické odpovědi v indexu rozsahu a tíže psoriatických projevů PASI (Psoriasis Area and Severity Index) ze 75 % a z 90 %, ve skóre DAS 28 CRP (Disease Activity Score C reactive protein), a dále klinické odpovědi ACR 50 a změny ve výsledcích dotazníku hodnocení kvality života pomocí skóre SF 36 (Study 36 Item Short Form Health Survey) ve 24. týdnu. Hodnocení radiografické progrese bylo provedeno pomocí Sharpova skóre modifikovaného dle van der Heijdeho (modified Total Sharp Score, mTSS) k posouzení účinku sekukinumabu na strukturální změny.
Primárních cílových ukazatelů bylo dosaženo a klinická odpověď ACR 20 byla ve 24. týdnu zaznamenána u statisticky signifikantně více pacientů užívajících sekukinumab v dávce 150 mg (50,0 %) a 75 mg (50,5 %) oproti placebové skupině (17,3 %; p < 0,001 pro obě skupiny). Rovněž bylo dosaženo sekundárních cílových ukazatelů (tab. 1).
Studie FUTURE 1 pokračovala extenzí, jež sledovala vybrané ukazatele choroby a kvality života nemocných. Sekukinumab prokázal udržení klinické odpovědi a dobré kvality života [9,10].
FUTURE 2
Dvojitě zaslepená, placebem
kontrolovaná multicentrická studie fáze III sledovala efektivitu
subkutánně podávaného sekukinumabu (300 mg, 150 mg a 75 mg)
u pacientů s vysokou aktivitou PsA. Ve studii bylo
celkem 397 pacientů randomizovaných podle schématu 1 : 1 : 1 : 1
z hlediska podávané medikace. Studijní medikace byla užívána
jedno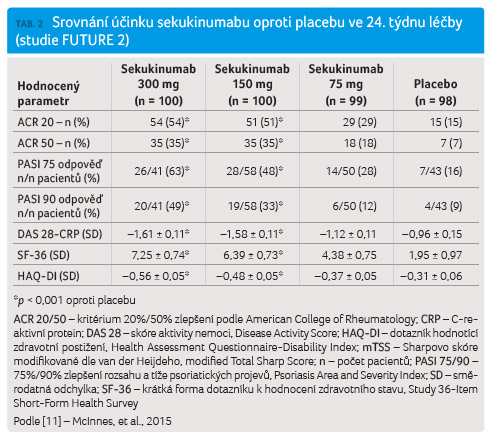 u týdně do 4. týdne terapie, a dále pak
ve čtyřtýdenním intervalu. Primární cílové ukazatele
byly principiálně obdobné jako ve studii FUTURE 1
a ve 24. týdnu dosáhlo terapeutické odpovědi ACR
20 celkem 54,0 % pacientů užívajících sekukinumab v dávce
300 mg (p < 0,0001),
51 % nemocných s dávkou 150 mg (p < 0,0001)
a 29,3 % jedinců s dávkou 75 mg (p < 0,0399)
oproti 15,3 % pacientů v placebové skupině. Rovněž další
sledované ukazatele dosahovaly statisticky signifikantně výrazného
zlepšení ve skupinách pacientů dostávajících sekukinumab
oproti placebové větvi. Efekt sekukinumabu přetrvával po celou
dobu 52týdenního sledování a klinická i laboratorní
odpověď byly statisticky významné ve srovnání s placebovou
větví. V 52. týdnu bylo klinické odpovědi ACR 20
ve skupinách užívajících sekukinumab dosaženo v 73 %
(300 mg), v 73 % (150 mg) a v 67 % (75 mg)
(tab. 2) [11].
u týdně do 4. týdne terapie, a dále pak
ve čtyřtýdenním intervalu. Primární cílové ukazatele
byly principiálně obdobné jako ve studii FUTURE 1
a ve 24. týdnu dosáhlo terapeutické odpovědi ACR
20 celkem 54,0 % pacientů užívajících sekukinumab v dávce
300 mg (p < 0,0001),
51 % nemocných s dávkou 150 mg (p < 0,0001)
a 29,3 % jedinců s dávkou 75 mg (p < 0,0399)
oproti 15,3 % pacientů v placebové skupině. Rovněž další
sledované ukazatele dosahovaly statisticky signifikantně výrazného
zlepšení ve skupinách pacientů dostávajících sekukinumab
oproti placebové větvi. Efekt sekukinumabu přetrvával po celou
dobu 52týdenního sledování a klinická i laboratorní
odpověď byly statisticky významné ve srovnání s placebovou
větví. V 52. týdnu bylo klinické odpovědi ACR 20
ve skupinách užívajících sekukinumab dosaženo v 73 %
(300 mg), v 73 % (150 mg) a v 67 % (75 mg)
(tab. 2) [11].
Výsledky sdělované pacientem ve studiích FUTURE 1 a FUTURE 2
Psoriatická artritida je onemocněním
zasahujícím do všech rovin života nemocného, jednak
omezením fyzické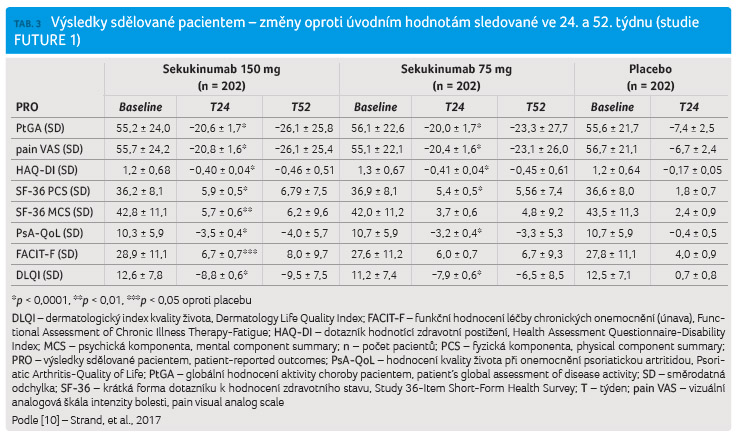 aktivity, jednak ovlivněním psychosociálních
složek. Terapie PsA není soustředěna jen na zvládnutí
projevů postihujících pohybový aparát, ale její nedílnou
součástí je rovněž eliminace kožního postižení. Kožní
projevy jsou často spojeny se sníženou kvalitou života, obzvláště
pokud se jedná o velký rozsah postižených ploch.
aktivity, jednak ovlivněním psychosociálních
složek. Terapie PsA není soustředěna jen na zvládnutí
projevů postihujících pohybový aparát, ale její nedílnou
součástí je rovněž eliminace kožního postižení. Kožní
projevy jsou často spojeny se sníženou kvalitou života, obzvláště
pokud se jedná o velký rozsah postižených ploch.
Nedílnou součástí studií FUTURE 1 a FUTURE 2 byly výsledky sdělované pacientem (patient reported outcomes, PRO) hodnotící efekt léčby z pohledu nemocných. Sledování PRO zahrnovalo řadu ukazatelů hodnocených pomocí skórovacích systémů HAQ DI, SF 36, FACIT F (Functional Assessment of Chronic Illness Therapy Fatigue) a PsA QoL (Psoriatic Arthritis Quality of Life) (tab. 3, 4).
Studie FUTURE 1 prokázala dobrou
klinickou účinnost sekukinumabu, jež se odrazila
i ve sledování PRO. Vyhodnocení skórovacích
systémů zaměřených na PRO prokázalo zlepšení ve všech
parametrech.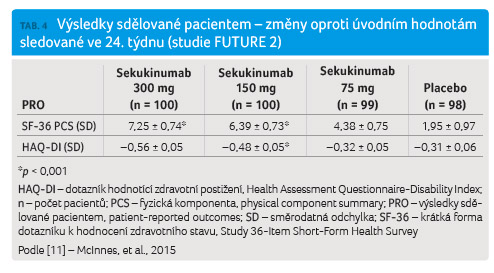
Skóre v doménách SF 36 v úvodu studie bylo nižší v porovnání s běžnou populací, nicméně v průběhu terapie sekukinumabem docházelo k výraznému statisticky signifikantnímu zlepšení v doméně sledující mentální i fyzickou složku. Ve 24. týdnu celkem 50,5 % pacientů užívajících sekukinumab v dávce 150 mg a 51 % pacientů s dávkou 75 mg vykázalo zlepšení ve skóre SF 36 oproti 39 % v placebové skupině. U nemocných docházelo ke zlepšení celkového stavu, a tím také ke zlepšení ve všech doménách SF 36 (tab. 3).
Sekukinumab prokázal dobrý účinek na symptomy PsA odrážející se ve statisticky významném zlepšení PRO hodnotících nejen celkovou aktivitu onemocnění, ale i psychosociální složku života nemocných s PsA [9‒11].
Bezpečnostní profil sekukinumabu
Sledování bezpečnosti terapie je nedílnou součástí klinických hodnocení. Pochybnosti ohledně inhibice IL 17A vycházely z jeho role v organismu, obzvláště obávaný byl výskyt neutropenie a mykotické infekce.
Analýza 10 studií fáze II a III
zahrnující celkem 3 993 pacientů s psoriázou prokázala
uspokojivý bezpečnostní profil sekukinumabu. Nebyly zjištěny
statisticky významné rozdíly mezi jednotlivými dávkami
sekukinumabu (150 mg a 300 mg). Studie srovnávající
účinek sekukinumabu proti etanerceptu rovněž nezjistily
statisticky významné rozdíly mezi nežádoucími účinky
spojenými s podáváním těchto bDMARDs v průběhu
hodnocení. Mezi zvlášť sledované nežádoucí účinky patřily
kandidózy. Incidence jejich výskytu byla nízká a byly
pozorovány pouze slizniční infekce. V průběhu klinických
sledování pacientů s psoriázou nebyl zachycen výskyt či
reaktivace tuberkulózy. Incidence neutropenie byla rovněž nízká
a její závažnost mírná [12].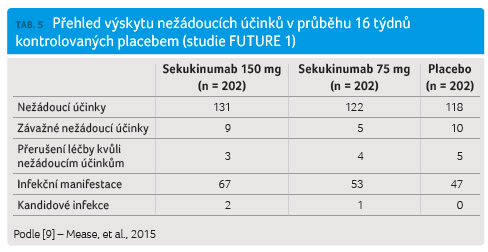
Dvě rozsáhlé studie fáze III FUTURE 1 a FUTURE 2 sledující pacienty s PsA prokázaly i v této populaci nemocných dobrou toleranci sekukinumabu. Výskyt nežádoucích účinků byl vyhodnocován po průměrnou dobu podávání sekukinumabu, která u studie FUTURE 1 činila 438,5 dne a u studie FUTURE 2 pak 411,7 dne. Incidence nežádoucích účinků byla pro FUTURE 1 celkem 471 a pro FUTURE 2 celkem 307, vztaženo na 100 pacientoroků. Stejně jako u předchozích klinických sledování zabývajících se populací pacientů s psoriázou patřily mezi nejčastěji hlášené nežádoucí účinky nazofaryngitidy, infekty horních cest dýchacích a bolesti hlavy. Závažné nežádoucí příhody byly v obou studiích velmi vzácné (tab. 5, tab. 6).
Výskyt kandidózy byl zaznamenán
u tří pacientů ve studii FUTURE 1 a u dvou
pacientů ve studii FUTURE 2 ve skupině nemocných
léčených sekukinumabem, v placebové skupině nebyla
kandidóza hlášena. Nová manifestace Crohn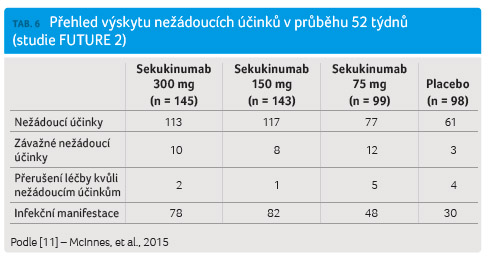 ovy choroby byla hlášena
v rámci studie FUTURE 1 u jednoho pacienta
užívajícího sekukinumab a u jednoho pacienta
v placebové skupině. Výskyt neutropenie byl popsán u 12
nemocných užívajících sekukinumab ve studii FUTURE 1
a u pěti nemocných se sekukinumabem ve studii FUTURE
2, hematologické změny byly reverzibilní a nevýznamné.
Velmi vzácný byl výskyt kardiovaskulárních nebo nádorových
onemocnění u pacientů, jimž byl podáván sekukinumab.
Dokonané sebevraždy nebo pokus o sebevraždu nebyly hlášeny
u žádného pacienta ve sledované populaci.
ovy choroby byla hlášena
v rámci studie FUTURE 1 u jednoho pacienta
užívajícího sekukinumab a u jednoho pacienta
v placebové skupině. Výskyt neutropenie byl popsán u 12
nemocných užívajících sekukinumab ve studii FUTURE 1
a u pěti nemocných se sekukinumabem ve studii FUTURE
2, hematologické změny byly reverzibilní a nevýznamné.
Velmi vzácný byl výskyt kardiovaskulárních nebo nádorových
onemocnění u pacientů, jimž byl podáván sekukinumab.
Dokonané sebevraždy nebo pokus o sebevraždu nebyly hlášeny
u žádného pacienta ve sledované populaci.
V průběhu obou studií bylo zaznamenáno pouze jedno úmrtí, a to ve studii FUTURE 1 v důsledku trombózy intrakraniálního venózního sinu [9‒11].
Závěr
Cílem terapie PsA je rychlé navození remise všech manifestací onemocnění zahrnujících pohybový aparát a postižení kůže. Sekukinumab je první anti IL17A bDMARD registrovaný pro léčbu PsA v České republice. Sekukinumab se již etabloval v léčbě psoriázy a rozsáhlá analýza studií fáze II a III stran výskytu nežádoucích účinků prokázala jeho dobrou snášenlivost a bezpečnostní profil, který se rámcově neliší od dalších monoklonálních protilátek využívaných v terapii tohoto onemocnění. Studie FUTURE 1 a FUTURE 2 zaměřené na nemocné s PsA vykazovaly rámcově výskyt obdobných nežádoucích účinků. Obavy z vyšší incidence závažných mykotických infekcí či hematologických nežádoucích účinků se nepotvrdily.
Účinnost a bezpečnostní profil nejsou jedinými významnými položkami sledovanými v průběhu léčby. Důležitou součástí jsou rovněž PRO, které odrážejí klinickou účinnost sekukinumabu vnímanou pacienty při ústupu manifestací PsA. Studie FUTURE 1 a FUTURE 2 ve svých primárních i sekundárních cílových ukazatelích dosáhly statisticky významných rozdílů ve vztahu k PRO v průběhu sledování a na jeho konci v porovnání s úvodními hodnotami.
Sekukinumab je dalším dostupným lékem vhodným pro terapii PSA, který dokáže dobře ovlivnit symptomy tohoto onemocnění a prokazatelně zlepšuje kvalitu života nemocných.
Podpořeno projektem (Ministerstva zdravotnictví ČR) koncepčního rozvoje výzkumné organizace 023728 (Revmatologický ústav).
Seznam použité literatury
- [1] Maharaj AB, Chandran V. Treatment of psoriatic arthritis with traditional DMARD’s and novel therapies: approaches and recommendations. Expert Rev Clin Immunol 2016; 18: 1–13.
- [2] D’Angelo S, Tramontano G, Gilio M, et al. Review of the treatment of psoriatic arthritis with biological agents: choice of drug for initial therapy and switch therapy for non‑responders. Open Access Rheumatol 2017; 2: 21–28.
- [3] Gossec L, Coates LC, de Wit M, et al. Management of psoriatic arthritis in 2016: a comparison of EULAR and GRAPPA recommendations. Nat Rev Rheumatol 2016; 12: 743–750.
- [4] Miossec P. Update on interleukin‑17: a role in the pathogenesis of inflammatory arthritis and implication for clinical practice. RMD Open 2017; 3: e000284.
- [5] Speeckaert R, Lambert J, Grine L, et al. The many faces of interleukin‑17 in inflammatory skin diseases. Br J Dermatol 2016; 175: 892–901.
- [6] Ma WY, Jia K, Zhang Y. IL‑17 promotes keratinocyte proliferation via the downregulation of C/EBPα. Exp Ther Med 2016; 11: 631–636.
- [7] Cosentyx (secukinumab). Souhrn údajů o přípravku. European Medicines Agency, leden 2015. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/003729/WC500183129.pdf) [navštíveno 12. 7. 2017]
- [8] Coates LC, Helliwell PS. Psoriatic arthritis: state of the art review. Clin Med (Lond) 2017; 17: 65–70.
- [9] Mease PJ, McInnes IB, Kirkham B, et al. FUTURE 1 Study Group. Secukinumab inhibition of interleukin‑17A in patients with psoriatic arthritis. N Engl J Med 2015; 373: 1329–1339.
- [10] Strand V, Mease P, Gossec L, et al. FUTURE 1 Study Group. Secukinumab improves patient‑reported outcomes in subjects with active psoriatic arthritis: results from a randomised phase III trial (FUTURE 1). Ann Rheum Dis 2017; 76: 203–207.
- [11] McInnes IB, Mease PJ, Kirkham B, et al. FUTURE 2 Study Group. Secukinumab, a human anti‑interleukin‑17A monoclonal antibody, in patients with psoriatic arthritis (FUTURE 2): a randomised, double‑blind, placebo‑controlled, phase 3 trial. Lancet 2015; 386: 1137–1146.
- [12] van de Kerkhof PC, Griffiths CE, Reich K, et al. Secukinumab long‑term safety experience: A pooled analysis of 10 phase II and III clinical studies in patients with moderate to severe plaque psoriasis. J Am Acad Dermatol 2016; 75: 83–98.