Siponimod v léčbě roztroušené sklerózy – kazuistika
Souhrn:
Pavelek Z, Krótká I, Vališ M. Siponimod v léčbě roztroušené sklerózy – kazuistika. Remedia 2022; 32: 248–252.
Siponimod je registrován v České republice k léčbě sekundárně progresivní formy roztroušené sklerózy (SP-RS). Siponimod je prvním účinným léčivým přípravkem určeným k terapii pacientů se SP-RS, který příznivě ovlivňuje jak klinické parametry, tak parametry zjistitelné zobrazením na magnetické rezonanci. Je prezentováno období 18 let, kdy byla pacientka léčena pro RS.
Summary:
Pavelek Z, Krotka I, Valis M. Siponimod in the treatment of multiple sclerosis – a case study. Remedia 2022; 32: 248–252.
In the Czech Republic, siponimod is registered for the treatment of secondary progressive multiple sclerosis (SPMS). Siponimod is the first effective medicinal product for treating patients with SPMS, which favorably affects both clinical and magnetic resonance parameters. An 18‑year period of patient treatment for MS is presented.
Key words: multiple sclerosis, SPMS, siponimod.
Úvod
Roztroušená skleróza (RS) je chronické zánětlivé demyelinizační a neurodegenerativní onemocnění autoimunitní povahy postihující centrální nervový systém (CNS). Přestože je etiologie roztroušené sklerózy nejasná, dostupné léky modifikují průběh onemocnění. Právě pochopení mechanismů imunitně zprostředkovaného poškození složek CNS u RS umožnilo v poslední době zavádění nových léků.
V České republice jsou pro léčbu pacientů s RS aktuálně dostupné přípravky interferon beta 1a, interferon beta 1b, peginterferon beta 1a, glatiramer acetát, teriflunomid, dimetylfumarát, fingolimod, natalizumab, alemtuzumab, kladribin, ofatumumab a okrelizumab. Všechny zmíněné léky jsou účinné u nemocných s klinicky izolovaným syndromem (CIS) nebo s relabující remitující formou RS (RR-RS), žádný z nich však neprokázal účinnost u sekundárně progresivní formy RS (SP-RS).
Sekundárně progresivní RS je charakterizována postupně narůstající disabilitou bez tendence k úpravě. Relapsy se vyskytují u některých pacientů sporadicky. Fenotypy progresivní RS lze dělit na aktivní s progresí, aktivní bez progrese, neaktivní s progresí a neaktivní bez progrese [1]. Mezi méně nepříznivé faktory ve vztahu k vývoji SP-RS řadíme mužské pohlaví, multifokální CIS, inkompletní remisi po první atace, krátké období remise po první atace, vysoký počet relapsů v prvních 2–5 letech nemoci nebo vyšší věk [2,3]. Dvěma nejsilnějšími prognostickými faktory pro vývoj SP-RS jsou délka trvání nemoci a vyšší věk [4].
Sekundárně progresivní RS ovlivňuje každodenní aktivity a schopnost práce. Vede ke snížení schopnosti chůze: více než 90 % pacientů se SP-RS vyžaduje do tří let od začátku progrese pomoc při chůzi [5]. Až 80 % pacientů se SP-RS má kognitivní poruchu [6]. Pacienti popisují zhoršení vizuálních funkcí, funkcí horních končetin, častěji se vyskytují deprese, bolest, únava a močová inkontinence [7,8].
Z dosud testovaných léků byla u SP-RS ověřena účinnost siponimodu.
Siponimod – základní fakta
V České republice je siponimod indikován k léčbě dospělých pacientů se SP-RS s aktivním onemocněním doloženým relapsy nebo zánětlivou aktivitou pomocí zobrazovacích metod (gadolinium enhancující T1 léze nebo nová a zvětšující se T2 ložiska v obraze magnetické rezonance [MR]). Léčba by měla být ukončena při dosažení hodnoty 7,0 na rozšířené stupnici disability (Expanded Disability Status Scale, EDSS), tedy při ztrátě schopnosti chůze.
Siponimod – perorálně podávaný selektivní modulátor receptoru pro sfingosin 1 fosfát (S1P1 a S1P5) – inhibuje výstup lymfocytů z lymfatických uzlin a tím i vstup do CNS [9]. Reverzibilní sekvestrace lymfocytů v lymfoidních tkáních vede ke snížení počtu lymfocytů v periferní krvi, což ve výsledku omezuje recirkulaci T lymfocytů do CNS. Ke snížení počtu lymfocytů v krvi dochází během šesti hodin po první dávce. U pacientů s genotypem CYP2C9*1/*1 nebo *1/*2 dosahuje pokles počtu lymfocytů hodnoty odpovídající 20–30 % před léčbou. K úpravě počtu lymfocytů dochází u 90 % pacientů do 10 dnů od ukončení léčby. U pacientů zahajujících léčbu siponimodem je nezbytné dodržet jasně definovaný iniciační protokol léčby, který je závislý na zjištění typu metabolizéra pro stanovení dávky (genotyp CYP2C9 ovlivňuje systémovou clearance siponimodu). Pacienti s genotypem CYP2C9*3/*3 nesmějí siponimod užívat.
Siponimod se užívá perorálně. Léčba začíná dávkou 0,25 mg, která se podává jednou denně po dobu dvou dnů, následuje dávka 0,5 mg denně 3. den, 0,75 mg 4. den a 1,25 mg 5. den. Poté je užívána udržovací dávka 2 mg denně. U pacientů s genotypem CYP2C9*1/*3 nebo CYP2C9*2/*3 je doporučená dávka 1 mg denně, aby se zamezilo zvýšené expozici siponimodu. Pokud během prvních šesti dnů léčby pacient zapomene užít denní titrační dávku, je nutné znovu zahájit léčbu novým titračním balením.
Kazuistika
Pacientkou je 44letá žena (ročník
1978) s negativním předchorobím. V rodině pacientky se
nevyskytovaly žádné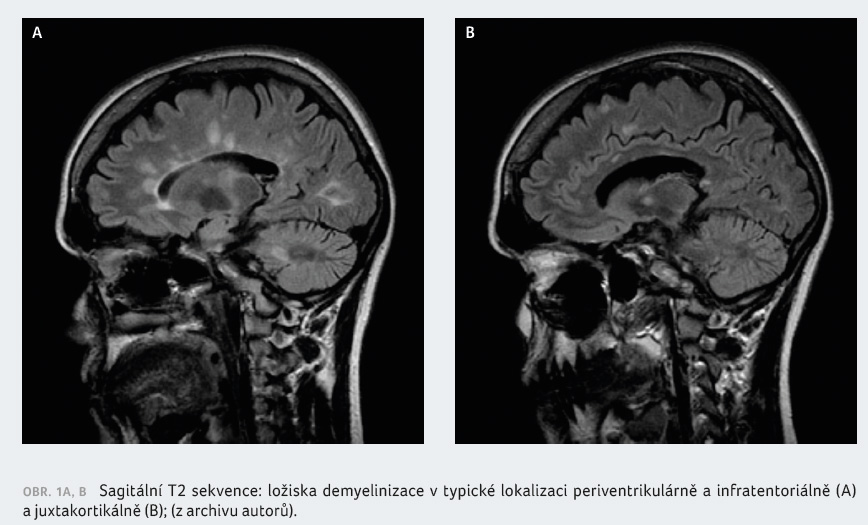 závažné neurologické diagnózy. V květnu
2004 prodělala zánět zrakového nervu vpravo a v říjnu
téhož roku byla vyšetřována pro levostrannou retrobulbární
neuritidu. V rámci vyšetřovacího procesu absolvovala MR
mozku. Ta podporovala diagnózu demyelinizačního onemocnění typu
RS pro nález ložisek periventrikulárně, juxtakortikálně
a infratentoriálně (obr. 1A, B). Diagnózu RS podpořilo
i vyšetření mozkomíšního moku (13 oligoklonálních pásů
v likvoru, které neměly korelát v séru). Při vyšetření
zrakových evokovaných potenciálů byla zjištěna
signifikantně prodloužená latence vlny P100 oboustranně. Nemocná
podstoupila pulzní intravenózní léčbu metylprednisolonem (IVMP)
v dávce 3× 1 000 mg. V prosinci 2004 byla
zahájena léčba interferonem beta 1 b (IFN) 250 µq obden
subkutánně (s.c.) v kombinaci s azathioprinem při EDSS
1,5.
závažné neurologické diagnózy. V květnu
2004 prodělala zánět zrakového nervu vpravo a v říjnu
téhož roku byla vyšetřována pro levostrannou retrobulbární
neuritidu. V rámci vyšetřovacího procesu absolvovala MR
mozku. Ta podporovala diagnózu demyelinizačního onemocnění typu
RS pro nález ložisek periventrikulárně, juxtakortikálně
a infratentoriálně (obr. 1A, B). Diagnózu RS podpořilo
i vyšetření mozkomíšního moku (13 oligoklonálních pásů
v likvoru, které neměly korelát v séru). Při vyšetření
zrakových evokovaných potenciálů byla zjištěna
signifikantně prodloužená latence vlny P100 oboustranně. Nemocná
podstoupila pulzní intravenózní léčbu metylprednisolonem (IVMP)
v dávce 3× 1 000 mg. V prosinci 2004 byla
zahájena léčba interferonem beta 1 b (IFN) 250 µq obden
subkutánně (s.c.) v kombinaci s azathioprinem při EDSS
1,5.
První ataku při léčbě IFN nemocná
vyvinula v květnu 2011 (relaps míšní symptomatiky), druhou
v lednu 2012 (relaps spastické paraparézy dolních
končetin) s progresí na EDSS 5,5. Při současně
provedené MR mozku byla zjištěna progrese ložisek (obr. 2A, B). Pacientka byla indikována k eskalaci na léčbu
2. linie (prodělala dvě ataky v průběhu osmi měsíců
při léčbě 1. volby, navíc byla prokázána progrese nálezu
na MR mozku). V červenci 2012, po ukončení léčby
IFN a šestiměsíční vymývací periodě po ukončení
podávání azathioprinu, byla zahájena léčba natalizumabem
(300 mg intravenózně v intervalu každé 4 týdny).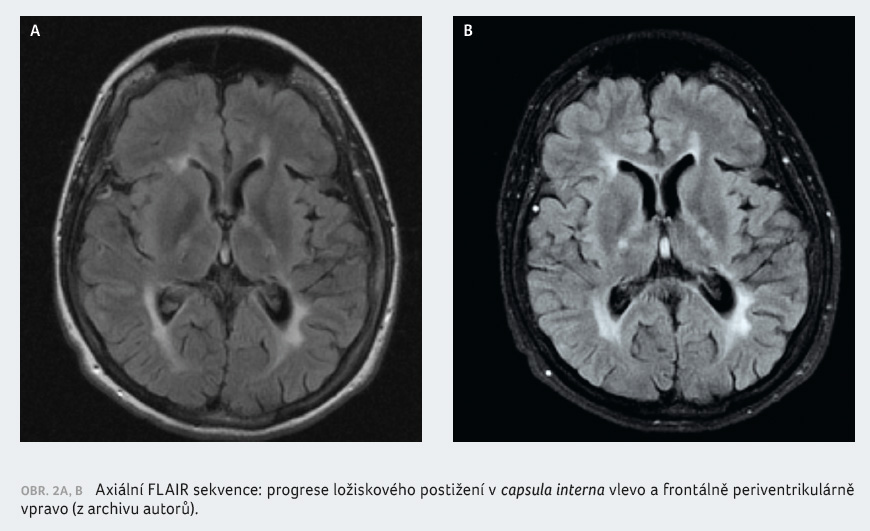
Od července 2012 do května 2019 byla pacientka bez relapsů, se stacionárním nálezem na MR, se stacionární hodnotou EDSS 5,5. V průběhu let však narůstal protilátkový JCV (John Cunningham virus) index až k hodnotě 3,9. S ohledem na riziko progresivní multifokální leukoencefalopatie (PML) byla po domluvě s pacientkou v květnu 2019 ukončena léčba natalizumabem a pacientce byla navržena léčba fingolimodem.
Před zahájením léčby fingolimodem pacientka absolvovala vyšetření oftalmologem (k vyloučení makulárního edému), kardiologem (k vyloučení srdeční arytmie), vyšetření hodnot protilátek proti viru varicella zoster, základní hematologické a biochemické vyšetření krve a vyšetření dermatologem (k vyloučení ev. bazaliomu). V červenci 2019 byla zahájena léčba fingolimodem. Protože zahájení léčby fingolimodem může vést k přechodnému snížení tepové frekvence a může být spojeno s poruchou atrioventrikulárního vedení, bylo před zahájením monitoringu a po šesti hodinách provedeno elektrokardiografické vyšetření (EKG), tepová frekvence a krevní tlak byly měřeny v hodinovém intervalu po dobu šestihodinového kontinuálního monitoringu.
V březnu 2021 byla pacientka
přeléčena pro relaps spastické paraparézy dolních končetin,
došlo ke zhoršení dle EDSS na 6,0 (pacientka používala
při chůzi hůl). V únoru 2022 nastala další progrese
deficitu (progrese nezávislá na relapsu) na EDSS 6,5
(chůze s oporou hole do 50 m). Magnetická rezonance
zobrazila mírnou mozkovou atrofii a atrofii kalózního tělesa
bez progrese počtu ložisek (obr. 3A, B). Byla stanovena
diagnóza SP-RS a navržena léčba siponimodem při EDSS 6,5.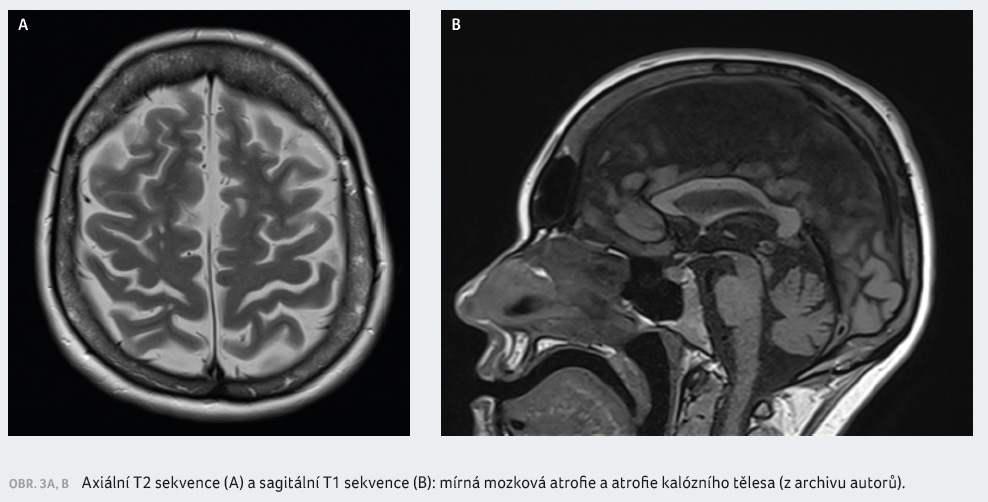
V rámci iniciačního protokolu léčby byl vyšetřen genotyp – CYP2C9*1/*1, krevní obraz, funkce jater (transaminázy a bilirubin), byl proveden těhotenský test a kontrolní sérologické vyšetření protilátek proti viru varicella zoster. Kontraindikace k zahájení léčby siponimodem nebyly shledány a léčba byla zahájena v březnu 2022 s titrací na udržovací dávku 2 mg denně.
Diskuse
Kazuistika popisuje osmnáctileté období pacientky léčené pro demyelinizační onemocnění typu RS. Během této doby byla nemocná léčena celkem čtyřmi přípravky – třemi léky pro atakovitou fomu (IFN, natalizumab a fingolimod) a jedním lékem pro SP-RS (siponimod).
Léčba IFN byla ukončena pro vysokou aktivitu nemoci (dvě ataky v průběhu 8 měsíců a progrese nálezu na MR mozku).
Velmi závažnou komplikací léčby natalizumabem je PML, infekční onemocnění mozku způsobené JC virem. Projevy PML zahrnují poruchy řeči, zraku, slabost, změny nálad a chování nebo epileptické záchvaty. Pacienty ohrožené vysokým rizikem onemocnění charakterizuje pozitivní výsledek testu protilátek proti JCV, vysoký index protilátek proti JCV (> 1,5) a léčba natalizumabem, která trvá déle než dva roky a jíž předcházelo užívání imunosupresiv. Vyšetření protilátek proti JCV a stanovení indexu jsou nezbytné nejen před zahájením léčby natalizumabem, ale i v jeho průběhu. U pacientů s vysokým rizikem vzniku PML je třeba pečlivě zvážit, zda přínosy léčby dostatečně převyšují toto riziko. Pro vysoký protilátkový JCV index (3,9) a předcházející imunosupresivní léčbu azathioprinem s ohledem na vysoké riziko PML byla u této pacientky změněna léčba na fingolimod.
Léčba fingolimodem byla ukončena pro potvrzenou progresi onemocnění. Bohužel, žádná definice pro SP-RS dosud nebyla všeobecně akceptována. Lorscheider a kol. publikovali práci hledající objektivní definici SP-RS, která by umožnila včasnou diagnózu a zohlednila dlouhodobé výstupy stran disability [10]. Studie hodnotila data získaná z velkého souboru pacientů z MSBase (n = 17 356) a analyzovala přesnost celkem 576 možných definic SP-RS. Definice vyhodnocená jako nejvíce vyhovující zahrnovala tyto ukazatele:
- progrese disability o 1 stupeň na škále EDSS u pacientů s EDSS ≤ 5,5 nebo progrese disability o 0,5 stupně u pacientů s EDSS ≥ 6 bez přítomnosti relapsů,
- minimální hodnota EDSS 4,
- pyramidový funkční systém – minimální skóre 2,
- potvrzená progrese ≥ 3 měsíce.
Tato definice prokázala 87% přesnost v porovnání s konsenzuálním stanoviskem tří nezávislých neurologů a o tři roky dřívější stanovení diagnózy SP-RS v porovnání s diagnózou stanovenou ošetřujícím lékařem.
Siponimod byl u pacientky zvolen po splnění indikačních kritérií a vyšetření v rámci iniciačního protokolu léčby. Indikační kritéria představují: vstupní hodnota EDSS 4–6,5; progrese disability o minimálně 1 stupeň EDSS u pacientů se vstupní hodnotou EDSS do 5,5 či o 0,5 stupně u pacientů se vstupní hodnotou EDSS nad 5,5; minimální doba trvání progrese disability 6 měsíců nezávisle na relapsech; aktivní onemocnění s prokázanými relapsy (v průběhu předchozích dvou let před zahájením léčby siponimodem) nebo se zánětlivou aktivitou na MR mozku (tj. gadolinium enhancující T1 léze nebo nová nebo zvětšující se T2 léze).
Závěr
Léčba roztroušené sklerózy je dlouhodobý proces, který musí být zahájen ihned po stanovení diagnózy RS. Výběr vhodného léku je zcela zásadní pro zachování funkční nezávislosti a udržení kvality života nemocného. Přestože jsou možnosti léčby RS v současné době již značné, doposud nebyl k dispozici dostatečně účinný lék na sekundárně progresivní formu RS. Právě siponimod rozšířil léčebné možnosti RS a je prvním účinným léčebným přípravkem určeným k léčbě pacientů se SP-RS.
Tato studie byla částečně podpořena granty Ministerstva zdravotnictví České republiky (FN HK 00179906) a Univerzity Karlovy v Praze, Česká republika (PROGRES Q40).
Seznam použité literatury
- [1] Lublin FD, Reingold SC, Cohen JA, et al. Defining the clinical course of multiple sclerosis: the 2013 revisions. Neurology 2014; 83: 278–286.
- [2] Confavreux C, Vukusic S, Adeleine P. Early clinical predictors and progression of irreversible disability in multiple sclerosis: an amnesic process. Brain 2003; 126: 770–782.
- [3] Vukusic S, Confavreux C. Prognostic factors for progression of disability in the secondary progressive phase of multiple sclerosis. J Neurol Sci 2003; 206: 135–137.
- [4] Larochelle C, Uphaus T, Prat A, et al. Secondary progression in multiple sclerosis: neuronal exhaustion or distinct pathology? Trends Neurosci 2016; 39: 325–339.
- [5] Scalfari A, Neuhaus A, Daumer M, et al. Onset of secondary progressive phase and long‑term evolution of multiple sclerosis. J Neurol Neurosurg Psychiatry 2014; 85: 67–75.
- [6] Papathanasiou A, Messinis L, Georgiou VL, et al. Cognitive impairment in relapsing remitting and secondary progressive multiple sclerosis patients: efficacy of a computerized cognitive screening battery. ISRN Neurol 2014; 2014: 151379.
- [7] Gross HJ, Watson C. Characteristics, burden of illness, and physical functioning of patients with relapsing‑remitting and secondary progressive multiple sclerosis: a cross‑sectional US survey. Neuropsychiatr Dis Treat 2017; 13: 1349–1357.
- [8] Beiske AG, Naess H, Aarseth JH, et al. Health‑related quality of life in secondary progressive multiple sclerosis. Mult Scler 2007; 13: 386–392.
- [9] Behrangi N, Fischbach F, Kipp M. Mechanism of Siponimod: Anti‑Inflammatory and Neuroprotective Mode of Action. Cells 2019; 8: 24.
- [10] Lorscheider J, Buzzard K, Jokubaitis V, et al. Defining secondary progressive multiple sclerosis. Brain 2016; 139: 2395–2405.