Teriflunomid v klinických studiích a real‑world analýzách
Úvod
Teriflunomid představuje imunomodulační lék určený k léčbě roztroušené sklerózy. Jedná se o doposud jediný perorálně podávaný přípravek v první linii léčby. Teriflunomid specificky a reverzibilně inhibuje dihydroorotát dehydrogenázu, enzym účastnící se syntézy pyrimidinu de novo. Omezením replikace DNA dochází k inhibici proliferace autoagresivních aktivovaných T a B lymfocytů. Teriflunomid je indikován k léčbě relabující remitující formy roztroušené sklerózy, podává se jednou denně v dávce 14 mg. Účinnost a bezpečnost léčby teriflunomidem zkoumala řada klinických hodnocení.
TEMSO
Klinická studie fáze III TEMSO (NCT00134563) si dala za cíl zhodnotit účinnost a bezpečnost léčby teriflunomidem oproti placebu. Randomizováno bylo 1 088 nemocných s roztroušenou sklerózou ve věku 18−55 let s disabilitou hodnocenou na škále EDSS (Expanded Disability Status Scale) 0−5,5, a to buď k léčbě 7 mg teriflunomidu, 14 mg teriflunomidu, nebo k podávání placeba. Primárním cílovým ukazatelem byl roční výskyt relapsů (ARR, annualized relapse rate). Sledování po dobu 108 týdnů ukázalo superioritu léčby teriflunomidem oproti placebu. Aktivní léčba snížila aktivitu onemocnění hodnocenou na zobrazení magnetickou rezonancí, progresi neurologického deficitu a redukovala ARR (0,37 pro teriflunomid vs. 0,54 pro placebo) se snížením relativního rizika o 31,2 %, resp. 31,5 % (p < 0,001) [1]. Z nežádoucích účinků se vyskytovaly průjem, nauzea, řídnutí vlasů, zvýšení aktivity alaninaminotransferázy.
Celkem 743 nemocných vstoupilo do extenze studie TEMSO (NCT00803049). Pacienti, kteří dříve dostávali aktivní léčbu, pokračovali stejnou dávkou, pacienti z placebové větve byli randomizováni v poměru 1 : 1 k podávání teriflunomidu v dávce 7 mg nebo 14 mg [2]. Analýza výsledků follow up studie prokázala účinnost a bezpečnost léčby teriflunomidem trvající devět let. Výsledky hodnocení bezpečnosti byly konzistentní s předchozími daty, neobjevily se nové nebo neočekávané nežádoucí účinky. U pacientů, kteří přešli z podávání placeba, nastal pokles aktivity onemocnění, u pacientů pokračujících v aktivní léčbě zůstala zachována aktivita nízká.
TENERE
Klinické hodnocení fáze III TENERE (NCT00883337) sledovalo léčbu teriflunomidem oproti terapii interferonem beta 1a (IFNβ 1a). Pacienti byli randomizováni v poměru 1 : 1 : 1 k léčbě teriflunomidem v dávce 7 mg, v dávce 14 mg nebo k subkutánní aplikaci 44 µg IFNβ 1a. Primárním cílovým ukazatelem byla doba do selhání léčby definovaná jako první výskyt potvrzeného relapsu nebo ukončení léčby z jakékoliv příčiny. Studie byla ukončena po 48 týdnech od randomizace posledního pacienta. Účinnost léčby teriflunomidem a IFNβ 1a byla srovnatelná. V rameni s podáváním 14 mg teriflunomidu a IFNβ 1a se nelišil ARR, vyšší byl zaznamenán ve větvi s dávkou teriflunomidu 7 mg. Únava hodnocená dle Fatigue Impact Scale byla častěji udávána při aplikaci IFNβ 1a, rozdíl byl signifikantní pouze oproti dávce teriflunomidu 7 mg. Významně pozitivněji hodnotili pacienti (dle Treatment Satisfaction Questionnaire for Medication) léčbu teriflunomidem [3].
TOWER
Přinést další doklady o efektivitě a bezpečnosti léčby teriflunomidem si dala za cíl klinická studie fáze III TOWER (NCT00751881). Dvojitě zaslepené kinické hodnocení sledovalo pacienty z 26 zemí randomizované v poměru 1 : 1 : 1 k léčbě teriflunomidem v dávkách 7 mg nebo 14 mg nebo k podávání placeba. Terapie teriflunomidem v dávce 14 mg byla asociována s nízkým ARR a s nízkým rizikem setrvalé kumulace disability v porovnání s placebem při zachování bezpečnostního profilu snášenlivosti z předešlého klinického hodnocení. Výsledky studie potvrdily jako optimální dávku pro léčbu 14 mg teriflunomidu [4].
Poolovaná analýza dat
Na podzimním kongresu ECTRIMS 2018 byly v posterové sekci prezentovány výsledky poolované analýzy studií fáze II (NCT01487096), fáze III (TEMSO, TOWER a TENERE) a jejich extenzí (NCT00228163, NCT00803049), které se týkaly dlouhodobé (až 12 let) účinnosti a bezpečnosti léčby teriflunomidem [5]. V hodnocených skupinách placeba a teriflunomidu „intention to treat“, tj. podle původního léčebného záměru, bylo zařazeno 812 a 896 pacientů. Kumulativní expozice léčbě teriflunomidem (14 mg) představovala 1 357 pacientoroků. Hodnoty ARR byly výrazně nižší u pacientů léčených teriflunomidem v dávce 14 mg (0,38; 95% interval spolehlivosti [CI]: 0,33–0,43) oproti placebu (0,59; 95% CI: 0,52–0,67), p < 0,0001. Míra disability (hodnoceno EDSS) zůstala stabilní po dobu 12 let (2,57 na počátku, na konci hodnota 2,27). Nežádoucí účinky se vyskytly u 86,4 % pacientů z placebové skupiny a u 89,7 % ze skupiny se 14 mg teriflunomidu, závažné nežádoucí účinky se vyskytly u 12,4 % a 12,8 % sledovaných. Podíl pacientů, kteří léčbu z důvodu nežádoucích účinků ukončili, byl 6,9 % a 13,1 %. Žádné nové signály týkající se bezpečnosti nebyly zaznamenány, většina zaznamenaných nežádoucích účinků byla mírné až střední intenzity.
TAURUS MS
Prospektivní observační studie
TAURUS MS hodnotila na úzení Německa léčbu
teriflunomidem v podmínkách reálné klinické praxe
u neselektovaných pacientů s relabující remitující
roztroušenou sklerózou. Vstupní charakteristiky zařazených
pacientů ukazuje tabulka 1.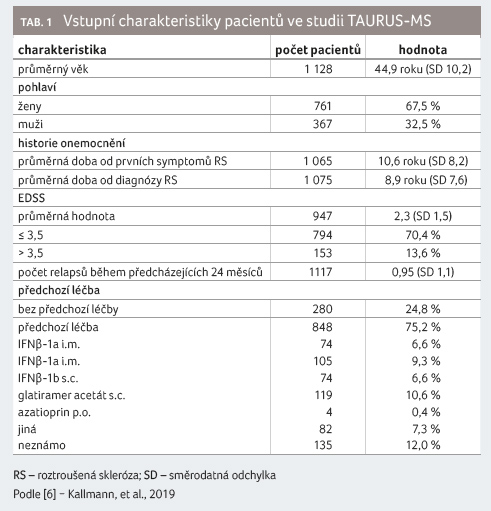
V porovnání s registračními studiemi (TEMSO, TOWER) se sledovaní v TAURUS MS podstatně lišili; byli starší (střední věk 44,9 roku vs. 37,9 roku), s delší dobou trvání nemoci (10,6 roku oproti 8,7, resp. 8,0 roku), s nižším skóre disability dle EDSS (medián 2,0 vs. 2,5 v obou studiích), s nižším podílem pacientů s EDSS > 3,5 (13,6 % oproti 22,8 %, resp. 25,5 %) a s nižším ARR (0,95 vs. 1,4) [6]. Také podíl pacientů s předchozí chorobu modifikující léčbou byl vyšší (75,2 % oproti 73 % a 67,2 %).
K analýze účinnosti dospělo po 24měsíčním sledování celkem 1 128 nemocných. Po 12 měsících léčby teriflunomidem byl střední počet relapsů 0,24 ± 0,53 (95% CI: 0,20−0,28), pro srovnání byl ARR 12 měsíců před vstupem do studie 0,59 ± 0,76 (95% CI: 0,54−0,65). Po 24 měsících léčby teriflunomidem byl ARR 0,35 ± 0,68 (95% CI: 0,29−0,0,41), kdežto 24 měsíců před léčbou 0,87 ± 1,10 (data 468 pacientů, 95% CI: 0,77−0,97; p ≤ 0,001).
Údaje hodnotící disabilitu (EDSS) a únavu (Fatigue Severity Scale) zůstaly zachovány. Při hodnocení spokojenosti (Treatment Satisfaction Questionnaire, TSQM 9) došlo při pozorování po 24 měsících ke zlepšení v bodech týkajících se účinnosti, pohodlí a všeobecné spokojenosti. Analýza hodnocení spokojenosti pacienta lékařem ukázala při léčbě teriflunomidem zlepšení; více než 90 % nemocných vnímalo podávání teriflunomidu jako jednoduché a snadno slučitelné s denním režimem.
Nežádoucí účinky jakékoliv závažnosti se vyskytly u 35,8 % (408 z 1 139 hodnocených), závažné pak u 13,0 % (148 pacientů). Nejčastěji byly hlášeny průjem, relaps onemocnění, řídnutí vlasů a virové infekce horních cest dýchacích.
Hodnocení spokojenosti s léčbou
V posterové sekci ECTRIMS 2018 byla prezentována také data sledující spokojenost s léčbou teriflunomidem [7]. Analýza hodnotila pacienty zařazené v extenzi studie TENERE (NCT00883337), kteří přešli z podávání INFβ 1a aplikovaného subkutánně třikrát týdně na perorální podávání 14 mg teriflunomidu denně (n = 59), a dále pacienty sledované v rámci TAURUS MS v reálné klinické praxi, kteří byli dříve léčeni jinou chorobu modifikující terapií (n = 593). Spokojenost s léčbou byla posuzována pomocí Treatment Satisfaction Questionnaire for Medication. Skóre všeobecné spokojenosti vzrostlo při přechodu na teriflunomid v obou studiích. Doklad o zlepšení zde přinesl malý vzorek populace v podmínkách klinického hodnocení a dále ho potvrdila zjištění u větší kohorty v reálném prostředí.
Redakčně zpracovala PharmDr. Kateřina Viktorová
Seznam použité literatury
- [1] O'Connor P, Wolinsky JS, Confavreux C, et al. Randomized trial of oral teriflunomide for relapsing multiple sclerosis. N Engl J Med 2011; 365: 1293−1303.
- [2] O'Connor P, Comi G, Freedman MS, et al. Long‑term safety and efficacy of teriflunomide: Nine‑year follow‑up of the randomized TEMSO study. Neurology 2016; 86: 920−930.
- [3] Vermersch P, Czlonkowska A, Grimaldi LM, et al.; TENERE Trial Group. Teriflunomide versus subcutaneous interferon beta‑1a in patients with relapsing multiple sclerosis: a randomised, controlled phase 3 trial. Mult Scler 2014; 20: 705−716.
- [4] Confavreux C, O'Connor P, Comi G, et al. Oral teriflunomide for patients with relapsing multiple sclerosis (TOWER): a randomised, double‑blind, placebo‑controlled, phase 3 trial. Lancet Neurol 2014; 13: 247−256.
- [5] Freedman MS, Ramió‑Torrentà L, Zaffaroni M, et al. Long‑term efficacy and safety of teriflunomide: an analysis of pooled clinical trials. ECTRIMS Online Library 2018: Abstract: P1233.
- [6] Kallmann BA, Tiel‑Wilck K, Kullmann JS, et al. Real‑life outcomes of teriflunomide treatment in patients with relapsing multiple sclerosis: TAURUS‑MS observational study. Ther Adv Neurol Disord 2019; 12: 1−14.
- [7] Vermersch P, Saiz A, Grigoriadis N, et al. Assessing teriflunomide treatment satisfaction in clinical trial and real‑world settings: TENERE and TAURUS‑MS I. ECTRIMS Online Library 2018: Abstract: P885.