Vysoce aktivní forma psoriatické artritidy nasedající na pemphigus vulgaris a její úspěšná léčba sekukinumabem
Key words: psoriasis, psoriatic arthritis, therapy, TNFα inhibitors, IL‑17 inhibitors, secukinumab, pemphigus vulgaris.
Summary:
Psoriatická artritida
Psoriatická artritida (PsA) je zánětlivé revmatické onemocnění sdružené s psoriázou. Vyskytuje se asi u 5−8 % pacientů s psoriázou, u závažných, generalizovaných forem dosahuje výskyt až 39 %. Ve většině případů (75 %) se vyvíjí PsA u nemocných s již existující psoriázou, předcházející artritidě o několik let. Asi u 15 % vzniká kožní a kloubní postižení současně a pouze u malé části nemocných (10 %) artritida manifestaci psoriázy předchází nebo může být jediným projevem nemoci (psoriatická artritida sine psoriasis) [1].
Klinický obraz je velmi variabilní, od lehčích forem přes polyartritidu až po deformující artritidu či spondylitidu, podobnou ankylozující spondylitidě. Nejčastější je asymetrická, oligoartikulární forma, která představuje až 50 % případů. Postihuje zpravidla drobné ruční nebo nožní klouby. Vyskytují se u ní i tzv. daktylitidy, jež vznikají současným zánětem všech tří kloubů prstu i probíhající šlachy a projevují se otokem celého prstu.
Symetrická, polyartikulární forma se
podobá revmatoidní artritidě, postihuje zpravidla drobné klouby
rukou a nohou, ale i větší klouby
(hlezna, kolena). Distální, interfalangeální forma je
charakteristickým projevem PsA a je v typickém případě
sdružena s psoriatickou onychopatií. Postihuje asi 10−15 %
nemocných. Nejtěžší, avšak vzácnější je mutilující forma,
která probíhá pod obrazem destruktivní artritidy rukou
s osteolytickými změnami a jejím výsledkem jsou těžké
deformity rukou (teleskopické prsty aj.). U nositelů antigenu
HLA B27 se častěji vyskytuje axiální forma se zánětlivým
postižením sakroiliakálních kloubů (sakroiliitida) nebo vyšších
úseků páteře (spondylitida).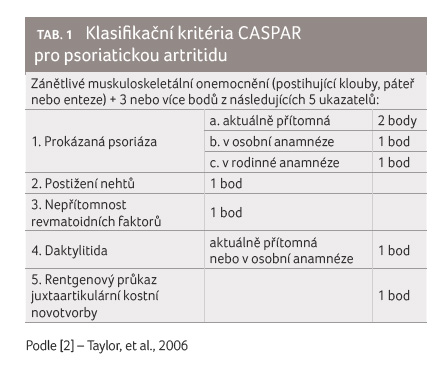
Psoriatická artritida představuje stejně jako ostatní spondyloartritidy systémové zánětlivé onemocnění, a může proto být provázena i řadou mimokloubních manifestací typických pro skupinu spondyloartritid (iridocyklitidy, idiopatické střevní záněty, aortitida).
Diagnóza PsA v typickém případě nečiní zpravidla větší obtíže. V nejasných případech nebo u pacientů bez zjevného kožního postižení mohou při stanovení diagnózy pomoci klasifikační kritéria CASPAR (Classification Criteria for Psoriatic Arthritis) [2], tab. 1.
Terapie psoriatické artritidy
Terapie PsA musí být vedena revmatologem ve spolupráci s dermatologem. V léčbě se užívají nesteroidní antirevmatika (NSA), intraartikulární injekce glukokortikoidů, syntetické chorobu modifikující léky a biologické léky. Strategie léčby závisí zejména na typu postižení, na aktivitě artritidy a na přítomnosti negativních prognostických faktorů. Nutné je samozřejmě zohlednit přidružená onemocnění a souběžnou chronickou medikaci. Podrobně je strategie léčby PsA popsána ve čtyřech krocích v doporučeních Evropské ligy proti revmatismu (EULAR) z roku 2015 [3] nebo v doporučení mezinárodní pracovní skupiny CASPAR [4], z nichž vycházejí i Doporučené léčebné postupy České revmatologické společnosti pro psoriatickou artritidu z roku 2016 [5].
U lehčích forem zahajujeme terapii NSA nebo intraartikulárními injekcemi glukokortikoidu. U závažnějších forem (polyartritida, vysoké laboratorní parametry zánětu, rychlá progrese) je indikována léčba metotrexátem hned v prvním kroku. Při jeho kontraindikacích nebo nedostatečném účinku je možné alternativně užít leflunomid, sulfasalazin, ev. cyklosporin. Tyto léky ovlivňují ve většině případů i kožní syndrom. Pokud není terapie účinná nebo je provázena nežádoucími účinky, doporučuje se u lehčích forem zkusit jiný z výše uvedených syntetických chorobu modifikujících léků, u závažnějších forem je indikována biologická léčba.
Jako lék první volby se doporučují tradičně inhibitory tumor nekrotizujícího faktoru alfa (TNFα). Jejich mohutný antiflogistický efekt na kožní i kloubní postižení byl potvrzen již v desítkách klinických studií. Donedávna byly inhibitory TNFα jedinou alternativou biologické léčby u PsA.
V posledních letech se objevuje nová skupina biologických léků, které ovlivňují jiné prozánětlivé cytokiny, resp. interleukiny (IL), jež se uplatňují v rozvoji psoriázy a PsA, např. IL 12, IL 23 a IL 17. Tato generace biologik je zatím dle současných doporučení indikována spíše jako terapie druhé volby při kontraindikaci nebo neúčinnosti inhibitorů TNFα, přestože data z klinických studií prokazují jejich účinnost i v první linii biologické léčby, kdy jsou výsledky léčby lepší [6].
Novou alternativou biologické léčby co do účinnosti jsou cílené syntetické chorobu modifikující léky, z nichž má indikaci pro PsA schválenou apremilast. Jedná se o malé syntetické molekuly, které se na rozdíl od biologické léčby užívají perorálně. Dle současných doporučení jsou indikovány jako léky druhé až třetí volby po selhání standardní biologické léčby [5].
Sekukinumab v terapii psoriatické artritidy
Sekukinumab je plně humánní monoklonální protilátka, která se selektivně váže na IL 17A a neutralizuje ho. Výsledkem je inhibice kaskády uvolňování dalších prozánětlivých cytokinů, chemokinů a jiných mediátorů tkáňového poškození. Jeho příznivý efekt na psoriázu byl prokázán v několika velkých randomizovaných studiích, včetně placebem kontrolovaných hodnocení (FIXTURE a ERASURE), v nichž došlo při terapii sekukinumabem k 75% redukci skóre PASI (Psoriasis Area and Severity Index score) u absolutní většiny pacientů (77–82 %) [7].
Efekt sekukinumabu u PsA byl hodnocen např. v randomizované, placebem kontrolované studii FUTURE 1, v níž byly rozdíly v účinnosti na artritidu statisticky významné oproti placebu, avšak méně impresivní nežli výsledky studií u psoriázy či ankylozující spondylitidy [8]. Studie však pracovala s nižšími dávkami, proto byly ve studii FUTURE 2 hodnoceny dávky vyšší (300 mg vs. placebo) s lepšími výsledky [9]. Nedávno byly publikovány výsledky extenze studie FUTURE 1 (102 týdnů), kterou dokončilo 476 pacientů (78,5 %). Výsledky byly výborné – účinnost sekukinumabu byla setrvalá po celou dobu klinického hodnocení ve všech sledovaných parametrech, včetně aktivity nemoci, kvality života, fyzické funkce, rozsahu kožního postižení, daktylitid a entezitid. Byla hodnocena i rentgenová progrese, přičemž u většiny léčených pacientů (84,3 %) nedošlo v průběhu sledování k progresi [10].
Sekukinumab je schválen pro léčbu psoriázy, PsA a ankylozující spondylitidy. U psoriatické artritidy je lék indikován již po selhání terapie syntetickými chorobu modifikujícími léky jako biologický lék první linie nebo druhé linie po selhání terapie inhibitory TNFα. Pokud je lék indikován v první linii, podává se v dávce 150 mg s.c. jedenkrát týdně první čtyři týdny, poté se pokračuje ve stejné dávce jednou měsíčně. V případě, že je sekukinumab podáván ve druhé linii, po selhání terapie inhibitory TNFα nebo u nemocných s těžkou nebo středně těžkou psoriázou, užívají se ve stejném schématu dávky dvojnásobné, tedy 300 mg s.c.
Popis případu
V našem případě se jednalo o 44letého pacienta s psoriázou a PsA, které se vyvinuly během dlouhodobé imunosupresivní terapie pro pemphigus vulgaris. V rodině nemocného se psoriáza ani PsA nevyskytly, pemphigus vulgaris však byl prokázán u sestry nemocného, která se pro něj rovněž léčí.
U pacienta byl pemphigus vulgaris zjištěn v roce 2014 a po dobu následujících 18 měsíců byl léčen glukokortikoidy a kontinuálně cyklofosfamidem per os. V létě 2016 se však začal kožní nález i přes kombinovanou imunosupresivní terapii (prednison 15 mg denně + cyklofosfamid 100 mg p.o. denně) horšit a měnit svůj charakter, proto byl pacient znovu hospitalizován a vyšetřen na dermatologické klinice včetně biopsie kůže a histologické vyšetření překvapivě svědčilo pro diagnózu psoriázy. Současně se objevily i kloubní obtíže, nejprve otok malíku pravé ruky bez zjevné příčiny, vzápětí pak se přidaly otoky prstů na nohou, otok levého nártu, bolesti v kříži, bolesti levého ramene a levého zápěstí.
V září 2016 bylo provedeno
klinické revmatologické vyšetření, při kterém byla zjištěna
artritida proximálního interfalangeálního kloubu malíku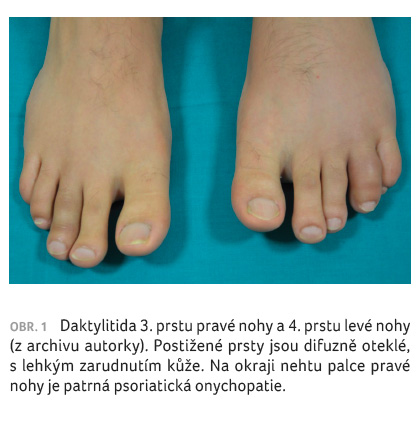 pravé
ruky, tendinitida levého zápěstí ulnárně, artritida v oblasti
intertarzálních skloubení levé nohy,
synovitidy metakarpofalangeálních skloubení 3. a 4. prstu
pravé ruky a daktylitidy 3. prstu pravé nohy a 4. prstu
levé nohy (obr. 1).
Sakroiliakální klouby byly bolestivé, rozvíjení páteře bylo
hraniční. Na rentgenových snímcích rukou byla popsána
diskrétní eroze distálního interfalangeálního kloubu malíku
pravé ruky (obr. 2A–C);
nálezy na nohou, na sakroiliakálních kloubech
a na páteři byly normální. Diagnóza PsA byla
nepochybná.
pravé
ruky, tendinitida levého zápěstí ulnárně, artritida v oblasti
intertarzálních skloubení levé nohy,
synovitidy metakarpofalangeálních skloubení 3. a 4. prstu
pravé ruky a daktylitidy 3. prstu pravé nohy a 4. prstu
levé nohy (obr. 1).
Sakroiliakální klouby byly bolestivé, rozvíjení páteře bylo
hraniční. Na rentgenových snímcích rukou byla popsána
diskrétní eroze distálního interfalangeálního kloubu malíku
pravé ruky (obr. 2A–C);
nálezy na nohou, na sakroiliakálních kloubech
a na páteři byly normální. Diagnóza PsA byla
nepochybná.
I přes stávající
imunosupresivní terapii z indikace pemphigu byla klinická
aktivita onemocnění vysoká, stejně tak byly výrazně zvýšené
i laboratorní parametry zánětu (sedimentace [FW] 42 mm/h,
C reaktivní protein [CRP] 16,9 mg/l), na rentgenovém
snímku rukou již byla nalezena eroze kloubu, jednalo se tedy
o těžkou PsA s negativní prognózou. Bezprostředně
byly provedeny obstřiky drobných ručních kloubů
glukokortikoidem, navýšena dávka prednisonu na 20 mg denně
a změněna imunosupresivní terapie –
podávání cyklofosfamidu bylo ukončeno a namísto něj byla
zahájena terapie metotrexátem v dávce 10 mg per
os, jež byla rychle titrována až
na 25 mg týdně a převedena na parenterální
ap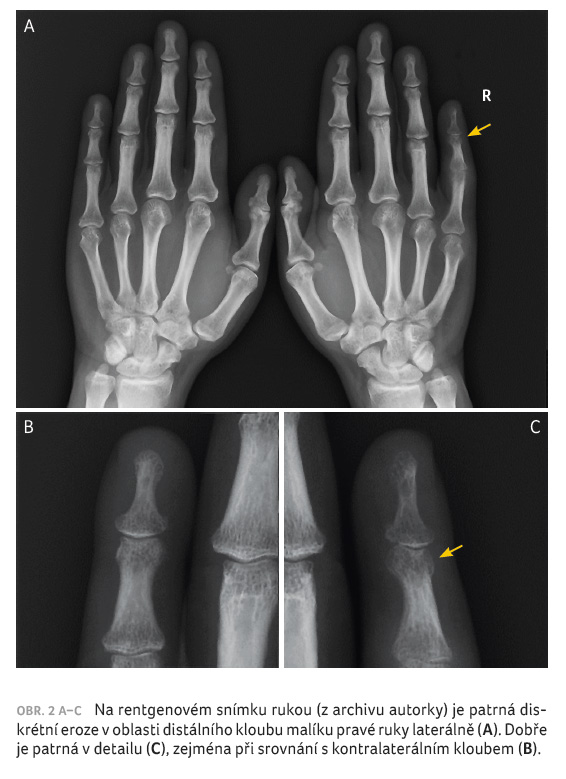 likaci. Úprava léčby však vedla pouze k mírné
subjektivní úlevě, klinické i laboratorní projevy zánětu
i přes intenzivní terapii přetrvávaly dále (FW 29 mm/h,
CRP 11,4 mg/l). V prosinci 2016 se ještě zhoršila
i lupénka. Pacient byl již několik měsíců
v pracovní neschopnosti.
likaci. Úprava léčby však vedla pouze k mírné
subjektivní úlevě, klinické i laboratorní projevy zánětu
i přes intenzivní terapii přetrvávaly dále (FW 29 mm/h,
CRP 11,4 mg/l). V prosinci 2016 se ještě zhoršila
i lupénka. Pacient byl již několik měsíců
v pracovní neschopnosti.
Nemocný v této době splňoval indikační kritéria biologické léčby pro PsA, kdy doporučeným postupem volby by byla léčba anti TNFα. Avšak s ohledem na skutečnost, že byl pacient v posledních dvou letech dlouhodobě léčen kontinuálně cyklofosfamidem a některá klinická data naznačují, že kombinace cyklofosfamidu s inhibitory TNFα by mohla zvyšovat riziko malignit (viz dále), byla zvolena léčba sekukinumabem již v první linii.
V lednu 2017 dostal pacient první 4 injekce (à 150 mg) v týdenních intervalech a velmi rychle došlo ke zmírnění obtíží, k regresi artritidy i k poklesu hodnot laboratorních parametrů zánětu. Při kontrolním vyšetření po 4 týdnech léčby byl pacient bez klidových bolestí, udával bolesti jen při větší fyzické námaze, podstatně se zmenšily otoky kloubů a prstů a zlepšil se i kožní nález. Sedimentace erytrocytů a sérová koncentrace CRP již byly v normě. Pacient dále pokračoval v léčbě sekukinumabem v dávce 150 mg 1× měsíčně v kombinaci s metotrexátem a po dosažení remise jsme zahájili detrakci glukokortikoidu.
Při následující kontrole v březnu 2017 byl již pacient bez kloubních obtíží, bez objektivních projevů zánětu a s normálními hodnotami biomarkerů zánětu. Léčbu prednisonem se podařilo během následujících měsíců ukončit úplně, aniž by nastalo zhoršení kožního nebo kloubního nálezu. Pouze v říjnu 2017 došlo při virovém onemocnění dýchacích cest přechodně k bolesti a otoku kolenního kloubu, který odezněl během několika dní bez specifické terapie při fyzickém šetření a tapování, dále již byl pacient bez obtíží a vrátil se do zaměstnání.
Léčbu pacient velmi dobře toleroval, v dubnu 2017 jsme opakovaně zaznamenali zvýšení hodnot alaninaminotransferázy (ALT) nad dvojnásobek normy, a proto jsme redukovali dávku metotrexátu postupně až na 15 mg týdně, jiné problémy se během jednoho roku léčby nevyskytly.
Při poslední kontrole v lednu 2018 byl pacient nadále ve velmi dobrém stavu, spokojen a bez klinických či laboratorních známek zánětu.
Diskuse
Tento případ je velmi zajímavý z několika hledisek. Pozornost budí již samotný vznik psoriázy a těžké PsA v návaznosti na pemphigus vulgaris, navíc při kombinované imunosupresivní terapii (glukokortikoidy + cyklofosfamid). Pemphigus vulgaris je vzácné, ale závažné bulózní onemocnění kůže autoimunitního původu, jež je velmi bolestivé a v těžkých případech může mít i fatální průběh [11]. Jeho asociace s psoriázou je s ohledem na výskyt obou onemocnění celkem vzácná; v literatuře jsou popsány sporadické případy, kdy se pemphigus objevil u preexistující chronické psoriázy, v některých případech po fototerapii UVB [12], opačný průběh, tedy vznik psoriázy v návaznosti na pemphigus, je opravdu raritní.
Neobvyklý je i prudký začátek vysoce aktivní artritidy při dlouhodobé intenzivní kombinované imunosupresivní terapii. Cyklofosfamid je velmi silné a účinné imunosupresivum zatížené poměrně častými a potenciálně závažnými nežádoucími účinky, proto je jeho užití vyhrazeno pouze pro těžké formy autoimunitních onemocnění, které pacienta ohrožují na životě a kdy nelze z různých důvodů užít bezpečnější alternativu terapie. Přestože se cyklofosfamid v léčbě PsA neužívá, je překvapivé, že dlouhodobá kontinuální perorální terapie tímto imunosupresivem v kombinaci s glukokortikoidy nedokázala manifestaci psoriázy a PsA zabránit.
Cyklofosfamid je značně toxické léčivo s velmi širokým spektrem nežádoucích účinků, mezi něž patří i zvýšené riziko vzniku malignit, přičemž toto riziko se zvyšuje s kumulativní dávkou a délkou podávání.
Riziko vzniku malignit při terapii inhibitory TNFα u pacientů s revmatoidní artritidou bylo široce diskutováno a studováno v řadě prospektivních i observačních studií vycházejících z národních registrů pacientů z běžné klinické praxe léčených biologiky. Na podkladě detailní analýzy všech těchto dat dospěla pracovní skupina EULAR k závěru, že toto riziko globálně zvýšené není a výskyt malignit při terapii inhibitory TNFα je srovnatelný s běžnou populací nemocných s revmatoidní artritidou [13]. V jiných indikacích inhibitorů TNFα však vyšší riziko vzniku zhoubných nádorů vyloučit nelze, zvláště při kombinaci s azathioprinem a cyklofosfamidem. Velmi sugestivní data v tomto smyslu přinesla klinická studie hodnotící etanercept u skupiny zahrnující 176 pacientů s granulomatózou s polyangiitidou (dříve Wegenerova granulomatóza), kdy byl pozorován výskyt nádorových onemocnění při podávání etanerceptu se standardní léčbou (n = 6), přičemž u kontrolní skupiny (placebo + standardní léčba) nebyl zaznamenán žádný případ.
Ve všech případech se jednalo o nemocné léčené dříve nebo současně cyklofosfamidem. Autoři poukazují na možnou potenciaci onkogenního potenciálu cyklofosfamidu etanerceptem. Mechanismus této interakce je nejasný, nicméně autoři doporučují, pokud je to možné, se této kombinaci vyhnout [14]. Z tohoto důvodu byl u pacienta zvolen jako biologický lék první linie sekukinumab. Výsledky dosud provedených klinických studií se sekukinumabem riziko vzniku malignit neuvádějí ani nenaznačují, avšak je třeba vzít potaz, že klinické zkušenosti se sekukinumabem jsou v porovnání s inhibitory TNFα zatím omezené.
Další otázkou u našeho pacienta byl potenciální vliv sekukinumabu na jeho druhé kožní onemocnění – pemphigus vulgaris. Sekukinumab se k léčbě tohoto vzácného onemocnění neužívá a v literatuře nejsou zatím dostupné žádné údaje týkající se bezpečnosti terapie sekukinumabem u této choroby. U našeho pacienta léčba sekukinumabem vedla nejen ke kompletní regresi psoriázy a k remisi PsA, ale umožnila i pozvolnou detrakci glukokortikoidu až jeho úplné vysazení. Po celou dobu sledování (v současnosti již více než 12 měsíců) k recidivě pemphigu nedošlo. Naše, zatím ojedinělé, sledování naznačuje, že sekukinumab, podávaný v daném případě z jiné indikace, průběh onemocnění pemphigus vulgaris zřejmě nezhoršuje.
Sekukinumab vedl u našeho pacienta k velmi rychlé a kompletní remisi onemocnění. Klinické studie ukazují, že účinnost sekukinumabu je v porovnání s inhibitory TNFα srovnatelná nebo pravděpodobně i lepší na kožní projevy a srovnatelná z hlediska působení na kloubní syndrom [6]. Při užití sekukinumabu v první linii se doporučují nižší dávky – 150 mg, které jsme užili i v našem případě. Pacientům, jimž je lék podáván ve druhé linii, tedy po selhání terapie inhibitory TNFα, se doporučují dávky dvojnásobné (300 mg) ve stejném dávkovacím schématu. Účinnost léku v první linii je samozřejmě lepší nežli po selhání jednoho či více biologik.
Závěr
Sekukinumab je účinný biologický přípravek k léčbě psoriázy a PsA, který se vyznačuje rychlým nástupem účinku. Je vhodný jako biologický lék první linie u pacientů s aktivní PsA navzdory terapii syntetickými chorobu modifikujícími léky, lze jej užít i jako lék druhé linie při kontraindikaci nebo nedostatečném účinku terapie anti TNF.
Inhibitory IL 17 představují novou generaci biologické terapie psoriázy a spondyloartritid včetně PsA a významně rozšiřují paletu léčiv užívaných u těchto onemocnění, jež byla donedávna omezena pouze na inhibitory TNFα.
Seznam použité literatury
- [1] Štolfa J, Štork J a kol. Psoriatická artritida a psoriáza. Praha: Maxdorf, 2007; 168 s.
- [2] Taylor W, Gladman D, Helliwell P, et al. Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum 2006; 54: 2665–2673.
- [3] Gossec L, Smolen JS, Ramiro S, et al. European League Against Rheumatism (EULAR) recommendations for the management of psoriatic arthritis with pharmacological therapies 2015 update. Ann Rheum Dis 2016; 75: 499–510.
- [4] Coates LC, Kavanaugh A, Mease PJ, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis 2015. Treatment recommendations for psoriatic arthritis. Arthritis Rheumatol 2016; 68: 1060–1071.
- [5] Štolfa J, Vencovský J, Pavelka K. Doporučené léčebné postupy České revmatologické společnosti pro psoriatickou artritidu. Čes Revmatol 2016; 24: 142–152.
- [6] Olejárová M. Inhibice IL‑17 – nový směr biologické léčby spondyloartritid. Farmakoterapie 2017; 13: 501–508.
- [7] Langley RG, Elewski BE, Lebwohl M, et al. Secukinumab in plaque psoriasis – results of two phase 3 trials. N Engl J Med 2014; 371: 326–338.
- [8] Mease PJ, McInnes IB, Kirkham B, et al. Secukinumab inhibition of interleukin‑17A in patients with psoriatic arthritis. N Engl J Med 2015; 373: 1329–1339.
- [9] McInnes IB, Mease PJ, Kirkham B, et al. Secukinumab, a human anti‑interleukin‑17A monoclonal antibody, in patients with psoriatic arthritis (FUTURE 2): a randomised, double‑blind, placebo‑controlled, phase 3 trial. Lancet 2015; 386: 1137–1146.
- [10] Kavanaugh A, Mease PJ, Reimold AM, et al. Secukinumab for long‑term treatment of psoriatic arthritis: a two‑year followup from a phase III, randomized, double‑blind placebo‑controlled study. Arthritis Care Res (Hoboken) 2017; 69: 347–355.
- [11] Pollmann R, Schmidt T, Eming R, Hertl M. Pemphigus: a Comprehensive Review on Pathogenesis, Clinical Presentation and Novel Therapeutic Approaches. Clin Rev Allergy Immunol 2018; 54: 1–25.
- [12] Kwon HH, Kwon IH, Chung JH, Youn JI. Pemphigus Foliaceus Associated with Psoriasis during the Course of Narrow‑Band UVB Therapy: A Simple Coincidence? Ann Dermatol 2011; 23 (Suppl 3): S281–284.
- [13] Ramiro S, Gaujoux‑Viala C, Nam, JL, et al. Safety of synthetic and biological DMARDs: a systematic literature review informing the 2013 update of the EULAR recommendations for management of rheumatoid arthritis. Ann Rheum Dis 2014; 73: 529–535.
- [14] Wegener’s Granulomatosis Etanercept Trial (WGET) Research Group. Etanercept plus standard therapy for Wegener‘s granulomatosis. N Engl J Med 2005; 352: 351–361.