Aflibercept v léčbě metastatického kolorektálního karcinomu
Souhrn:
Aflibercept je rekombinantní fúzní protein, který působí jako falešný receptor a váže ligandy s vyšší afinitou než přirozený receptor. Vazbou ligandů blokuje aktivaci receptorů vaskulárního endotelového růstového faktoru a následnou proliferaci buněk a novotvorbu cév. Aflibercept je indikován ve druhé linii léčby metastatického kolorektálního karcinomu rezistentního k oxaliplatině, v kombinaci s chemoterapií FOLFIRI prodlužuje celkové přežívání nemocných.
Key words: aflibercept – chemotherapy – colorectal carcinoma
Summary:
Aflibercept is a recombinant fusion protein acting as a false receptor and binding ligands with a higher affinity than the natural receptor. By binding the ligands, it blocks the activation of VEGFR (vascular endothelial growth factor receptor) and the subsequent proliferation of cells and blood vessels. Aflibercept is indicated in second line treatment of patients with metastatic colorectal carcinoma resistant to oxaliplatin since, in combination with FOLFIRI chemotherapy, it prolongs overall survival of these cancer patients.
Úvod
Kolorektální karcinom je jednou z celosvětově nejčastěji se vyskytujících malignit. Nemocní s neresekabilním či metastatickým onemocněním jsou nyní indikováni k několika řadám protinádorové léčby dle svého výkonnostního stavu (performance status, PS) posuzovaného na škále ECOG (Eastern Cooperative Oncology Group) stupněm (grade, G) 1–4. Mezi hlavní cytostatika v léčbě pacientů s metastatickým kolorektálním karcinomem (mCRC) patří 5‑fluorouracil (5‑FU), irinotecan a oxaliplatina, protilátka proti vaskulárnímu endotelovému růstovému faktoru (vascular endothelial growth factor antibody, anti‑VEGF) bevacizumab a aflibercept a dva inhibitory receptoru pro epidermální růstový faktor (epidermal growth factor receptor, EGFR) cetux![Obr. 1 Strategie léčby pacientů s metastatickým kolorektálním karcinomem; podle [1] – ESMO Guidelines, 2014. 1 dublet chemoterapie – fluoropyrimidin + oxaliplatina nebo irinotecan; 2 divoký typ onkogenu Ras; 3 afl ibercept pouze v kombinaci s FOLFIRI anti-EGFR – protilátka proti receptoru pro endotelový růstový faktor; FOLFIRI – irinotecan + 5-fluorouracil + leucovorin](https://www.remedia.cz/photo-a-30295---.jpg) imab a panitumumab. Pokud vyčerpáme všechny zmíněné léčebné modality, zbývá nám regorafenib, který je ještě schopen prodloužit život našich nemocných [1], obr. 1. V českých podmínkách vedlo využití těchto léčebných možností k prodloužení mediánu přežití nemocných s mCRC v běžné klinické praxi za hranici 30 měsíců.
imab a panitumumab. Pokud vyčerpáme všechny zmíněné léčebné modality, zbývá nám regorafenib, který je ještě schopen prodloužit život našich nemocných [1], obr. 1. V českých podmínkách vedlo využití těchto léčebných možností k prodloužení mediánu přežití nemocných s mCRC v běžné klinické praxi za hranici 30 měsíců.
Aflibercept
Relativně novou molekulou v armamentáriu léčby pacientů s relabujícím kolorektálním karcinomem je aflibercept, indikovaný k léčbě nemocných s mCRC, u nichž došlo po podání režimu s oxaliplatinou k progresi onemocnění nebo kteří jsou vůči této léčbě rezistentní.
Aflibercept, označovaný v odborné literatuře též jako VEGF‑trap, je rekombinantní fúzní protein, který se skládá z vazebných částí VEGF (vascular endothelial growth factor) tvořených extracelulárními doménami lidských receptorů VEGF 1 a 2 (VEGFR‑1, VEGFR‑2) fúzovaných k Fc části lidského IgG1. Aflibercept se vyrábí technologií rekombinantní DNA v savčím expresním systému s linií ovariálních buněk křečíka čínského (CHO‑K1). Je to dimerní glykoprotein s molekulovou hmotností proteinové části 97 kDa; glykosylace zvyšuje celkovou molekulární hmotnost o 15 % na hodnotu 115 kDa.
Mechanismus účinku
Vaskulární endotelový růstový faktor A a B (VEGF‑A, VEGF‑B) a placentární růstový faktor (placental growth factor, PlGF) patří do rodiny angiogenních faktorů VEGF, které působí jako silné mitogenní a chemotaktické faktory a faktory cévní permeability pro buňky endotelu; VEGF‑A působí prostřednictvím dvou rece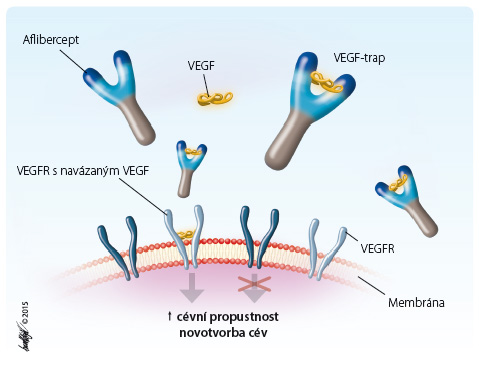 ptorových tyrosinkináz VEGFR‑1 a VEGFR‑2, které jsou přítomny na povrchu buněk endotelu. Nadměrná aktivace těchto receptorů faktorem VEGF‑A může vést k patologické neovaskularizaci a k nadměrné cévní propustnosti; PlGF je rovněž spojen s patologickou novotvorbou cév a s přesunem zánětlivých buněk do nádorů (tzv. recruitment). Faktory PlGF a VEGF‑B se vážou pouze na VEGFR‑1, který je rovněž přítomen na povrchu leukocytů.
ptorových tyrosinkináz VEGFR‑1 a VEGFR‑2, které jsou přítomny na povrchu buněk endotelu. Nadměrná aktivace těchto receptorů faktorem VEGF‑A může vést k patologické neovaskularizaci a k nadměrné cévní propustnosti; PlGF je rovněž spojen s patologickou novotvorbou cév a s přesunem zánětlivých buněk do nádorů (tzv. recruitment). Faktory PlGF a VEGF‑B se vážou pouze na VEGFR‑1, který je rovněž přítomen na povrchu leukocytů.
Aflibercept působí jako solubilní „decoy“ receptor, který váže VEGF‑A s vyšší afinitou než přirozené receptory, stejně jako příbuzné ligandy PlGF a VEGF‑B; působí jako lapač ligandů (ligand‑trap), brání vazbě endogenních ligandů na jejich receptory a tím blokuje signální dráhy zprostředkované receptorem, obr. 2.
Váže se na lidský VEGF‑A (rovnovážná disociační konstanta KD = 0,5 pM pro VEGF‑A165 a 0,36 pM pro VEGF‑A121), na lidský PlGF (KD = 39 pM pro PlGF‑2) a na lidský VEGF‑B (KD = 1,92 pM) za vzniku stabilního inertního komplexu, který nemá detekovatelnou biologickou aktivitu [2].
Aflibercept blokuje aktivaci receptorů VEGF a proliferaci endoteliálních buněk a tím inhibuje růst nových cév, které zásobují nádor kyslíkem a živinami.
Dávkování
Aflibercept je podáván v dávce 4 mg/kg tělesné hmotnosti v jednohodinové nitrožilní (intravenózní, i.v.) infuzi s následným podáním chemoterapie FOLFIRI (irinotecan 180 mg/m2 v 90minutové i.v. infuzi, leucovorin 400 mg/m2 ve dvouhodinové i.v. infuzi) následované podáním nitrožilního bolusu 5‑FU v dávce 400 mg/m2 a poté kontinuálním podáním 2 400 mg/m2 5‑FU po dobu 46 hodin. Tato léčba je považována za jeden léčebný cyklus, který se opakuje každé dva týdny a probíhá do progrese onemocnění či do výskytu neakceptovatelné toxicity.
Eliminace z organismu
Volný aflibercept je z organismu primárně odstraňován navázáním na endogenní VEGF za vzniku stabilního inaktivního komplexu. Stejně jako u jiných velkých proteinů se předpokládá, že jak volný, tak i vázaný aflibercept bude metabolizován, byť pomaleji, dalšími biologickými mechanismy, jako je například proteolytické štěpení. Při dávkách vyšších než 2 mg/kg činila clearance volného afliberceptu přibližně 1,0 l/den s terminálním poločasem eliminace 6 dnů.
Klinické hodnocení
Aflibercept byl zkoušen ve studii 3. fáze VELOUR. Celkem 1 226 nemocných (s rezistencí k oxaliplatině, u nichž došlo k progresi onemocnění během podávání léčby s oxaliplatinou či od jejího podání uplynulo více než 6 měsíců, s léčbou bevacizumabem nebo bez bevacizumabu) zde bylo randomizováno do ramene, kde byl podáván režim FOLFIRI s afliberceptem či bez něho. Aflibercept byl podáván v dávce 4 mg/kg v jednohodinové i.v. infuzi předcházející podání chemoterapie FOLFIRI (irinotecan 180 mg/m2 ve formě 90minutové i.v. infuze, leucovorin 400 mg/m2 v dvouhodinové i.v. infuzi; následovalo podání bolusu 5‑FU v dávce 400 mg/m2 i.v. a kontinuální podání 5‑FU 2 400 mg/m2 i.v. po dobu 46 hodin). Cykly se opakovaly každé dva týdny do progrese onemocnění nebo do výskytu neakceptovatelné toxicity.
Hlavním cílem studie bylo monitorovat celkové přežití nemocných. Ti byli stratifikováni podle výkonnostního stavu a předchozí expozice bevacizumabu. Medián věku nemocných byl 61 let, 59 % pacientů tvořili muži, výkonnostní stav podle ECOG byl v 98 % případů hodnocen stupněm G0–1. Všichni nemocní byli dříve léčeni režimem s oxaliplatinou. Bylo zaznamenáno statisticky významné prodloužení přežití ve skupině s afliberceptem ve srovnání se skupinou s placebem, medián přežití byl 13,5 měsíce oproti 12,06 měsíce, poměr rizik (hazard ratio, HR) 0,82 (interval spolehlivosti, confidence interval – 95% CI: 0,71–0,94, p = 0,0032), medián času do progrese byl 6,9 měsíce ve skupině s afliberceptem a 4,37 měsíce ve skupině s placebem (HR 0,76, 95% CI: 0,66–0,87, p = 0,00007). Míra celkové odpovědi (kompletní + částečné odpovědi, overall response rate, ORR) dosahovala 19,8 % v rameni aflibercept/FOLFIRI oproti 11,1 % v rameni placebo/FOLFIRI (p = 0,0001) [3–6].
Snášenlivost léčby afliberceptem
Ve studii VELOUR dosáhli nemocní léčení kombinací afliberceptu s režimem FOLFIRI mediánu 9 podaných cyklů oproti 8 cyklům podaným v placebové větvi s režimem FOLFIRI.
Ve skupině s afliberceptem byla léčebná dávka snížena u 17 % nemocných, ve skupině s placebem u 5 % nemocných. K odložení cyklu na déle než sedm dní došlo u 60 % nemocných ze skupiny s léčbou afliberceptem a u 43 % nemocných ze skupiny s kombinací placeba a FOLFIRI.
Nejčastějšími nežádoucími účinky léčby afliberceptem s incidencí 20 % a více byly astenie, únavnost, průjmy, dehydratace, hypertenze, stomatitida, venózní tromboembolická nemoc, neutropenie a proteinurie. Hluboká žilní trombóza a plicní embolie se objevily u 9 % nemocných léčených kombinací aflibercept/FOLFIRI a u 7 % léčených kombinací placebo/FOLFIRI.
Krvácení bylo zaznamenáno u 38 % nemocných léčených kombinací aflibercept/
FOLFIRI oproti 19 % nemocných ze skupiny placebo/FOLFIRI. U nemocných léčených afliberceptem se objevilo několik případů intrakraniálního krvácení a hemoptýzy. Nejzávažnější, byť vzácnou komplikací je perforace gastrointestinálního traktu.
Úhradový mechanismus
Aflibercept je hrazen v kombinaci s režimem FOLFIRI k léčbě pacientů se stavem výkonnosti (dle ECOG) G0–1 s mCRC, který je rezistentní na léčbu nebo progredoval po léčbě režimem obsahujícím oxaliplatinu. Toto omezení dává v České republice, kde je oxaliplatina v první linii léčby metastatického onemocnění kolorekta v rámci schémat FOLFOX 4 a FOLFOX 6 velice oblíbena, možnost širokého uplatnění pro aflibercept.
Závěr
Základem léčby kolorektálního karcinomu je již více než padesát let podávání 5‑FU. Tato molekula se dostala do klinické praxe v roce 1956 a dodnes neztratila nic ze svého významu. Její samostatné podávání v osmdesátých letech zabezpečovalo nemocným s metastatickým kolorektálním karcinomem přežití v délce 6–8 měsíců. S rozvojem chemoterapie a přidáním cílené léčby se tato hranice posunula na více než 30 měsíců a aflibercept se na těchto výsledcích spolupodílí. Kombinace s afliberceptem navíc odpovídá na častou otázku v českých onkologických ambulancích, jak pokračovat v léčbě po vyčerpání možností oblíbeného schématu FOLFOX 6, ať již s cílenou léčbou, či bez ní. Tyto výsledky dokazují potřebu dalších linií v léčbě tohoto refrakterního onemocnění. Probíhá intenzivní výzkum možného postavení afliberceptu v léčbě jiných malignit, příkladem může být karcinom prostaty.
Seznam použité literatury
- [1] Metastatic colorectal cancer: ESMO Clinical Practice Guidelines. Ann Oncol 2014; 25 (Suppl. 3): iii1–iii9.
- [2] Summary of product characteristics, Zaltrap, 2013, dostupné na www.ema.europa.eu.
- [3] Van Cutsem E, Tabernero J, Lakomy R, et al. Addition of aflibercept to fluorouracil, leucovorin and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin based regimen. J Clin Oncol 2012; 30: 3499–3506.
- [4] Van Cutsem, Nordlinger B, Cervantes A and on behalf of the ESMO Guidelines Working Group. Advanced colorectal cancer: ESMO Clinical Practice Guidelines for treatment. Abstract O 0024 and presentation at: ESMO 13th WCGIC. June 22–25, 2011; Barcelona, Spain. Ann Oncol 2011; 22 (Suppl. 5): 93–97.
- [5] Joulain F, Van Cutsem E, Iqbal SU, et al. Aflibercept versus placebo in combination with FOLFIRI in previously treated metastatic colorectal cancer (mCRC): Mean overall survival (OS) estimation from a phase III trial (VELOUR). ASCO Annual Meeting Abstracts. J Clin Oncol 2012; 30: Abstr. 3602.
- [6] Tabernero J, Van Cutsem E, Lakomy R, et al. Results From VELOUR, a Phase 3 Study of Aflibercept (A) Versus Placebo (pbo) in Combination with FOLFIRI for the Treatment of Patients (pt) with Previously Treated Metastatic Colorectal Cancer (MCRC). Abstract 6LBA and presentation at: ESMO 2011 EMCC. September 23–27, 2011; Stockholm, Sweden Eur J Cancer 2011; 47: 5.