Alemtuzumab v současné klinické praxi
Souhrn:
Roztroušená skleróza představuje v našich zeměpisných šířkách nejčastější autoimunitní onemocnění centrálního nervového systému, které postihuje zejména mladé pacienty v produktivním věku. Skupina léků se schopností modifikovat průběh choroby se postupně od devadesátých let minulého století stále rozrůstá. Dosud posledním registrovaným přípravkem je monoklonální protilátka alemtuzumab (Lemtrada®). Článek podává základní informace o účinnosti, bezpečnosti a indikacích léčby alemtuzumabem.
Key words: multiple sclerosis – treatment – alemtuzumab.
Summary:
Multiple sclerosis represents the most frequent autoimmune disease of the central nervous system in our region, mainly afflicting young people in productive age. The group of disease modifying drugs is gradually enlarging since the nineties. So far, the latest registered drug is a monoclonal antibody – alemtuzumab (Lemtrada®). The article provides fundamental information about efficacy, safety, and indications to alemtuzumab treatment in multiple sclerosis.
Úvod
Roztroušená skleróza (RS) představuje v našich zeměpisných šířkách nejčastější autoimunitní onemocnění centrálního nervového systému (CNS), které postihuje mladé pacienty v produktivním věku.
Patogeneticky probíhá u pacientů s RS v mozku a míše od počátku onemocnění komplexní zánětlivý proces zahrnující buňky a mediátory přirozené i získané imunity. Paralelně se zánětem zároveň dochází v různé míře k nevratné ztrátě neuronů – neurodegeneraci [1].
Dřívější klasifikace autoimunitních onemocnění na dominantně protilátkové (např. myasthenia gravis), kde hraje roli zejména produkce autoprotilátek B‑lymfocyty a plazmatickými buňkami, a dominantně buněčné (např. RS), kde hrají hlavní úlohu T‑lymfocyty, již není při současných znalostech patogeneze zánětu tak jednoznačná. U roztroušené sklerózy se uplatňuje významným způsobem i protilátková získaná imunita, což dokazuje mimo jiné překvapivě vysoká účinnost léčby protilátkou proti B‑lymfocytárnímu znaku CD20 – ocrelizumabem [2], který je nyní ve fázi III klinického zkoušení. Již registrovaná monoklonální protilátka alemtuzumab je namířena proti povrchovému znaku CD52, který je exprimován na zralých T‑ i B‑lymfocytech a méně také na monocytech a dendritických buňkách. Svým působením tak alemtuzumab přímo zasahuje více podtypů buněk imunitního systému, aniž by ovlivnil jejich vlastní zdroj – kmenové buňky.
Zánětlivá aktivita je v CNS přítomna především v prvních letech choroby (relabující‑remitující RS). S delším trváním onemocnění ovšem dochází ke snížení intenzity zánětu a k nárůstu neurodegenerace, která je spojena s trvalým neurologickým postižením (progresivní forma RS). V humánní medicíně dosud neexistuje žádná efektivní a bezpečná možnost neuroregenerace CNS. Zásadním cílem léčby RS proto zůstává co nejčasnější útlum zánětlivé aktivity a tím prevence neurodegenerace.
V léčbě akutního relapsu se jedná o vysokodávkovaný methylprednisolon. V rámci dlouhodobé preventivní léčby relabující‑remitující RS máme k dispozici tzv. léky modifikující průběh choroby (disease modifying drugs, DMD), které zahrnují léky 1. volby (interferony beta, glatiramer acetát, teriflunomid, dimethyl fumarát) a léky 2. volby (natalizumab, fingolimod). Dnes již spíše výjimečně indikovanou skupinu léků 3. volby tvoří imunosupresiva (azathioprin) a cytostatika (cyklofosfamid, mitoxantron). Alemtuzumab byl svým rozsáhlým účinkem na imunitní systém zařazen do skupiny eskalačních léků 2. volby [3].
Mechanismus účinku
Alemtuzumab je humanizovaná monoklonální protilátka proti povrchovému antigenu CD52. Funkce membránového glykopeptidu CD52, exprimovaného na lymfocytech, monocytech, makrofázích i NK buňkách (natural killers – přirození zabíječi), není přesně známa, ale podle dostupných prací se zřejmě uplatňuje v procesu omezení adheze imunitních buněk [4] a snížení aktivace T‑lymfocytů [5]. Navázáním alemtuzumabu na cílový antigen CD52 dochází k opsonizaci buňky a k její smrti buď mechanismem buněčné lýzy zprostředkované komplementem nebo cytotoxickou reakcí závislou na protilátkách.
Podání alemtuzumabu (12 mg denně celkem pět po sobě následujících dnů v prvním roce léčby a 12 mg denně celkem tři po sobě jdoucí dny ve druhém roce léčby) u člověka vede řádově ve dnech k výraznému poklesu počtu T‑ i B‑lymfocytů v periferní krvi, aniž byl pozorován stejně významný vliv na buňky přirozené imunity. Obdobně jako je tomu například po imunoablaci v rámci procesu autologní transplantace kmenových buněk [6], po depleci imunitních buněk nejdříve dochází k znovuobnovení populace B‑lymfocytů (normalizace na původní hodnoty zhruba do šesti měsíců) s relativně větším zastoupením nezralých forem.
Mnohem pomaleji po depleci repopulují T‑lymfocyty, jejichž počty se normalizují nejdříve za rok od léčby. Proliferují přitom zejména periferní lymfocyty mimo thymus, což je spojeno s rizikem proliferace také autoreaktivních klonů, které unikly thymové kontrole, a přirozeně se jinak vyskytují pouze v malých a neškodných počtech. Tento jev může být zodpovědný za zvýšené riziko rozvoje sekundárních autoimunitních onemocnění po léčbě alemtuzumabem [7]. Na druhou stranu lze v obnovované populaci buněk detekovat větší procento regulačních T‑lymfocytů i T‑lymfocytů produkujících neurotrofní faktor BDNF (brain‑derived neurotrophic factor), což může mít pozitivní reparační vliv na myelin CNS [8].
Celkem lze shrnout, že alemtuzumab mohutně zasáhne do imunitního systému deplecí specifických lymfocytů s jejich následnou repopulací či lépe vyjádřeno „restartem“ včetně změny v zastoupení i ve vlastnostech nově obnovovaných buněk. Délka trvání vlivu na imunitní systém (měsíce až roky) je mnohonásobně delší ve srovnání s biologickým poločasem eliminace samotného alemtuzumabu (30 dnů po léčebném cyklu jsou již detekovány jen velmi nízké až nulové koncentrace léčiva v séru) [9].
Klinické studie
Monoklonální protilátka alemtuzumab byla vyvinuta již v osmdesátých letech minulého století v britské Cambridgi (odtud také název Campath‑1 = Department of Pathology, University of Cambridge) původně pro léčbu chronické B‑lymfocytární leukemie.
Pilotní studie u RS v devadesátých letech zahrnovala 28 pacientů se sekundárně progresivní formou onemocnění [10]. Ačkoliv u pacientů došlo ke snížení zánětlivé aktivity choroby, nebyla zásadně ovlivněna progrese invalidity, což odpovídá současnému pochopení a konceptu celé protizánětlivé léčby RS – tedy smysluplná indikace protizánětlivé léčby výhradně v počátečních zánětlivých fázích choroby jako jediná prevence pozdější nezastavitelně progredující neurodegenerace. S touto myšlenkou byly další klinické studie s alemtuzumabem již plánovány pro pacienty s relabující‑remitující formou RS. Jednalo se o studie CAMMS223 fáze II a studie CARE‑MS I a II fáze III klinického hodnocení, všechny s aktivním komparátorem interferonem beta‑1a podávaným v dávce 44 µg subkutánně 3× týdně.
Do studie CAMMS223 [11] byli zařazeni pacienti s aktivní relabující‑remitující RS (alespoň dva relapsy v posledních dvou letech a alespoň jedno aktivní ložisko na magnetické rezonanci – MR – mozku), relativně na počátku onemocnění (stupeň neurologického postižení na škále EDSS – Expanded Disability Status Scale – maximálně 3,0 a délka trvání RS do tří let). Schéma podávání alemtuzumabu zahrnovalo intravenózní podávání dávky 12 mg nebo 24 mg denně pět po sobě jdoucích dnů v prvním roce (podáno u 97 % pacientů) a tři po sobě jdoucí dny ve druhém roce studie (podáno u 93 % pacientů). Třetí cyklus léčby ve 24. měsíci studie byl podán dle uvážení ošetřujícího neurologa, pokud počet CD4+ lymfocytů přesáhl 100 × 106/l (podáno u 21 % pacientů). Při léčbě alemtuzumabem bylo dosaženo snížení počtu relapsů v porovnání s interferonem beta o 69 % (dávka 12 mg), resp. o 79 % (dávka 24 mg). Riziko trvalé invalidity bylo sníženo při léčbě alemtuzumabem o 75 % oproti léčbě interferonem beta (dávka 12 mg), resp. o 67 % (dávka 24 mg). Dle post hoc analýzy dosáhlo po třech letech sledování dlouhodobé klinické remise 73 % pacientů léčených alemtuzumabem oproti 43 % pacientů léčených interferonem beta [12].
Klinické studie fáze III zahrnovaly dvě paralelní studie CARE‑MS I (pacienti s relabující‑remitující RS s délkou trvání choroby do pěti let, EDSS ≤ 3,0, bez předchozí léčby DMD) a CARE‑MS II (pacienti s relabující‑remitující RS s délkou trvání choroby do 10 let, EDSS ≤ 5,0 a s alespoň jedním relapsem při předchozí léčbě DMD včetně natalizumabu) [13,14]. Alemtuzumab v dávce 12 mg byl podáván ve stejném schématu jako ve studii fáze II, ale pouze v prvním a ve druhém cyklu. Ve dvouleté základní fázi obou studií bylo pozorováno snížení počtu relapsů v porovnání s interferonem beta o 55 % (CARE‑MS I), resp. o 49 % (CARE‑MS II). Celkem dosáhlo stavu bez průkazné klinické i MR aktivity onemocnění 38,6 % pacientů léčených alemtuzumabem (oproti 26,7 % pacientů léčených interferonem beta) ve studii CARE‑MS I a 32,2 % (oproti 13,6 %) ve studii CARE‑MS II.
Všem pacientům ze studií fáze II a III byla nabídnuta možnost dalšího sledování a léčby opakovanými cykly alemtuzumabu dle individuální potřeby v rámci extenze. V průběhu čtyřletého následného sledování se počet pacientů s nutností přeléčení dalším cyklem terapie alemtuzumabem pohyboval mezi 26–31 %. Číselný údaj z některých menších studií iniciovaných samotnými výzkumníky uvádí pouze 48 % v průběhu dvanáctiletého sledování [15], což by mělo představovat důležitou ekonomickou informaci pro plátce zdravotního pojištění.
V rámci pětiletého sledování pacientů ze studie CAMMS223 (dávka 12 mg) bylo dosaženo snížení počtu relapsů o 66 % oproti interferonu beta, snížení rizika trvalé invalidity o 69 % a zlepšení či stabilizace EDSS o 74 % (oproti 54 % pacientů léčených interferonem beta) [16].
Bezpečnost, tolerance, preventivní doporučení
Data dokladující důležité informace o nežádoucích účincích spojených s léčbou alemtuzumabem máme k dispozici díky studiím fáze II a III, jejich extenzím a více než desetiletému sledování původní cambridgeské skupiny pacientů se sekundárně progresivní formou RS [10–16].
Nejčastějšími nežádoucími účinky jsou infuzní reakce (bolest hlavy, návaly, nauzea, zvýšená teplota, pruritus, aj.), které zřejmě souvisejí s rozpadem imunitních buněk a s uvolněním jejich působků do periferní krve. Nepředstavují zásadní problém, protože závažné byly pouze v méně než 3 % případů, nezpůsobily klasickou anafylaktickou reakci či úmrtí pacienta a mají tendenci ke snížení výskytu s opakováním cyklů léčby (85 % pacientů při 1. cyklu, 69 % při 2. cyklu, 63 % při 3. cyklu). V rámci premedikace je před každou aplikací alemtuzumabu standardně podán kortikosteroid (např. methylprednisolon v dávce 500 mg intravenózně), antihistaminikum (např. cetirizin 10 mg perorálně) a antipyretikum (např. paracetamol 1 000 mg perorálně).
Další dvě skupiny významných nežádoucích účinků při léčbě alemtuzumabem představují infekce a sekundární autoimunitní onemocnění, přičemž je zjevné, že z hlediska výskytu a vlivu na zdraví a život pacienta jsou mezi nimi skutečným problémem právě poslední uvedené.
Infekce všech stupňů závažnosti byly častěji pozorovány ve skupině pacientů léčených alemtuzumabem oproti pacientům léčeným interferonem beta. Nejčastěji se jednalo o běžné infekce dýchacích a močových cest. Riziko infektů (typicky dýchacích cest s kapénkovým přenosem) je nejvyšší v prvních dvou měsících od podání přípravku. Pacientům doporučujeme vyhýbat se po tuto dobu místům s vysokou koncentrací osob (např. městská hromadná doprava), případně užívat roušky. Ve stejném období doporučujeme pacientům vyhýbat se ve stravě výrobkům s předpokládaným či známým obsahem bakterií či plísní (např. jogurty s živou kulturou, syrové maso, plísňové sýry, ořechy apod.).
Výskyt běžných herpetických infekcí (virem herpes simplex, varicella zoster) byl snížen po zavedení standardní profylaxe aciclovirem v průběhu léčby (aciclovir 200 mg perorálně 2× denně alespoň po dobu cyklu a 4 týdny po jeho ukončení, při zvýšeném riziku infekce lépe dlouhodobě).
Ze závažných infekcí je nutno zmínit riziko progresivní multifokální leukocencefalopatie (PML). Jedná se o dosud neléčitelnou oportunní infekci CNS způsobenou JC virem (JCV), která je až ve 25 % případů fatální a ve většině ostatních případů vede k trvalému neurologickému postižení (hybnost, zrak, kognice). Komplikace PML byla zatím hlášena u pacientů léčených alemtuzumabem pro chronickou lymfocytární leukemii a rejekci štěpu (dle dostupných údajů v literatuře byl hlášen jediný případ PML u pacienta s RS léčeného alemtuzumabem, ovšem s předchozí léčbou natalizumabem, u kterého je riziko PML již dobře známo [17]).
Právě vzhlede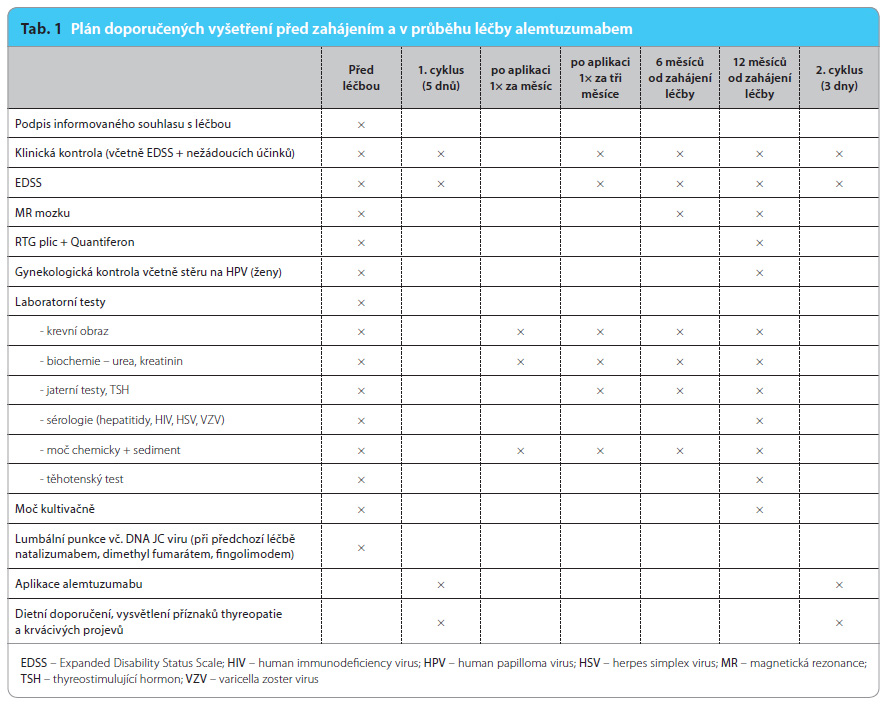 m k zařazení alemtuzumabu jako eskalační léčby lze předpokládat léčbu pacientů již předléčených natalizumabem i jinými léčivy, kteří potenciálně rizikoví z rozvoje PML nepochybně jsou. Před zahájením léčby alemtuzumabem doporučujeme vždy kontrolu titru protilátek proti JC viru v séru, kontrolu přítomnosti DNA JC viru v likvoru pacienta a aktuální MR mozku k vyloučení incipientních známek PML. Plán doporučených vyšetření před zahájením a v průběhu léčby alemtuzumabem ukazuje tab. 1.
m k zařazení alemtuzumabu jako eskalační léčby lze předpokládat léčbu pacientů již předléčených natalizumabem i jinými léčivy, kteří potenciálně rizikoví z rozvoje PML nepochybně jsou. Před zahájením léčby alemtuzumabem doporučujeme vždy kontrolu titru protilátek proti JC viru v séru, kontrolu přítomnosti DNA JC viru v likvoru pacienta a aktuální MR mozku k vyloučení incipientních známek PML. Plán doporučených vyšetření před zahájením a v průběhu léčby alemtuzumabem ukazuje tab. 1.
K vzácným infekcím při léčbě alemtuzumabem patří listeriová meningitida (celkem tři případy, vždy po prvním cyklu léčby), kauzálně léčitelná, s doporučením vyšetření tohoto mikroorganismu vždy v případě podezření na meningitidu u pacienta léčeného alemtuzumabem [18].
Sekundární autoimunitní onemocnění znamenají nejzávažnější problém ve spojitosti s léčbou alemtuzumabem. Jedná se především o autoimunitní thyreopatie (častěji s hyperfunkcí štítné žlázy) a s výrazně nižším výskytem imunitní trombocytopenie a glomerulonefritidy.
Rozvoj thyreopatie lze podle dat z provedených studií očekávat až u 39 % pacientů, s typickým rozvojem prvních příznaků nejčastěji ve třetím roce od podání prvního cyklu alemtuzumabu (ve studiích rozvoj všech případů mezi 6.–61. měsícem od začátku léčby, z toho celých 21 % ve třetím roce [16]). Thyreopatie dobře reagovaly na konvenční léčbu, a důraz je tedy kladen především na pravidelný screening funkce štítné žlázy po léčbě alemtuzumabem – edukace pacienta týkající se symptomů hyper‑ a hypofunkce štítné žlázy, laboratorní kontrola TSH (thyreostimulační hormon) každé tři měsíce [9].
Imunitní trombocytopenie se vyskytla ve studiích s alemtuzumabem zhruba u 2 % pacientů, z čehož u jednoho pacienta ve studii fáze II vedla k úmrtí na intrakraniální krvácení. Z rozboru ostatních případů však vyplývá, že včasným odhalením a léčbou (kortikosteroidy, intravenózní imunoglobuliny, substituční léčba, rituximab) lze dosáhnout dobré odpovědi a dlouhodobé remise. K monitoringu pacientů v tomto ohledu patří vedle edukace o krvácivých projevech kontrola krevního obrazu jedenkrát měsíčně [9].
Nejvzácnější typ sekundární autoimunity po léčbě alemtuzumabem (0,3 %) představovala nefropatie způsobená autoprotilátkami proti bazální membráně glomerulů. Také případy této autoimunity zareagovaly dobře na konvenční léčbu. K prevenci zde patří laboratorní kontroly (kreatinin a urea v séru, mikroskopické vyšetření moči), opět jedenkrát měsíčně [9].
Fertilita, gravidita a kojení
Přes průkaznou expresi molekuly CD52 na spermiích a buňkách mužského pohlavního traktu nebyl prokázán negativní vliv alemtuzumabu na počet a funkci spermií [19].
Nejsou k dispozici žádné studie vlivu alemtuzumabu na plod a léčivo je zařazeno v tomto ohledu do kategorie C. Vzhledem k prostupnosti placenty pro molekuly protilátek IgG lze předpokládat také prostup a možný vliv na plod u alemtuzumabu. Z dosavadních zpráv o graviditách v proběhlých klinických studiích s alemtuzumabem (asi 150) lze považovat výskyt spontánních abortů za odpovídající běžné populaci (cca 30 %), stejně tak jako výskyt vývojových vad (3 případy). Pacientkám je při léčbě alemtuzumabem doporučena vhodná kontracepce po dobu podávání léku a čtyř následujících měsíců [9]. Nepředpokládáme vliv na kojení a přestup do mateřského mléka vzhledem ke krátkému biologickému poločasu eliminace léku v organismu matky.
Zařazení alemtuzumabu do klinické praxe
Úhradová kritéria pro alemtuzumab v České republice (ČR) indikují tento přípravek pro pacienty s relabující‑remitující formou RS, u kterých nedošlo navzdory léčbě léky 1. linie k poklesu počtu relapsů na méně než dva relapsy ročně, nebo u pacientů s rychle se vyvíjející těžkou formou RS, kteří prodělali nejméně dva relapsy v jednom roce a současně vykazují jednu nebo více lézí vychytávajících gadolinium na MR mozku nebo výrazné zvýšení počtu T2‑vážených lézí ve srovnání s předchozí MR (provedenou před 3–6 měsíci). Úhradová kritéria odpovídají medicínskému náhledu na alemtuzumab, podle kterého by měl být indikován pouze u jednoznačně aktivní choroby dosud s relabujícím‑remitujícím průběhem (účinek u progresivní formy nebyl prokázán).
Optimálně bychom zřejmě měli o alemtuzumabu uvažovat především jako o vhodné variantě 2. linie léčby po selhání léků první volby 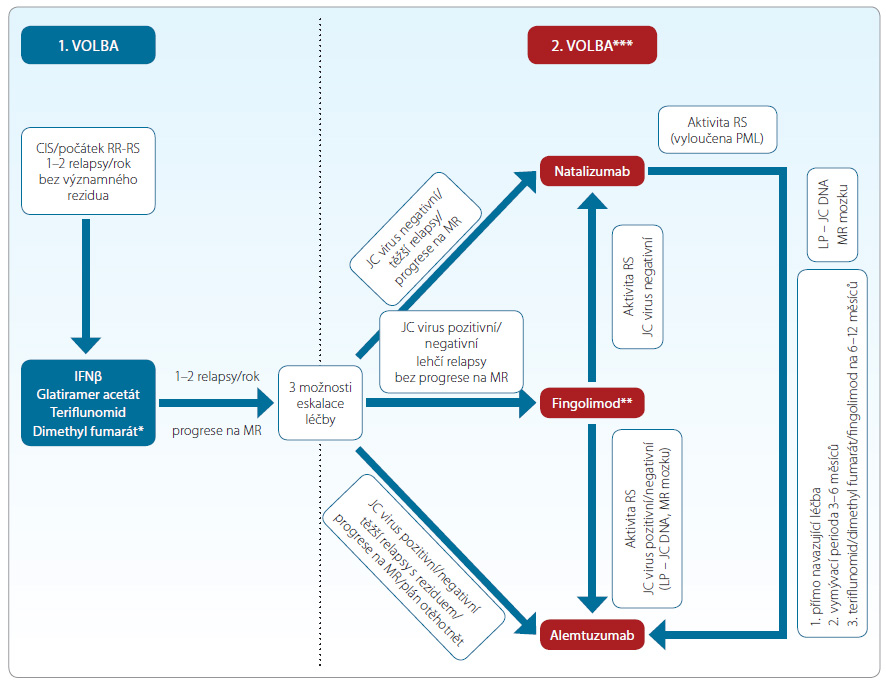 u pacientů s pozitivitou JC viru ve vysokém riziku PML (obr. 1). Je ovšem otázkou, zda si toto privilegium alemtuzumab udrží do budoucna po registraci ocrelizumabu (monoklonální protilátky proti znaku CD20), který se doposud jeví jako obdobně účinný a přitom bezpečnější. Eskalace z léčby 1. linie rovnou na alemtuzumab (ocrelizumab) by pomohla odstranit zvýšené riziko vzniku PML u JCV‑pozitivních pacientů či riziko obnovení aktivity RS (rebound fenoménu) při bezpečnostním převádění na léčbu fingolimodem, který je většinou v této indikaci nedostatečně účinný.
u pacientů s pozitivitou JC viru ve vysokém riziku PML (obr. 1). Je ovšem otázkou, zda si toto privilegium alemtuzumab udrží do budoucna po registraci ocrelizumabu (monoklonální protilátky proti znaku CD20), který se doposud jeví jako obdobně účinný a přitom bezpečnější. Eskalace z léčby 1. linie rovnou na alemtuzumab (ocrelizumab) by pomohla odstranit zvýšené riziko vzniku PML u JCV‑pozitivních pacientů či riziko obnovení aktivity RS (rebound fenoménu) při bezpečnostním převádění na léčbu fingolimodem, který je většinou v této indikaci nedostatečně účinný.
Alemtuzumab dále představuje vhodnou variantu pro pacientky s vysokou aktivitou RS, které plánují graviditu. Jeho aplikací dosahujeme dlouhodobého účinku, který přetrvává dlouho po eliminaci samotného léčiva z organismu. Lze tak opět obejít problémy jak s natalizumabem (zvýšené riziko rebound fenoménu RS po přerušení léčby v graviditě i po jejím ukončení), tak s fingolimodem (nutné přerušení léčby dva měsíce před otěhotněním s rizikem relapsu).
Naše dosavadní zkušenost
V našem Centru pro demyelinizační onemocnění Neurologické kliniky 1. LF UK a VFN v Praze zahájilo dosud od registrace alemtuzumabu v ČR tuto léčbu celkem 14 pacientů s relabující‑remitující RS (tab. 2). Soubor pacientů a krátkodobá data zatím neumožňují vyhodnocovat účinnost či bezpečnost léčby alemtuzumabem, ale přinášejí prvotní charakteristiky pacientů, kteří jsou indikováni k této léčbě mimo klinickou studii v reálné praxi. Vzhledem k pozici přípravku ve schématu léčby RS i vzhledem k jeho bezpečnostnímu profilu nepřekvapuje, že byli indikováni pacienti často již bohatě předléčení jinou léčbou RS. Kromě léků 1. volby (n = 12) a 2. volby (n = 12) se jednalo rovněž o cytostatikum cyklofosfamid a imunosupresivum azathioprin (celkem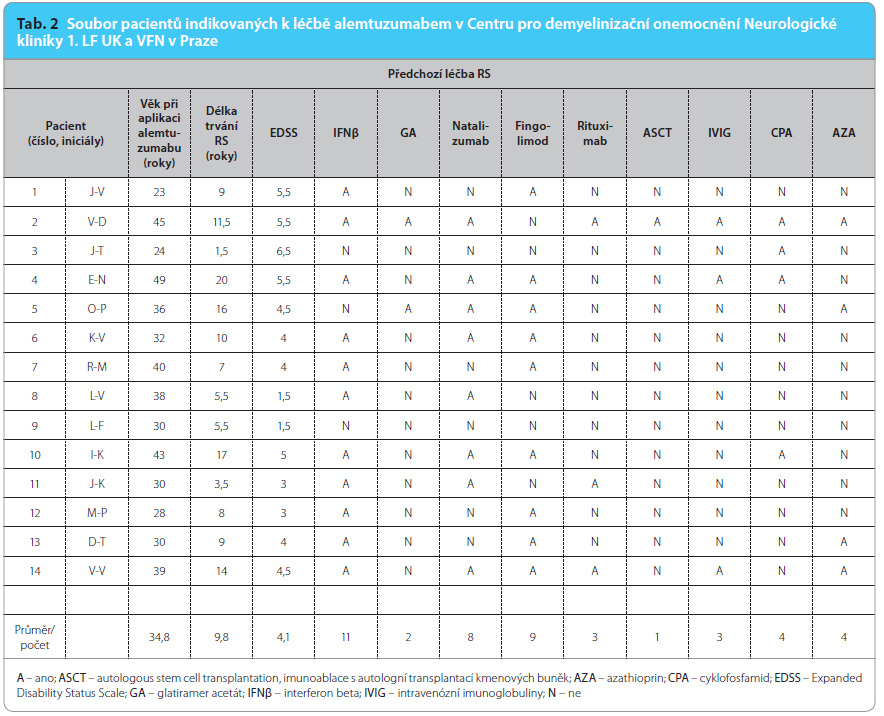 n = 7, tedy 50 % pacientů), off‑label podání rituximabu (n = 3) a v jednom případě dokonce o vysokodávkovanou imunoablaci s autologní transplantací kmenových buněk. Pacienti byli indikováni k léčbě alemtuzumabem v průměru po desetiletém průběhu choroby (1,5–20 let) a při průměrném stupni neurologického postižení EDSS 4,0 (1,5–6,5). Dva pacienti byli indikováni pro vysokou aktivitu RS k léčbě alemtuzumabem v první volbě.
n = 7, tedy 50 % pacientů), off‑label podání rituximabu (n = 3) a v jednom případě dokonce o vysokodávkovanou imunoablaci s autologní transplantací kmenových buněk. Pacienti byli indikováni k léčbě alemtuzumabem v průměru po desetiletém průběhu choroby (1,5–20 let) a při průměrném stupni neurologického postižení EDSS 4,0 (1,5–6,5). Dva pacienti byli indikováni pro vysokou aktivitu RS k léčbě alemtuzumabem v první volbě.
Na rozdíl od navržených optimálních indikací v předchozím odstavci článku zde vidíme, že v klinické praxi je alemtuzumab častěji indikován již po předchozím předléčení jiným přípravkem 2. linie (natalizumabem nebo fingolimodem). Zejména u natalizumabu se tak otevírá k diskusi změna postupu léčby u pacientů s vysokým rizikem vzniku PML, které hrozí ještě i po ukončení podávání natalizumabu (nejčastěji prvních šest měsíců po jeho vysazení). Je potřeba mít na zřeteli jak tento možný oddálený rozvoj PML u JCV‑pozitivního pacienta, tak i možnost sérokonverze pacienta JCV‑negativního po tuto dobu (nutnost kontroly titru protilátek v séru). Obávaná PML představuje oportunní infekci, která je neléčitelná. Zmírnění jejích následků lze dosáhnout pouze včasnou diagnostikou a maximální snahou o rekonstituci imunitního systému při rozvoji onemocnění, což po podání alemtuzumabu logicky není urychleně možné. Giovannoni a kol. [17] proto poukazují na tři možné způsoby změny léčby (tzv. switch) z natalizumabu na alemtuzumab a na jejich rizika:
1. přímá návaznost aplikace alemtuzumabu a natalizumabu po kontrole MR mozku a vyloučení pozitivity DNA JC viru v likvoru (vysoké riziko oddáleného rozvoje PML již po aplikaci alemtuzumabu, a tedy nemožnost zastavit jeho imunosupresivní účinek);
2. tří‑ až šestiměsíční vymývací perioda mezi ukončením léčby natalizumabem a zahájením podávání alemtuzumabu s provedením dvou MR mozku v čase a s vyloučením pozitivity DNA JC viru v likvoru (střední riziko zejména možné reaktivace RS);
3. převedení na léčbu jiným přípravkem podávaným na dobu 6–12 měsíců v období mezi ukončením léčby natalizumabem a zahájením podávání alemtuzumabu (teriflunomid, dimethyl fumarát nebo fingolimod) s provedením dvou MR mozku v čase a s vyloučením pozitivity DNA JC viru v likvoru (nejmenší riziko oddálené PML s rozvojem až po aplikaci alemtuzumabu, ale riziko aktivity RS při léčbě přípravky s nižší účinností).
S konkrétním pacientem je nutno jednotlivá rizika před zahájením léčby alemtuzumabem pečlivě diskutovat.
Po porovnání charakteristik naší skupiny pacientů se skupinou pacientů z dosavadních klinických studií jednoznačně vyplývá nutnost dlouhodobého sběru klinických dat do větších pacientských registrů (ReMUS v ČR, mezinárodní MS‑Base), neboť jedině tímto způsobem získáme reálná data ukazující na účinnost a bezpečnost přípravků tak, jak je skutečně indikujeme v praxi.
Odhlédnuto od účinnosti a bezpečnosti alemtuzumabu nelze nezmínit na závěr také otázku úhrady tohoto přípravku. Náklady na první cyklus léčby alemtuzumabem činí zhruba 1 140 000 Kč, cena druhého cyklu je 680 000 Kč s tím, že následně lze předpokládat různě dlouhý interval rekonstituce imunitního systému a nutnost podání dalšího cyklu (dle klinických studií viz výše indikováno u přibližně 30 % pacientů v následujících čtyřech letech a u přibližně poloviny pacientů v následujících deseti letech). Náklady na léčbu alemtuzumabem po dobu 2–10 let lze vyčíslit zhruba na dva miliony Kč. Porovnání s náklady na léčbu natalizumabem (přibližně jeden milion Kč za dva roky) se odvíjí od počtu opakování cyklů léčby alemtuzumabem. V případě dlouhodobé stabilizace RS může být výsledná cena alemtuzumabu dokonce nižší. Bohužel jednorázová investice v podobě jednoho cyklu alemtuzumabu je natolik vysoká, že v rozpočtech zdravotnických zařízení činí velký problém bez ohledu na délku trvání účinku. Do budoucna jsou proto žádoucí změny systému úhrady léčiv a jednání mezi regulačními orgány, zdravotními pojišťovnami a nemocnicemi tak, aby byl účinný lék dostupný všem indikovaným pacientům, kteří následně zachovanou práceschopností dostatečně zpětně přispějí do hrubého domácího produktu.
Závěr
Alemtuzumab představuje zatím druhou monoklonální protilátku v řadě registrovanou pro léčbu relabující‑remitující RS. Jeho prokázaná vysoká účinnost je spojena s určitými bezpečnostními riziky a na první pohled s vysokou jednorázovou cenou za cyklus léčby. Jedině správným výběrem pacientů a pečlivým sběrem dat takto léčených pacientů v klinické praxi může mít z této léčby do budoucna ve větší míře prospěch širší skupina nemocných.
Seznam použité literatury
- [1] Compston A, McDonald I, Noseworthy J, et al. McAlpine´s Multiple Sclerosis. Elsevier Inc. 2006.
- [2] Kappos L, Li D, Calabresi PA, et al. Ocrelizumab in relapsing remitting multiple sclerosis: a phase 2, randomised, placebo controlled, multicentre trial. Lancet 2011; 378: 1779–1787.
- [3] Havrdová E. Alemtuzumab. Remedia 2014; 24: 232–238.
- [4] Hale G, Waldmann H. From Laboratory to Clinic: The Story of CAMPATH 1. Methods Mol Med 2000; 40: 243–266.
- [5] Bandala Sanchez E, Zhang Y, Reinwald S, et al. T cell regulation mediated by interaction of soluble CD52 with the inhibitory receptor Siglec 10. Nat Immunol 2013; 14: 741–748.
- [6] Koehne G, Zeller W, Stockschlaeder M, et al. Phenotype of lymphocyte subsets after autologous peripheral blood stem cell transplantation. Bone Marrow Transplant 1997; 19: 149–156.
- [7] Jones JL, Thompson SA, Loh P, et al. Human autoimmunity after lymphocyte depletion is caused by homeostatic T cell proliferation. Proc Natl Acad Sci U S A 2013; 110: 20200–20205.
- [8] Jones JL, Anderson JM, Phuah CL, et al. Improvement in disability after alemtuzumab treatment of multiple sclerosis is associated with neuroprotective autoimmunity. Brain 2010; 133: 2232–2247.
- [9] Summary of Product Characteristics (SPC) Lemtrada, dostupný na www.sukl.cz: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_ _Product_Information/human/003718/WC500150521.pdf
- [10] Coles AJ, Wing MG, Molyneux P, et al. Monoclonal antibody treatment exposes three mechanisms underlying the clinical course of multiple sclerosis. Ann Neurol 1999; 46: 296–304.
- [11] CAMMS223 Trial Investigators, Coles AJ, Compston DA, Selmaj KW, et al. Alemtuzumab vs. interferon beta 1a in early multiple sclerosis. N Engl J Med 2008; 359: 1786–1801.
- [12] Coles AJ, Fox E, Vladic A, et al. Alemtuzumab versus interferon β 1a in early relapsing remitting multiple sclerosis: post hoc and subset analyses of clinical efficacy outcomes. Lancet Neurol 2011; 10: 338–248.
- [13] Cohen JA, Coles AJ, Arnold DL, et al. Alemtuzumab versus interferon beta 1a as first line treatment for patients with relapsing remitting multiple sclerosis: a randomised controlled phase 3 trial. Lancet 2012; 380: 1819–1828.
- [14] Coles AJ, Twyman CL, Arnold DL, et al. Alemtuzumab for patients with relapsing multiple sclerosis after disease modifying therapy: a randomised con-trolled phase 3 trial. Lancet 2012; 380: 1829–1839.
- [15] Tuohy O, Costelloe L, Hill Cawthorne G, et al. Alemtuzumab treatment of multiple sclerosis: long term safety and efficacy. J Neurol Neurosurg Psychiatry 2015; 86: 208–215.
- [16] Coles AJ, Fox E, Vladic A, et al. Alemtuzumab more effective than interferon β 1a at 5 year follow up of CAMMS223 clinical trial. Neurology 2012; 78: 1069–1078.
- [17] Giovannoni G, Marta M, Davis A, et al. Switching patients at high risk of PML from natalizumab to another disease modifying therapy. Pract Neurol 2016. pii: practneurol 2015 001355.
- [18] Rau D, Lang M, Harth A, et al. Listeria meningitis Complicating Alemtuzumab Treatment in Multiple Sclerosis – Report of Two Cases. Int J Mol Sci 2015; 16: 14669–14676.
- [19] Margolin DH, Rizzo M, Smith G, et al. Alemtuzumab treatment has no adverse impact on sperm quality, quantity, or motility: A CARE MS substudy. 21st World Congress of Neurology; September 21 26, 2013; Vienna, Austria.