Alergenová imunoterapie u dětských pacientů – „čím dříve, tím lépe“
Na počátku října letošního roku se v Praze konal již XXXIX. sjezd českých a slovenských alergologů a klinických imunologů a XVIII. kongres českých a slovenských imunologů. Součástí této odborné akce bylo také sympozium společnosti ALK Slovakia s názvem „Kauzální léčba alergií – silná data v rukou alergologa“, jemuž předsedal docent MUDr. Petr Čáp, Ph.D., z Nemocnice Na Homolce v Praze. Příspěvky zaměřené především na pediatrické pacienty s alergií prezentovali profesor MUDr. Mgr. Miloš Jeseňák, PhD., MBA, Dott Ric., MHA, (Oddělení klinické imunologie a alergologie, JLF UK a UN Martin), MUDr. Radovan Košturiak, PhD., (Ambulance klinické imunologie a alergologie, Poliklinika Klokočina, Nitra) a MUDr. Irena Krčmová, CSc., (Ústav klinické imunologie a alergologie FN Hradec Králové).
Redukce alergických symptomů u dětí léčených SQ SLIT tabletami
„Alergenová imunoterapie představuje jedinou exkluzivní léčbu, kterou máme jako alergologové a kliničtí imunologové k dispozici,“ zahájil svoji přednášku profesor Jeseňák. Kožní testy jsou podle něj pouze jednou součástí diagnostiky, ale důraz by měl být kladen především na další oblasti terapie pacientů s alergií. Zažíváme pandemii různých civilizačních chorob, mezi něž jednoznačně patří alergická onemocnění, která postihují jednu třetinu populace. Nevíme, kolik pacientů se neléčí a nevyhledá specialistu, reálné odhady tedy budou zřejmě ještě vyšší a počty nemocných stoupají.
Přednášející se dále zaměřil na vyhodnocení části studií s pediatrickými pacienty společnosti ALK, jejíž široké portfolio zahrnuje přípravky alergenové imunoterapie (AIT) s různými alergeny. Sublinguální tablety s extrakty alergenů (SQ SLIT), které jsou k dispozici, pokrývají většinu spektra alergických pacientů. Uvedená léčba je účinná, pokud onemocnění správně diagnostikujeme a vybereme vhodnou terapii proti danému alergenu.
Alergická rinitida
Také v případě alergické rinitidy (AR) platí fenotypizace – na fenotyp monoalergický a polyalergický [1]. Pokud se monoalergický pacient s AR neléčí, nastupuje u něj proces bisenzibilizace a polysenzibilizace, z tohoto důvodu je poté komplikované zvolit správný alergen pro AIT. Při monoalergii je velká šance, že zasáhneme do atopického pochodu. U polyalergického typu probíhá postupná ztráta sezonality, kdy symptomy už nejsou spojeny pouze s obdobím výskytu alergenu, velmi často se objevují obtěžující příznaky v podobě rinorey, kongesce či výraznějšího zánětlivého infiltrátu. V případě AR byl rovněž prokázán výskyt komorbidit ve formě alergického astmatu, rozvoje adenoidní vegetace, poruch spánku, sekretorické formy otitis media (porušení funkce Eustachovy trubice a s tím související problémy) nebo poruchy čichu [2–4]. Alergický terén přispívá k vysoké nemocnosti pediatrických pacientů – jeho přítomnost byla doložena u poloviny až třetiny dětí s recidivujícími infekcemi. Alergenová imunoterapie dokáže tuto nemocnost redukovat. „Alergolog by měl léčit bezpečně, moderně a účinně,“ zdůraznil profesor Jeseňák, neboť alergie ovlivňuje kvalitu života, výkonnost dítěte a prospěch ve škole, zvyšuje riziko rozvoje bronchiální hyperreaktivity/astmatu, je jedním z rizikových faktorů pro vznik aterosklerózy, nese s sebou riziko rozvoje chronického únavového syndromu, chronických bolestí hlavy, respiračních infekcí, široké spektrum extranazálních příznaků a v neposlední řadě zvýšení přímých a nepřímých finančních nákladů [5–13].
Vyhodnocení studií
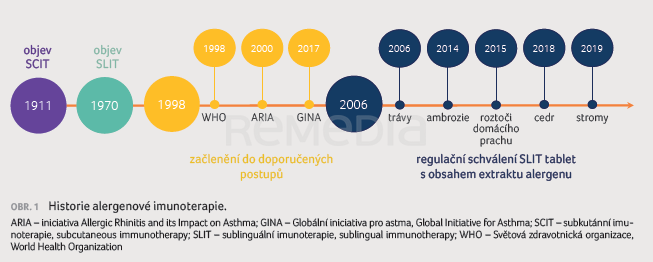
Alergenová imunoterapie funguje už více než sto let (obr. 1) a její princip se v podstatě příliš nezměnil, změnila se však kvalita používaných přípravků, standardizace výroby a kvalita studií, které jsou podkladem pro registraci, ale i kvalita studií z běžné klinické praxe. V rámci evidence pro léčebnou intervenci rozlišujeme tzv. efficacy – potvrzení účinnosti za ideálních podmínek (klinické studie), effectiveness – potvrzení účinnosti v reálné klinické praxi, (cost)efficiency – potvrzení nákladové efektivity. Studie z reálné klinické praxe portfolia společnosti ALK v některých případech předčily účinnost prokázanou klinickými studiemi. Při správném zhodnocení nákladové efektivity se v budoucnosti snižuje riziko rozvoje nových alergií, polysenzibilizace, zvýšení počtu hospitalizací, nemocnosti atd.
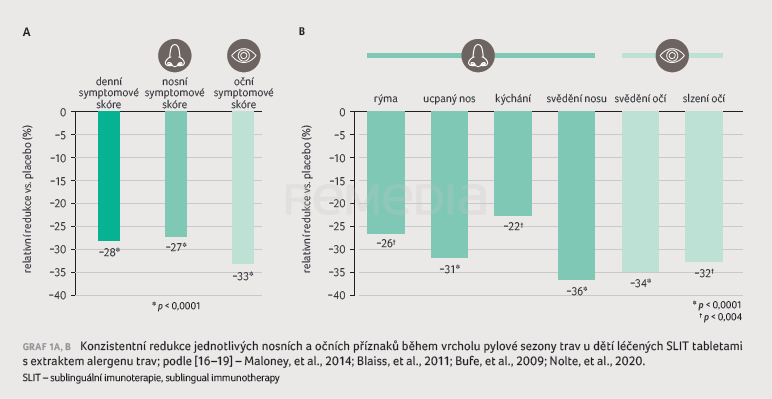
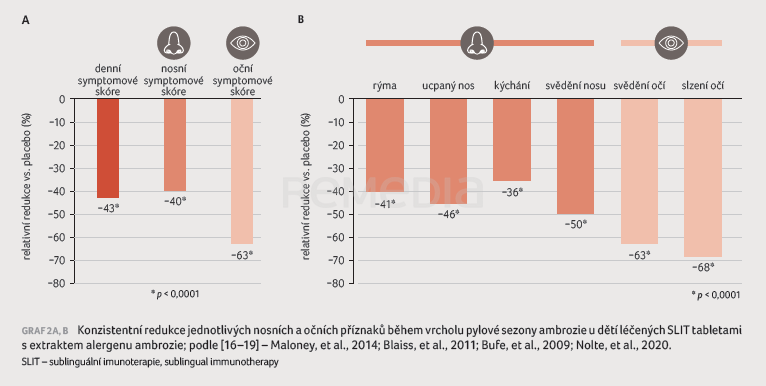
Ucpaný nos a svědění očí patří mezi nejčastější obtěžující klinické symptomy u dětí a adolescentů s AR. V klinické praxi by měly být nosní i oční příznaky u dětí vhodně léčeny z důvodu zmírnění projevů nemoci a zlepšení kvality života [14,15]. Ve studiích sledujících léčbu AR v dětském věku byly hodnoceny dvě formy tabletové AIT: 1. s extraktem pylu trav, 2. s extraktem pylu ambrozie, který představuje jeden z největších alergenů v rámci Evropy. Sledováno bylo celkové symptomové skóre zahrnující čtyři nosní a dva oční příznaky a celkové skóre medikace. Subanalýza z publikovaných studií zařadila více než 1 000 dětí léčených SLIT tabletami s extraktem pylu trav a více než 1 000 dětí léčených SLIT tabletami s extraktem pylu ambrozie [16–19]. Pacienti začali užívat AIT minimálně 3–4 měsíce před sezonou a poté pokračovali během sezony. Vždy se vyhodnocovaly příznaky z hlediska vrcholové sezony daného pylu a během celé sezony, pro niž byl pacient léčen. V symptomovém skóre (nosní, oční, celkové) byla prokázána výrazná, klinicky významná redukce oproti placebové skupině, stejně jako v případě jednotlivých nosních a očních příznaků (graf 1A, B). Při porovnání pylu trav a pylu ambrozie byla zaznamenána větší redukce zejména očních symptomů oproti placebu při léčbě SLIT s extraktem pylu ambrozie (graf 2A, B).
K dispozici jsou rovněž další SLIT, např. tableta s obsahem extraktu z roztočů, kterou je však zatím možno podat pacientům ve věku 12 let a výše, studie u mladších dětí probíhají.
Shrnutí
Analýza léčby SLIT s extraktem pylu trav nebo ambrozie přinesla konzistentní klinicky významný výsledek z hlediska očních i nosních příznaků v celkovém kompozitním skóre, a to ve vrcholové sezoně alergenů i během celé sezony. Alergenovou imunoterapii lze považovat nejen za léčebný, ale i za preventivní nástroj vycházející z postupů medicíny založené na důkazech (evidence based medicine, EBM). Používáním AIT můžeme pomoci zastavit atopický pochod a rozvoj nových senzibilizací, čím dříve je s léčbou započato, tím lépe pro pacienta. Uvedenou léčbu zatím provázejí určité limitace, např. věk pacienta, délka trvání nemoci, stadium senzibilizace, rozsah postižení dýchacích cest, stadium remodelace či délka dispenzarizace.
REACT – od studií k praxi
Další přednášející – doktor Košturiak – v úvodu své prezentace zdůraznil, že klinické randomizované studie stále zůstávají zlatým standardem v EBM, ale neodpovídají na všechny naše otázky z pozice klinických pracovníků. Randomizovaná kontrolovaná studie (randomized controlled trial, RCT) nám dává odpověď na tzv. nulovou hypotézu, tedy na to, zda existuje nějaký rozdíl mezi kontrolní skupinou a mezi skupinou užívající studijní léčivo. Při interpretaci výsledků daných studií chceme vědět, jak velký tento rozdíl je, avšak nesmíme zapomínat na to, že tyto konkrétní číselné hodnoty platí pouze pro vybranou skupinu pacientů. Výsledky RCT obecně jsou platné jen pro 5 % celkové populace. Uvedené studie přinášejí informaci o tom, zda léčba funguje, či nefunguje, tedy jaký je její účinek. Pro nás je však důležité vědět, zda lze u dané léčby prokázat účinnost v celé různorodé populaci alergiků. K tomu slouží studie z reálného života (real‑world evidence, RWE) [20]. Na základě RCT bylo sice shromážděno mnoho poznatků o AIT, ale vzhledem k absenci RWE nemáme dostatek informací také pro naši klinickou praxi [20].
„I v rámci vlastní klinické praxe bychom rádi měli důkazy o tom, že daná léčba funguje,“ uvedl doktor Košturiak a v této souvislosti představil příklad ze své praxe, kdy jako relevantní údaj pro ověření účinnosti terapie analyzoval spotřebu antibiotik (ATB). Výzkum byl cílený na skupinu pacientů, kteří AIT užívali minimálně jeden rok, a zároveň šlo o pacienty, u nichž bylo možné dohledat z elektronických záznamů reálnou spotřebu ATB. Soubor čítal 113 pacientů s průměrným věkem 16 let, tedy především adolescentní nemocné, čímž byla do určité míry limitována i léčba. Tři čtvrtiny těchto pacientů užívaly SLIT. Při porovnání spotřeby ATB před nasazením AIT a minimálně rok po ní bylo zjištěno, že počet ATB kúr na osobu a rok statisticky signifikantně poklesl (64% pokles spotřeby ATB, u celkové spotřeby téměř 40 %). Zajímavé výsledky byly zachyceny v podskupině pacientů, kteří předtím užívali ATB (n = 43) – pokles spotřeby ATB téměř 77 % a celkově téměř 65 % [21]. I z této drobné analýzy tedy vyplývá, že bychom AIT měli indikovat co nejčastěji.
Výsledky studie REACT
REWEAL představuje první RWE program společnosti ALK, který rozšiřuje evidenci pro AIT o důkazy z reálného života. Jeho součástí je studie REACT. Primárním cílem studie bylo posoudit vliv AIT na spotřebu medikace na AR u pacientů s AR a s astmatem nebo bez něj. Sekundárním cílem pak bylo zhodnocení vlivu AIT na astma: spotřeba léků na astma, zhoršení onemocnění, exacerbace astmatu. Uvedené doplnily výzkumné cíle, které zahrnovaly posouzení efektu AIT na spotřebu zdrojů ve zdravotnictví a na náklady vynaložené kvůli respiračním infekcím [22].
Studie byla realizována prostřednictvím databáze německých pojišťoven, která zahrnuje 90 % všech obyvatel (zhruba 6 500 000 alergiků). Vybráno bylo 92 052 pacientů, přičemž hlavní kohortu tvořili nemocní s alergií léčení AIT (n = 46 026) vs. nemocní s alergií bez AIT, další kohortu nemocní s astmatem (n = 14 614) s léčbou a bez léčby. Pacienti museli být AIT léčeni minimálně jeden rok. Přínosem studie je porovnání stejných pacientů s AIT a bez ní. Takové srovnání pacientů s odpovídajícími charakteristikami, stejného věku, závažnosti onemocnění, spotřeby léků atd., je ve studiích velmi náročné. V hodnocení REACT toho bylo dosaženo využitím tzv. propensity skóre – byli zde srovnáváni pacienti, jimž bylo přiřazeno určité skóre pravděpodobnosti, že by jim měla být aplikována AIT. Skóre bylo vypočítáno na základě skupiny pacientů, kteří AIT užívali, a u každého nemocného pak bylo zváženo, jak dalece se vychyluje od průměrných hodnot. Třetím krokem bylo přiřazení pacientů, tedy vytvoření navzájem porovnávaných dvojic [22]. Takové sladění je potřebné rovněž z důvodu eliminace klinických pochybení.
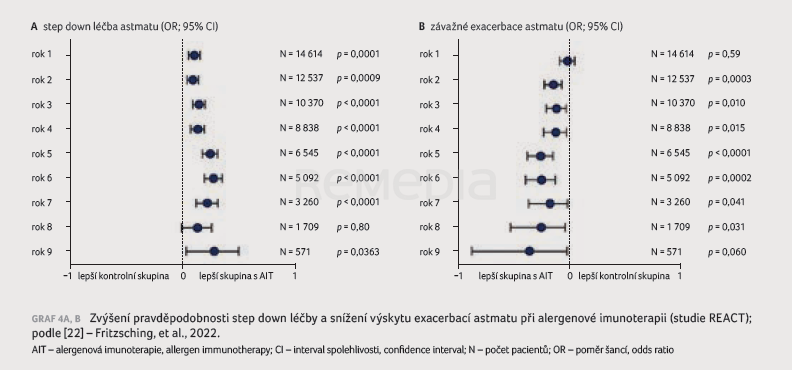
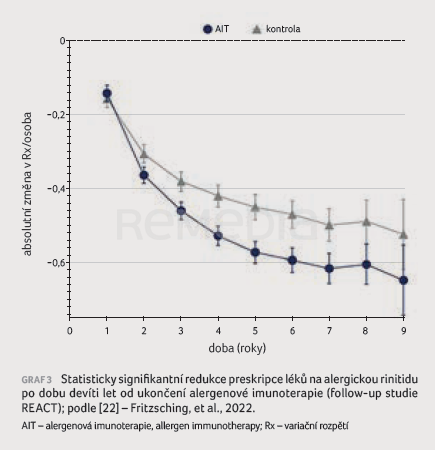 V průběhu devítiletého období sledování byla doložena statisticky signifikantní redukce preskripce přípravků na AR (intranazálních kortikosteroidů a antihistaminik), byl tedy potvrzen minimálně devět let přetrvávající efekt AIT (graf 3). Z hlediska sekundárního cílového ukazatele se v průběhu sledování snížil počet exacerbací astmatu. Studie REACT ukázala, že při AIT máme vyšší pravděpodobnost tzv. step down léčby (zpočátku razantní léčba, která se postupně redukuje) a že AIT funguje jako prevence exacerbací astmatu (graf 4A, B). Zároveň klesl počet hospitalizací pacientů s astmatem (kvůli závažným exacerbacím) vlivem poklesu výskytu respiračních infekcí, snížily se délka hospitalizací i samotné náklady na léčbu. Studie REACT doložila, že AIT je účinná i v reálné praxi [22]. Alergenová imunoterapie zlepšuje kontrolu astmatu, trvale snižuje spotřebu léků užívaných na AR, zabraňuje progresi onemocnění (redukuje pravděpodobnost závažného průběhu astmatu), snižuje počet hospitalizací, jejich délku a náklady s nimi spojené, má pozitivní dopad na dolní cesty dýchací (snižuje pravděpodobnost rozvoje zápalu plic a užívání ATB). Příznivé účinky AIT v případě astmatu byly zjištěny u pacientů s méně závažným průběhem onemocnění. To podporuje hypotézu, že AIT dokáže zabránit progresi onemocnění z mírného do závažnějšího stadia astmatu. Alergenová imunoterapie dosahuje dlouhodobých a setrvalých účinků v léčbě AR.
V průběhu devítiletého období sledování byla doložena statisticky signifikantní redukce preskripce přípravků na AR (intranazálních kortikosteroidů a antihistaminik), byl tedy potvrzen minimálně devět let přetrvávající efekt AIT (graf 3). Z hlediska sekundárního cílového ukazatele se v průběhu sledování snížil počet exacerbací astmatu. Studie REACT ukázala, že při AIT máme vyšší pravděpodobnost tzv. step down léčby (zpočátku razantní léčba, která se postupně redukuje) a že AIT funguje jako prevence exacerbací astmatu (graf 4A, B). Zároveň klesl počet hospitalizací pacientů s astmatem (kvůli závažným exacerbacím) vlivem poklesu výskytu respiračních infekcí, snížily se délka hospitalizací i samotné náklady na léčbu. Studie REACT doložila, že AIT je účinná i v reálné praxi [22]. Alergenová imunoterapie zlepšuje kontrolu astmatu, trvale snižuje spotřebu léků užívaných na AR, zabraňuje progresi onemocnění (redukuje pravděpodobnost závažného průběhu astmatu), snižuje počet hospitalizací, jejich délku a náklady s nimi spojené, má pozitivní dopad na dolní cesty dýchací (snižuje pravděpodobnost rozvoje zápalu plic a užívání ATB). Příznivé účinky AIT v případě astmatu byly zjištěny u pacientů s méně závažným průběhem onemocnění. To podporuje hypotézu, že AIT dokáže zabránit progresi onemocnění z mírného do závažnějšího stadia astmatu. Alergenová imunoterapie dosahuje dlouhodobých a setrvalých účinků v léčbě AR.
Pediatrická studie GAP
Primářka Krčmová na začátku své přednášky označila pediatrickou studii GAP za nesmírně odvážnou a celosvětově důležitou. Mezi vstupní kritéria randomizované, dvojitě zaslepené, placebem kontrolované studie patřily věk 5–12 let a projevy alergické rinokonjunktivitidy bez historie bronchiálního astmatu. Pediatričtí pacienti užívali SLIT tablety s extraktem pylu trav po dobu tří let a následně byli sledováni po dobu dvou let [23]. „Vždy litujeme, že pacienti nebyli sledováni i nadále, neboť by z daného léčebného postupu jistě měli prospěch a znamenalo by to další argument pro to, aby AIT byla více používána a nasazována časně,“ podotkla přednášející. Dle demografických charakteristik zařazených pacientů převládali chlapci, průměrného věku 8,5 roku, trvání alergie činilo něco přes tři roky [24]. Už v tomto raném věku jsou tedy vlastně děti polysenzibilizovány. Hodnocení účinnosti bylo přísné – podmínkami pro jednoznačnou diagnózu astmatu v průběhu studie byly reverzibilita, epizoda dušnosti nebo sípání, nebo užívání léků na astma, nebo splnění třetího kritéria, které bylo v podstatě kombinací kritérií předchozích. Současně bylo sledováno symptomové skóre rinokonjunktivitidy a skóre spotřeby medikace. „Z mého pohledu je klíčový dlouhodobý životní osud alergika, protože primárně nebojujeme s farmakoterapií, ale máme v léčbě zcela jiné cíle,“ doplnila primářka Krčmová.
Studie PAT a studie GAP
Studii GAP předcházela studie PAT, která vzbudila určitá očekávání ve smyslu, že AIT může zabrzdit nepříznivý alergický pochod v souvislosti s atopickým ekzémem, AR, bronchiálním astmatem. PAT byla ve svém cíli úspěšná, protože prokázala při subkutánní AIT (SCIT) pokles nově diagnostikovaného astmatu o 45 %, a to v dlouhodobém horizontu [25]. Ve stejném období Evropská léková agentura (EMA) změnila a zpřísnila pravidla pro provádění studií s AIT, o to obtížněji se nyní koncipují nová klinická hodnocení.
Alergici představují velmi heterogenní skupinu pacientů, z tohoto důvodu bylo ve studii GAP stanovení diagnózy astmatu ošetřeno přísnými kritérii – důkaz reverzibility byl vyžadován jak při screeningu, tak každý půlrok sledování, i při neplánovaných kontrolách z důvodu zhoršení zdravotního stavu. V aktivní skupině byl dokladován 34% pokles rizika rozvoje astmatu nebo užívání léků, tzn. že astma, které vzniklo u dětí z této skupiny, bylo daleko lehčího typu než u dětí z placebové skupiny. Definice počátku astmatu ve studii GAP ovlivnila rozdílnou četnost příhod ve studii PAT vs. GAP. Ve studii PAT postačovala historie příznaků astmatu pro diagnózu onemocnění (opakovaný výskyt alespoň dvou ze tří následujících příznaků během posledních 12 měsíců: kašel, sípání a dušnost; symptomy nebyly spouštěny pouze infekcemi a pacienti reagovali na léčbu beta2 agonisty). Studie GAP byla postavena striktně: astma bylo charakterizováno opakujícími se epizodami symptomů a asymptomatickými obdobími a diagnóza onemocnění vyžadovala objektivní nález u lékaře [24,25]. Ve studii GAP měla AIT následný efekt v imunomodulaci (dvouleté follow‑up), ale současně byla snížena spotřeba medikace u pacientů s nově diagnostikovaným astmatem (graf 5A, B) [24]. Kritiky je někdy poukazováno na nízké počty pacientů, kteří v průběhu studie dospěli k užívání inhalačních kortikosteroidů (viz poslední dva sloupce grafu 5B), nicméně děti v této skupině potřebovaly inhalační kortikosteroidy o dvě třetiny méně ve srovnání s placebovou skupinou. Jde sice o menší statistické soubory, ale nacházejí se na vysoké hladině významnosti.
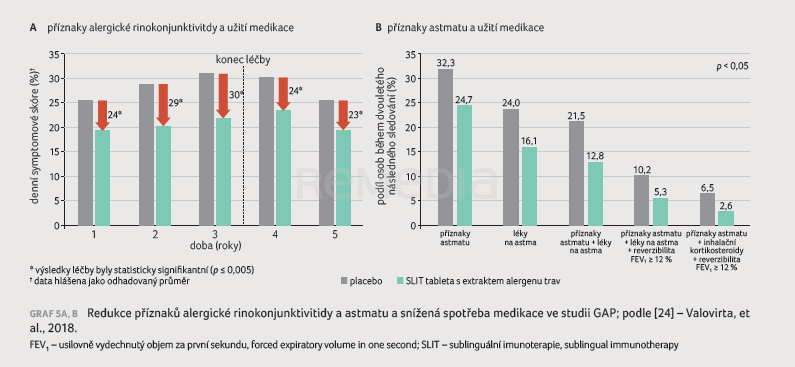
Studie GAP analyzovala příznaky astmatu a spotřebu medikace i v zimním období – to nám poskytuje cenný důkaz o tom, že děti mají mnohem méně respiračních infektů, daleko nižší bronchiální hyperreaktivitu a menší zahlenění, pokud jsou podrobeny AIT. Zahájení AIT představuje u sledované skupiny určitou imunitní zátěž, zejména v prvním roce měli pediatričtí pacienti vyšší spotřebu medikace. Nicméně je třeba toto období překlenout, o efektu svědčí nižší spotřeba medikace v následujících dvou letech [24].
Imunologické podklady AIT
V malých pilotních studiích České společnosti alergologie a klinické imunologie (ČSAKI) ČLS JEP jsme stále nedospěli k biomarkeru, který by byl mezníkem ukončení AIT, přetrvávajícího protektivního efektu atp. V těchto cytokinových studiích stále jediným významným ukazatelem zůstává hodnota blokujících specifických IgG4 protilátek. Ještě dva roky po ukončení AIT zůstávají hodnoty těchto protilátek signifikantně zvýšeny oproti placebové skupině. Podle určitých diskutovaných matematických modelů je udáváno, že během 5–7 let by měl nastat pokles na předchozí úroveň. Stejně tak je tématem k diskusi také to, zda bychom po určitém období neměli u některých pacientů aplikovat posilovací dávku AIT po dobu několika měsíců oproti opakování celého tříletého postupu. Publikace z roku 2017 dokládá, že imunitní změny, které sledujeme a v něž doufáme (IgG4 protilátky navozující imunotoleranční cytokin IL‑10 ad.), skutečně nastupují a konsolidují se po půlroce pravidelné imunoterapie [26]. Kontinuální AIT tedy navozuje imunomodulační efekt.
Zajímavé je, že ve studii GAP byly během dvouletého sledování příznaky astmatu a užívání léků na astma redukovány u dětí, které měly v době randomizace nižší věk [24]. Podle matematického modelu by měly mít spíše vyšší spotřebu antiastmatik (operujeme‑li s číslem NNT, number needed to treat), ale naopak bylo dokladováno, že čím dříve je AIT zahájena, tím je imunomodulace důraznější.
Ve studii GAP nebylo dosaženo primárního cíle, nese to však s sebou otázku, zda byl tento cíl jasně definovaný. Významný je u této studie průkaz redukce symptomů astmatu, příznaků a léčby, dokonce snížení podílu dětí s reverzibilitou symptomů [23]. GAP doložila, že při podávání AIT mají pediatričtí pacienti větší naději dospět k intermitentnímu či lehkému astmatu.
Podle publikace z roku 2012 bychom měli sledovat časný účinek AIT, abychom motivovali pacienty [27]. Důležitá je snaha, aby AIT při dobré compliance ve svém účinku dále progredovala a přetrvávala, její preventivní účinek je stále diskutován. V uvedené publikaci se uvádí, že imunologické změny by mohly vést potenciálně ke kurativnímu efektu. „Trochu se obávám, že potenciálně kurativního efektu není možné dosáhnout, protože míříme proti genetice, epigenetice, vnějším faktorům, ale v současné medicíně dosud nemáme k dispozici lepší imunomodulační postup. Nástup změn je u každého pacienta individuální, jako lékaři bychom se měli zaměřit na efekt konsolidační a přetrvávající,“ vysvětlila primářka Krčmová.
Závěr
Studie GAP byla ve své podstatě úspěšná a použitý statistický parametr – odds ratio – lze chápat také jako poměr šancí, který danému alergikovi poskytneme.
Závěrem přednášející rovněž zmínila probíhající jednání iniciovaná ČSAKI vzhledem k problémům s úhradou kontinuální tabletové AIT, kterou lze aktuálně považovat za klíčový terapeutický nástroj pro léčbu alergických onemocnění.
Literatura
[1] Gelardi M, Ciprandi G, Incorvaia C, et al. Allergic rhinitis phenotypes based on mono‑allergy or poly‑allergy. Inflamm Res 2015; 64: 373–375.
[2] Vlaykov A, Vicheva D, Stoyanov V. Main epidemiological characteristics of allergic rhinitis. Rom J Rhinol 2014; 4: 45–48.
[3] Cingi C, Gevaert P, Mösges R, et al. Multi‑morbidities of allergic rhinitis in adults: European Academy of Allergy and Clinical Immunology Task Force Report. Clin Transl Allergy 2017; 7: 17.
[4] Bousquet J, Schünemann HJ, Togias A, et al. Next‑generation ARIA care pathways for rhinitis and asthma: a model for multimorbid chronic diseases. Clin Transl Allergy 2019; 9: 44.
[5] Benninger MS, Benninger RM. The impact of allergic rhinitis on sexual activity, sleep, and fatigue. Allergy Asthma Proc 2009; 30: 358–365.
[6] Devillier P, Bousquet J, Salvator H, et al. In allergic rhinitis, work, classroom and activity impairments are weakly related to other outcome measures. Clin Exp Allergy 2016; 46: 1456–1464.
[7] Gryglas A. Allergic Rhinitis and Chronic Daily Headaches: Is There a Link? Curr Neurol Neurosci Rep 2016; 16: 33.
[8] Jaruvongvanich V, Mongkolpathumrat P, Chantaphakul H, Klaewsongkram J. Extranasal symptoms of allergic rhinitis are difficult to treat and affect quality of life. Allergol Int 2016; 65: 199–203.
[9] Kirmaz C, Yuksel H, Bayrak P, Yilmaz Ö. Symptoms of the olive pollen allergy: Do they really occur only in the pollination season? Ann Allergy Asthma Immunol 2005; 15: 140–145.
[10] Leynaert J, Neukirch F, Demoly P, Bousquet J. Epidemiologic evidence for asthma and rhinitis comorbidity. J Allergy Clin Immunol 2000; 106(5 Suppl): S201–205.
[11] Matheson EM, Player MS, Mainous AG, et al. The Association Between Hay Fever and Stroke in a Cohort of Middle Aged and Elderly Adults. J Am Board Fam Med 2008; 21: 179–183.
[12] Roger A, Campillo EA, Torres MC, et al. Reduced work/academic performance and quality of life in patients with allergic rhinitis and impact of allergen immunotherapy. Allergy Asthma Clin Imunol 2016; 12: 40.
[13] Tay TR, Radhakrishna N, Hore‑Lacy F, et al. Comorbidities in difficult asthma are independent risk factors for frequent exacerbations, poor control and diminished quality of life. Respirology 2016; 21: 1384–1390.
[14] Devillier P, Bousquet P‑J, Grassin‑Delyle S, et al. Comparison of outcome measures in allergic rhinitis in children, adolescents and adults. Pediatr Allergy Immunol 2016; 27: 375–381.
[15] Leger D, Bonnefoy B, Pigearias B, et al. Poor sleep is highly associated with house dust mite allergic rhinitis in adults and children. Allergy Asthma Clin Immunol 2017; 13: 36.
[16] Maloney J, Bernstein DI, Nelson H, et al. Efficacy and safety of grass sublingual immunotherapy tablet, MK‑7243: a large randomized controlled trial. Ann Allergy Asthma Immunol 2014; 112: 146–153.
[17] Blaiss M, Maloney J, Nolte H, et al. Efficacy and safety of timothy grass allergy immunotherapy tablets in North American children and adolescents. J Allergy Clin Immunol 2011; 127: 64–71.
[18] Bufe A, Eberle P, Franke‑Beckmann E, et al. Safety and efficacy in children of an SQ‑standardized grass allergen tablet for sublingual immunotherapy. J Allergy Clin Immunol 2009; 123: 167–173.
[19] Nolte H, Bernstein DI, Nelson HS, et al. Efficacy and Safety of Ragweed SLIT‑Tablet in Children with Allergic Rhinoconjunctivitis in a Randomized, Placebo‑Controlled Trial. J Allergy Clin Immunol Pract 2020; 6: 2322–2331.
[20] Paoletti G, Di Bona D, Chu DK, et al. Allergen immunotherapy: The growing role of observational and randomized trial “Real‑World Evidence”. Allergy 2021; 76: 2663–2672.
[21] Košturiak R. Vplyv sublingválnej alergénovej imunoterapie na spotrebu antibiotík u pacientov s alergickou nádchou. Klinická imunológia alergológia 2020; 30: 4–6.
[22] Fritzsching B, Contoli M, Porsbjerg C, et al. Long‑term real‑world effectiveness of allergy immunotherapy in patients with allergic rhinitis and asthma: Results from the REACT study, a retrospective cohort study. Lancet Regional Health – Europe 2022; 13: 100275.
[23] Valovirta E, Petersen TH, Piotrowska T, et al. Results from the 5‑year SQ grass sublingual immunotherapy tablet asthma prevention (GAP) trial in children with grass pollen allergy. J Allergy Clin Immunol 2017; 141: 529–538.e13.
[24] Valovirta E, Petersen TH, Piotrowska T, et al. Results from the 5‑year SQ grass sublingual immunotherapy tablet asthma prevention (GAP) trial in children with grass pollen allergy. J Allergy Clin Immunol 2018; 141: 529–538.e13.
[25] Niggemann B, Jacobsen L, Dreborg S, et al. Five‑year follow‑up on the PAT study: specific immunotherapy and long‑term prevention of asthma in children. Allergy 2006; 61: 855–859.
[26] Shamji MH, Durham SR. Mechanisms of allergen immunotherapy for inhaled allergens and predictive biomarkers. J Clin Allergy Immunol 2017; 140: 1485–1498.
[27] Jacobsen L, Wahn U, Bilo MB. Allergen‑specific immunotherapy provides immediate, long‑term and preventive clinical effects in children and adults: the effects of immunotherapy can be categorised by level of benefit – the centenary of allergen specific subcutaneous immunotherapy. Clin Transl Allergy 2012; 2: 8.