Anémie u nádorových onemocnění a jejich léčba
Anémie se objevuje u více než 50 % nemocných s nádorovým onemocněním a významně koreluje se zhoršenou kvalitou života nemocných i s kratší dobou jejich přežití. Patogeneze této anémie je velmi různorodá. Nejčastěji vzniká jako přímý účinek nádoru, jehož buňky produkují různé inhibiční cytokiny, nebo jako důsledek myelotoxického účinku chemoterapie či radioterapie. Na jejím vzniku se podílejí i další mechanismy. K léčbě se doporučují transfuze erytrocytů a přípravky stimulující erytropoezu. V přehledu jsou uvedeny výhody a rizika těchto léčebných modalit.
Úvod
Anémie provází nádorová onemocnění velmi často, podle různých statistických analýz až v 60 % [1]. Považuje se proto za „paraneoplastický příznak“. Významně zhoršuje kvalitu života onkologických nemocných a může zkracovat dobu jejich přežití. Kromě toho tkáňová hypoxie, která anémii provází, zhoršuje odpověď na protinádorovou léčbu, zejména na radioterapii. Korekce anémie by měla tyto negativní důsledky anémie eliminovat. Účinná terapie je však relativně obtížná vzhledem k velmi různorodé patogenezi této průvodní anémie.
Patogeneze
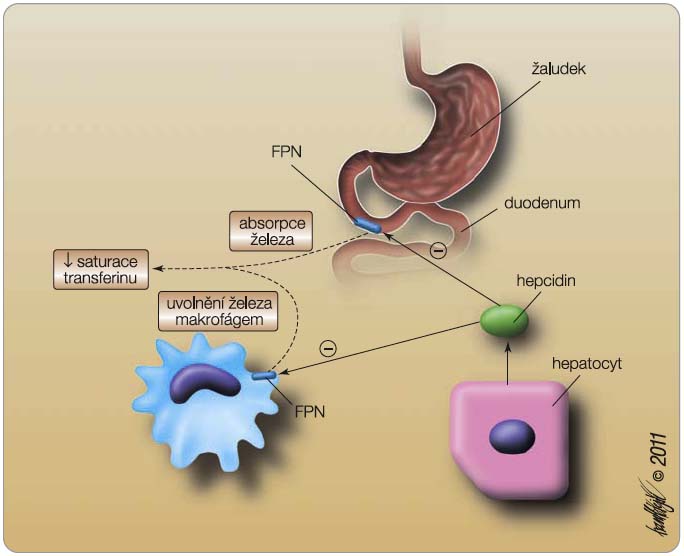 Anémie u nádorových onemocnění je komplexní povahy [2]. Může vznikat z různých příčin, které se často vzájemně kombinují. Na jejím vzniku se podílí především samotné nádorové onemocnění. Nádorové buňky a buňky imunitního systému produkují četné cytokiny s inhibičním účinkem na krvetvorbu, jako je TNF-a (tumor necrosis factor a), některé interleukiny (IL-1, IL-4, IL-6, interferon g). Tyto cytokiny přispívají ke vzniku anémie nejméně dvojím mechanismem [3]. Jednak potlačují produkci erytropoetinu a tvorbu erytroid-ních prekurzorů a tím snižují produkci ery-trocytů, jednak ovlivňují metabolismus železa. Stimulují tvorbu feritinu a hepcidinu [4]. Hepcidin se uplatňuje v regulaci příjmu a výdeje železa buňkou tím, že inhibuje funkci ferroportinu – bílkoviny zod-povědné za transport železa z buňky do extracelulárního prostoru. Výsledkem je pokles koncentrace železa v séru s jeho retencí intracelulárně v buňkách monocyto-makrofágového systému a sekundárně též inhibicí vstřebávání železa z trávicího traktu. Mírně se snižuje saturace transfe-rinu, kdežto hodnoty sérového feritinu jsou zpravidla normální (obr. 1). Tyto mechanismy jsou charakteristické pro anémii chronických onemocnění, která bývá u nádorových onemocnění nejčastějším typem anémie.
Anémie u nádorových onemocnění je komplexní povahy [2]. Může vznikat z různých příčin, které se často vzájemně kombinují. Na jejím vzniku se podílí především samotné nádorové onemocnění. Nádorové buňky a buňky imunitního systému produkují četné cytokiny s inhibičním účinkem na krvetvorbu, jako je TNF-a (tumor necrosis factor a), některé interleukiny (IL-1, IL-4, IL-6, interferon g). Tyto cytokiny přispívají ke vzniku anémie nejméně dvojím mechanismem [3]. Jednak potlačují produkci erytropoetinu a tvorbu erytroid-ních prekurzorů a tím snižují produkci ery-trocytů, jednak ovlivňují metabolismus železa. Stimulují tvorbu feritinu a hepcidinu [4]. Hepcidin se uplatňuje v regulaci příjmu a výdeje železa buňkou tím, že inhibuje funkci ferroportinu – bílkoviny zod-povědné za transport železa z buňky do extracelulárního prostoru. Výsledkem je pokles koncentrace železa v séru s jeho retencí intracelulárně v buňkách monocyto-makrofágového systému a sekundárně též inhibicí vstřebávání železa z trávicího traktu. Mírně se snižuje saturace transfe-rinu, kdežto hodnoty sérového feritinu jsou zpravidla normální (obr. 1). Tyto mechanismy jsou charakteristické pro anémii chronických onemocnění, která bývá u nádorových onemocnění nejčastějším typem anémie.
Krvetvorba může být utlumena také v důsledku infiltrace kostní dřeně nádo-rovými buňkami, které utlačí normální krvetvorbu. Je častá u leukemií, lymfomů a mnohočetného myelomu, ale také u některých solidních nádorů, jako je karcinom prsu, karcinom prostaty, karcinom plic nebo maligní melanom. Přítomnost buněk solidních nádorů často naruší mikrovaskulaturu v kostní dřeni, což se projeví vyplavováním nezralých erytroidních i myeloidních buněk (leukoerytroblastická reakce).
Anémie z hemolýzy způsobená imunologickými mechanismy a přítomností protilátek je častá u maligních lymfopro-liferací, někdy provází i karcinom ovaria. Neimunní hemolýza může vzniknout u diseminovaných mucinózních karcinomů (karci-nom žaludku, prsu či plic). Při invazi nádoru do velkých cév dochází k fragmentaci ery-trocytů a vzniká obraz mikroangiopatické hemolytické anémie s přítomností deformovaných krvinek a jejich fragmentů v nátěrech periferní krve. Podobný typ anémie mohou indukovat i některá cytostatika, např. mitomycin.
Chemoterapie a radioterapie působí útlum krvetvorby projevující se nejprve poklesem granulocytů a krevních desti-ček, ale myelotoxicita může postihnout i tvorbu červených krvinek [5]. Poněkud odlišně přispívají ke vzniku anémie platinové deriváty a chemoterapeutické kombinace obsahující tato cytostatika. Cisplatina a karboplatina působí dysfunkci renálních tubulů a tím omezí výdej erytropoetinu a produkci červených krvinek [5].
U nádorů trávicího či močového ústrojí, podobně jako u gynekologických nádorů, může anémii prohloubit akutní nebo chronická ztráta krve. Méně časté je intratumorózní krvácení popisované u sarkomů nebo u ovariálních karcinomů.
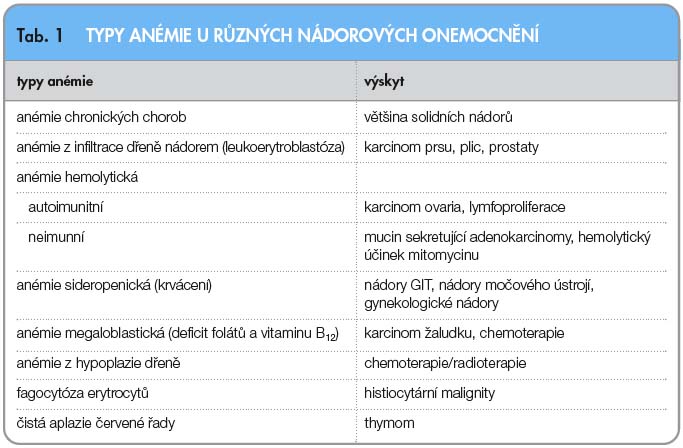 Ze vzácnějších příčin anémie lze uvést nedostatek vitaminu B12 u karcinomu žaludku vedoucí k megaloblastové anémii. Ta může být způsobena i nedostatkem folátů, k němuž vede účinek některých cytostatik. Fagocytóza erytrocytů s následnou anémií může provázet histiocytární malignity a čistá aplazie červené řady (PRCA) maligní thymom. Typy anémie projevující se u různých nádorových onemocnění jsou v přehledu uvedeny v tab. 1.
Ze vzácnějších příčin anémie lze uvést nedostatek vitaminu B12 u karcinomu žaludku vedoucí k megaloblastové anémii. Ta může být způsobena i nedostatkem folátů, k němuž vede účinek některých cytostatik. Fagocytóza erytrocytů s následnou anémií může provázet histiocytární malignity a čistá aplazie červené řady (PRCA) maligní thymom. Typy anémie projevující se u různých nádorových onemocnění jsou v přehledu uvedeny v tab. 1.
Diagnostika a klinický obraz
Laboratorní diagnostika anémie je snadná, neboť se opírá o zjištění sníženého počtu erytrocytů, pokles koncentrace hemoglobinu a hematokritu. Nejprve je však nutno vyloučit anémii, která nemá souvislost s přítomností nádoru. Význam dalších vyšetření ke stanovení typu anémie nádorového původu vyžaduje opa-trnou interpretaci. Pokles koncentrace železa (a koncentrace feritinu) je výrazný u posthemoragických anémií, ale bývá zjišťován i u anémie chronických chorob, kde však je koncentrace feritinu v séru normální nebo zvýšená. Současně klesá syntéza transferinu, a jeho saturace není proto snížena. Velmi citlivou metodou je vy-šetření solubilních transferinových receptorů (u posthemoragických anémií zvýšené, u anémie chronických chorob normální). Vysokou výpovědní hodnotu má feritinový index (receptor/feritin v séru), který při ztrátě krve výrazně stoupá. Morfologicky bývá anémie normocytární, při deficitu železa mikrocytármí, hypochromní. U hemolytických anémií nacházíme sférocyty, u mikro-angiopatické anémie fragmenty erytrocytů, akantocyty a schistocyty. Klinické příznaky anémie u nádorových onemocnění se v zásadě neliší od symptomů anémií bez souvislosti s nádorem. Jsou však modifikovány příznaky základního nádorového onemocnění a podílejí se tak spolu s nimi na zhoršení kvality života nemocného. Dominantní bývá únava, dušnost a palpitace.
Terapie
Nejjednodušší je substituční léčba podáním transfuze erytrocytů. Po podání jedné transfuzní jednotky lze předpokládat vzestup koncentrace hemoglobinu o 10 g/l. Pro léčbu transfuzí se však rozhodujeme více podle klinických příznaků než podle hodnoty hemoglobinu [6]. Mnozí nemocní jsou totiž na anémii, která se často vyvíjí postupně, adaptováni. Mimoto, podání transfuze nemusí být jednoznačně prospěšné. Upozorňuje se na riziko komplikací, které může aplikace transfuzí způsobit [7]. Kromě možného přenosu infekcí (HIV, hepatitida) nejsou vyloučeny různé potransfuzní reakce včetně závažné reakce TRALI (transfusion related acute lung injury). V úvahu je třeba brát také ekonomické aspekty [8]. V literatuře existuje řada studií, které upozorňují na kratší dobu přežití nemocných s kolorektálním karcinomem nebo s karcinomem ovaria, kteří zejména v perioperačním období dostávali trans-fuze [9]. Z těchto důvodů se doporučuje vymezit podávání transfuze jen pro případ akutní potřeby nebo při kritickém poklesu hladin hemoglobinu pod 70 g/l.
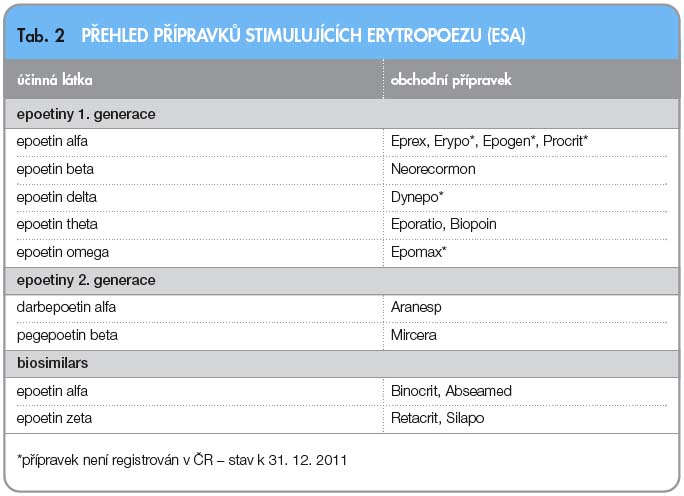 Látky stimulující erytropoezu jsou další léčebnou alternativou. Nízká koncentrace erytropoetinu u nemocných se solidními nádory přímo nabízela řešení v aplikaci těchto látek. Tyto přípravky se souhrnně označují jako ESA (erythropoiesis stimulating agents) a patří mezi ně rekombinantní erytropoetiny a jejich biosimilars. Jsou v přehledu uvedeny v tab. 2. Počáteční studie s rekombinantními erytropoetiny přinášely slibné výsledky jak po léčbě epoe-tinem alfa, tak po terapii epoetinem beta nebo darbepoetinem [10, 11]. Za výhodu se považovaly též celkově nižší léčebné náklady dané omezenou potřebou transfuzí a eliminace možných nežádoucích účinků transfuzní terapie [12, 13]. V krátkém časovém odstupu se však začaly objevovat méně optimistické zprávy, poukazující na opačný účinek této léčby, a to urychlení nádorového růstu, které se projeví kratší dobou do progrese i zkrácením celkové doby přežití [14]. Vysvětlení se hledalo ve skutečnosti, že na buňkách mnohých solidních nádorů byly nalezeny receptory pro erytropoetin, jejichž stimulace může urychlit nádorový růst [15]. Navíc je i tato léčba provázena rizikem nežádoucích účinků, zejména trombotickými komplikacemi. Proto je dnes stanovisko k aplikaci erytropoetinů k léčbě anémie u solidních nádorů spíše zdrženlivé [16, 17]. Ukazuje se, že prospěšná je tato léčba u anémií způsobených chemoterapií obsahující zejména platinové deriváty a u nemocných s mnohočetným myelomem [18, 19].
Látky stimulující erytropoezu jsou další léčebnou alternativou. Nízká koncentrace erytropoetinu u nemocných se solidními nádory přímo nabízela řešení v aplikaci těchto látek. Tyto přípravky se souhrnně označují jako ESA (erythropoiesis stimulating agents) a patří mezi ně rekombinantní erytropoetiny a jejich biosimilars. Jsou v přehledu uvedeny v tab. 2. Počáteční studie s rekombinantními erytropoetiny přinášely slibné výsledky jak po léčbě epoe-tinem alfa, tak po terapii epoetinem beta nebo darbepoetinem [10, 11]. Za výhodu se považovaly též celkově nižší léčebné náklady dané omezenou potřebou transfuzí a eliminace možných nežádoucích účinků transfuzní terapie [12, 13]. V krátkém časovém odstupu se však začaly objevovat méně optimistické zprávy, poukazující na opačný účinek této léčby, a to urychlení nádorového růstu, které se projeví kratší dobou do progrese i zkrácením celkové doby přežití [14]. Vysvětlení se hledalo ve skutečnosti, že na buňkách mnohých solidních nádorů byly nalezeny receptory pro erytropoetin, jejichž stimulace může urychlit nádorový růst [15]. Navíc je i tato léčba provázena rizikem nežádoucích účinků, zejména trombotickými komplikacemi. Proto je dnes stanovisko k aplikaci erytropoetinů k léčbě anémie u solidních nádorů spíše zdrženlivé [16, 17]. Ukazuje se, že prospěšná je tato léčba u anémií způsobených chemoterapií obsahující zejména platinové deriváty a u nemocných s mnohočetným myelomem [18, 19].
Podávání železa je nepochybně užitečné u anémií způsobených krevními ztrátami. Upřednostňují se přípravky pro nitrožilní podání, které jsou účinnější a mají méně nežádoucích gastrointestinálních účinků [20].
Jiná antianemická léčba má spíše doplňkový význam. Vitamin B12 podáváme při jeho deficitu, prednison má své místo v terapii autoimunitních anémií a čisté aplazie červené řady.
Závěr
Anémie provázející zhoubné nádory zhoršuje kvalitu života nemocných. Její léčba se však nemůže řídit pouze podle laboratorního nálezu, ale musí brát v úvahu klinický obraz a možná rizika, jež by mohla energická antianemická terapie pro nemocného představovat. Ve svém důsledku by pak tato léčba přes dočasný přínos mohla zhoršit celkový stav nemocného.Seznam použité literatury
- [1] Ludwig H, Belle SV, Baswrrett-Lee P, et al. The European Cancer Anaemia Survey (ECAS): A large, multinational, prospective survey defining the prevalence, incidence, and treatment of anaemia in cancer patients. Eur J Cancer 2004; 40: 2293–2300.
- [2] Mercadante S, Gebbia V, Marazzo A, et al. Anaemia in cancer: pathophysiology and treatment. Cancer Treat Rev 2000; 4: 303–311.
- [3] Grotto HZW. Anaemia of cancer: an overview of mechanisms involved in its pathogenesis. Med Oncol 2006; 25: 12–21.
- [4] Mehta AN, Hoffbrand AV. Haematological aspects of systemic disease. p. 940-945 in: Hoffbrand AV, et al: Postgraduate haematology, 6th ed. Blackwell Publish. Ltd. Chichester, 2011.
- [5] Harrison LB, Shasha D, Ramdeen B. Radiotherapy-associated anemia: The scope of the problem. The Oncologist 2000; 5 (Suppl. 2): 1–7.
- [6] Gordon MS. Managing anemia in the cancer patients: Old problems, future solutions. The Oncologist 2002; 7: 331–341.
- [7] Schrijvers D. Management of anemia in cancer patients: transfusions. Oncologist 2011; 16 (Suppl. 3): 12–18.
- [8] Littlewood T, Zambrowski JP, Cornes P. Treating anemia: deconstructing healthcare costs. Curr Med Res 2006; 22 (Suppl. 4): 23–33.
- [9] Amato A, Pescatori M. Perioperative blood transfusions for the reccurrence of colorectal cancer. Cochrane Database Syst Rev 2006; 25: 31–38.
- [10] Soubeyran P, Castro J. Optimising the response to epoetin beta for the treatment of cancer-related anemia. Curr Med Res 2006; 22 (Suppl. 4): 35–44.
- [11] Smith RE, Aapro MS, Ludwig H, et al. Darbepoe-tin alpha for treatment of anemia in patients with active cancer not receiving chemotherapy: Results of phase III multicenter, randomised, double-blind, placebo-controlled study. J Clin Oncol 2008; 26: 1040–1050.
- [12] Weigang-Köhler K, Vetter A, Thyroff-Freisinger U. HX575, recombinant epoetin alfa, for the treatment of chemotherapy-associated symptomatic anemia in patients with solid tumours. Onkologie 2009; 32: 168–174.
- [13] Tjulandin SA, Bias P, Elsasser R, et al. Epoetin theta with a new dosing schedule in anaemic cancer patients receiving nonplatinum-based chemotherapy: A randomised controlled trial. Arch Drug Int 2011; 4: 33–41.
- [14] Hedley BD, Allan AL, Xenocostas A. The role of erythropoietin and erythropoiesis-stimulating agents in tumor progression. Clin Cancer Res 2011; 17: 6373–6380.
- [15] Szenajch J, Wcislo G, Jeong JY, et al. The role of erythropoietin and its receptor in growth, survival and therapeutic response of human tumor cells. From clinic to bench – a critical review. Biochim Biophys Acta 2010; 1806: 82–95.
- [16] Macdougall IC. Iron supplementation in nephrology and oncology: what do we have in common? Oncologist 2011; 16 (Suppl. 3): 25–34.
- [17] Fínek J. Korekce anémie u nemocných se solidními nádory. Klin Onkologie 2004; 17: 142–143.
- [18] Ludwig H, Pohl G, Osterborg A. Anemia in multi-ple myeloma. Clin Adv Hematom Oncol 2004; 2: 233–241.
- [19] Baz R, Walker E, Choueiri TK, et al. Recombinant human erythropoietin is associated with increased overall survival in patients with multiple myeloma. Acta Haematol 2007; 117: 162–167.
- [20] Szucs TD, Blank PR, Schwenkglenks M, et al. Potential health economic impact of intravenous iron supplementation to erythropoiesis-stimulating agent treatment in patients with cancer-or chemotherapy-induced anemia. Oncology 2011; 81: 45–49.