Angioedém indukovaný léky
Souhrn
Králíčková P. Angioedém indukovaný léky. Remedia 2023; 33: 84–86.
Angioedém indukovaný léky představuje potenciálně život ohrožující nežádoucí polékovou reakci. Významný procentuální podíl patogeneticky tvoří angioedém bradykininového původu. Jeho nejčastější příčinou bývají inhibitory angiotenzin konvertujícího enzymu podané predisponovaným osobám. V diagnostice hraje klíčovou úlohu anamnéza. Laboratorní vyšetření nebývají přínosná. V akutní fázi je základním léčebným postupem zajištění volných dýchacích cest, neboť podání kortikosteroidů a antihistaminik není efektivní. Z dlouhodobého hlediska je nezbytná změna medikace. Mezi další riziková léčiva patří sartany, sakubitril valsartan, aliskiren, gliptiny, inhibitory mTOR či tkáňový aktivátor plazminogenu.
Klíčová slova: angioedém – bradykinin – ikatibant – inhibitory ACE.
Summary
Kralickova P. Drug induced angioedema. Remedia 2023; 33: 84–86.
Drug‑induced angioedema is a potential life‑threatening adverse event. Significant proportion is represented by angioedema of bradykinine origin. It may occur in predisposed people following the treatment with ACE inhibitors. Personal history plays a key role in the evaluation of this condition. Laboratory tests are usually not helpful. Airway patency maintenance is a cornerstone of acute phase therapy since corticosteroids and antihistamines are completely ineffective. Medication change is necessary in the long‑term management. Other risky medications include angiotensin‑receptor blockers, sacubitril, valsartan, aliskiren, gliptins, mTOR inhibitors, or tissue‑type plasminogen activators.
Key words: angioedema – bradykinin – icatibant – ACE inhibitors.
Angioedém (AE) je charakterizován jako otok podkoží a/nebo submukózy způsobený přechodným zvýšením vaskulární permeability, která vede k přestupu intravaskulární tekutiny do intersticia [1]. Jednou z možných příčin může být nežádoucí reakce na léky. Z hlediska etiopatogeneze rozlišujeme dva základní typy: histaminergní a non‑histaminergní (převážně bradykininový). Základní rozdíly uvádí tabulka 1. Oba typy mohou být potenciálně život ohrožující. Způsob léčby se však v obou skupinách zcela zásadně odlišuje.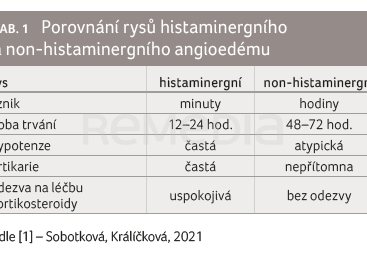
Studie italských autorů sledovala pacienty ošetřené na pohotovosti. V průběhu šestiměsíčního období zde bylo ošetřeno celkem 120 000 pacientů, z toho 447 (0,37 %) z důvodu AE. Celkem 62 případů bylo dáno do příčinné souvislosti s užívanými léky. Nejčastější příčinu tvořily reakce vzniklé po podání nesteroidních antirevmatik (22/62), antibiotik (15/62) a antihypertenziv (10/62). Z dalších léků byly četněji zastoupeny blokátory protonové pumpy, paracetamol, antiastmatika a antiepileptika [2].
V další části textu se zaměříme na skupinu polékových otoků bradykininového původu. Dominující úlohu zde hrají inhibitory angiotenzin konvertujícího enzymu (ACEi). Výskyt AE způsobeného ACEi je v literatuře udáván u 0,1–0,7 % léčených [3]. Z hlediska zvyšujícího se počtu léčených nemocných na světě tak nabývá na významu [4]. V patogenezi se uplatňuje řada faktorů: geneticky podmíněná aktivita enzymů degradujících angiotenzin (obr. 1), kombinace s další medikací (nesteroidní antirevmatika, estrogeny), ženské pohlaví, afroamerický původ, věk nad 65 let. Vznik AE není závislý na dávce [3,5].![OBR. 1 Schéma degradace molekuly bradykininu a vliv užívané medikace; podle [1] – Sobotková, Králíčková, 2021. OBR. 1 Schéma degradace molekuly bradykininu a vliv užívané medikace; podle [1] – Sobotková, Králíčková, 2021.](https://www.remedia.cz/1-23-84b-photo-pg-947-367-313-.png)
Angioedém vzniká u dvou třetin nemocných v prvních třech měsících užívání. Nelze však vyloučit i vznik řadu měsíců či let od zahájení léčby. Typické jsou i několikaměsíční intervaly mezi jednotlivými atakami, tyto rozestupy se postupem času zkracují. U části nemocných ataky přetrvávají ještě nějakou dobu po ukončení podávání [6]. Typický je otok jazyka a rtů. Mohou však být postiženy i celý obličej či končetiny. Jsou popisovány rovněž otoky viscerální, které se projevují kolikovitými bolestmi břicha, jsou doprovázeny průjmem či zvracením a často imitují náhlou příhodu břišní. Na rozdíl od ní jsou však známky zánětu nízké. Ultrazvukové vyšetření prokazuje volnou tekutinu v břišní dutině a/nebo významně ztluštělé střevní kličky [7]. Při postižení měkkých tkání horních cest dýchacích včetně subglotické oblasti hrozí asfyxie. AE indukovaný ACEi není provázen svěděním či urtikarií. Obecně je klinicky významná obstrukce popisována v 10 % případů postižených.
Základem správně stanovené diagnózy je podrobná anamnéza. K dispozici není dostupný specifický laboratorní test. Spíše v rámci diferenciální diagnostiky je v prvním kontaktu doporučováno laboratorní zjištění hodnoty tryptázy (odlišení od anafylaktické reakce) a C4 složky komplementu (screeningový test pro hereditární ae). V akutní fázi je základním úkolem lékaře zajištění průchodnosti dýchacích cest. Z hlediska patogeneze není podání antihistaminik a kortikosteroidů zcela účelné [8,9]. Z logistických důvodů je vhodné upozornit, že současně platící úhradová vyhláška neumožňuje podání léků běžně užívaných v indikaci hereditárního AE, byť jejich etiopatogeneze má obdobné charakteristiky. Vždy je nutno žádat revizního lékaře o schválení výjimky. V literatuře je nejčastěji uváděno využití ikatibantu (blokátoru bradykininových receptorů). Provedené studie však dospívají k nejednotným závěrům. V německé randomizované studii se zařazením 27 pacientů bylo popsáno významné zkrácení doby trvání otoku na průměrně 8 hodin (rozsah 8–16 h) ve skupině s ikatibantem versus 27 hodin (20–48 h) při léčbě prednisolonem v kombinaci s antihistaminikem [10]. Naopak multicentrická randomizovaná, placebem kontrolovaná studie amerických autorů z roku 2017, které se účastnilo 121 nemocných užívajících ACEi a přijatých nejdéle do osmi hodin od začátku rozvoje symptomů, nepozorovala žádný rozdíl v počátku ústupu příznaků (ikatibant 2 h vs. placebo 1,6 h), a jeho podání proto obecně nedoporučila [11].
V dlouhodobém managementu se uplatňuje ukončení léčby přípravkem a kontrola další potenciálně rizikové medikace (tab. 2). Při převedení pacienta z ACEi na sartany přetrvává riziko kolem 9 % [12]. Zde je vhodné zvážit poměr přínosu a rizika. Kontraindikované je i podání inhibitoru neprilysinu (sakubitrilu) [13]. ACEi tak nejsou jedinou skupinou zapříčiňující vznik AE bradykininového původu [13–17]. Německá studie z roku 2020 se snažila definovat specifika dalších léčiv, jejichž případnou kombinací riziko AE dále stoupá. Otoky způsobené sartany či aliskirenem bývají častěji spojeny s urtikarií a současně jsou významně méně hlášeny jako „život ohrožující“. Jejich přesná etiopatogeneze není uspokojivě objasněna. Postižení častěji v předchorobí udávají alergické obtíže ve formě alergické rýmy, astmatu či kopřivky. Otok po podání sartanů typicky postihuje oční víčka [13].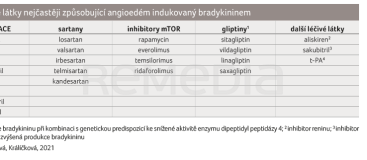
K dokreslení problematiky uvádíme několik krátkých kazuistik.
Kazuistika 1
71letý muž dlouhodobě sledovaný a léčený pro ischemickou chorobu srdeční a arteriální hypertenzi byl doporučen k vyšetření pro opakující se otoky jazyka. Obtíže trvaly posledních pět let s postupně narůstající frekvencí. Otok byl vždy lokalizován do oblasti jazyka, nikdy nepostihl jinou část těla. Urtikarie nebyla přítomna. Nemocný byl typicky buzen v noci. Obtíže odeznívaly v průběhu následujících 12 hodin. Dosud nikdy nevedly k nutnosti ošetření na pohotovosti. Předepsaná antihistaminika a kortikoidy nemocný hodnotil jako zcela bez efektu. Ve farmakologické anamnéze byl doložen losartan, délku užívání nebylo možné od nemocného zjistit, pravděpodobně se jednalo o několik let. Po vysazení medikace došlo k plné úpravě obtíží.
Závěr: Typická anamnéza nemocného s AE indukovaným sartany.
Kazuistika 2
48letý muž byl sledován alergologem pro recidivující otoky obličeje, genitálu, končetin, vždy bez kopřivky. Otoky trvaly řádově několik hodin. Nemocný vždy zaznamenal velmi dobrou odpověď na perorálně podané kortikoidy a antihistaminika. Následně byla nemocnému diagnostikována srdeční vada a do medikace přidán ramipril. Od té doby byly otoky významně četnější a efekt antihistaminik nebyl již patrný. K akutnímu otoku s nutností zajištění dýchacích cest došlo v perioperačním období srdeční vady. V této fázi se odebraná hodnota sérové tryptázy, C4 složky komplementu i C1 inhibitoru včetně funkčního testu nacházely v normě. Ukončení terapie ACEi a doplnění antihistaminika do pravidelné denní medikace vedly k plné úpravě stavu.
Závěr: Pravděpodobná kombinace histaminového a bradykininového AE v různých obdobích života u jednoho nemocného.
Kazuistika 3
63letý muž byl doporučen k vyšetření pro otoky různých částí těla opakující se po mnoho let. Vznik otoků dával často do souvislosti s pracovní zátěží. Nikdy nebyly provázeny výsevem kopřivky. Bez ohledu na to, zda byl, či nebyl léčen kortikoidy či antihistaminiky, otoky obvykle odeznívaly do 72 hodin. Otok lokalizovaný na končetinách byl natolik rozsáhlý, že znemožňoval např. obutí boty či manuální práci. Obtíže pozoroval od mládí s různou frekvencí, obvykle několikrát do roka. Ve věku 60 let mu byla diagnostikována arteriální hypertenze a nasazen kandesartan‑cilexetil. Od té doby frekvence otoků významně vzrostla na několikrát do měsíce. Při podrobnější anamnéze lékař zjistil, že s otoky stejného charakteru mají zkušenost i jeho dva synové, i když ve významně nižší frekvenci. Laboratorní vyšetření prokázalo sníženou sérovou koncentraci C4 složky komplementu – 0,07 g/l (fyziologicky 0,15–0,4). Hladina C1 inhibitoru byla v normě, avšak funkční test prokázal významně sníženou funkci – na 37,4 % (průměrné normální rozmezí hodnot funkčního C1 inhibitoru – 68–120 %). Následně provedené genetické vyšetření prokázalo u nemocného i obou jeho synů mutaci v genu pro C1 inhibitor v heterozygotním stavu typu missense p.Arg466Cys.
Závěr: Hereditární AE II. typu, který byl demaskován nasazením sartanů při léčbě arteriální hypertenze.
Kazuistika 4
80letá žena byla přijata na oddělení ORL pro významný laryngeální otok, který byl na hranici indikace pro intubaci a nereagoval v akutní fázi na podání kortikosteroidů. Nemocná byla v posledních 15 letech léčena pro arteriální hypertenzi ramiprilem a před 20 lety prodělala splenektomii pro lymfom. V akutní fázi otoku byla odebrána hladina sérové tryptázy a C4 složky komplementu. Zatímco fyziologická hodnota tryptázy vylučovala anafylaxi, hodnota C4 složky komplementu byla velmi nízká – 0,02 g/l (fyziologicky 0,15–0,40). Pro podezření na AE bradykininového původu byla pacientka odeslána na vyšetření alergologem, který zjistil nízkou hodnotu C1 složky komplementu 0,095 g/l (fyziologicky 0,150–0,350) doprovázenou snížením C1q složky 0,056 g/l (fyziologicky 0,100–0,250). Rodinná anamnéza však nepotvrdila rodinný výskyt obtíží. Pro anamnézu lymfomu byla doplněna zobrazovací vyšetření, která vedla k odhalení lymfomu plášťové zóny v oblasti příušní žlázy. U nemocné byla následně zahájena chemoimunoterapie, preventivně doporučeno podávání kyseliny tranexamové a léčba ACEi byla ukončena. Od té doby nedošlo ke vzniku dalšího otoku, a to i když se s odstupem několika let lymfom dále transformoval do difuzního velkobuněčného typu. Aktivitu onemocnění i nadále kopírovalo setrvalé spotřebovávání složek komplementu, včetně C1 inhibitoru.
Závěr: Na pozadí léčby ACEi vedl relaps lymfomu k manifestaci získaného AE bradykininového typu.
Závěr
Léky indukované AE mohou vznikat samostatně nebo mohou napomáhat zvýšené aktivitě hereditárního či získaného AE. Klíčem ke správné diagnóze je podrobná anamnéza se zaměřením se na komplikující onemocnění i další farmakoterapii. Důležitý je fakt, že u AE bradykininového původu jsou antihistaminika a kortikosteroidy zcela neefektivní. V akutní fázi je nezbytné zajištění průchodnosti dýchacích cest s následnou úpravou užívané medikace.
Literatura
[1] Sobotková M, Králíčková P. Hereditární angioedém a diferenciální diagnostika angioedému. Praha: Current Media, 2021.
[2] Bertazzoni G, Spina MT, Scarpellini MG, et al. Drug‑induced angioedema: experience of Italian emergency departments. Intern Emerg Med 2014; 9: 455–462.
[3] Kostis WJ, Shetty M, Chowdhury YS, Kostis JB. ACE Inhibitor‑Induced Angioedema: a Review. Curr Hypertens Rep 2018; 20: 55.
[4] Ma J, Lee KV, Stafford RS. Changes in antihypertensive prescribing during US outpatient visits for uncomplicated hypertension between 1993 and 2004. Hypertension 2006; 48: 846–852.
[5] Liau Y, Chua I, Kennedy MA, Maggo S. Pharmacogenetics of angiotensin‑converting enzyme inhibitor‑induced angioedema. Clin Exp Allergy 2019; 49: 142–154.
[6] Davin L, Marechal P, Lancellotti P, et al. Angioedema: a rare and sometimes delayed side effect of angiotensin‑converting enzyme inhibitors. Acta Cardiol 2019; 74: 277–281.
[7] Scheirey CD, Scholz FJ, Shortsleeve MJ, Katz DS. Angiotensin‑converting enzyme inhibitor‑induced small‑bowel angioedema: clinical and imaging findings in 20 patients. AJR Am J Roentgenol 2011; 197: 393–398.
[8] Grumach AS, Veronez CL, Csuka D, Farkas H. Angioedema Without Wheals: Challenges in Laboratorial Diagnosis. Front Immunol 2021; 12: 785736.
[9] Macy E. Practical Management of New‑Onset Urticaria and Angioedema Presenting in Primary Care, Urgent Care, and the Emergency Department. Perm J 2021; 25: 21.058.
[10] Baş M, Greve J, Stelter K, et al. A randomized trial of icatibant in ACE‑inhibitor‑induced angioedema. N Engl J Med 2015; 372: 418–425.
[11] Sinert R, Levy P, Bernstein JA, et al. Randomized Trial of Icatibant for Angiotensin‑Converting Enzyme Inhibitor‑Induced Upper Airway Angioedema. J Allergy Clin Immunol Pract 2017; 5: 1402–1409.
[12] Haymore BR, Yoon J, Mikita CP, et al. Risk of angioedema with angiotensin receptor blockers in patients with prior angioedema associated with angiotensin‑converting enzyme inhibitors: a meta‑analysis. Ann Allergy Asthma Immunol 2008; 101: 495–499.
[13] Bas M, Greve J, Strassen U, et al. Angioedema induced by cardiovascular drugs: new players join old friends. Allergy 2015; 70: 1196–1200.
[14] Dubrall D, Schmid M, Stingl JC, Sachs B. Angioedemas associated with renin‑angiotensin system blocking drugs: Comparative analysis of spontaneous adverse drug reaction reports. PLoS One 2020; 15: e0230632.
[15] Byrd JB, Touzin K, Sile S, et al. Dipeptidyl peptidase IV in angiotensin‑converting enzyme inhibitor associated angioedema. Hypertension 2008; 51: 141–147.
[16] Hurford R, Rezvani S, Kreimei M, et al. Incidence, predictors and clinical characteristics of orolingual angio‑oedema complicating thrombolysis with tissue plasminogen activator for ischaemic stroke. J Neurol Neurosurg Psychiatry 2015; 86: 520–523.
[17] Duerr M, Glander P, Diekmann F, et al. Increased incidence of angioedema with ACE inhibitors in combination with mTOR inhibitors in kidney transplant recipients. Clin J Am Soc Nephrol 2010; 5: 703–708.