Antiemetická profylaxe chemoterapií indukované nevolnosti a zvracení
Moderní antiemetická profylaxe výrazně snížila výskyt nevolnosti a zvracení po protinádorové chemoterapii, přesto však ani dnes zdaleka není úspěšná u každého pacienta. Inhibitory 5-HT3 receptorů podávané samostatně zabraňují těmto potížím jen asi u poloviny nemocných s emetogenní chemoterapií, jejich efekt je však možno zvýšit kombinací s dalšími antiemeticky účinnými léky. Zvláště opožděné zvracení a nevolnost představují přetrvávající problém, který může snadno uniknout pozornosti lékaře.
O to více je třeba trvat na respektování všeobecně přijatých standardních doporučení pro antiemetickou profylaxi, která jsou založena na výsledcích mnoha velkých klinických studií vysoké kvality. Optimálním přístupem je předcházení vzniku jakékoliv nevolnosti či zvracení od počátku podávání chemoterapie, protože léčba již vzniklých potíží je daleko méně úspěšná. Článek shrnuje doporučené standardní postupy antiemetické profylaxe podle několika mezinárodních odborných společností, aniž by odkazoval na jednotlivé vědecké doklady.
Výskyt nevolnosti a zvracení po chemoterapii
Přes významné pokroky v prevenci a léčbě patří nevolnost a zvracení i dnes mezi časté a závažné nežádoucí účinky protinádorové chemoterapie. Podávání moderních antiemetik ze skupiny inhibitorů 5-HT3 receptorů předchází vzniku těchto potíží u mnoha onkologických pacientů, ale současně může někdy vytvářet dojem, že ve většině případů již nemocným tyto potíže téměř nehrozí.
Inhibitory 5-HT3 receptorů neboli setrony však mají vysokou účinnost pouze při předcházení akutnímu zvracení, které nastává prvních 24 hodin po zahájení chemoterapie. Méně je známo, že jejich efekt proti opožděnému zvracení, k němuž často dochází v dalších dnech, již není významně vyšší než účinek metoklopramidu nebo dexamethasonu. Dokonce i v profylaxi akutního zvracení mají samotné setrony úplnou účinnost jen u poloviny nemocných, což dokumentuje nezbytnost kombinovat setrony s dalšími antiemetiky.
Nevolnost a zvracení indukované chemoterapií (chemotherapy-induced nausea and vomiting, CINV) jsou i dnes mnoha nemocnými vnímány jako stresující a obávané nežádoucí účinky protinádorové léčby. Klinické studie dokládají, že CINV významně zhoršují kvalitu života nemocných, a to nejen zvracení; i samotná nevolnost je velmi zatěžující. Opakované zvracení může mít za následek metabolický rozvrat a může vést až k nutnosti hospitalizace. Už i mírná několikadenní nauzea zřetelně snižuje příjem stravy, což může být závažné zejména pro pacienty, kteří ztrácejí na hmotnosti.
V běžné praxi snadno dochází z pohledu lékařů k podhodnocení skutečného výskytu CINV, především v opožděné fázi po podání chemoterapie, kdy tyto potíže již nemusí být přičítány cytotoxické léčbě, zvláště když jimi ambulantní pacient trpí doma. Ukazuje to i klinická studie, v níž podle šestidenních záznamů pacientů byl při dnešní standardní antiemetické profylaxi reálný výskyt opožděného zvracení po vysoce emetogenní chemoterapii 50 % a po středně emetogenní chemoterapii 28 %. Výskyt opožděné nevolnosti byl v těchto případech ještě vyšší – činil 60 % po vysoce a 52 % po středně emetogenní léčbě. Odhad lékařů však byl zřetelně nižší [1]. Je zřejmé, že reálný výskyt CINV nemůže být posuzován podle dojmu, který vzniká první den chemoterapie.
Příčiny přetrvávajícího výskytu CINV
Antiemetika mají nejvyšší účinek, pokud jsou podána preventivně. Důrazná anti-emetická profylaxe od prvního cyklu chemoterapie podle její emetogenity je doporučena s cílem zabránit vzniku jakéhokoliv zvracení, protože již vzniklé potíže jsou obvykle daleko hůře ovlivnitelné.
Antiemetická profylaxe je dnes indikována podle mezinárodních nebo národních standardů odborných společností (MASCC – Multinational Association for Supportive Care in Cancer, ESMO – European Society of Medical Oncology, NCCN – National Comprehensive Cancer Network, ASCO – American Society of Clinical Oncology) při každém cyklu emetogenní chemoterapie [2–4]. Vědecký průkaz pro toto doporučení je založen na řadě velkých kontrolovaných klinických studií a je silnější než u mnoha jiných způsobů podpůrné léčby.
Protože na vzniku CINV se podílejí různé nervové dráhy a receptory periferního i centrálního nervového systému (5-HT3 receptory, dopaminové D2 receptory, neurokininové NK1 receptory a další), není možné najít jediný lék, který by byl plně účinný. Standardním doporučením u každé středně nebo vysoce emetogenní chemoterapie je proto použití kombinace anti-emetik.
Přestože jsou mezinárodní standardy dnes již běžně dostupné, zůstává mezi těmito doporučeními a klinickou praxí stále významný rozdíl. Častým příkladem je nepřiměřené spoléhání na účinek samotného inhibitoru 5-HT3 receptorů. Jedna klinická studie výstižně ukazuje, že nemocní, kteří nedostali antiemetickou profylaxi podle uvedených doporučení, měli vyšší výskyt opožděné nevolnosti a zvracení než nemocní, kteří byli léčeni podle standardů (71,6 % oproti 49,5 %) [5].
Avšak i když je postupováno podle standardů, je dobré si uvědomit, že v běžné praxi je situace často horší, než je tomu v klinických studiích. Převážná většina dnešních vědeckých důkazů se totiž týká nemocných, kteří dostávali své první cykly chemoterapie, často s jednodenní aplikací cytotoxických léků. V běžné praxi je však většina nemocných léčena mnoha cykly kombinované léčby, přičemž je známo, že účinnost antiemetické profylaxe s pokračujícími cykly klesá [6, 7]. Nedostatečné doklady se týkají také vícedenních režimů cytotoxické léčby, kdy dochází k překrývání akutního, opožděného, a dokonce i anticipačního zvracení a nevolnosti.
Navíc i ve velkých studiích, kde je podávána optimální kombinovaná antiemetická profylaxe, stále zůstává významné procento nemocných, kteří mají potíže.
Typy nevolnosti a zvracení po chemoterapii
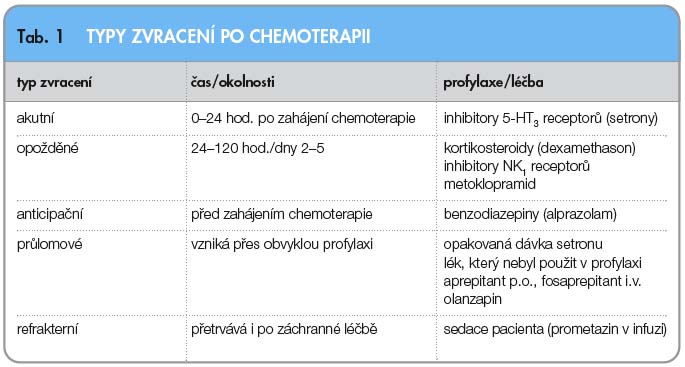 Z klinického pohledu je třeba rozlišovat různé typy zvracení po chemoterapii, protože jim odpovídají i různé způsoby léčby (tab. 1).
Z klinického pohledu je třeba rozlišovat různé typy zvracení po chemoterapii, protože jim odpovídají i různé způsoby léčby (tab. 1).
Akutní zvracení je zprostředkováno náhlým uvolněním serotoninu vlivem cytotoxických léků a jeho vazbou na 5-HT3 receptory, k čemuž dochází jak na periferii v zažívacím traktu, tak i v oblasti chemorecepční spouštěcí zóny na spodině IV. mozkové komory. Nastává v době od několika minut po zahájení chemoterapie až do 24 hodin, s maximem výskytu většinou za 5–6 hodin (po cyklofosfamidu za 9–18 hodin).
Opožděné zvracení má jiný mechanismus vzniku, na něm významně participují nově rozpoznané NK1 receptory se svým přirozeným mediátorem – substancí P, ale mohou se podílet i jiné receptory a mediá-tory.
Působení serotoninu na 5-HT3 receptorech představuje zřejmě časnou fázi emetické odpovědi, zatímco NK1 receptory mají úlohu v pozdější fázi emetické dráhy a jejich spektrum účinku může být širší.
Anticipační nevolnost a zvracení se dříve vyskytovaly u 20 % pacientů s opakovanou chemoterapií. V posledních letech s účinnější antiemetickou profylaxí se vyskytují přibližně u 10 % pacientů. Riziko se zvyšuje s narůstajícím počtem cyklů chemoterapie a symptomy mohou přetrvávat ještě dlouho po jejím skončení.
Nevolnost po chemoterapii sice do určité míry ve svém výskytu koresponduje se zvracením, ale její mechanismus vzniku je odlišný, na jejím vzniku se podílejí i jiné oblasti centrálního nervového systému, včetně mozkové kůry. Proto také samotná nevolnost je po chemoterapii ještě častější než zvracení a její léčba je obtížnější.
Průlomové zvracení vzniká navzdory standardní antiemetické profylaxi.
Refrakterní zvracení je charakterizováno přetrvávajícími potížemi i při optimální profylaxi v dalším cyklu léčby a navzdory farmakologické intervenci.
Emetogenita protinádorových léků
Emetogenita jednotlivých protinádorových léků je dnes hodnocena podle pravděpodobnosti výskytu zvracení za podmínek nepodání účinné antiemetické profylaxe. Vysoce emetogenní lék by při samostatném podání vyvolal zvracení u více než 90 % léčených, zatímco středně emetogenní u 30–90 %. V širším slova smyslu jsou obě tyto kategorie považovány za emetogenní léčbu, a představují tak indikaci k preventivnímu podání antiemetik u všech nemocných. Text nového odstavce.
Emetogenita jednotlivých protinádorových léků je dnes hodnocena podle pravděpodobnosti výskytu zvracení za podmínek nepodání účinné antiemetické profylaxe. Vysoce emetogenní lék by při samostatném podání vyvolal zvracení u více než 90 % léčených, zatímco středně emetogenní u 30–90 %. V širším slova smyslu jsou obě tyto kategorie považovány za emetogenní léčbu, a představují tak indikaci k preventivnímu podání antiemetik u všech nemocných. Text nového odstavce.
Emetogenita jednotlivých protinádorových léků je dnes hodnocena podle pravděpodobnosti výskytu zvracení za podmínek nepodání účinné antiemetické profylaxe. Vysoce emetogenní lék by při samostatném podání vyvolal zvracení u více než 90 % léčených, zatímco středně emetogenní u 30–90 %. V širším slova smyslu jsou obě tyto kategorie považovány za emetogenní léčbu, a představují tak indikaci k preventivnímu podání antiemetik u všech nemocných. Text nového odstavce.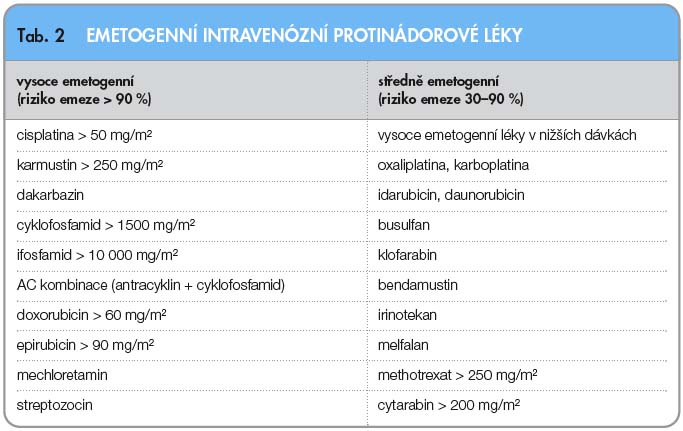 Řazení léků do jednotlivých kategorií se podle doporučení různých odborných společností poněkud liší, prodělává jisté změny v čase a také s příchodem nových léků. Proti poslední konsenzuální verzi evropské a mezinárodní odborné společnosti (ESMO a MASCC) z roku 2010 jsou v současné aktuální verzi americké sítě NCCN pro rok 2012 patrné určité změny, zejména pak v zařazení některých antracyklinů ve vyšším dávkování a v kombinaci s cyklofosfamidem mezi vysoce emetogenní léčbu (tab. 2) [3].
Řazení léků do jednotlivých kategorií se podle doporučení různých odborných společností poněkud liší, prodělává jisté změny v čase a také s příchodem nových léků. Proti poslední konsenzuální verzi evropské a mezinárodní odborné společnosti (ESMO a MASCC) z roku 2010 jsou v současné aktuální verzi americké sítě NCCN pro rok 2012 patrné určité změny, zejména pak v zařazení některých antracyklinů ve vyšším dávkování a v kombinaci s cyklofosfamidem mezi vysoce emetogenní léčbu (tab. 2) [3].
Při současném podání několika protinádorových léků rozhoduje o emetogenitě kombinace nejvíce emetogenní lék, je však třeba počítat s faktem, že riziko zvracení může být u kombinované léčby vyšší. Autoři klasifikace také uvádějí, že pro některé pacienty mohou být léky ze skupiny střední emetogenity ve skutečnosti vysoce emetogenními.
Naopak podání stejné dávky léku v kontinuální infuzi je obvykle podstatně méně emetogenní než bolusová aplikace.
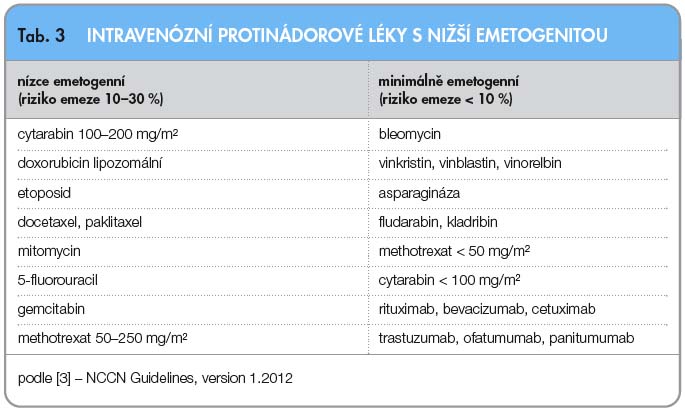 Poslední verze klasifikací nově vyčleňují perorální protinádorové léky. Sem patří mezi emetogenní léky prokarbazin, busulfan v dávce 4 mg/kg/den a vyšší, cyklofosfamid 100 mg/kg/den a více, etoposid, lomustin a některé další.
Poslední verze klasifikací nově vyčleňují perorální protinádorové léky. Sem patří mezi emetogenní léky prokarbazin, busulfan v dávce 4 mg/kg/den a vyšší, cyklofosfamid 100 mg/kg/den a více, etoposid, lomustin a některé další.
Protinádorové léky s nižší emetogenitou mají podstatně nižší riziko vzniku CINV (tab. 3) [3].
Individuální faktory rizika CINV
Vznik CINV nezávisí pouze na emetogenitě cytotoxických léků, ale také na samotném pacientovi [8].
Obecně je toto riziko vyšší u mladých jedinců a u žen. Významnou roli hraje anamnestický údaj o zvracení v minulosti, zejména při jízdě dopravním prostředkem, při změnách pohybu nebo i v těhotenství. Zvýšené riziko mají nemocní, kteří trpí úzkostí nebo i abnormální únavou. Pokud je přítomna  deprese, zvyšuje se riziko nespolupráce pacienta při antiemetické profylaxi a tím i pravděpodobnost vzniku CINV. Naopak zvláštní výhodu v této souvislosti představuje pravidelná konzumace alkoholu (tab. 4).
deprese, zvyšuje se riziko nespolupráce pacienta při antiemetické profylaxi a tím i pravděpodobnost vzniku CINV. Naopak zvláštní výhodu v této souvislosti představuje pravidelná konzumace alkoholu (tab. 4).
Při opakovaných cyklech protinádorové léčby je jedním z nejdůležitějších faktorů anamnestický údaj o toleranci předcho-zího cyklu, se zohledněním podané anti-emetické profylaxe a případně i efektu léčby již vzniklých potíží. Toto zhodnocení však musí zahrnout nejen akutní, ale i opožděné zvracení až do 3 dnů po skončení chemoterapie a musí také vedle zvracení posoudit i žaludeční nevolnost z hlediska míry jejího výskytu, intenzity a trvání.
Inhibitory 5-HT3 receptorů
Blokují účinek uvolněného serotoninu v akutní fázi po podání cytotoxických léků, a to jak v centrálním nervovém systému, tak i na periferních zakončeních nervu vagu v oblasti zažívacího traktu.
Starší léky z této skupiny, ondansetron a granisetron, jsou dnes považovány za 1. generaci inhibitorů 5-HT3 receptorů. Jsou ekvivalentní ve svém účinku (dolasetron a tropisetron nejsou dnes u nás běžně po-užívány). Biologická dostupnost perorálně podaných setronů je kolem 60 %, přesto není významný rozdíl v antiemetické účinnosti mezi aplikací perorální a intravenózní.
I když ondansetron má poměrně krátký biologický poločas, většina klinických studií používala tento lék v jedné denní dávce. Podle standardních doporučení je ondansetron i granisetron možno podávat buď v jedné denní dávce nebo rozděleně do dvou dávek.
Palonosetron je vysoce selektivní kompe-titivní antagonista 5-HT3 receptorů 2. generace, dostupný původně pouze v intra-venózní formě. Proti dosud používaným lékům této skupiny má až stokrát vyšší afinitu k receptoru a podstatně delší terminální plazmatický eliminační poločas, který činí přibližně 40 hodin [9].
Na molekulární úrovni působí, na roz-díl od ostatních inhibitorů 5-HT3 receptorů, jako alosterický antagonista s pozitivní kooperací. Vazbou do nesubstrátového místa receptoru (alosterická vazba) usnadňuje vazbu druhé molekuly palonosetronu do samotného vazebného místa pro serotonin (ortosterická vazba), což způsobuje vysokou afinitu léku k receptoru. Výsled-kem je internalizace 5-HT3 receptorů s dlouhodobou inhibicí funkce receptoru, což se jeví zdánlivě jako ireverzibilní účinek [10].
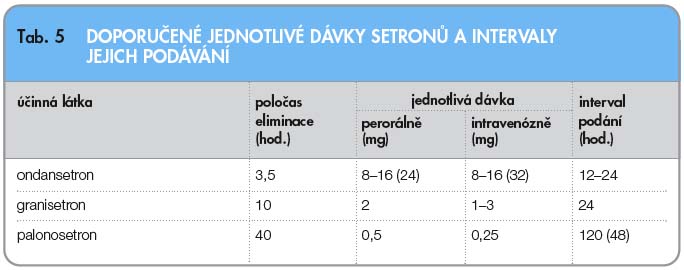 Standardní dávku představuje 0,25 mg i.v. podaných jednorázově před chemo-terapií pro celý cyklus léčby. Vzhledem k tomu, že byla testována i trojnásobná dávka – 0,75 mg – bez závažných nežádoucích účinků, je považováno za možné a bezpečné opakovat u vícedenních cyklů chemoterapie podání palonosetronu i v dalších dnech léčby, například v odstupu 48 hodin (tab. 5).
Standardní dávku představuje 0,25 mg i.v. podaných jednorázově před chemo-terapií pro celý cyklus léčby. Vzhledem k tomu, že byla testována i trojnásobná dávka – 0,75 mg – bez závažných nežádoucích účinků, je považováno za možné a bezpečné opakovat u vícedenních cyklů chemoterapie podání palonosetronu i v dalších dnech léčby, například v odstupu 48 hodin (tab. 5).
Setronová antiemetika včetně palonosetronu mohou vyvolávat bolesti hlavy a zácpu, většinou však jen mírného stupně, přičemž výskyt nepřesahuje 10 % léčených.
Kortikosteroidy
Mají vlastní antiemetický účinek, jehož mechanismus není zcela jasný. Potencují účinek inhibitorů 5-HT3 receptorů, a navíc mají významný efekt proti opožděnému zvracení a nevolnosti.
Přednostně je doporučen dexamethason, u něhož je prokázána závislost účinku na dávce v rozmezí 4–20 mg. Plně účinnou dávkou v profylaxi akutního zvracení po vysoce emetogenní chemoterapii je proto 20 mg podaných perorálně nebo nitrožilně. Při kombinaci s aprepitantem je však do-poručeno snížení dávky na 12 mg – vzhledem k prokázané interakci, která vede ke zvýšení hladiny steroidů při jejich současném podávání.
Pokud protinádorová léčba obsahuje jiný kortikosteroid, dexamethason se již nepřidává.
Nežádoucí účinky léčby kortikosteroidy jsou všeobecně známy a je třeba s nimi počítat i při antiemetické terapii. Vzhledem ke krátkodobému podávání je nejčastějším problémem hyperglykemie, která se netýká jen diabetků, ale i nemocných s porušenou tolerancí glukózy a často i obézních pacientů. Při ranní dávce kortikosteroidů glykemie většinou narůstá až v odpoledních a večerních hodinách a do rána opět klesá k normě. Optimálním řešením při vícedenní terapii kortikosteroidy je večerní kontrola glykemie. U mnoha nemocných je namístě doporučit úpravu stravy s přechodným omezením příjmu jednoduchých sacharidů ve stravě a u diabetiků krátkodobé zvýšení dávky antidiabetik. U diabetiků, jejichž glykemie je špatně kompenzovatelná, je možno nahradit dexamethason aprepitantem.
Inhibitory NK1 receptorů
Léky této nové skupiny antiemetik působí blokádu substance P na NK1 receptorech. Tyto receptory jsou hojně exprimovány v mozkovém kmeni v oblastech, které regulují reflex pro zvracení, ale také periferně na vagových zakončeních v oblasti dolního jícnového svěrače.
Aprepitant je prvním klinicky účinným inhibitorem NK1 receptorů, původně dostupným pouze v perorální formě. Jeho biologická dostupnost je přibližně 60 % a má velmi dobrý průnik do mozku, což je podstatné pro jeho antiemetický účinek. Významným přínosem je především vliv na zvracení v opožděné fázi, který je vyšší než u všech dosud používaných antiemetik. Vzhledem k odlišnému mechanismu účinku s výhodou doplňuje antiemetickou kombinaci blokátorů 5-HT3 receptorů s kortiko-steroidy (trojkombinace).
Za standardní dávkování je dnes po-važován třídenní perorální režim, první den 125 mg a další dva dny vždy 80 mg. S úspěchem bylo také testováno alternativní podání všech tří tablet naráz (285 mg) před zahájením chemoterapie. Také je možné prodloužené podávání tablety 80 mg čtvrtý a pátý den léčby [11].
V současné době je již k dispozici také intravenózní forma, prekurzor fosaprepitant, jehož dávka 115 mg je ekvivalentní 125 mg perorálního aprepitantu. Pro celý cyklus léčby je možno použít jednorázovou dávku fosaprepitantu 150 mg [3].
Blokátory NK1 receptorů vykazovaly pouze v některých studiích proti placebu častější výskyt únavy a škytavky, většinou však byly jen mírného stupně. Vzhledem k metabolismu aprepitantu cestou izoenzymu 3A4 cytochromu P-450 vzniká určitý potenciál pro lékové interakce, z nichž ta s kortikosteroidy byla popsána výše. Zatím nebyly zjištěny významné interakce s cytotoxickými léky, až na několik případů neurotoxicity při současném podávání isofosfamidu [12].
Benzodiazepiny
Nemají sice přímý antiemetický účinek, ale u anxiózních pacientů představují účinný doplněk profylaxe při emetogenní chemoterapii. Přednostně je doporučen lorazepam nebo alprazolam v jednotlivých dávkách 0,25–0,5 mg podávaných čtyřikrát denně. U starších a oslabených pa-cientů je doporučena dávka nižší.
Olanzapin je psychofarmakem schváleným pro léčbu schizofrenie. Působí blokádu četných neurotransmiterů na dopaminergních, serotoninergních, histaminergních i muskarinových receptorech. V klinických studiích u nemocných s emetogenní chemoterapií byla potvrzena jeho bezpečnost a účinnost proti akutnímu i opožděnému zvracení, ale také proti nevolnosti, která je obecně hůře ovlivnitelná než zvracení [13]. O podání olanzapinu v dávkách 2,5-5 mg dvakrát denně je možno uvažovat při léčbě průlomového a refrakterního zvracení, zatím ovšem mimo standardní indikace, přičemž předpis na recept je vázán na odbornost psychiatra.
Blokátory D2 receptorů
Metoklopramid tlumí dopaminové receptory na periferní i centrální úrovni, má prokinetický účinek na zažívací trakt a v dávkách 10–20 mg podávaných každých 4–6 hodin působí také proti CINV.
Jeho nejčastějším závažným nežádoucím účinkem jsou okulomotorické a křečové projevy, které nejednou znemožní další podávání. V těchto případech je možno využít blokády dopaminových receptorů haloperidolem v dávkách 0,5–2 mg podávaných perorálně nebo intravenózně, opakovaných každých 4–6 hodin [3].
Standardní přístup k antiemetické profylaxi
Každé podání protinádorové léčby by dnes mělo být provázeno posouzením rizika CINV podle všeobecně přijatých standardních postupů – emetogenita protinádorových léků, rizikové faktory podle konkrétního pacienta, zhodnocení tolerance předchozího cyklu léčby (včetně efektu antiemetik).
U každého cyklu emetogenní léčby (vy-soce i středně emetogenní) je standardním přístupem profylaktické podání kombinace antiemetik každý den aplikace chemote-rapie a následně pak pokračování v anti-emetické profylaxi 3–4 dny po skončení této léčby. V praxi to znamená, že nestačí podání samotného setronového antiemetika a nestačí ani podání pouze ve dny, kdy pacient dostává protinádorové léky.
Ambulantní pacient musí dostat léky k profylaxi opožděného zvracení a současně by měl mít k dispozici doporučení pro případ průlomového zvracení.
Také při chemoterapii s nízkou eme-togenitou je indikováno paušální podání antiemetika před každým cyklem chemoterapie, není však rutinně nutné zajišťovat opožděnou fázi.
U jednotlivých pacientů je třeba přihlédnout ke skutečnosti, že i středně emetogenní léčba může pro některé z nich znamenat vysoké riziko zvracení.
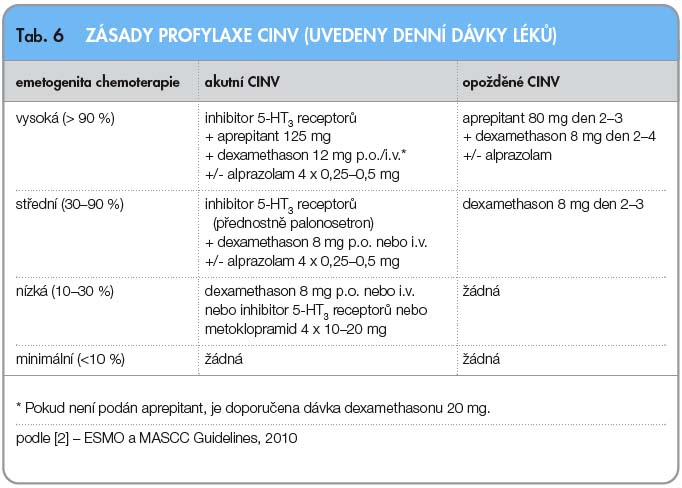 Při rozpisu antiemetické kombinace je třeba brát v úvahu možné nežádoucí účinky antiemetik (viz výše). Zásady profylaxe CINV shrnuje tab. 6.
Při rozpisu antiemetické kombinace je třeba brát v úvahu možné nežádoucí účinky antiemetik (viz výše). Zásady profylaxe CINV shrnuje tab. 6.
Zásady antiemetické profylaxe u vysoce emetogenní chemoterapie
Standardním postupem v profylaxi akutního zvracení při vysoce emetogenní chemoterapii je trojkombinace obsahující inhibitor 5-HT3 receptorů, aprepitant a dexamethason [2, 3]. Všechny tři léky je třeba podat před zahájením chemoterapie a u vícedenních režimů pokračovat v užívání každý další den podání emetogenní léčby. Riziko CINV však trvá i po jejím skončení, a proto je třeba pokračovat s profylaxí opožděného zvracení další 3 dny [14, 15].
Poslední klinické studie ukazují, že i u vysoce emetogenní léčby má palonosetron vyšší účinnost ve srovnání s inhibitory 5-HT3 receptorů 1. generace, a proto se stává preferovaným inhibitorem 5-HT3 receptorů také u vysoce emetogenní chemoterapie [16].
U anxiózních nemocných je možno zvýšit efekt antiemetické kombinace přidá-ním anxiolytika, přednostně alprazolamu. Někteří nemocní mají po chemoterapii i dyspeptické potíže těžko odlišitelné od nevolnosti, které často reagují na inhibitory kyselé žaludeční sekrece [3].
Středně emetogenní chemoterapie
Standardním přístupem k profylaxi akutního zvracení u středně emetogenní chemoterapie je podávání kombinace inhibitoru 5-HT3 receptorů s dexamethasonem každý den aplikace emetogenních léků. Preferovaným setronem je palonosetron, který významně snižuje výskyt zvracení nejen v akutní, ale i v opožděné fázi; zvláštní výhodu má u vícedenních režimů chemoterapie. Přitom je třeba zdůraznit, že ve většině studií byl palonosetron podáván spolu s dexamethasonem [17].
Nedávná velká randomizovaná klinická studie s trojkombinací obsahující aprepitant prokázala i u středně emetogenní léčby signifikantní zvýšení efektu (úplná zábrana zvracení či nutnosti farmakologické intervence pro průlomové potíže po dobu 5 dnů u 68,7 % oproti 56,3 % ve skupině bez aprepitantu) [18, 19]. Aprepitant však zatím není rutinní součástí profylaxe od prvního cyklu, ale je doporučeno podávat jej vybraným nemocným se zvýšeným rizikem opožděného zvracení (karboplatina > 300 mg/m2 nebo cyklofosfamid > 600 mg/m2 nebo doxorubicin > 50 mg/m2) [2, 3].
Také u středně emetogenní chemoterapie je indikováno pokračování antiemetické profylaxe i po skončení aplikace emetogenních cytotoxických léků – nej-méně další 2 dny. Je možno použít buď samotný dexamethason 8 mg p.o. nebo i.v. denně nebo aprepitant nebo kombinaci obou těchto léků. Podle doporučení NCCN je také možno použít samotný inhibitor 5-HT3 receptorů, i když v klinických studiích jeho přidání k dexamethasonu již dále signifikantně nesnížilo výskyt potíží v opožděné fázi.
Při perorální emetogenní léčbě je indikován samotný inhibitor 5-HT3 receptorů, s možností přidat alprazolam nebo i inhibitor kyselé žaludeční sekrece [3].
Chemoterapie s nízkou nebo minimální emetogenitou
U minimálně emetogenní chemoterapie je indikována profylaxe akutního zvracení jedním lékem, přičemž není nutné krýt opožděnou fázi. Chemoterapie s minimální emetogenitou nevyžaduje rutinně žádnou profylaxi, pokud není jiný zvláštní důvod pro její podání.
Průlomové a refrakterní zvracení
Pokud při standardní antiemetické profylaxi vznikne průlomové zvracení nebo nauzea, může být u části nemocných účinná druhá dávka téhož inhibitoru 5-HT3 receptorů, což se může týkat i palono-setronu (při vícedenní chemoterapii byla účinnou záchrannou antiemetickou léč-bou druhá dávka palonosetronu podaná za 72 hodin po první dávce).
Selhání léčby setronem však nemusí být způsobeno nedostatečnou blokádou 5-HT3 receptoru, ale také zapojením jiných neurotransmiterů do mechanismu zvra-cení. Proto může být účinné podání léku s jiným mechanismem účinku, jako jsou kortikosteroidy, antagonisté D2 receptorů, aprepitant, anitihistaminika nebo benzo-diazepiny [20].
Zvracení po chemoterapii vyžaduje také vyloučit jiné možné příčiny, jakými jsou obstrukce střeva nádorem, mozkové metastázy, metabolické poruchy a další komplikace. Průlomové zvracení nezřídka vyžaduje úpravu hydratace a iontové dysbalance.
 U nemocných s nedostatečnou kontrolou nevolnosti a zvracení v předchozím cyklu chemoterapie je nutno v dalším cyklu profylaktickou léčbu změnit (tab. 7).
U nemocných s nedostatečnou kontrolou nevolnosti a zvracení v předchozím cyklu chemoterapie je nutno v dalším cyklu profylaktickou léčbu změnit (tab. 7).
Pokud CINV přetrvávají i v dalších cyklech chemoterapie navzdory posílené antiemetické profylaxi, mohou být důvodem ke změně protinádorové léčby.
U refrakterního zvracení je ve zvláště obtížných případech alternativou léčby podat sedativa s navozením lehkého spánku, který často umožní výraznou redukci dávky klasických antiemetik. Tohoto cíle lze u hospitalizovaných pacientů dosáhnout kontinuální infuzí chlorpromazinu s prometazinem.
Závěr
Předcházení nevolnosti a zvracení při emetogenní chemoterapii je daleko účinnějším postupem než léčba již vzniklých potíží. Proto je dnes zásadním požadavkem důsledná antiemetická profylaxe CINV od prvního cyklu emetogenní léčby.
V posledních dvou desetiletích se s příchodem nových antiemetik významně zlepšily možnosti profylaxe CINV a byly vypracovány standardní postupy pro předcházení těmto stresujícím potížím. Přesto nemalá část onkologických pacientů i nadále zažívá nevolnost nebo i zvracení při onkologické léčbě, zvláště pak při jejím delším trvání a opakovaných cyklech (30–50 %). Jednou z příčin může být sklon k podhodnocování těchto potíží odborným personálem a nedodržování standardních doporučení.
Samotné inhibitory 5-HT3 receptorů zabraňují zvracení pouze u poloviny nemocných s vysoce emetogenní chemoterapií v akutní fázi a ještě menší účinek mají v opožděné fázi po chemoterapii. Tato skutečnost není překvapením, protože na vzniku zvracení se podílí větší počet různých neurotransmiterů a jejich receptorů.
Zvýšení efektu antiemetické profylaxe vyžaduje postupovat podle standardních doporučení, jejichž cílem je kompletní ochrana před vznikem jakékoliv nevolnosti či zvracení. Kromě emetogenity chemoterapie je třeba posuzovat také individuální rizikové faktory pacienta a vyhodnocovat efekt profylaxe v předchozích cyklech léčby.
Do budoucna by při nedostatečném efektu standardní profylaxe měla být v klinických studiích testována kombinace palonosetronu s aprepitantem a dexame-thasonem [21], případně s přidáním olanzapinu. Z nových forem léků – granisetron ve formě náplasti zajišťuje šestidenní udržení účinku, srovnatelné s každodenním užíváním tablet. Nazální forma setronových antiemetik bude vzhledem k rychlému nástupu účinku vhodná spíše k řešení průlomových potíží [22].
Seznam použité literatury
- [1] Grunberg S, Deuson RR, Mavros P, et al. Incidence of chemotherapy-induced nausea and emesis after modern antiemetics. Cancer 2004; 100: 2261–2268.
- [2] Roila F, Herrstedt J, Aapro M, et al. Guideline update for MASCC and ESMO in the prevention of chemotherapy- and radiotherapy-induced nausea and vomiting: results of the Perugia consensus conference. Ann Oncol 2010; 21: v232–v243.
- [3] Ettinger DS and Pannel Members. NCCN Clinical Practice Guidelines in Oncology. Version 1.2012. dostupné na www.nccn.org/professionals/physician_gls/.
- [4] Bash E, Prestrud AA, Hesketh PJ, et al. Anti-emetics: American Society of Clinical Oncology Clinical Practice Guideline Update. J Clin Oncol 2011, doi: 10.1200/JCO.2010.34.4614.
- [5] Ihbe-Heffinger A, Ehlken B, Bernard R, et al. The impact of delayed chemotherapy-induced nausea and vomiting on patients, health resource utilisation and costs in German cancer centers. Ann Oncol 2004; 15: 526–536.
- [6] Ellebaek E, Herrstedt J. Optimizing antiemetic therapy in multiple-day and multiple cycles of chemotherapy. Current Opinion in Supportive and Palliative Care 2008; 2: 28–34.
- [7] Schwartzberg L, Szabo S, Gilmore J, et al. Likelihood of a subsequent chemotherapy-induced nausea and vomiting (CINV) event in patients receiving low, moderately and highly emetogenic chemotherapy (LEC, MEC, HEC). Curr Med Res Opinion 2011; 27: 837–845.
- [8] Hesketh PJ, Aapro M, Street JC, Carides AD. Evaluation of risk factors predictive of nausea and vomiting with current standard-of-care antiemetic treatment: analysis of two phase III trials of aprepitant in patients receiving cisplatin-based chemotherapy. Support Care Cancer 2010; 18:1171–1177.
- [9] Tomíška M, Vorlíček J. Palonosetronum. Remedia 2006; 16: 57–60.
- [10] Rojas C, Thomas AG, Alt J, et al. Palonosetron triggers 5-HT3 receptor internalization and causes prolonged inhibition of receptor function. European J Pharmacol 2010; 626: 193–199.
- [11] Tomíška M. Aprepitant. Remedia 2009; 19: 3–8.
- [12] Howell JE, Szabatura AH, Hatfield Seung A, Nesbit SA. Characterization of the occurence of ifosfamide-induced neurotoxicity with concomitant aprepitant. J Oncol Pharm Pract 2008; 14: 157–162.
- [13] Navari RM. Prevention of emesis from multiple-day and high-dose chemotherapy regimens. J Nation Compr Cancer Network 2007; 5: 51–59.
- [14] Warr DG, Grunberg SM, Gralla RJ, et al. The oral NK1 antagonist aprepitant for the prevention of acute and delayed chemotherapy-induced nausea and vomiting: Pooled data from 2 randomised, double-blind, placebo controlled trials. Eur J Cancer 2005; 41: 1278–1285.
- [15] de Wit R, Herrstedt J, Rapoport B, et al. Addition of the oral NK1 antagonist aprepitant to standard antiemetics provides protection against nausea and vomiting during multiple cycles of cisplatin-based chemotherapy. J Clin Oncol 2003; 21: 4105–4111.
- [16] Botrel TE, Clark OA, Clark L, et al. Efficacy of palonosetron (PAL) compared to other serotonin inhibitors (5-HT3R) in preventing chemotherapy-induced nausea and vomiting (CINV) in patients receiving moderately or highly emetogenic (MoHE) treatment: systematic review and meta-analysis. Support Care in Cancer 2011; 19: 823–832.
- [17] Gralla R, Lichinitser M, Van der Vegt S, et al. Palonosetron improves prevention of chemotherapy-induced nausea and vomiting following moderately emetogenic chemotherapy: results of a double-blind randomized phase III trial comparing single doses of palonosetron with ondansetron. Annals of Oncology 2003; 14: 1570–1577.
- [18] Warr DG, Hesketh PJ, Gralla RJ, et al. Efficacy and tolerability of aprepitant for the prevention of chemotherapy-induced nausea and vomiting in patients with breast cancer after moderately emetogenic chemotherapy. J Clin Oncol 2005; 23: 2822–2830.
- [19] Rapoport BL, Jordan K, Boice JA, et al. Aprepitant for the prevention of chemotherapy-induced nausea and vomiting associated with broad spectrum of moderately emetogenic chemotherapies and tumor types: a randomized, double blind study. Support Care Cancer 2009; DOI 10.1007/s00520-009-0680-9.
- [20] Oechsle K, Müller MR, Hartmann JT, et al. Aprepitant as salvage therapy in patients with chemotherapy-induced nausea and emesis re-fractory to prophylaxis with 5-HT3 antagonists and dexamethasone. Onkologie 2006; 29: 557–561.
- [21] Grote T, Hajdenberg J, Cartmell A, et al. Combination therapy for chemotherapy-induced nausea and vomiting in patients receiving moderately emetogenic chemotherapy: palonosetron, dexametasone, and aprepitant. A phase II, open label study. J Support Oncol 2006; 4: 403–408.
- [22] Grunberg S, Clark-Snow RA, Koeller J. Chemo-therapy-induced nausea and vomiting: contemporary approaches to optimal management. Support Care Cancer 2010; 18: S1–S10.