Antihistaminika v léčbě alergického zánětu
Autor podává přehled o lékové skupině antihistaminik se zaměřením hlavně na přípravky druhé generace se zvýrazněným imunomodulačním účinkem, které se stále významněji uplatňují u všech onemocnění, jejichž základem je alergický zánět. Účinnost a bezpečnost těchto léčiv by měla být široce využita nejen specialisty, ale hlavně praktickými lékaři ke včasnému zvládnutí alergického zánětu.
Úvod
Antihistaminika patří k nejpoužívanějším lékům při terapii alergických chorob a zároveň k nejpředepisovanějším lékům v lékařství vůbec. Jejich používání je založeno na blokování aktivity histaminových receptorů. Aktivace žírných buněk a bazofilních granulocytů prostřednictvím IgE protilátek, ale i jinými mechanismy (přímá imunologická i neimunologická histaminoliberace) vede v první řadě k vyplavení zásobních mediátorů z těchto buněk.
Histamin a histaminové receptory
Nejvýznamnějším mediátorem časné alergické reakce je histamin, který je spouštěčem jak fyziologicky vznikajících zánětlivých změn, tak přehnané alergické reakce u přecitlivělých osob. Aktivace histaminových receptorů prostřednictvím histaminu vyvolává celou řadu klinických příznaků, které jsou odvislé od typu histaminového receptoru a orgánu, v němž se nacházejí.Histaminový receptor H1 (obr. 1) patří do velké rodiny receptorů spřažených s G-proteinem (GPCR – G-protein-coupled receptors). Můžeme jej považovat za „buněčný vypínač“, který se nachází v rovnováze mezi neaktivním stavem „vypnuto“ a aktivním stavem „zapnuto“ [2]. V případě histaminového receptoru H1 se histamin váže na místě transmembránové domény III a V (obr. 1b) a tím přivádí receptor do stavu aktivace – „zapnuto“ [3]. H1-antihistaminika, která nejsou strukturálně odvozena od histaminu, neantagonizují vazbu histaminu, ale navazují se na jiné místo receptoru, čímž vyvolávají opačný efekt. Např. cetirizin se váže na transmem![Obr. 1a–c Schéma histaminového receptoru; podle [1] – Church, et al., 2013. a Schéma histaminového receptoru H1 se sedmi transmembránovými doménami. Histamin stimuluje receptor vstupem do centrální části receptoru; b histamin aktivizuje receptor propojením domén III a V do pozice „zapnuto“; c cetirizin propojuje transmembránové domény IV a VI a stabilizuje receptor v poloze „vypnuto“.](https://www.remedia.cz/photo-a-29823---.jpg) bránové doméně IV a VI (obr. 1c) a stabilizuje receptor v inaktivní poloze „vypnuto“. To znamená, že H1-antihistaminika nejsou receptorovými antagonisty, ale jsou inverzními agonisty vyvolávajícími na histaminovém receptoru opačný efekt než histamin, takže toto označení by mělo být přednostně používáno při označení této lékové skupiny před označením histaminový antagonista.V současné době jsou dobře prozkoumány funkce receptorů H1 a H2, pokračuje identifikace umístění a funkčního zapojení receptorů H3 a H4.
bránové doméně IV a VI (obr. 1c) a stabilizuje receptor v inaktivní poloze „vypnuto“. To znamená, že H1-antihistaminika nejsou receptorovými antagonisty, ale jsou inverzními agonisty vyvolávajícími na histaminovém receptoru opačný efekt než histamin, takže toto označení by mělo být přednostně používáno při označení této lékové skupiny před označením histaminový antagonista.V současné době jsou dobře prozkoumány funkce receptorů H1 a H2, pokračuje identifikace umístění a funkčního zapojení receptorů H3 a H4.
Aktivace receptorů H1 vyvolává kontrakce hladké svaloviny bronchů, střeva a dělohy, zvyšuje propustnost postkapilárních venul, v plicích navozuje vazokonstrikci, zvyšuje tvorbu hlenu v nosní sliznici, zvyšuje nitrobuněčné hladiny cyklického guanosinmonofosfátu (cGMP), zvýrazňuje chemotaxi leukocytů.Aktivace receptorů H2 vyvolává zvýšenou sekreci žaludeční kyseliny, stimuluje produkci hlenu v dýchacích cestách, zvyšuje hladiny nitrobuněčného cyklického adenosinmonofosfátu (cAMP), potlačuje chemotaxi leukocytů, působí stimulaci tlumivých T lymfocytů. Společné dráždění receptorů H1 a H2 vyvolává maximální vazodilataci, zvyšuje dráždivost srdečního svalu a svědění.Aktivace receptorů H3 a H4 stále ještě není dostatečně probádána. Nacházejí se v CNS, v menším rozsahu i v periferním nervovém systému, ale i na některých buňkách cévní soustavy a imunitního systému. Uplatňují se při regulaci cévního tonu, aktivity gastrointestinálního traktu a při autoregulaci syntézy a uvolňování histaminu.
Klinickými projevy uvolnění histaminu jsou místní prosáknutí se zarudnutím, svěděním a pocitem horka na kůži (kopřivka, angioedém), bronchokonstr+ikce s tvorbou vazkého hlenu v průduškách, otok a svědění sliznic oční spojivky a nosohltanu spojené se slzením, vodnatou nosní sekrecí, kýcháním, kašláním nebo i se stridorem laryngu. V zažívacím traktu se uvolnění histaminu a aktivace histaminových receptorů projeví překyselením žaludku, kolikovitými bolestmi břicha a zvýšenou peristaltikou a hlenotvorbou ve střevě. V oběhovém systému se projeví poklesem krevního tlaku, srdečními arytmiemi, v CNS předrážděním a dezorientací, přičemž klinické projevy mohou být vystupňovány až do celkového anafylaktického šoku. Snaha o ovlivnění těchto klinických projevů vedla k vývoji lékové skupiny, kterou označujeme jako antihistaminika.
Antihistaminika první generace
První antihistaminikum spatřilo světlo světa ve čtyřicátých letech minulého století (1944 – D. Bovet – fenbenzamin). V následujících letech se objevila celá řada molekul, které se uplatňovaly jako antihistaminika. Jejich působení bylo různě selektivní a obecně je možno říci, že se projevovalo většinou tlumivou aktivitou na receptorech H1, ale současně více či méně ovlivňovaly i jiné receptory (muskarinové, serotoninové, dopaminové), což vyvolávalo některé nežádoucí účinky (zahušťování hlenu v dýchacích cestách, zvýšenou suchost sliznic dýchacích cest, tlumivý vliv na CNS s projevy únavy, zhoršení koncentrace, spavosti), takže je můžeme používat pouze u pacientů a stavů, kde tyto vedlejší účinky nejsou na závadu nebo jsou v některých případech i výhodné (např. při tlumení svědění u kopřivek a ekzému, hlavně při večerním podání). Skupinu těchto léků označujeme jako antihistaminika první generace a patří k nim dosud používané přípravky jako např. bisulepin, dimetinden, klemastin, hydroxyzin, dosulepin, promethazin, vesměs v tabletové formě, ale i ve formě kapek nebo injekcí.
Vývoj nových antihistaminik S rozvojem znalostí o mechanismech alergické reakce, a především s rozvojem dokladů o alergickém zánětu založených na znalostech o aktivaci buněk zánětu (u časného alergického zánětu hlavně žírných buněk a bazofilních leukocytů a u pozdního alergického zánětu zejména eozinofilních leukocytů a aktivovaných lymfocytů) a cytokinových a chemokinových interakcích došlo i k objevování nových molekul. Ty se uplatňovaly nejen jako kompetitivní inhibitory – či lépe inverzní agonisté – histaminu, ale měly i významné vlastnosti, které napomáhaly tlumení zánětlivých aktivit na histaminu nezávislých. Možno říci, že prvním průkopníkem v této oblasti byl „prvogenerační“ ketotifen s účinkem na tlumení aktivity PAF (platelet activating factor – destičky aktivující faktor) [4].
Hlavní pokrok v rozvoji antihistaminik nastal v osmdesátých letech minulého století objevem druhé generace antihistaminik [5], která nemají žádné sedativní účinky, nebo jsou tyto účinky jen minimální vzhledem k jejich omezenému průniku přes hematoencefalickou bariéru. Navíc jsou tato nová léčiva vysoce selektivní k receptoru H1 a nemají žádný anticholinergní efekt. Novou generaci antihistaminik zastupují molekuly astemizol, cetirizin, ebastin, loratadin a terfenadin, které se začaly objevovat v praxi v sedmdesátých a osmdesátých letech minulého století. Poslední desetiletí jsou pak spojena s vývojem dále zdokonalených molekul těchto antihistaminik druhé generace (fexofenadin, levocetirizin, desloratadin) i nových molekul (azelastin, rupatadin, bilastin a další), jež mají ještě výraznější selektivnost vazby na receptorech H1 a ještě širší protizánětlivé účinky a redukované nežádoucí účinky. Jsou tak někdy označovány jako antihistaminika se zvýrazněným imunomodulačním působením. V naší odborné literatuře – a to i ve starších číslech tohoto časopisu – můžeme najít přehledové články, které popisují chemické struktury, vlastnosti a klinické použití jednotlivých nových molekul [6–14]. Přestože již samotné potlačení aktivity histaminu můžeme považovat za imunomodulační působení, v následujícím textu se budeme věnovat hlavně molekulám se zvýrazněným imunomodulačním efektem.
Základní charakteristiky antihistaminik druhé generace
Účinnost
Účinnost H1-antihistaminik je dána dvěma faktory. Afinitou látky k receptoru H1 a koncentrací látky v místě receptoru H1. Podle těchto in vitro parametrů se jeví jako nejúčinnější H1-antihistaminikum desloratadin, následně pak levocetirizin a fexofenadin [15]. Nicméně in vivo mohou být tyto poměry ovlivněny dalšími faktory, jakými jsou absorpce léku, jeho metabolizace, vazebnost v plazmě. Proto v praxi účinnost raději vztahujeme na klinické projevy účinku, například ovlivnění kožních projevů, jakými jsou hlavně schopnost potlačení pupenu a erytému vlivem podané medikace [15–17], nebo hodnoceným skóre jednotlivých symptomů u rinokonjunktivitidy.
Nástup účinku a jeho trvání
Studie u dětí [18, 19] prokazují, že plazmatické koncentrace dosahují svého maxima průměrně za 30 minut a do 90 minut dochází k dostatečné difuzi do extravaskulárního prostoru a k navození maximálního klinického efektu. U dospělých je pozorována maximální klinická odpověď do 4 hodin u levocetirizinu, fexofenadinu a desloratadinu [17, 20, 21], ale její nástup může trvat déle u léčiv typu loratadinu a ebastinu, jež vyžadují metabolizaci do aktivní formy [20]. V klinických studiích se potvrzuje, že klinický účinek levocetirizinu a desloratadinu přetrvává delší dobu, než by tomu nasvědčovaly jejich plazmatické koncentrace [21, 22]; v případě fexofenadinu trvá alespoň 70% potlačení erytému kolem 8,5 hodiny (při podání dávky 120 mg) ve srovnání s 19 hodinami u cetirizinu [40]. Toto kratší trvání klinického účinku je vysvětlováno aktivní sekrecí fexofenadinu do střeva a moči [23].
Eliminace z organismu
U cetirizinu a levocetirizinu nedochází k metabolizaci a tyto látky jsou vylučovány nezměněné přímo do moči [15]. Desloratadin je podroben rozsáhlé metabolizaci v játrech. Tato skutečnost by naznačovala, že by tak mohlo docházet k lékovým interakcím. Žádné předpokládané interakce však nebyly zaznamenány [24]. Fexofenadin, který je také minimálně metabolizován, je vylučován přímo do stolice aktivním transportem (transportními molekulami) ve střevě [24]. Zde je možnost interakce s látkami typu grapefruitového džusu, který inhibuje transport přes tyto molekuly. Bilastin není v těle aktivně metabolizován. Ve studiích na zdravých dobrovolnících bylo prokázáno, že bilastin se až v 95 % vylučuje v nezměněné formě, 28,2 % látky je vyloučeno močí a 66,5 % je vyloučeno do stolice [25, 26].
Nežádoucí účinky
Nejčastěji uváděným nežádoucím účinkem antihistaminik je somnolence, celková únava, zhoršení koncentrace, které jsou více či méně pozorovány u všech antihistaminik první generace. Jsou vyvolány průnikem přes hematoencefalickou bariéru a působením na histaminových receptorech v mozku. Hlavním předpokladem omezeného průniku antihistaminik druhé generace do mozku je, že transport přes hematoencefalickou bariéru je kontrolován aktivními transportními proteiny, jejichž funkce je již dobře známa [27, 28]. Při vyšetření užitím pozitronové emisní tomografie (PET) bylo v případě fexofenadinu obsazení receptorů H1 v mozku negativní (méně než 0,1 %) a v psychomotorických testech se výsledky u pacientů léčených fexofenadinem nelišily od skupiny s placebem [29]. Experimentální studie na myších a krysách nepotvrdily ani u radioaktivně značeného bilastinu průnik do CNS a míchy [30]. U fexofenadinu nebyl prokázán vliv na CNS ani v dávkách vyšších než 360 mg [31]. U jiných H1-antihistaminik druhé generace se však nevelký průnik do mozku předpokládá, a tím se dá předpokládat i jistá úroveň únavy a ospalosti, zvláště při použití vyšších dávek. Při PET vyšetření lidského mozku se prokázalo, že dávky 10 mg a 20 mg cetirizinu podané per os vyvolají 12,5%, eventuálně 25% obsazení receptorů H1 v mozkové kůře a cingulu [32]. Tyto výsledky vysvětlují klinické nálezy průkazu únavy a malátnosti u skupin s cetirizinem ve srovnání s placebem [33–36]. Poslední publikace naznačují, že doporučované dávky levocetirizinu jsou méně sedativní než cetirizin [37] a desloratadin nevyvolává somnolenci [24, 38].
V souvislosti s některými antihistaminiky druhé generace (astemizol, terfenadin) byly výjimečně popsány případy s prodloužením intervalu QT a případy závažných komorových arytmií [2, 39] a ve většině zemí včetně ČR byla tato antihistaminika stažena z trhu. U antihistaminik druhé generace, která jsou u nás v současné době k dispozici (loratadin, fexofenadin, ebastin, azelastin, cetirizin, desloratadin, levocetirizin, bilastin, rupatadin), nebyla zaznamenána žádná kardiotoxicita [40–44].
Klinické použití
Antihistaminika se obecně používají v léčbě alergických onemocnění, u kterých je etiologicky vyjádřena časná nebo pozdní fáze alergického zánětu s aktivací žírných buněk, bazofilních a eozinofilních granulocytů a dalších zánětových buněk. Jedná se především o sezonní a celoroční alergickou rinokonjunktivitidu a akutní a chronickou kopřivku, kde je systémové podání antihistaminik metodou první volby. Efekt systémově podaných antihistaminik je možno doplnit topicky působícími antihistaminiky (nosní spreje, oční kapky, kožní gely), která u lehčích forem výše uvedených onemocnění mohou vystačit k léčbě jako monoterapie. Významně se mohou antihistaminika léčebně uplatnit i u dalších onemocnění, v jejichž etiologii se významně uplatňuje alergický zánět (u některých forem průduškového astmatu, atopického ekzému, v prevenci a léčbě potravinové a lékové alergie anebo při zvládání reakcí na hmyzí bodnutí). V oficiálních mezinárodních dokumentech (GINA 2014) nejsou antihistaminika uvedena mezi léčivy používanými u průduškového astmatu, ale v praxi je potvrzeno, že dobře léčebně kontrolovaná alergická rýma (nejčastější komplikace průduškového astmatu) významně ovlivňuje i úroveň astmatických potíží. Antihistaminika jsou nepostradatelnou součástí pohotovostních balíčků u pacientů s rizikem anafylaxe.
Charakteristika a specifika jednotlivých antistaminik s imunomodulačním účinkem
Ketotifen
Ketotifen běžně řadíme mezi antihistaminika první generace, ale studie in vitro a in vivo u něj prokázaly významné imunomodulační účinky. Chemicky se jedná o benzocykloheptathiofen. Je účinnou protialergickou a antiastmatickou látkou dlouhodobě známou v perorální tabletové nebo tobolkové formě (v posledních letech se dostal na náš trh i jako oční kapky). U ketotifenu byly potvrzeny inhibiční účinky na bronchiální reakci vyvolanou inhalovaným histaminem, alergenem nebo aspirinem a na oční, nosní a kožní reakce vyvolané alergenem u senzibilizovaných jedinců. Neovlivňuje rozvoj bronchokonstrikce vyvolané metacholinem a námahou. Profylaktické podávání ketotifenu snižuje eozinofilii, inhibuje vyplavení anebo aktivitu prozánětlivých mediátorů, jako jsou histamin, PAF, metabolity kyseliny arachidonové, chemotaktický faktor neutrofilů, zvyšuje intracelulární koncentrace cAMP ve studiích in vitro a v experimentech na zvířecích modelech. Podávání ketotifenu in vitro nebo in vivo nemělo vliv na počet a aktivitu lymfocytů u dětských astmatiků, ale byl zaznamenán pokles sérové koncentrace IgE a celkového počtu eozinofilů u pacientů s průduškovým astmatem [4].Ketotifen je k dispozici ve formě tobolek, sirupu a očních kapek. Po zahájení léčby se u 10–20 % pacientů objevuje sedativní účinek, který však po několika dnech většinou ustupuje. U některých pacientů je možno pozorovat větší chuť k jídlu, což je hlavně u žen středního věku spojeno s nežádoucím přírůstkem tělesné hmotnosti, je proto nutné na tento fakt pacienty předem upozornit. V současné době je však ketotifen používán již sporadicky – při celkovém podání je nahrazen antihistaminiky nové generace – své místo si ještě zachovává jeho topická forma – oční kapky.
Cetirizin
Cetirizin je karboxylovaný metabolit hydroxyzinu a patří do skupiny piperazinových antihistaminik. Má výraznou a selektivní vazebnou schopnost k periferním receptorům H1. V běžném dávkování nemá ve srovnání s antihistaminiky první generace sedativní účinek na CNS. Má potvrzenou výraznější protektivní schopnost vůči vytvoření kožního pupenu po aplikaci histaminu ve srovnání s ostatními antihistaminiky. Byl u něj rovněž prokázán protektivní účinek při histaminem vyvolaném bronchospasmu u astmatiků. U alergických pacientů byl rovněž prokázán jeho inhibiční vliv na chemotaxi eozinofilů [17, 33, 34, 45].Cetirizin je k dispozici ve formě tablet a na našem trhu jsou již dostupná četná generika tohoto přípravku. Je rovněž dostupný ve formě sirupu a kapek k perorální aplikaci. U dospělých většinou vystačíme s podáváním 1krát za 24 hodin, u dětí – hlavně předškolních – je výhodnější podávání 2krát denně pro jeho rychlejší metabolizaci. Cetirizin je prezentován jako nejbezpečnější antihistaminikum druhé generace (nejrozsáhlejší studie zabývající se bezpečností jeho podávání) a ve srovnávacích kontrolovaných studiích je často používán jako referenční přípravek druhé generace antihistaminik při testování nových molekul.
Levocetirizin
Jedná se o levotočivou izoformu cetirizinu, která má dvojnásobnou vazebnou afinitu k receptoru H1, takže je možno dosáhnout stejné účinnosti při polovičním dávkování. K jiným receptorům je vazebná kapacita až 500krát menší. Levocetirizin je minimálně metabolizován, má velmi nízký distribuční objem, což je velmi výhodné z hlediska bezpečnosti léku. Jeho biologický poločas je asi 8 hodin. Při sledování potlačení kožního pupenu vyvolaného histaminem byl levocetirizin v dávce 2,5 mg stejně účinný jako cetirizin v dávce 5 mg a byl účinnější než ebastin, loratadin, fexofenadin a mizolastin v ekvivalentních dávkách. Byly potvrzeny jeho výrazné protizánětlivé účinky sledováním inhibice migrace eozinofilů po provokaci alergenem, blokování exprimace adhezních molekul VCAM-1 a snížení cévní permeability [11, 20, 24, 46].Levocetirizin je dostupný ve formě tablet o síle 5 mg, na trhu jsou k dispozici četná generika.
Loratadin
Loratadin patří do skupiny piperidinových antihistaminik. Loratadin je dlouhodobě působící nesedativní antihistaminikum s velmi rychlým nástupem účinku (při perorální aplikaci je možno zjistit účinné hladiny do 30 minut) s výraznou selektivitou vazby na receptory H1 a protizánětlivou aktivitou potvrzenou in vitro – tlumivý vliv na uvolňování prostaglandinu D2, leukotrienu C4 z žírných buněk a bazofilů, čímž se může uplatňovat při ovlivnění pozdní fáze alergického zánětu [20, 35, 47].Loratadin je na našem trhu ve formě tablet a jsou dostupná rovněž jeho četná generika.
Desloratadin
Desloratadin je vysoce selektivní H1-antihistaminikum odvozené od loratadinu (aktivní forma loratadinu) s vysokou vazebnou afinitou k receptoru H1 (udává se 10krát vyšší účinnost než u loratadinu). Jeho biologický poločas je 24–27 hodin. Biologická dostupnost není ovlivněna současně přijímanou potravou. Mimo výrazné selektivní antihistaminové působení se projevuje hlavně četnými účinky protizánětlivými. Vedle blokády receptoru H1 se desloratadin velmi významně uplatňuje při inhibici dalších pochodů alergické reakce. Ve studiích in vitro na buněčných kulturách byl potvrzen inhibiční vliv desloratadinu na aktivitu epiteliálních a endoteliálních buněk, lidských žírných buněk a bazofilních granulocytů dokumentovanou sníženým uvolněním cytokinů, jako jsou interleukiny IL-4, IL-6, IL-8, IL-13, GM-CSF (granulocyte-monocyte colony-stimulating factor), chemokinů a RANTES (regulated on activation, normal T cell expressed and secreted), sníženou produkcí leukotrienu C4, prostaglandinu D2, tryptázy a adhezních molekul ICAM-1 a P-selektinu. In vitro je rovněž prokázán tlumivý vliv desloratadinu na chemotaxi, adhezivitu a tvorbu superoxidových radikálů eozinofilními granulocyty – klíčových buněk pozdní alergické reakce. In vitro se desloratadin projevuje i kompetitivní inhibicí muskarinových receptorů M1 a M2, ale nízká afinita této vazby se in vivo neprojevuje [13, 16, 24, 38].Desloratadin je dostupný ve formě tablet, podává se jedenkrát denně v dávce 5 mg. K dispozici jsou četná generika.
Fexofenadin
Z dalších antihistaminik s imunomodulačním účinkem je v zahraniční již delší dobu k dispozici fexofenadin. Na náš trh se dostal až v posledních letech v generických přípravcích (tablety s obsahem 120 mg a 180 mg účinné látky). U fexofenadinu je doceňován hlavně jeho výraznější účinek na chronické kopřivky neurčené etiologie a výraznější ovlivnění nosní kongesce u chronické rýmy ve srovnání s antihistaminiky druhé generace [15, 20, 23, 31, 34]. Nebyl u něj zaznamenán průnik do CNS ani při vyšším dávkování [36]. S narůstající dávkou narůstá i léčebný efekt, přičemž zvyšování dávek nevede k nežádoucím účinkům. Ve studiích s chronickými kopřivkami byla potvrzena účinnost a bezpečnost čtyřnásobných dávek oproti běžně doporučovaným.
Bilastin
Bilastin je nové nesedativní antihistaminikum s dlouhotrvajícím účinkem, které působí jako selektivní antagonista periferních histaminových receptorů H1. Nemá téměř žádnou afinitu k receptorům H2, H3 nebo H4 ani k muskarinovým či serotoninovým receptorům. Výhodou bilastinu ve srovnání s ostatními antihistaminiky nové generace je to, že není metabolizován v játrech ani v ledvinách (vylučuje se nezměněný – 67 % ve stolici a 33 % v moči) a neinterferuje s jinými léky, nepotencuje vliv alkoholu a nezatěžuje pacienty s poruchou funkce jater či ledvin. Je indikován k symptomatické léčbě alergické rinokonjunktivitidy a urtikarie. Bezpečnost – zvláště vliv na ospalost a únavu – je na úrovni placeba a lepší než u cetirizinu 10 mg [8, 25, 26, 30]. V posledních studiích ([48]; Maurer a Zuberbier též prezentovali na kongresu EAACI, Kodaň 2014) byla potvrzena jeho účinnost a bezpečnost i ve čtyřnásobné dávce (80 mg/den) – na základě mezinárodního doporučení krokové terapie torpidních forem kopřivky – u chronické kontaktní chladové kopřivky. V ČR je k dispozici ve formě tablet o síle 20 mg pro dospělé a děti od 12 let.
Rupatadin
Jedná se o antihistaminikum nové generace s imunomodulačními účinky. Rupatadin je derivátem N-alkylpyridinu ve formě fumarátu. Od přípravků ze stejné generace antihistaminik se odlišuje tím, že vedle inhibice histaminového receptoru má schopnost antagonizovat receptory pro PAF. Aktivace tohoto receptoru je odpovědná za některé projevy pozdní alergické reakce (zvýšení cévní permeability, chemotaxe eozinofilů), což se ve svém důsledku příznivě projeví i v potlačení bronchiální hyperreaktivity, bronchokonstrikce a potlačením zánětlivých změn v kůži u kopřivkových projevů a psoriázy. Vedle antihistaminového a anti-PAF účinku byla u rupatadinu in vitro popsána i celá řada dalších antialergických a protizánětlivých aktivit – např. potlačení uvolňování TNFα (tumor nekrotizující faktor alfa) z mastocytů, snížení produkce leukotrienu C4 (cysteinylový leukotrien) a cytokinů IL-5, IL-6, IL-8, inhibice chemotaxe eozinofilů a neutrofilů a inhibice adhezních molekul CD18, CD11b [49, 50].
Ebastin
Jedná se o antihistaminikum druhé generace – derivát piperazinu, které je v dosud provedených klinických studiích dobře tolerované a neprostupuje hematoencefalickou bariérou. V kontrolovaných klinických studiích u dospělých a adolescentů s alergickou rýmou prokázal perorálně podávaný ebastin v dávce 10 mg jedenkrát denně signifikantně lepší symptomové skóre než placebo a podobný efekt jako 10 mg loratadinu a 10 mg cetirizinu podaných jedenkrát denně. V dávce 20 mg denně má ebastin lepší efekt než uvedená antihistaminika. Účinek byl prokázán i u chronické idiopatické kopřivky [51]. Menší studie prokázaly jeho účinek i u dalších onemocnění, jako je chladová kopřivka, dermografická kopřivka, průduškové astma, nachlazení a reakce po bodnutí komáry. Na našem trhu není v současnosti registrován.
Antihistaminika druhé generace k lokální aplikaci
V současné době je k dispozici i dosti široká škála antihistaminik určených k lokální aplikaci s velmi dobrým účinkem. Jsou dostupná ve formě očn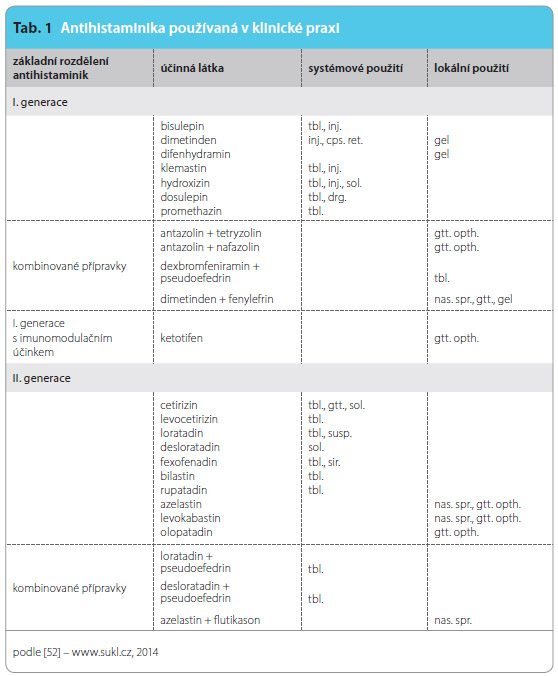 ích kapek, nosních sprejů, gelů či gelů k aplikaci na kůži (tab. 1). K novějším molekulám na našem trhu patří především azelastin a olopatadin.
ích kapek, nosních sprejů, gelů či gelů k aplikaci na kůži (tab. 1). K novějším molekulám na našem trhu patří především azelastin a olopatadin.
Azelastin
Lokálně používané antihistaminikum druhé generace azelastin je derivátem ftalazinonu. In vitro vykazuje rozsáhlé protizánětlivé působení při potlačení aktivity mediátorů zánětu, jakými jsou leukotrieny, kininy nebo PAF. Rovněž byl prokázán vliv na snížení exprese ICAM-1, čímž dochází k redukci migrace zánětových buněk u pacientů s alergickou rýmou [53]. V klinické praxi se azelastin osvědčil jako účinné lokálně působící antihistaminikum s rychlým nástupem účinku ovlivňující nosní symptomy u pacientů se sezonní a vazomotorickou rýmou. Klinické studie prokázaly, že azelastin může ještě zmírnit nosní symptomy u pacientů léčených perorálně podávanými antihistaminiky a zmírňuje symptomy rýmy v kombinaci s intranazálně podaným flutikasonem. V ČR se používá ve formě nosního spreje, očních kapek a do distribuce se připravuje nový kombinovaný přípravek azelastin + flutikason propionát [54].
Olopatadin
Olopatadin je antihistaminikum druhé generace určené k lokální aplikaci jako oční kapky nebo nosní sprej. Má rychlý nástup účinku, je dobře tolerován a je určen k léčbě alergické rinokonjunktivitidy [55]. Vedle účinku na histaminové receptory se uplatňuje i ve stabilizaci žírných buněk, čímž se zvýrazňuje jeho protizánětlivé působení [56]. Podobně jako azelastin může při lokální aplikaci zlepšit symptomové skóre při léčbě perorálními antihistaminiky a rovněž ovlivňuje i nosní kongesci [57]. V kontrolovaných srovnávacích studiích se při léčbě alergické konjunktivitidy potvrzuje velmi podobný efekt olopatadinu, ketotifenu, epinastinu, emedastinu a fluorometholonu [58].
Kombinace antihistaminik s dekongestivem
Často – hlavně u pacientů se zduřením sliznic nosu a paranazálních dutin – se s výhodou používají antihistaminika v kombinaci s dekongescenční látkou. Systémově se podávají loratadin či desloratadin + pseudoefedrin nebo ze starší generace dexbromfeniramin + pseudoefedrin. Ve formě očních kapek je možno použít osvědčené kombinované přípravky antihistaminik první generace s dekongestivy (antazolin + tetryzolin, antazolin + nafazolin).
Závěr
S rozvojem znalostí o mechanismech alergického zánětu dochází postupně i k vývoji nových léků, které se uplatňují svým protizánětlivým účinkem. K těmto lékům se řadí i nové generace antihistaminik. V dřívějších dobách, kdy jsme měli k dispozici pouze antihistaminika první generace, bylo jejich podávání omezeno jen na alergickou rýmu, konjunktivitidu a svědivé projevy kožních alergií a jejich podávání např. u bronchiálního astmatu bylo pro jejich vedlejší účinky (zahušťování hlenu, vysušování sliznic) kontraindikováno. Druhá generace antihistaminik již nemá tyto vedlejší účinky, ponechává si výrazné antihistaminové působení, a navíc získává i další protizánětlivé vlastnosti. Tyto vlastnosti je předurčují k systémové léčbě alergických onemocnění, zvláště s přihlédnutím k nově předkládaným důkazům o tom, že alergie je systémovým onemocněním s klinickou manifestací na orgánu či tkáni, která je nejvíce zasažena působením alergenu nebo která má sníženou rezistenci proti těmto vlivům. Antihistaminika druhé generace (loratadin, cetirizin) jsou již dlouhodobým používáním prověřena jako velmi účinná a bezpečná léčiva alergických onemocnění v kterékoliv lokalizaci (včetně slizničních a kožních alergií, průduškového astmatu či alergií zažívacího traktu). Podobný a ještě lepší léčebný a bezpečnostní profil mají i novější molekuly (desloratadin, levocetirizin, fexofenadin, bilastin, rupatadin), které jsou v praxi stále oblíbenější a používanější.
Antihistaminika nové generace v kombinaci s ostatními antialergickými léčivy a opatřeními by měla být široce využívána [59] nejen specialisty – alergology, dermatology či otorinolaryngology, ale hlavně praktickými lékaři v první linii kontaktu s alergickým pacientem, protože včasná a dostatečně dlouhá terapie může zabránit rozvoji závažnějších komplikací.
Seznam použité literatury
- [1] Church MK, Church DS. Pharmacology of antihistamines. Indian J Dermatol 2013; 58: 219–224.
- [2] Leurs R, Church MK, Taglialatela M. H-1 antihistamines: Inverse agonism, antiinflammatory actions and cardiac effects. Clin Exp Allergy 2002; 32: 489–498.
- [3] Wieland K, Laak AM, Smit MJ, et al. Mutational analysis of the antagonist binding site of the histamine H(1) receptor. J Biol Chem 1999; 274: 29 994–30 000.
- [4] Grant SM, Goa KL, Fitton A, Sorkin EM. Ketotifen. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic use in asthma and allergic disorders. Drugs 1990; 40: 412–448.
- [5] Holgate ST, Canonica GW, Simons FE, et al. Consensus Group on New-Generation Antihistamines (CONGA): present status and recommendations. Clin Exp Allergy 2003; 33: 1305–1324.
- [6] Bystroň J. Antihistaminika známá a neznámá. Causa subita 2003; 6: 168–170.
- [7] Bystroň J. Antihistaminika – současný přehled přípravků používaných v klinické praxi. Practicus 2004; 3: 38–42.
- [8] Čáp P, Doležal T. Bilastin. Farmakoterapie 2012; 8: 49–53.
- [9] De Vos C, Mitchev K, Pinelli ME, et al. Non-interventional study comparing treatment satisfaction in patients treated with antihistamines. Clin Drug Investig 2008; 28: 221–230.
- [10] Doležal M. Přehled H1-antihistaminik určených nejen pro sezónní pylovou alergii. Prakt Lékárenství 2012: 8: 55–61.
- [11] Doležal T, Vnoučková K. Levocetirizinum. Remedia 2004; 14: 226–232.
- [12] Petrů V. Antihistaminika – důležitá součást léčby alergií. Practicus 2006; 5: 98–100.
- [13] Rybníček O. Možnosti použití desloratadinu u dětí. Remedia 2011; 21: 73–75.
- [14] Seberová E. Antihistaminika v léčbě alergických chorob. Remedia 2003; 13: 49–56.
- [15] Molimard M, Diquet B, Benedetti MS. Comparison of pharmacocinetics and metabolism of desloratadine, fexofenadine, levocetirizine, and mizolastine in humans. Fundam Clin Pharmacol 2004; 18: 399–411.
- [16] Denham KJ, Boutsiouki P, Clough GF, Church MK. Comparison of the effects of desloratadine and levocetirizine on histamin-induced wheel, flare and itch in human skin. Inflam Res 2003; 52: 424–427.
- [17] Purohit A, Melac M, Pauli G, Frossard N. Comparative activity of cetirizine and desloratadine on histamin--induced wheel and flare response during 24 hours. Ann Allergy Astma Immunol 2004; 92: 635–640.
- [18] Simons FE, Simons KJ. Levocetirizine: Pharmaco kinetics and pharmacodynamics in children age 6 to 11 years. J Allergy Clin Immunol 2005; 116: 355–361.
- [19] Simons KJ, Benedetti MS, Simons FE, et al. Relevance of H1-receptor occupancy to H1 antihistamine dosing in children. J Allergy Clin Immunol 2007; 119: 1551–1554.
- [20] Grant JA, Riethuisen JM, Moulaert B, DeVos C. A double-blind, randomised, single-doses crossover comparison of levocetirizine with ebastine, fexofenadine, loratadine, mizolastine, and placebo. Suppression of histamin-induced wheel and flare response during 24 hours in healthy male subjects. Ann Allergy Astma Immunol 2002; 88: 190–197.
- [21] Purohit A, Melac M, Pauli G, Frossard N. Twenty-four-hour activity and consistency of activity of levocetirizine and desloratadine in the skin. Br J Clin Pharmacol 2003; 56: 388–394.
- [22] Purohit A, Duvernelle C, Melac M, et al. Twenty four hours activity of cetirizine and fexofenadine in the skin. Ann Allergy Astma Immunol 2001; 86: 387–392.
- [23] Miura M, Uno T. Clinical pharmacokinetics and pharmacodynamics of desloratadin, fexofenadine and levocetirizine. A comparative review. Expert Opin Drug Metab Toxicol 2010; 6: 69–74.
- [24] Devillier P, Roche N, Faisy C. Clinical pharmacokinetics and pharmacodynamics of desloratadin, fexofenadine and levocetirizine. A comparative review. Clin Pharmacokinet 2008, 47: 2170–2230.
- [25] Sologuren A, Lucero ML, Valiente R, et al. Human mass balance with (14C)-bilastine folowing oral administration to healthy volunteers (absNoTP85). Basic Clin Pharmacol Toxicol 2009; 105 (suppl.1): 106–107.
- [26] Lucero ML, Gonzalo A, Mumford R, et al. An overview of bilastine metabolism during preclinical investigations. Drug Chem Toxicol 2012; 35 (suppl 1): 18–24.
- [27] Schinkel AH. P-Glycoprotein, a gatekeeper in the blood-brain barier. Adv Drug Deliv Rev 1999; 36: 179–194.
- [28] Chen C, Hanson E, Watson JW, Lee JS. P-Glycoprotein limits the brain penetration of nonsedating but not sedating H1-antagonists. Drug Metab Dos 2003; 31: 312–318.
- [29] Tashiro M, Sakurada Y, Iwabuchi K, et al. Central effects of fexofenadine and cetirizine: Measurement of psychomotor performance, subjective sleepiness, and brain histamine H1-receptor occupancy using 11C-doxepin positron emission tomography. J Clin Pharmacol 2004; 44: 890–900.
- [30] Mumford R, Allan L, Hoey R, et al. The disposition, metabolism and elimination in rats of bilastine, a potent selective H1 receptor antagonist. Drug Metab Rev 2007; 39 (suppl 1): 200–201.
- [31] Hindmarch I, Shamsi Z, Kimber S. An evaluation of the effects of high-dose fexofenadine on the central nervous system: A double-blind, placebo-controlled study in healthy volunteers. Clin Exp Allerg 2002; 32: 133–139.
- [32] Tashiro M, Kato M, Miyake M, et al. Dose dependency of brain histamine H (1) receptor occupancy following oral administration of cetirizine hydrochloride measured using PET with [11C] doxepin. Hum Psychopharmacol 2009; 24: 540–548.
- [33] Meltzer EO, Weiler JM, Widlitz MD. Comparative outdoor study of the efficacy, onset and duration of action, and safety of cetirizine, loratadine, and placebo for seasonal allergic rhinitis. J Allergy Clin Immunol 1996; 97: 617–626.
- [34] Howarth PH, Stern MA, Roi L, et al. Double-blind, placebo-controlled study comparing the efficacy and safety of fexofenadine hydrochloride (120 and 180 mg once daily) and cetirizine in seasonal allergic rhinitis. J Allergy Clin Immunol 1999; 104: 927–933.
- [35] Salmun LM, Gates D, Scharf M, et al. Loratadine versus cetirizine: Assessment of somnolence and motivation during the workday. Clin Ther 2000; 22: 573–582.
- [36] Mann RD, Pearce GL, Dunn N, Shakir S. Sedation with “non-sedating” antihistamines: Four prescription-event monitoring studies in general practice. BMJ 2000; 320: 1184–1186.
- [37] De Vos C, Mitchev K, Pinelli ME, et al. Non-interventional study comparing treatment satisfaction in patients treated with antihistamines. Clin Drug Investig 2008; 28: 221–230.
- [38] Henz BM. The pharmacologic profile of desloratadine. Allergy 2001; 56: 7–13.
- [39] Woosley RL. Cardiac actions of antihistamines. Annu Rev Pharmacol Toxicol 1996; 36: 233–252.
- [40] Ten Eick AP, Blumer JL, Reed MD. Safety of antihistamines in children. Drug Saf 2001; 24: 119–147. Review.
- [41] DuBuske LM. Second-generation antihistamines: The risk of ventricular arrhythmias. Clin Ther 1999; 21: 281–295.
- [42] Hulhoven R, Rosillon D, Letieche M, et al. Levocetirizine does not prolong the QT/QTc interval in healthy subjects: Results from a thorough QT study. Eur J Clin Pharmacol 2007; 63: 1011–1017.
- [43] Simons FE, Prenner BM, Finn A Jr, Desloratadine Study Group. Efficacy and safety of desloratadine in the treatment of perennial allergic rhinitis. J Allergy Clin Immunol 2003; 111: 617–622.
- [44] Norman P, et al. Desloratadine: A preclinical and clinical overwiew. Drugs Today 2001; 37: 215–227.
- [45] Campoli-Richards DM, Buckley MM, Fitton A. Cetirizine. A review of its pharmacological properties and clinical potential in allergic rhinitis, pollen-induced asthma, and chronic urticaria. Drugs 1990; 40: 762–781.
- [46] Michel L, Jean Louis F, Dubertret L. Pharmacological study of levocetirizine in IgE-dependent hypersensitivity cutaneous reaction in grass pollen allergic volunteers. Demonstration of mediator release and eosinophil recruitment modulation by levocetirizine. Allergy 2001; 56 (Suppl. 68): 150–151.
- [47] Van Cauwenberge PB. New Data on the Safety of Loratadine. Drug Investigation 1992; 4: 283–291.
- [48] Krause K, Spohr A, Zuberbier T, et al. Up-dosing with bilastine results in improved effectiveness in cold contact urticaria. Allergy 2013; 68: 921–928.
- [49] Mullol J, Bousquet J. Rupatadine in Allergic Rhinitisand Chronic Urticaria. Allergy 2008; 63 (suppl. 87): 5–28.
- [50] Seberová E. Rupatadin. Remedia 2009; 19: 69–72.
- [51] Sastre J. Ebastin in allergic rhinitis and chronic idiopatic urticaria. Allergy 2008; 63 (Suppl. 89): 1–20.
- [52] Databáze léků www.sukl.cz (navštíveno 20. 6. 2014)
- [53] Berger WE, Shah S, Lieberman P, et al. Long-term, randomised safety study of MP 29-02 (a novel intranasal formulation of azelastine hydrochloride and fluticasone propionate in an advanced delivery system) in subjects with chronic rhinitis. J Allergy Clin Immunol Pract 2014; 2: 179–185.
- [54] Bernstein JA. Azelastine hydrochloride: a review of pharmacology. Curr Med Res Opin 2007; 23: 2441–2252.
- [55] Rosenwasser LJ, O´Brien T, Weyne J. Mast cell stabilization and anti-histamine effects of olopatadine ophthalmic solution: review of pre-clinical and clinical research. Curr Med Res Opin 2005; 21: 1377–1387.
- [56] Leonbardi A, Quintieri L. Olopatadine: a drug for allergic conjunctivitis targeting the mast cell. Expert Opin Pharmacother 2010; 11: 969–981.
- [57] Kaliner MA. Azelastine and olopatadine in the treatment of allergic rhinitis. Ann Allergy Astma Immunol 2009; 103: 373–380.
- [58] Borazan M, Karalezli A, Akova YA, et al. Efficacy of olopatadine HCl 0,1%, ketotifen fumarate 0,025%, epinastine HCl 0,05%, emedastine 0,05% and fluorometholone acetate 0,1% ophthalmic solutions for seasonal allergic conjunctivitis: a placebo-controlled enviromental trial. Acta Ophthalmol 2009; 87: 549–554.
- [59] Brado F, Scilfi F, Ferrando M, Canonica GW. New therapies for allergic rhinitis. Curr Allergy Astma Rep 2014; 14: 422.