Antitrombotická léčba je indikována v řadě situací spojených s protrombotickým stavem, tj. s aktivací primární či sekundární hemostázy. S aktivací destičkové hemostázy se setkáváme při postižení tepenného řečiště (nejčastěji na aterosklerotickém podkladě – při nestabilním plátu), při endoteliální dysfunkci (nestabilní céva) či při generalizované aktivaci destiček, například při zánětlivé afekci či při některých polymorfismech destičkových receptorů (u nestabilního pacienta). Naopak koagulační kaskáda (tedy vytvoření fibrinové sítě) je primárně aktivována při oblenění průtoku, jako je tomu například u flebotrombóz či v oušku síní při fibrilaci, po implantaci cizorodých materiálů do cirkulace (například chlopenních protéz) či u trombofilií. U tepenných uzávěrů dochází k tvorbě fibrinové zátky až sekundárně. Jak je vidět, antitrombotika jsou indikována v řadě situací, v ČR jsou podávána masově, nejméně u jednoho milionu obyvatel. Podle údajů ÚZIS je dispenzarizováno cca 750 000 osob s ICHS, 280 000 osob po cévní mozkové příhodě, 100 000 osob s ischemickou chorobou končetin a 120 000 osob s fibrilací síní. Na základě metaanalýz antitrombotických studií zahrnujících více než 200 000 probandů se pokles mortality či výskytu kardiovaskulárních chorob pohyboval kolem 20–25 % [1].
Shrneme-li, pak není pochyb, že antit
rombotická léčba je široce užívána a je vysoce účinná.
Každá mince však má však vedle líce i rub. Tím je při léčbě antitrombotiky riziko krvácení. Z metaanalýz vyplývá, že při užívání protidestičkových léků se výskyt krvácení do zažívacího traktu pohybuje pod hranicí 1 % (0,3–0,6/100 léčených ročně při podávání kyseliny acetylsalicylové a 0,2
–
0,4/100 léčených ročně při podávání klopidogrelu), četnost výskytu krvácení do mozku je o řád nižší [2, 3]. Krvácivý potenciál antikoagulancií podávaných
lege artis
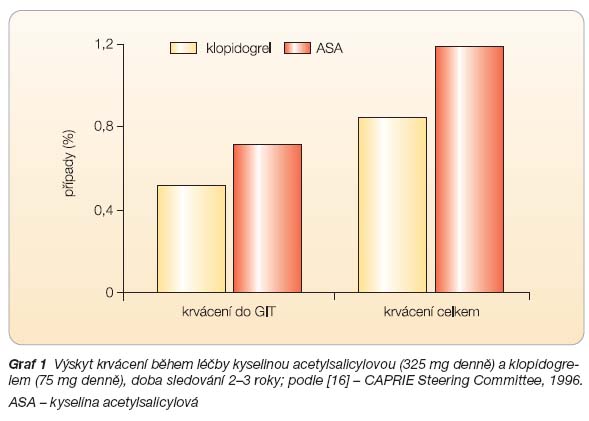
se pohybuje jen o něco málo výše: warfarin při udržování INR mezi 2–3 zvyšuje riziko významného krvácení asi o třetinu v porovnání s protidestičkovými léky. Vzestup hodnoty INR o každou jednotku však výskyt krvácení zdvojnásobuje [4, 5]. Pro řadu z nás může být překvapením srovnatelný výskyt krvácení při aplikaci různých antitrombotik. Mýtus, že krvácení do zažívacího traktu je specifické pro kyselinu acetylsalicylovou (ASA), byl souhrnnými analýzami vyvrácen [2]. V jediné velké „head to head" studii srovnávající ASA s klopidogrelem (CAPRIE) byl výskyt jakéhokoli krvácení i krvácení do zažívacího traktu srovnatelný (
graf 1
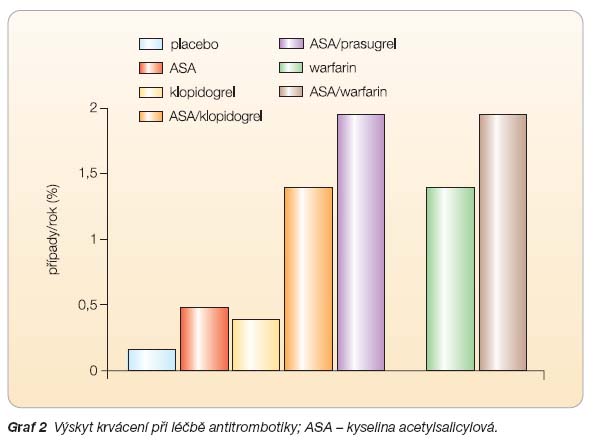
). Duální protidestičková léčba (ASA a klopidogrel) či kombinace ASA s warfarinem pak zvyšuje riziko významného krvácení na 1,5–2 % ročně (
graf 2
). Z uvedeného roz
boru je zřejmé, že riziko krvácení je sku
tečně reálné a zákonitě se s ním musíme dříve či později setkat. V praxi to pak zna
mená, že nezbývá než vždy zvážit na jed
né straně přínos (tedy zamezení trombotické příhodě) a na straně druhé riziko (tedy
krvá
cení). Kličkujeme tak mezi Scyllou a Charybdou.
U nemocného s anamnézou krvácení ať již při antitrombotické léčbě či bez ní je riziko krvácení významně vyšší. Je však správné z tohoto důvodu protidestičkovou či antikoagulační léčbu neindikovat či ji ukončit? Závěry velké analýzy sledující riziko ukončení léčby ASA ukazují, že rozhodně ne. Systematický rozbor studií zahrnující data více než 50 000 nemocných indikovaných k léčbě ASA z důvodu ICHS ukázal, že přerušení léčby zvýšilo riziko závažné kardiovaskulární příhody trojnásobně, nemocní po implantaci stentu, s akutními koronárními příhodami či po implantaci aorto-koronárního bypassu byli ohroženi významně více nežli nemocní s chronickými formami ICHS [6].
Jak tedy postupovat, chceme-li zajistit nemocného antitrombotikem, nechceme-li však nadměrně zvýšit riziko? Strategie
je jiná v profylaxi recidivy krvácení do zažívacího trak
tu a jiná po mozkové příhodě na podkladě hemoragie. V etiopatogenezi krvácení v oblasti gastroduodenální má zásadní význam přítomnost
Helicobacter pylori
. Tato nejčastější specificky lidská infekce – v ČR je infikována více než polovina populace – zvyšuje riziko krvácení při léčbě ASA trojnásobně až šestinásobně. Eradikace
Helicobacter pylori
pak, sama
o sobě, sní
ží riziko recidivy několikanásob
ně. Optimálním způsobem, jak tuto infekci vymýtit, je podávání kombinace inhibitoru protonové pumpy, tj. omeprazolu, event. pantoprazolu, lansoprazolu či esomeprazolu, s dvojkombinací antibiotik či chemoterapeutik – klarithromycinu, amoxicilinu či
metronida
zo
lu – po dobu 10–28 dnů. Vzhledem k rizi
ku recidivy infekce je výhodné
pokračovat v léčbě inhibitorem protono
vé
pumpy dlouhodobě. Takováto strategie sníží riziko recidivy krvácení do zažívacího traktu pod hranici 1–2 % ročně, v naprosté
většině studií nebyla zaznamenána recidi
va
krvácení [7–10]. Srovnání s dříve uvádě
ným alternativním postupem – tj. s převedením z léčby ASA na léčbu klopidogrelem – ukázalo výrazně nižší účinnost druhého léčebného postupu. Během čtyř let sledování se ve skupině nemocných léčených po eradikaci esomeprazolem neobjevilo při podávání ASA krvácení ani jedenkrát, naproti tomu převedení na léčbu klopidogrelem (opět po eradikační terapii) bylo komplikováno krvácením téměř ve 14 % [7]. Také farmako
ekonomický pohled svědčí pro kombina
ci ASA s omeprazolem. Roční náklady na tuto léčbu (včetně eradikace) jsou kolem 2000 Kč, naproti tomu léčba klopidogrelem nás stojí téměř 16 000 Kč ročně.
Z hlediska dalšího snížení rizika krvácení by mohla být zajímavá též kombinace omeprazolu s klopidogrelem. Máme k dispozici jednu studii, kde byla porovnávána kombinace ASA/omeprazol s kombinací klopidogrel/omeprazol u nemocných ve stresu, tentokrát ve stresových podmínkách daných operací. Výskyt krvácení se
v obou skupinách nelišil: 1,1 % při podá
vání kombinace s ASA a 0,9 % při podávání kombinace s klopidogrelem [11]. Jak je patrné, léčba touto kombinací nezvýšila významně bezpečnost, došlo jen k podstatnému zvýšení nákladů.
Komedikace ASA s inhibitory protonové pumpy s sebou nese riziko lékové interakce. Je známo, že ASA se resorbuje pou
ze v kyselém prostředí. Inhibice sekrece kyseliny chlorovodíkové by proto mohla s resorpcí interferovat. Naštěstí potlačení sekrece kyseliny v žaludku není nikdy úplné a zejména podání ASA několik desítek minut před požitím omeprazolu či jiného inhibitoru protonové pumpy umožní dostatečné vstřebání. Nepříznivou interakcí se může projevit
rovněž podávání kombinace klopidogrelu s omeprazolem. Klopidogrel je proléčivo, které musí být bioaktivováno na účinný metabolit. Omeprazol bohužel tuto konverzi inhibuje [12]. Proto, budeme-li kombinovat klopidogrel s inhibitorem pro
tonové
pumpy, zvolíme jiného zástupce, například pantoprazol či esomeprazol, které nejsou inhibitory izoenzymů systému cytochromu P-450.
Shrneme-li, pak strategie snížení recidivy krvácení do zažívacího traktu při antitrombotické léčbě je založena na optimální
dávce (75–100 mg ASA denně, 75 mg
klopidogrelu denně, při podávání warfari
nu
INR v rozmezí 2–3), na vyloučení kome
di
kace s nesteroidními antiflogistiky
a vy
lou
čení kouření, na eradikaci
Helico
bacter
pylori
(stačí léčit jen 7 nemocných k zame
zení jedné recidivy krvácení) a na dlouho
dobé profylaxi inhibitory protonové pum
py. Naopak převedení na léčbu jiným antitrombotikem racionální není.
Při snižování rizika krvácení intrakrani
álního máme daleko méně možností. V tomto případě není k dispozici žádná specifická léčba. Proto se v prvé řadě snažíme optimalizovat krevní tlak. Je známo, že riziko hemoragického iktu klesá o 50 % při snížení systolického tlaku o 9 mm Hg
a pokles o 12 mm Hg sníží riziko dokon
ce o 76 % [13]. Nedílnou součástí racionálního přístupu k nemocnému je důsledné dodržování kontrol INR při léčbě warfarinem. Je nutno zabránit nekontrolovanému předávkování antikoagulanciem.
K potřebě pečlivého monitorování léčby warfarinem přispívá i fakt, že warfarin interaguje s řadou léčiv (včetně fytofarmak) a s potravinami bohatými na vitamin K [14, 15]. Látky, které ovlivňují krevní srážlivost (antiagregancia, nesteroidní antiflogistika), interagují s warfarinem na farmakodyna
mickém podkladě – zvýšené riziko krvá
cení se zde neprojeví zvýšením INR. Farmakokinetické lékové interakce jsou jednou z nejčastějších příčin předávkování warfarinem. Je proto potřeba mít alespoň základní povědomí o mechanismu jejich vzniku. Warfarin je metabolizován prostřednictvím cytochromu P-450 – izoenzymem CYP2C9 (účinnější S-enantiomer) a izoenzymy CYP3A4, CYP1A2 (R-enantiomer). Izoenzym CYP2C9 (ev. jeho genetický polymorfismus) je zodpovědný za řadu nebezpečných lékových interakcí, významně se uplatňují ale i další dva zmíněné izoenzymy. Komedikace s induktory
příslušných cytochromů (barbituráty, kar
bamazepin, rifampicin) snižuje efekt warfarinu, naopak při ukončení jejich podávání musíme počítat se vzestupem účinku war
farinu a dávku redukovat. Opačně, enzy
matické inhibitory (amiodaron, propafenon, omeprazol, fluvastatin, nesteroidní antiflogistika, antidepresiva SSRI, cefalosporiny vyšších generací, chinolony, makrolidová antibiotika, azolová antimykotika, metronidazol) nabídku warfarinu zvyšují, proto na počátku komedikace musíme dávku warfarinu redukovat a po ukončení léčby těmito farmaky často opět zvýšit na původní hodnotu. Pryskyřice (kolestyramin) snižují absorpci warfarinu, hrozí pak poddávkování. Rovněž přísun vitaminu K v potravě musíme hlídat a nemocnému připomínat nutnost konzumace srovnatelných dávek
zeleniny v průběhu léčby. Léčiva ovlivňují
cí střevní mikroflóru (antibiotika) jsou rovněž spojována se změnou odpovědi na terapii warfarinem.
Dodržováním uvedených zásad přispějeme ke zkvalitnění péče o naše nemocné, zlepšíme jejich prognózu a snížíme riziko závažných komplikací.

