Atrofie mozku u roztroušené sklerózy a možnosti medikamentózního ovlivnění
Roztroušená skleróza je autoimunitní zánětlivé, demyelinizační a neurodegenerativní onemocnění, které je způsobeno patologickou imunitní reakcí, jež je namířena proti nervovému systému, mozku a míše. Postupně přibývá znalostí o procesech a mechanismech, které vedou k poškození až zániku neuroaxonálního cytoskeletu. V klinickém průběhu nejdříve dominují zánětlivé změny a demyelinizace, ale existují důkazy, že i v časném období, a zvláště pak v progresivním stadiu se vyvíjí často plíživý, ale setrvalý pokles funkcí bez reakce na léčbu. S tímto stavem korelují progredující neurodegenerativní změny a rostoucí ztráta objemu mozku a míchy. Důsledkem je atrofie mozku a míchy. Intenzivně se hledá lék, který by nejen zpomalil a oddálil progresi nemoci, ale umožnil, aby došlo k plné klinické, imunologické i radiologické stabilitě.
Úvod
Ztráta mozkového objemu jako součást roztroušené sklerózy (RS) je popsána v časných nálezech klasických patologů, neurofyziologů a neurologů. V roce 1838 publikoval poznatky o atrofii u RS Robert Carswell v Patologickém atlase, fokální atrofii mozku popsal Eduard Rindfleisch v roce 1863 [1] a ztráty myelinu u RS zachytili Edme Felix, Alfred Vulpian a J. M. Charcot v roce 1860. Ačkoliv je zřejmé, že atrofie mozku u RS je výsledkem nevratné ztráty mozkových elementů, základní mechanismy jsou rozdílné a komplikované [1].
![Obr. 1 Progrese atrofie mozku v čase podle fáze onemocnění; podle [7] – Simon, 2006.](https://www.remedia.cz/photo-a-29484---.jpg) V etiopatogenezi, která není známa v celém rozsahu, sehrává klíčovou roli autoimunitní imunopatologická aktivita charakterizovaná jako zhroucení imunitní tolerance závislé na genetické dispozici, spouštěcích faktorech zevního prostředí a na poruše imunitní regulace [2]. Pro RS jsou z patologického hlediska charakteristické autoimunitní zánět a demyelinizace, ale s progresí nemoci a s klinickým průběhem jsou spojeny a lépe korelují spíše neložiskové, difuzní změny v mozku a míše, především ztráta axonů a porucha funkce mitochondrií, než celkový rozsah lézí [3]. Lze srovnávat průměrnou redukci objemu mozku u zdravých jedinců, kde je průměr úbytku mozkové tkáně 0,1–0,4 % za rok [4], u časné fáze RS představuje asi 0,7 % [6, 7] a u relaps-remitentní RS (RR-RS) 0,6–1,35 % za rok [1], obr. 1. Mozková atrofie u RS je klinicky relevantní komponentou progrese nemoci, a proto se stupňuje snaha o lepší pochopení molekulárních mechanismů, s čímž je také spojen vývoj nových a účinnějších léčiv.
V etiopatogenezi, která není známa v celém rozsahu, sehrává klíčovou roli autoimunitní imunopatologická aktivita charakterizovaná jako zhroucení imunitní tolerance závislé na genetické dispozici, spouštěcích faktorech zevního prostředí a na poruše imunitní regulace [2]. Pro RS jsou z patologického hlediska charakteristické autoimunitní zánět a demyelinizace, ale s progresí nemoci a s klinickým průběhem jsou spojeny a lépe korelují spíše neložiskové, difuzní změny v mozku a míše, především ztráta axonů a porucha funkce mitochondrií, než celkový rozsah lézí [3]. Lze srovnávat průměrnou redukci objemu mozku u zdravých jedinců, kde je průměr úbytku mozkové tkáně 0,1–0,4 % za rok [4], u časné fáze RS představuje asi 0,7 % [6, 7] a u relaps-remitentní RS (RR-RS) 0,6–1,35 % za rok [1], obr. 1. Mozková atrofie u RS je klinicky relevantní komponentou progrese nemoci, a proto se stupňuje snaha o lepší pochopení molekulárních mechanismů, s čímž je také spojen vývoj nových a účinnějších léčiv.
Neurodegenerace
Neurodegenerace u RS jako proces je považována za významnou příčinu postupného zhoršování neurologických funkcí, které je zřejmé u většiny pacientů s RS především v progresivním stadiu nemoci [8]. Důsledkem tohoto procesu je ztráta objemu mozku a míchy. Není stále objasněno, zda k degeneraci nervového systému při RS nepřispívá také nezávislý neurodegenerativní proces [3]. Léze vznikající v průběhu RS zahrnují poškození hematoencefalické bariéry, mnohočetný zánět, demyelinizaci, ztrátu oligodendrocytů, reaktivní gliózu a axonální degeneraci [9]. Zatímco imunitně vázaná destrukce centrálního myelinu a oligodendrocytů je považována u RS za primární patologii, je prokázáno, že progresivní ztráta axonů je hlavní příčinou neurologického postižení [10].
Nervové struktury jsou vysoce závislé na energii ve formě adenosintrifosfátu (ATP), který vzniká především v mitochondriích. Tato důležitá organela hraje roli také v homeostáze kalcia, které se účastní procesu axonální degenerace. Z výzkumů mitochondriálních funkcí (in vivo, in vitro) lze vyvodit, že mitochondriální parametry včetně dynamiky a velikosti mitochondrií v axonu mají zásadní vliv na axonální integritu a funkci. Integrita myelinu, funkce iontových kanálů (sodíkové, draslíkové a vápníkové) a iontových pump ( Na+/K+, ATPáza a Na+/Ca2+) stejně jako mitochondrie jsou nezbytné pro rychlé a efektivní nervové vedení a jejich interakce je důležitá a závisí na stavu myelinu [8, 11]. Rozdílné mitochondriální defekty způsobí, že neurony jsou zranitelnější zvýšeným sodíkovým a vápníkovým influxem a v demyelinizačních lézích se zvyšuje množství degenerovaných axonů. Mitochondriální změny v neuronech probíhají nezávisle na zánětu, a to zejména v ložiscích, která se svým charakterem podobají hypoxickému postižení. Dochází zde především k degeneraci oligodendrocytů [12]. Porozumět těmto pochodům na buněčné i molekulární úrovni je nutné pro rozvoj nových terapeutických strategií [13]. Také v míše probíhají neurodegenerativní pochody. Lze předpokládat, že podstata procesu je podobná.
Atrofie šedé hmoty
Histopatologické studie ukazují kromě postižení bílé hmoty také výraznou patologii v šedé mozkové hmotě – především v mozkové kůře, thalamu a dalších částech mozku souhrnně nazvaných hluboká šedá hmota (nucleus caudatus, putamen, pallidum, claustrum, amygdala, hypothalamus a substantia nigra). V těchto strukturách nastávají podobné změny jako v bílé hmotě, ale s převahou aktivované mikroglie a s výskytem makrofágů obléhajících myelin. Aktivace mikroglie a makrofágů vede k uvolnění toxických působků, jež indukují apoptózu a ingesci oligodendrocytů, které již apoptóze podlehly [14]. Ve srovnání s postižením bílé hmoty je zde menší rozsah axonálních lézí [15].
Další původní výzkumy se zabývají nálezy depozit železa (Fe). Ty jsou dokumentovány speciálními metodikami magnetické rezonance (MR) a jsou podloženy histopatologicky. Depozita Fe jsou nacházena především v hluboké šedé hmotě od časných fází RS, nejvíce v progresivních fázích RS. Předpokládá se, že zvyšující se množství Fe a jeho reaktivních kyslíkových sloučenin může způsobit poškození mozkové tkáně a předchází atrofii. Depozita Fe mohou vznikat z poškozeného myelinu, oligodendrocytů, z makrofágů a jako produkt drobných hemoragií. Při vyšetření MR s využitím speciálních metodik jsou zřejmé ložiskové a difuzní atrofie. Jde o směs neuronálních ztrát, prokazatelné ztenčení mozkové kůry a patologie v „normálně vypadající šedé hmotě“. Tyto změny se objevují u všech fenotypů RS a atrofie může být přítomna již v časných stadiích nemoci.
Atrofie šedé hmoty narůstá v průběhu nemoci zvláště v progresivní fázi a kortikální léze mohou předcházet výskytu degenerativních změn v bílé hmotě [16]. Histopatologická a imunologická charakteristika těchto postižení je odlišná. Míra zánětlivé infiltrace je variabilní a liší se při postižení šedé a bílé hmoty. Interpretace ztráty neuronů v souvislosti s meningeálním zánětem není jednoznačná [17]. Magliozzi demonstruje u progresivní RS kortikální neurodegeneraci a generalizovanou ztrátu buněk šedé hmoty v asociaci s meningeálním zánětem a formací lymfocytů, což podporuje hypotézu, že cytotoxiny, které pronikají z meningeálního kompartmentu, působí poškození mozkové kůry [18]. Klinicky jsou změny v šedé hmotě spojeny s kognitivním deficitem a neurologickým postižením.
Význam, klinická závažnost atrofie mozku a její kvantifikace
Ztráta objemu mozku se dotýká bílé i šedé hmoty a může být velmi přesně diferencována a kvantifikována. Jsou vypracovány účinné MR techniky a analytické metody, které pomáhají zvýšit naše znalosti o patofyziologii RS a podrobně dokumentují změny objemu jednotlivých částí mozku. V posledních letech se výzkumy zaměřují na úbytek šedé hmoty i z toho důvodu, že histopatologickými studiemi byl doložen mnohem častější výskyt kortikálních lézí, než se předpokládalo. Spektroskopické studie ukazují, že koncentrace kyseliny N-acetylaspartové, která je biomarkerem neuronální integrity, klesá v šedé hmotě mozkové kůry [19]. Závislost mezi atrofií šedé a bílé hmoty a klinickým obrazem u časné RR-RS byla sledována ve studii ASA (Avonex-Steroid-Azathioprine). Ze souboru podrobných výsledků MR vyšetření vyplývá, že atrofie šedé hmoty je spolehlivější známkou progrese neurologického postižení než atrofie bílé hmoty. Měření regionální atrofie může přinést další informace o rozvoji neurologického obrazu. Výskyt relapsů nejen zhoršuje nemocnému kvalitu života, ale současně urychluje progresi mozkové atrofie [20].
S novými poznatky a technickým pokrokem je možno detailně zkoumat neurodegenerativní změny, které vedou k mozkové atrofii, a monitorovat je v průběhu nemoci. Nedílnou součástí těchto procesů je vyšetření MR, které dokáže monitorovat průběh RS, rozpoznat a kvantifikovat změny v jednotlivých částech mozku. V klinických studiích je MR rozhodující ve sledování účinnosti a možných nežádoucích účinků léčiv. Orientaci ve velkém množství technik a vyšetřovacích postupů pak přináší monitorovací protokol, který umožňuje rychlou reakci na změny a individualizaci terapie [21, 22]. Porozumění patologickým pochodům v myelinu, pochopení dynamiky mitochondrií a metabolismu axonu může pomoci identifikovat molekulární cíle pro terapii u RS [8].
Farmakologické možnosti ovlivnění progrese atrofie mozku
Cílem nových léčiv není jen zpomalit a oddálit progresi RS, ale dosáhnout úplného vymizení nemoci. V současnosti se v léčbě RR-RS využívá řada léčiv s protizánětlivým, imunosupresivním a imunomodulačním účinkem. Jde o léky modifikující průběh onemocnění (disease-modifying drugs – DMD), které řadíme do kategorie léků první volby. Léky jsou ověřené nejen ve studiích, ale i v běžné neurologické praxi, jsou relativně bezpečné a jsou dobře tolerovány. Jejich účinek je významný a potřebný, ale léčiva ovlivňují především změny zánětlivé, snižují průměrný počet relapsů, jejich intenzitu a zpomalují progresi nemoci [2].
Je to významný úspěch, ale průběh primárně progresivní nebo sekundárně progresivní formy RS není touto terapií ovlivněn. Přestože komplexní souvislosti mezi zánětem a neuroaxonálním postižením s postupujícími neurodegenerativními změnami nejsou doposud zcela objasněny, je snaha nalézt léčbu s kombinovaným účinkem – protizánětlivým, imunomodulačním a neuroprotektivním [3]. V posledních letech jsou vyvíjena nová léčiva, jejichž neuroprotektivní účinek byl potvrzen v klinických studiích [23]. Některá z nich jsou již zavedena v klinické praxi a jsou získávány nové klinické zkušenosti o jejich účinnosti, bezpečnosti a nežádoucích reakcích.
dat o vlivu léčby DMD na neurodegenerativní proces vychází z velkých souborů studií a údaje jsou doloženy longitudinálním sle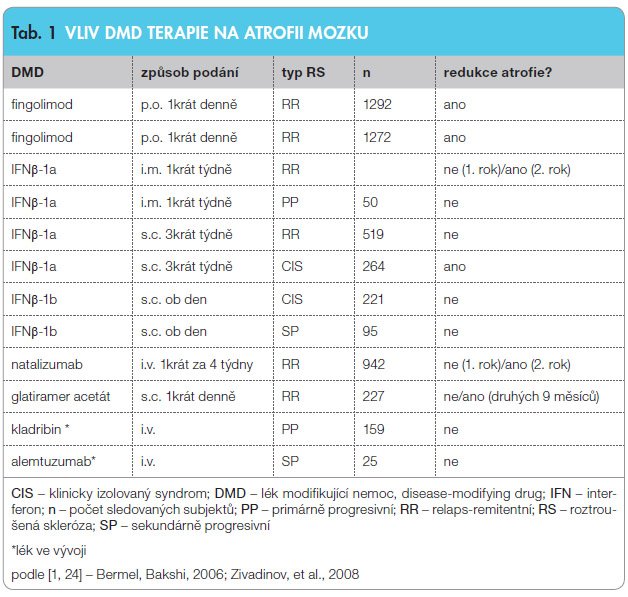 dováním. Protokol studií dává do souvislostí MR nálezy s klinickými vyšetřeními. Dosažené výsledky jsou srovnávány v interim analýzách. Hodnocení probíhá pod dohledem specialistů a publikované výsledky jsou uplatňovány v praxi. Prokázaná účinnost DMD první a druhé linie na atrofii mozku je zachycena v tab. 1 [1, 24]. Velké klinické studie sledovaly vývoj mozkové atrofie většinou jako sekundární cíl. Primárním cílem bylo obvykle sledovat průměrný počet relapsů za rok, počet nových aktivních lézí, vývoj invalidity, sekundárním pak rozvoj redukce objemu mozku. Takto jsou získána dlouhodobá data z velkých souborů s průkazem signifikantní redukce ztráty mozkového objemu. Sledování a sběr dat v těchto studiích nadále probíhají. Jsou známa data týkající se fingolimodu a natalizumabu, další léčiva jsou testována. U léků první linie byl zkoumán vliv na atrofii mozku až následně – v době, kdy již byly dlouhodobě zavedeny do klinické praxe.
dováním. Protokol studií dává do souvislostí MR nálezy s klinickými vyšetřeními. Dosažené výsledky jsou srovnávány v interim analýzách. Hodnocení probíhá pod dohledem specialistů a publikované výsledky jsou uplatňovány v praxi. Prokázaná účinnost DMD první a druhé linie na atrofii mozku je zachycena v tab. 1 [1, 24]. Velké klinické studie sledovaly vývoj mozkové atrofie většinou jako sekundární cíl. Primárním cílem bylo obvykle sledovat průměrný počet relapsů za rok, počet nových aktivních lézí, vývoj invalidity, sekundárním pak rozvoj redukce objemu mozku. Takto jsou získána dlouhodobá data z velkých souborů s průkazem signifikantní redukce ztráty mozkového objemu. Sledování a sběr dat v těchto studiích nadále probíhají. Jsou známa data týkající se fingolimodu a natalizumabu, další léčiva jsou testována. U léků první linie byl zkoumán vliv na atrofii mozku až následně – v době, kdy již byly dlouhodobě zavedeny do klinické praxe.
Fingolimod
Fingolimod (FTY720, FTY) je modulátor sfingosin-1-fosfátových (S1P) receptorů a působí na internalizaci a degradaci r![Obr. 2 Možný mechanismus působení fingolimodu na atrofii mozku; podle [27] – Singer, 2013. BDNF – brain-derived neurotrophic factor; S1P – sfingosin-1-fosfát](https://www.remedia.cz/photo-a-29486---.jpg) eceptorů S1P1, které se nacházejí především na buňkách imunitního a nervového systému, na endoteliích a svalových buňkách. Dochází k inhibici vycestování lymfocytů po S1P gradientu a k jejich selektivnímu zadržení v lymfatických orgánech (autoagresivní lymfocyty nepronikají do centrální nervové soustavy). Fingolimod přestupuje přes hematoencefalickou bariéru a předpokládá se, že působí přímo na neurální elementy, které exprimují receptory S1P (astrocyt, neuron, oligodendrocyty, mikroglie). Vazbou na astrocyty zlepšuje junkční spojení mezi jednotlivými neurogliemi. Dochází k efektivní komunikaci astrocytů a neuronů s endotelovými buňkami v hematoencefalické bariéře. Fingolimod moduluje receptory S1P – jejich zralost, dynamiku, přežívání oligodendrocytů, snižuje propustnost endotelu [25, 26]. Je doložena redukce astrogliózy, zvýšení remyelinizace, snížení demyelinizace, zvýšení produkce neurotrofního faktoru, aktivace mikroglie a tím ochrana axonů [27, 28]. Obr. 2 zachycuje vliv na neurální elementy v CNS [27]. Výsledky studií TRAN
eceptorů S1P1, které se nacházejí především na buňkách imunitního a nervového systému, na endoteliích a svalových buňkách. Dochází k inhibici vycestování lymfocytů po S1P gradientu a k jejich selektivnímu zadržení v lymfatických orgánech (autoagresivní lymfocyty nepronikají do centrální nervové soustavy). Fingolimod přestupuje přes hematoencefalickou bariéru a předpokládá se, že působí přímo na neurální elementy, které exprimují receptory S1P (astrocyt, neuron, oligodendrocyty, mikroglie). Vazbou na astrocyty zlepšuje junkční spojení mezi jednotlivými neurogliemi. Dochází k efektivní komunikaci astrocytů a neuronů s endotelovými buňkami v hematoencefalické bariéře. Fingolimod moduluje receptory S1P – jejich zralost, dynamiku, přežívání oligodendrocytů, snižuje propustnost endotelu [25, 26]. Je doložena redukce astrogliózy, zvýšení remyelinizace, snížení demyelinizace, zvýšení produkce neurotrofního faktoru, aktivace mikroglie a tím ochrana axonů [27, 28]. Obr. 2 zachycuje vliv na neurální elementy v CNS [27]. Výsledky studií TRAN![Graf 1 Účinek fingolimodu na mozkovou atrofii ve studiích TRANSFORMS, FREEDOMS a FREEDOMS II – podle [29, 30] – Cohen, et al., Jeffery, et al., 2013. TRANSFORMS ***p < 0,001 proti IFNβ-1a (hodnoty p podle Wilcoxonova testu) FREEDOMS/FREEDOMS II *p < 0,05; **p < 0,01; ***p < 0,001 proti placebu (k výpočtu použita analýza kovariance – ANCOVA)](https://www.remedia.cz/photo-a-29487---.jpg) SFORMS, FREEDOMS a FREEDOMS II ukazují signifikantní redukci poměru ztráty objemu mozku ve srovnání s placebem a interferonem beta-1a (IFNβ-1a) aplikovaným nitrosvalově. Účinek je prokazatelný již za šest měsíců od počátku léčby, jak ukazuje graf 1 [29, 30].
SFORMS, FREEDOMS a FREEDOMS II ukazují signifikantní redukci poměru ztráty objemu mozku ve srovnání s placebem a interferonem beta-1a (IFNβ-1a) aplikovaným nitrosvalově. Účinek je prokazatelný již za šest měsíců od počátku léčby, jak ukazuje graf 1 [29, 30].
Natalizumab
Natalizumab je humanizovaná monoklonální protilátka, která je antagonistou α4-integrinu a selektivně inhibuje jeho va![Graf 2 Průměrná změna objemu mozku v průběhu léčby natalizumabem ve srovnání s placebem; podle [32] – Miller, et al., 2007. BPF – mozková parenchymální frakce, brain parenchymal fraction](https://www.remedia.cz/photo-a-29488---.jpg) zbu na adhezní molekuly vaskulárního endotelu a tím brání migraci agresivních bílých krvinek do mozkové tkáně přes hematoencefalickou bariéru. Jsou známa data z klinických studií, z nichž základní je studie AFFIRM [31]. Natalizumab má výrazný vliv na aktivitu RS ovlivněním počtu relapsů a na akumulaci zánětu v bílé mozkové hmotě. Při měření celkového objemu vyjádřeného při MR vyšetření mozkovou parenchymální frakcí bylo zjištěno, že mozková atrofie je po roce léčby větší než po dvou letech [32], viz graf 2. Předpokládá se, že díky léčbě natalizumabem dochází ke snížení zánětlivé aktivity především v bílé hmotě, proto měřený objem mozku klesá, ale nejedná se v tomto období o skutečnou redukci nervových elementů. Tento jev se označuje jako pseudoatrofie [33].
zbu na adhezní molekuly vaskulárního endotelu a tím brání migraci agresivních bílých krvinek do mozkové tkáně přes hematoencefalickou bariéru. Jsou známa data z klinických studií, z nichž základní je studie AFFIRM [31]. Natalizumab má výrazný vliv na aktivitu RS ovlivněním počtu relapsů a na akumulaci zánětu v bílé mozkové hmotě. Při měření celkového objemu vyjádřeného při MR vyšetření mozkovou parenchymální frakcí bylo zjištěno, že mozková atrofie je po roce léčby větší než po dvou letech [32], viz graf 2. Předpokládá se, že díky léčbě natalizumabem dochází ke snížení zánětlivé aktivity především v bílé hmotě, proto měřený objem mozku klesá, ale nejedná se v tomto období o skutečnou redukci nervových elementů. Tento jev se označuje jako pseudoatrofie [33]. 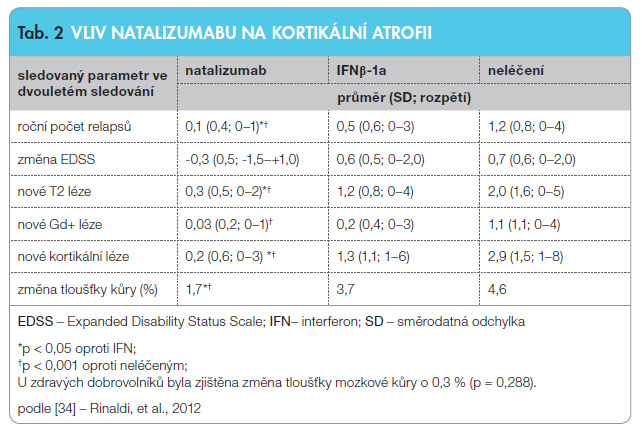
Vzhledem ke klinickým aspektům se pozornost obrátila k patologickým změnám šedé hmoty. Fokální a difuzní změny v mozkové kůře jsou dobře vizualizované specifickým MR zobrazením. Patologie v mozkové kůře hraje klíčovou roli v predikci klinického průběhu RS, souvisí s atrofií mozku, s progresí v neurologickém nálezu včetně kognitivních funkcí. Léčba natalizumabem signifikantně snižuje množství a progresi kortikálních lézí [34]. Číselně je účinek natalizumabu na kortikální atrofii vyjádřen v tab. 2 [34].
Léčiva modifikující onemocnění – první linie léčby
Je prokázáno, že také DMD první linie (IFNβ-1a, -1b a glatiramer acetát, GA) snižují ztrátu mozkového objemu. Jejich účinnost byla srovnávána v MR studii, která trvala pět let. Pacienti s RR-RS vstupovali do studie bez předchozího léčení, trvání nemoci před zahájením léčby a pozorováním nepřesáhlo hranici pěti let. Přípravek nebyl během sledování![Graf 3 První linie léčby roztroušené sklerózy a její účinek na ztrátu objemu mozku po pěti letech (vyjádřeno v procentech); [35] – Khan, et al., 2012. HD-IFNβ – vysokodávkovaný interferon β; LD-IFNβ – nízkodávkovaný interferon β; GA – glatira- mer acetát](https://www.remedia.cz/photo-a-29490---.jpg) změněn. Byl zkoumán vliv GA a IFNβ (nízkodávkovaný a vysokodávkovaný IFNβ s vyšší frekvencí aplikace). Procentuální změny v objemu mozku byly měřeny použitím plně automatizovaného programu. Analýza MR vyšetření byla zaslepená. Bylo zjištěno, že skupina léčená GA prokázala nejmenší redukci objemu mozku ve srovnání s pacienty s nízko- i s vysokodávkovaným IFNβ. Nicméně výsledky všech léčených skupin byly signifikantně lepší než míra ztráty objemu mozku u neléčené skupiny (p < 0,0001) [30]. Grafické znázornění procentuální změny v mozkovém objemu po pěti letech vyjádřené v MR parametrech zachycuje graf 3 [34]. Účinek GA lze vysvětlit významnou podporou obnovy myelinu díky pozitivnímu neurotrofnímu působení [36].
změněn. Byl zkoumán vliv GA a IFNβ (nízkodávkovaný a vysokodávkovaný IFNβ s vyšší frekvencí aplikace). Procentuální změny v objemu mozku byly měřeny použitím plně automatizovaného programu. Analýza MR vyšetření byla zaslepená. Bylo zjištěno, že skupina léčená GA prokázala nejmenší redukci objemu mozku ve srovnání s pacienty s nízko- i s vysokodávkovaným IFNβ. Nicméně výsledky všech léčených skupin byly signifikantně lepší než míra ztráty objemu mozku u neléčené skupiny (p < 0,0001) [30]. Grafické znázornění procentuální změny v mozkovém objemu po pěti letech vyjádřené v MR parametrech zachycuje graf 3 [34]. Účinek GA lze vysvětlit významnou podporou obnovy myelinu díky pozitivnímu neurotrofnímu působení [36].
Závěr
Celková ztráta mozkového objemu – mozková atrofie – je dynamický proces, který začíná již v časných fázích RS. K zániku nervových elementů dochází v bílé i šedé hmotě. Destrukce centrálního myelinu a oligodendrocytů je považována za primární patologii u RS, ale progresivní ztráta axonů je hlavní příčinou neurologického postižení. Cílem nových léčiv je dosáhnout plné klinické, imunologické i radiologické stability [37] bez relapsů, bez progrese reziduálního neurologického postižení, bez vývoje mozkové atrofie. Novými sofistikovanými programy s využitím specifických technik MR spolu s klinickými parametry je sledován dlouhodobý účinek již zavedených a zejména nově vyvíjených DMD. Nové poznatky o patologických procesech na úrovni neuroaxiální jednotky posunují i léčebnou snahu na vyšší úroveň ovlivnění neurodegenerativních procesů.
Seznam použité literatury
- [1] Bermel RA, Bakshi R. The measurement and clinical relevance of brain atrophy in multiple sclerosis. Lancet Neurol 2006; 5: 158–170.
- [2] Zapletalová O. Léčba časných stadií roztroušené sklerózy mozkomíšní. Remedia 2009; 19: 198–204.
- [3] Stadelmann Ch. Multiple sclerosis as a neurodegenerative disease: pathology, mechanisms and therapeutic implications. Curr Opin Neurol 2011; 24: 224–229.
- [4] Barkhof F, Calabresi PA, Miller DH, et al. Nat Rev Neurol 2009; 5: 256–266.
- [5] Filippi M, Falini A, Arnold DL, et al. Magnetic resonance techniques for the in vivo assessment of multiple sclerosis pathology: Consensus report of the white matter study group. J Magn Reson Imaging 2005; 21: 669–675.
- [6] Filippi M, Rocca MA. MRI aspects of the „inflammatory phase“ of multiple sclerosis. Neurol Sci 2003; 24: S275–S278.
- [7] Simon JH. Brain atrophy in multiple sclerosis:what we know and would like to know. Multiple Sclerosis 2006; 12: 679–687.
- [8] Campbell GR, Ohno N, Turnbull DM, et al. Mitochondrial changes within axons in multiple sclerosis: an update. Curr Opin Neurol 2012; 25: 221–230.
- [9] Dutta R, Trapp BD. Mechanisms of neuronal dysfunction and degeneration in multiple sclerosis. Progress in Neurobiology 2011; 93: 1–12.
- [10] Trapp BD, Nave KA. Multiple sclerosis an immune or neurodegenerative disorder? Ann Rev Neurosci 2008; 31: 247–269.
- [11] Waxman SG. Axonal conduction and injury in multiple sclerosis: the role of sodium channels. Nat Rev Neurosci 2006; 7: 932–941.
- [12] Sättler MB, Bähr M. Future neuroprotective strategies. Experimental Neurology 2010; 225: 40–47.
- [13] Petratos S, Azari MF, Ozturk E, et al. Novel therapeutic targets for axonal degeneration in multiple sclerosis. Neuropathol Exp Neurol 2010; 69: 323–324.
- [14] Hradílek P. Demyelinizace a remyelinizace v CNS. Neurol pro Praxi 2010; 11: 256–259.
- [15] Vercellino M, Masera S, Lorenzatti M, et al. Demyelination, inflammation and neurodegeneration in multiple sclerosis deep gray matter. J Neuropathol Exp Neurol 2009; 68: 489–502.
- [16] Hagemeier J, Weinstock-Guttman B, Bergsland N, et al. Iron deposition on SWI-filtered phase in the subcortical deep gray matter of patients with clinically isolated syndrome may precede structure-specific atrophy. Am J Neuroradiol 2012; 33: 1596–1601.
- [17] Daams M, Geurts JJ, Barkhof F. Cortical imaging in multiple sclerosis: recent findings and ´grand challenges. Curr Opin Neurol 2013; 26: 345–352.
- [18] Magliozzi R, Howell OW, Reeves CM, et al. A gradient of neuronal loss and meningeal inflammation in multiple sclerosis. Ann Neurol 2010; 68: 477–493.
- [19] Grassiot B, Desgranges B, Eustache F, et al. Quantification and clinical relevance of brain atrophy in multiple sclerosis: a review. J Neurol 2009; 256: 1397–1412.
- [20] Horakova D, Dwyer G, Havrdova E, et al. Gray matter atrophy and disability progression in patients with early relapsing-remitting multiple sclerosis A 5-year longitudinal study. J Neurol Sci 2009; 282: 112–119.
- [21] Horáková D, Vaněčková M. Význam magnetické rezonance ve sledování aktivity roztroušené sklerózy – pohled klinického neurologa. Neurol pro Praxi 2012; 13: 320–324.
- [22] Vaněčková M, Seidl Z, Krásecký J, et al. Naše zkušenosti s MR monitorováním pacientů s roztroušenou sklerózou v klinické praxi. Cesk Slov Neurol N 2010; 73: 716–720.
- [23] Fox EJ, Rhoades RW. New treatments and treatments goals for patients with relapsing-remitting multiple sclerosis. Curr Opin Neurol 2012; 25 (Suppl. 1): S11–19.
- [24] Zivadinov R, Reder AT, Filippi M, et al. Mechanisms of action of disease-modifying agents and brain volume changes in multiple sclerosis. Neurology 2008; 71: 136–144.
- [25] Havrdová E. Fingolimod. Remedia 2011; 21: 297–303.
- [26] Zapletalová O. Fingolimod. Remedia 2011; 21: 88–92.
- [27] Singer BA. Fingolimod for the treatment of relapsing multiple sclerosis. Expert Rev Neurother 2013; 13: 589–602.
- [28] Kipp M, Amor S. FTY720 on the way from base camp to the summit of the mountain; relevance for remyelination. Multiple Scler J 2012; 18: 258–263.
- [29] Cohen J, Radue EW, Barkhof F, et al. Fingolimod-effect on brain atrophy and clinical /MRI correlations in three phase 3 studies – TRANSFORMS, FREEDOMS and FREEDOMS II [online]. AAN, 21 March 2013, San Diego, S51.006 [accessed 2013-08-29]. Dostupné z: http://www.projectsinknowledge.com/Activity/pdfs/2141.05.pdf
- [30] Jeffery DR, Cohen JA, Meng X. Effect of fingolimod on brain atrophy: MRI data from phase 3 studies. 5th cooperative meeting of the consortium of multiple sclerosis centers and Americas comitee for treatment and research in multiple sclerosis. May 29–June 1, 2013 Orlando FL
- [31] Havrdova E, Galetta S, Mutchinson M. Effect of natalizumab on clinical and radiological disease activity in multiple sclerosis: a retrospective analysis of the natalizumab safety and efficacy in relapsing-remittining multiple sclerosis (AFFIRM) study. Lancet Neurol 2009; B: 254–260.
- [32] Miller DH, Soon D, Fernando KT. MRI outcomes in a placebo-controlled trial of natalizumab in relapsing MS. Neurology 2007; 68: 1390–1401.
- [33] Vidal-Jordana A, Sastre-Garriga J, Pérez FM, et al. Early brain pseudoatrophy while on natalizumab therapy is due to white matter volume changes. Mult Scler 2013; 19: 1175–1181.
- [34] Rinaldi F, Calabrese M, Seppi D, et al. Natalizumab strongly suppresses cortical pathology in relapsing-remitting multiple sclerosis. Mult Scler 2012; 18: 1760–1767.
- [35] Khan O, Bao F, Shah M, et al. Effect of disease-modyfying therapies on brain volume in relapsing-remitting multiple sclerosis: Results of a five-year brain study. J Neurol Sci 2012; 312: 7–12.
- [36] Blanchette F, Neuhaus O. Glatiramer acetate. Evidence for a dual mechanism of action. J Neurol 2008; 225 (Suppl. 1): 26–36.
- [37] Multiple Sclerosis Therapy Consensus Group (MSTCG), Wiendl H, Toyka KV, Rieckmann P, et al. Basic et escalating immunomodulatory treatments in multiple sclerosis: current therapeutic recommendations. J Neurol 2008; 255: 1449–1463.