B lymfocyty jako integrální součást poškozujícího zánětu u roztroušené sklerózy a jejich ovlivnění terapií cílící na molekulu CD20
Souhrn:
Roztroušená skleróza mozkomíšní (RS) je závažné zánětlivé neurodegenerativní onemocnění, které postihuje struktury mozku a míchy. Nepříznivý přirozený vývoj onemocnění lze ovlivnit několika léčivy s klinicky prokazatelnými efekty. Většina stávajících léků cílí především na T lymfocytární systém, který podle současných názorů sehrává nejvýznamnější úlohu v patogenezi RS. Bylo překvapením, že v rozsáhlých klinických studiích byla prokázána výborná odpověď na léčbu monoklonální protilátkou anti‑CD20 (ocrelizumab), která cílí na strukturu specificky vyjádřenou pouze na zralých B lymfocytech. Je to dokladem toho, že imunopatogenetické procesy u nemocných s RS jsou komplexnější, než jsme předpokládali.
Key words: multiple sclerosis – immunopathogenesis – B cell – biological therapy – anti‑CD20 – ocrelizumab.
Summary:
Multiple sclerosis (MS) is a severe inflammatory and neurodegenerative disease of the central nervous system. Unfavorable natural course of MS is therapeutically affected by several drugs with clinically proven effects. Most of the current drugs are generally targeting T cell system which is supposed to be critically involved in MS pathogenesis. It was surprising that excellent therapeutic response was achieved in large clinical trials using anti‑CD20 monoclonal antibody (ocrelizumab) targeted at a structure specifically expressed only on mature B cells. MS immunopathogenesis is likely much more complex than previously thought, based on these results.
Úvod
Roztroušená skleróza mozkomíšní (RS) je závažné zánětlivé neurodegenerativní onemocnění, které postihuje struktury mozku a míchy. Její patogeneze je komplexní a popsaná v hlubokém detailu, protože RS je studována již řadu desetiletí jak v rámci klinických studií, tak s použitím experimentálního zvířecího modelu EAE (experimental autoimmune encephalitis). Roztroušená skleróza je onemocnění, jehož diagnostika je v současné době dobře zvládnuta. Je postavena na klinickém neurologickém vyšetření, nálezu získaném nukleární magnetickou rezonancí s podporou přítomnosti oligoklonálních pásů imunoglobulinů v mozkomíšním moku. U nemocných s RS je třeba včasně zahájit léčbu, aby se zabránilo nepříznivému přirozenému průběhu onemocnění. Léčebné možnosti se rychle vyvíjejí a zásadně proměňují životní perspektivy nemocných s RS. U nás v první linii léčby nemocných s relabující remitující formou RS (RR RS) zůstávají rekombinantní interferony beta a glatiramer acetát, které jsou postupně doplňovány o další léčivé přípravky s klinicky prokázanou účinností, jež působí jinými mechanismy. Velmi usilovně se hledají postupy, které by ovlivnily i „nebezpečnější“ podoby nemoci, jakými jsou progresivní formy RS.
Překvapivě účinným lékem je ocrelizumab. Jedná se o humanizovanou monoklonální protilátku cílící na molekulu CD20, výlučně vyjádřenou na zralých B lymfocytech. Léčebný efekt ocrelizumabu velmi zásadně doložil, že naše předchozí chápání patogenetických mechanismů RS bylo omezené. Ukázal, že do našich úvah musíme doplnit také imunopatologické aktivity B lymfocytů, které byly až donedávna u nemocných s RS spojovány pouze s tvorbou oligoklonálních imunoglobulinů nalézaných v mozkomíšním moku. Jejich přítomnost v likvoru byla považována za epifenomén nesouvisející přímo s imunopatogenezí RS.
Imunopatogeneze roztroušené sklerózy
V průběhu zhruba šedesáti let jsme nahromadili obrovské množství dokladů o tom, že RS je imunopatologické autoimunitní onemocnění cílící na struktury myelinové pochvy nervových vláken. Na základě genetické dispozice, která v případě RS není příliš silná, a v kontextu nepopsatelného množství proměnných faktorů vnějšího světa dochází u nemocných s RS k prolomení autotolerance vlastních struktur CNS [1]. Následuje aktivace a klonální expanze autoreaktivních klonů T lymfocytů. T lymfocyty jsou aktivovány prostřednictvím dendritických buněk, které identifikují signály vnitřního poškození (damage associated molecular patterns, DAMP) nebo vnějšího nebezpečí (pathogen associated molecular patterns, PAMP). Tyto signály jsou internalizovány, zpracovány do podoby antigenních peptidů a prezentovány autoreaktivním T lymfocytům v kontextu molekul HLA. Na základě těchto, u člověka velmi obtížně popsatelných proměnných, se klonálně expandované autoreaktivní T lymfocyty dále funkčně polarizují.
V případě RS se jedná o preferenční funkční vyzrávání do subsetů Th1 a Th17 (T pomocných lymfocytů). Abnormální aktivity subsetů Th1 a Th17 skupiny T lymfocytů se současnou ztrátou regulačních subsetů Treg jsou nalézány jak v experimentu EAE, tak u nemocných s RS. Výsledkem je neregulovaný vstup aktivovaných autoreaktivních T lymfocytů přes hematoencefalickou bariéru. V samotném mozku se do poškozujícího zánětu významně zapojují rezidentní imunitní buňky, tj. mikroglie. Opomenout však nesmíme rovněž podíl vlastních struktur mozku, především astrocytů. Stále více chápeme, že součástí poškozujícího zánětu je i dysfunkce oligodendrocytů, které nedokáží efektivně reparovat a remodelovat léze na myelinových pochvách poškozených zánětem. Je narušena i jejich obnova z kmenových buněk. Dochází též k poškození a smrti samotných neuronů. Především je omezena jejich schopnost reparace z neuronálních kmenových buněk. Mimořádnou úlohu sehrává v tomto patogenetickém procesu také dysfunkce, či přímo patologie mitochondrií, která vede ke zvýšenému oxidačnímu stresu. Na lipidové struktury bohatá mozková tkáň je mimořádně vnímavá k chemickým modifikacím, k nimž dochází v přítomnosti oxidačního stresu. Lze uzavřít, že podle současného konceptu probíhají ruku v ruce poškozující zánět a procesy neurodegenerace [2].
Možnosti, jak zasáhnout do poškozujícího zánětu, jsou v současné době již poměrně rozsáhlé. Postrádáme však léčiva, která by ve větší míře současně podporovala procesy neuroreparace a oddalovala procesy neurodegenerace, jež neoddělitelně provázejí RS. Již jsme poznamenali, že bylo překvapením, že biologika cílící na B lymfocyty prostřednictvím molekuly CD20 zasahují léčebně do poškozujícího zánětu dokonce ještě efektivněji než klasická léčiva nebo jiné nověji zaváděné léky, a to i u osob s primárně progresivní formou RS. Je tedy velmi užitečné, abychom podali cíleně informace, které se týkají imunobiologie B lymfocytů a jejich úlohy v poškozujícím zánětu. Poukážeme také na bližší charakteristiky molekuly CD20 jako terče biologické léčby ocrelizumabem [3].
Imunobiologické charakteristiky B lymfocytů
B lymfocyty jsou součástí specifické větve imunity. Patří mezi klasicky studované složky imunity. Po narození se diferencují v kostní dřeni. Diferenciaci B lymfocytů můžeme účinně sledovat molekulárně biologickými postupy. Pomocí nich bylo prokázáno, že vývoj B lymfocytů můžeme rozdělit na etapu, která je nezávislá na antigenním podnětu, a na etapu, která probíhá po antigenní stimulaci zralých B lymfocytů. Na antigenu nezávislá fáze diferenciace se uskutečňuje v přesných vývojových krocích z kmenové buňky krvetvorby, která nese znak CD34. Velmi brzy po oddělení lymfoidní větve progenitorové buňky zadané pro vývoj v B lymfocyty exprimují molekulu CD19. V mikroprostředí krvetvorných orgánů dochází k jejich proliferaci a k další diferenciaci.
Kritickým okamžikem ve vývoji B lymfocytů je náhodné přeskupení genových segmentů, které kódují těžké a lehké řetězce imunoglobulinů. Přeskupení se uskutečňuje bez antigenní stimulace. Je to proces, který velmi zjednodušeně řečeno zajistí B lymfocytům s pomocí několika set výchozích genových segmentů kódujících těžké a lehké řetězce receptorů pro antigen na B lymfocytech obrovskou pestrost receptorů pro antigen BcR, jež jsou na zralých B lymfocytech vyjádřeny. Teoretický počet receptorových struktur BcR se odhaduje v řádu 1016. Výsledkem genového přeskupení je základní repertoár B lymfocytů, který je schopen reagovat teoreticky na všechny podněty, jimž bude v budoucnu člověk vystaven. Je samozřejmé, že při budování B lymfocytárního repertoáru dochází z principů genového přeskupení ke vzniku autoreaktivních B lymfocytů.
Uzavíráme, že na konci vývoje B lymfocytu nezávislého na antigenu je zralý B lymfocyt, který je charakterizován membránovou expresí receptorových struktur BcR. Ty se skládají z membránového imunoglobulinu, který určuje specificitu receptoru. Je spojen s membránovými molekulami, především CD79b a CD79a. Na povrchu zralého B lymfocytu se specificky nachází několik membránových molekul. Jmenovat můžeme CD20, CD21, CD22, CD24, CD27, CD40, CD43 a další. Jsou tam také vyjádřeny receptory pro nejrozmanitější cytokiny, kostimulační a koinhibiční molekuly a mnoho dalších funkčních molekul. Jejich počet se různí i v závislosti na míře aktivace B lymfocytů. Představují komplexní signální systém, který je nezbytný pro další fáze vývoje B lymfocytů, jež se uskutečňují po antigenní stimulaci.
Po diferenciaci v krvetvorných orgánech migruje zralý B lymfocyt cíleně do sekundárních lymfatických tkání a orgánů. Počtem největší je lymfatická tkáň spojená se sliznicí, zvláště sliznicí trávicí trubice. Zralé B lymfocyty jsou však rovněž nahromaděny v lymfatických uzlinách, slezině a dalších okrscích lymfatické tkáně. V sekundárních orgánech imunity B lymfocyty čekají na antigenní stimulaci. Ta se uskutečňuje buď přímo antigenem, který se do těchto struktur dostává lymfatickými cévami, nebo zprostředkovaně prostřednictvím rozmanitých prezentujících buněk. Mezi nimi významné místo zaujímají folikulární dendritické buňky a další subsety dendritických buněk, které jsou v sekundárních lymfatických tkáních a orgánech přítomny.
B lymfocyty rozpoznávají antigeny,
receptory BcR v jejich nativní konformační struktuře. To je
velký rozdíl od T lymfocytů, které rozpoznávají pouze
antigenní lineární peptidy prezentované v kontextu molekul
HLA. K tomuto kognitivnímu podnětu získává stimulovaný B
lymfocyt informace prostřednictvím kostimulačních membránových
molekul, z nichž zdůrazníme interakce CD40/CD40L
(ligand CD40). Výsledkem je aktivace B lymfocytu,
vzbuzení signálních drah, které vedou k aktivaci
a translokaci transkripčních faktorů. Na konci těchto
procesů je klonální expanze B lymfocytu specifického pro
daný antigenní podnět. Tyto B lymfocyty se v sekundárních
lymfatických orgánech dále diferencují. Na konci této antigenem
stimulované diferenciace je tvorba plazmatických buněk. Ty tvoří
protilátky stejné specificity, jakou má receptor BcR na počátku
celé antigenní stimulace. Plazmatické buňky ztrácejí molekulu
CD20 (obr. 1).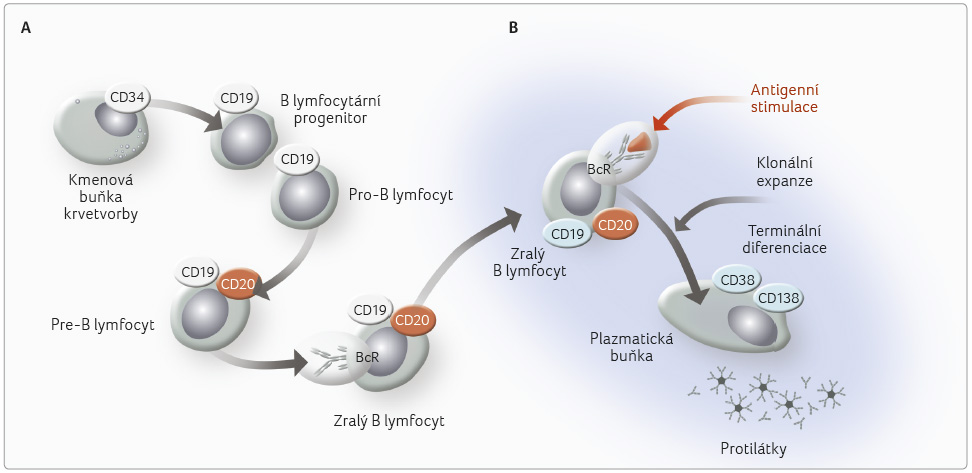
Aktivity B lymfocytů po antigenní stimulaci můžeme rozdělit na ty, které probíhají nezávisle na podpoře T lymfocytárního systému a jsou charakterizovány rychlou protilátkovou odpovědí v třídě IgM (imunoglobulin M), a na procesy, které vyžadují kooperaci s T lymfocyty. Většina odpovědí po antigenní stimulaci B lymfocytů je však závislá na přímé funkční podpoře T lymfocytárního systému. Během ní dochází vedle klonální expanze B lymfocytů po antigenní stimulaci též ke klonální expanzi odpovídajících T lymfocytů. Ty se dále funkčně polarizují do subsetu Th2. Ten je odpovědný za interakce s B lymfocyty, které mají rozsáhlé dopady na charakteristiku protilátkové odpovědi. Během ní dochází především k tzv. izotypovému přepnutí. Takto se tedy utvářejí protilátky ostatních tříd a podtříd imunoglobulinů. Na přepnutí se podílejí také interakce mezi membránovými molekulami B lymfocytů, například mezi CD40 a membránovými molekulami T lymfocytů (CD40L) v mikroprostředí IL 4 tvořeném T lymfocyty subsetu Th2.
V procesu regulovaném T lymfocyty dochází po antigenní stimulaci k dalšímu zásadnímu jevu, který označujeme jako somatická mutace. Zvyšuje se tak specificita protilátek, které jsou tvořeny po antigenní stimulaci. Tyto vlastnosti jsou uchovány ve formě paměťových buněk. Ty zajistí, že následné setkání se stejným antigenním podnětem vede k efektivnější a rychlejší tvorbě protilátek. Přežívání a proliferace B lymfocytů po antigenní stimulaci je mimořádně delikátní proces. Bez přítomnosti řady růstových faktorů a antiapoptotických molekul podléhají B lymfocyty stimulované antigenem apoptóze. Z mnoha dalších interakcí nezbytných pro dlouhodobé přežívání B lymfocytů a tvorbu protilátek zmíníme pouze interakce zprostředkované molekulami BAFF (B cell activating factor) z rozsáhlé rodiny molekul tumor nekrotizujícího faktoru alfa (TNFα) a membránovými receptory BAFFR (B cell activating factor receptor) [4].
B lymfocyty v patogenezi roztroušené sklerózy
Je paradoxní, že v diagnostice RS, která je definována jako imunopatologické onemocnění s abnormální aktivitou T lymfocytů, především subsetů Th1 a Th17, je stále využíván průkaz oligoklonálních imunoglobulinů v mozkomíšním moku jako jedno ze silných diagnostických kritérií. Přítomnost oligoklonálních imunoglobulinů v likvoru ukazuje na intratékální syntézu protilátek. Podle současného názoru podloženého nejnáročnějšími experimenty je zatím dovozováno, že specificita protilátek tvořících imunoglobulinové pásy u nemocných s RS je převážně zaměřena proti různým strukturám s původem v CNS, chemicky především lipidového původu. Tyto nálezy jsou interpretovány jako důkaz úklidových reakcí, které mají prostřednictvím vazby protilátek zajistit odstraňování poškozených struktur CNS [5].
Důkazy o zapojení B lymfocytů do obranného i poškozujícího zánětu v CNS je velmi obtížné přinést. Jsou obvykle pouze implicitní, vycházející z analýzy periferní krve nebo mozkomíšního moku. Je nemožné tyto analýzy provést intra vitam přímo v mozkových strukturách. Proto jsme odkázáni zatím prakticky výlučně na histopatologická vyšetření vzorků tkání CNS získaných post mortem. Je pochopitelné, že nejběžnější forma RR RS, která nemocné bezprostředně neohrožuje smrtí, není v tomto ohledu analyzována a histopatologické analýzy jsou prováděny u nemocných s progresivní formou RS. U nich bylo prokázáno, že v některých strukturách mozku, především na meningách, lze nalézt agregáty lymfoidních buněk tvořených B lymfocyty v různém stupni diferenciace, folikulárními dendritickými buňkami a dalšími buněčnými typy [6]. Tyto struktury jsou za normálních okolností součástí struktur sekundárních lymfatických orgánů, v nichž probíhá B lymfocytární odpověď po antigenní stimulaci. Nálezy těchto tzv. terciárních lymfoidních struktur v CNS nemocných s RS nejsou překvapivé. Jsou běžně prokazovány u jiných imunopatologických zánětlivých onemocnění, např. aterosklerózy, revmatoidní artritidy, vaskulitid. V nich je prokázáno, že aktivity B lymfocytů z těchto struktur významně přispívají k imunopatologii. Léčba cílená na B lymfocytární systém je v těchto indikacích prokazatelně účinná [7]. Bylo však překvapením, že aplikace biologické léčby představované monoklonální protilátkou anti CD20 vedla k významné klinické odpovědi i u nemocných s RS, kde jsme účast B lymfocytů nepředpokládali [8].
Můžeme si tedy klást otázku, jak je B lymfocytární systém zahrnut do imunopatogeneze RS. Pro tyto úvahy musíme vyjít z kompartmentalizace imunitní odpovědi. Lze předpokládat, že B i T lymfocytární imunitní odpověď je indukována v sekundárních lymfatických orgánech mimo CNS, kde jsou pro ni vytvořeny podmínky. Aktivované, případně klonálně zmnožené a též funkčně polarizované T (B) lymfocyty následně migrují složitě řízenými procesy přes hematoencefalickou bariéru do CNS. Tento regulovaný prostup je nutný nejen pro zajištění ochrany mozku před infekčními agens, ale poskytuje mozku prokazatelně i mnohovrstevnou podporu, která je nutná pro průběžné odstraňování poškozených struktur a jejich náhradu z kmenových buněk v procesech neuroreparace [9].
Bylo by nesprávné považovat B lymfocyty klasicky pouze za imunocyty, které se po antigenní stimulaci diferencují do plazmatických buněk tvořících protilátky. Jejich úloha v obranném i poškozujícím zánětu je komplexní. Stručně připomeneme, že B lymfocyty slouží jako mimořádně účinné buňky schopné zpracovat antigenní podněty a prezentovat je pak v úplném kontextu rozpoznávání T lymfocytům. B lymfocyty jsou také výrazným zdrojem cytokinů, které tvoří velmi brzy po expozici antigenním podnětům. Nemusí se nutně jednat o aktivaci B lymfocytů vyžadující antigenní stimulaci prostřednictvím BcR. B lymfocyty exprimují bohatě na svém povrchu i v nitrobuněčných lokalizacích receptory PRR (pattern recognition receptor), např. z rodiny receptorů TLR (Toll like receptor), jimiž identifikují celé spektrum vzorů PAMP/DAMP. Výsledkem je přepis genů, jež kódují např. TNFα, interleukin (IL) 2, 6, 15, 17 a též chemokiny, s obecně prozánětlivými účinky [4].
V centrální nervové soustavě nemocných s RS jsou přímé důkazy o zapojení protilátek tvořených B lymfocyty do poškozujícího zánětu. Je možné detekovat depozita imunoglobulinů, často spolu se složkami komplementového systému, odpovědná za poškozování struktur CNS. Je velmi pravděpodobné, že se protilátky uplatňují i v cytotoxických aktivitách T lymfocytů a NK buněk zprostředkovaných mechanismy buněčné cytotoxicity závislé na protilátkách (antibody dependent cytotoxicity, ADCC). Prostřednictvím cytokinů B lymfocyty abnormálně aktivují astrocyty a glie. Významnou úlohu v zapojení B lymfocytů do poškozujícího zánětu v CNS sehrávají chemokiny. Ty zajistí selektivní migraci B lymfocytů přes hematoencefalickou bariéru. Přežívání B lymfocytů je zásadním způsobem regulováno cytokiny z rodiny TNFα označovanými jako BAFF. Ty interagují s BAFFR na povrchu B lymfocytů. BAFF byl prokázán v ektopických lymfoidních strukturách mozku a v likvoru nemocných s RS [10].
Podíl B lymfocytů v imunopatogenezi RS ukazuje, jak škodlivé je nekritické využívání stávajících paradigmat v biomedicíně. Změny v B lymfocytárním systému u nemocných s RS a také dopady různých léčebných zásahů používaných v RS jsou dlouhodobě bohatě dokumentovány v odborné literatuře. Byly však interpretovány chybně. Jejich význam byl ve světle převažujících názorů zdůrazňujících podíl T lymfocytárního systému podceňován. V případě léčebných zásahů byly dokonce interpretovány jako nežádoucí účinky léčby nemocných s RS. Význam ovlivnění B lymfocytů v rámci poškozujícího zánětu různými léčivy nebyl v našem předchozím zúženém chápání imunopatogeneze RS doceněn [11].
Imunobiologické charakteristiky molekuly CD20
Membránová molekula CD20 je specificky vyjádřena pouze v B lymfoidní linii. Jedná se o glykosylovaný fosfoprotein, který čtyřikrát prochází cytoplazmatickou membránou. Řadíme ho tedy do rodiny tetraspanových molekul. Molekula CD20 je exprimována poměrně brzy v průběhu diferenciace B lymfocytů. Chybí v nejranějších vývojových stadiích. Tato molekula též není vyjádřena na plazmablastech a plazmatických buňkách. Neznáme její ligandy a přesnou funkci.
Molekula CD20 je rozpoznávána celou řadou monoklonálních protilátek anti CD20. Ty se používají k průkazu B lymfocytů metodou imunofluorescence s vyhodnocením průtokovou cytometrií, např. pro diagnostiku lymfoproliferativních onemocnění vycházejících z B lymfocytární větve. Do klinické praxe byla již před mnoha lety zavedena chimérická monoklonální protilátka anti CD20 nazvaná rituximab. Používá se v léčbě nemocných s B lymfoproliferativními onemocněními, B buněčným non Hodgkinovým lymfomem a s B buněčnou chronickou lymfocytární leukemií. Postupně byly konstruovány a v klinické praxi ověřeny i další monoklonální protilátky reagující s CD20. Jedná se o ocrelizumab, který představuje humanizovanou protilátku. Nejnověji byla zavedena i plně humánní protilátka anti CD20 označovaná jako ofatumumab. Rituximab i ocrelizumab se váží na epitopy, které jsou lokalizovány na prakticky totožné části molekuly CD20, ofatumumab se váže na odlišnou část molekuly CD20 [9].
Vazba anti CD20 na B lymfocyty vede k jejich depleci, kterou lze prokázat jak v periferní krvi, tak v kostní dřeni, slezině a v periferních lymfatických uzlinách. Deplece se uskutečňuje mechanismem ADCC, lýzou zprostředkovanou komplementem, zesílenou fagocytózou a také indukcí apoptózy v B lymfocytech. Tyto aktivity jsou do značné míry určeny Fc částí monoklonálních protilátek [12]. Je rozsáhle dokumentováno, že biologická léčba anti CD20 nesnižuje významně koncentrace protilátek. To je jistě vysvětlitelné skutečností, že molekula CD20 není exprimována na plazmatických buňkách. Po přerušení terapie dochází k rekonstituci B lymfocytárního systému s odstupem zhruba 7–10 měsíců. B lymfocytární kompartment je aplikací biologické terapie anti CD20 trvale alterován. Při obnově prakticky chybějí nebo jsou silně potlačeny paměťové B lymfocyty [11]. Modulační efekt biologika v kompartmentu CNS, kam v minimálním množství proniká, není jasný, protože nebyl prokázán klinický efekt, i pokud byla biologická léčba anti CD20 aplikována přímo do míšního kanálu.
S klinickou aplikací anti CD20, především rituximabu, je obrovská a dlouhodobá pozitivní klinická zkušenost. Používají se rutinně v hematoonkologii již desetiletí k léčbě lymfoproliferací vycházejících z B lymfocytární větve. Aplikace je obvykle spojena pouze s nezávažnými nežádoucími účinky, které lze dobře zvládnout medikací. Jsou důkazy, že aplikace humanizované protilátky ocrelizumab je spojena s ještě menším výskytem nežádoucích účinků. Z dlouhodobého pohledu lze jednoznačně uzavřít, že léčbu anti CD20 je možné považovat za bezpečnou. Až na kazuistické výjimky nejsou takto léčení nemocní ohroženi infekčními komplikacemi. Nejsou ani zdokumentovány případy nádorového bujení, které by ukazovalo na oslabení obranných protinádorových složek imunity [13,14].
Biologika anti CD20 byla ověřena v řadě klinických indikací spojených s poškozujícím zánětem, jejichž imunopatogenezi dominuje tvorba autoprotilátek. Jedná se např. o revmatoidní artritidu, o některé vaskulitidy a z neurologických indikací o myasthenia gravis a o nemocné s autoprotilátkovou aktivitou proti akvaporinu 4. U nich je tato léčba mimořádně účinná. Překvapivě to bylo jasně prokázáno i u nemocných s RS, která byla až dosud považována za imunopatologii zprostředkovanou T lymfocyty. U ocrelizumabu byla jednoznačně prokázána dobrá klinická účinnost u primárně progresivní formy RS. Jedná se o formu RS, která prakticky neodpovídá na léčivé prostředky používané v současné době. Ocrelizumab prokázal klinickou účinnost i u nemocných s relabující formou RS při zhoršujícím se postupu choroby v sekundárně progresivní RS. Efekt přitom není provázen závažnými bezprostředními nebo dlouhodobějšími nežádoucími účinky léčby [15].
Závěr
Lze jednoznačně uzavřít, že biologická terapie humanizovanou monoklonální protilátkou anti CD20 ‒ ocrelizumabem ‒ představuje zásadní rozšíření léčebných možností, které mohou ovlivnit přirozený průběh onemocnění RS. Výhodou je jeho účinnost u primárně progresivní formy, která není ovlivněna jinými dostupnými léky. Léčebný efekt je přitom provázen dobrým bezpečnostním profilem.
Seznam použité literatury
- [1] Parnell GP, Booth DR. The Multiple Sclerosis (MS) Genetic Risk Factors Indicate both Acquired and Innate Immune Cell Subsets Contribute to MS Pathogenesis and Identify Novel Therapeutic Opportunities. Front Immunol 2017; 8: 425.
- [2] Kempuraj D, Thangavel R, Natteru PA, et al. Neuroinflammation Induces Neurodegeneration. J Neurol Neurosurg Spine 2016; 1: 1003.
- [3] Wekerle H. B cells in multiple sclerosis. Autoimmunity 2017; 50: 57–60.
- [4] Krejsek J, Andrýs C, Krčmová I. Imunologie člověka. Hradec Králové: Garamon, 2016, 495 s.
- [5] Winger RC, Zamvil SS. Antibodies in multiple sclerosis oligoclonal bands target debris. Proc Natl Acad Sci U S A 2016; 113: 7696–7698.
- [6] Jones GW, Hill DG, Jones SA. Understanding Immune Cells in Tertiary Lymphoid Organ Development: It Is All Starting to Come Together. Front Immunol 2016; 7: 401.
- [7] Ludwig RJ, Vanhoorelbeke K, Leypoldt F, et al. Mechanisms of Autoantibody‑Induced Pathology. Front Immunol 2017; 8: 603.
- [8] Milo R. Therapeutic strategies targeting B‑cells in multiple sclerosis. Autoimmun Rev 2016; 15: 714–718.
- [9] Radick L, Mehr SR. The Latest Innovations in the Drug Pipeline for Multiple Sclerosis. Am Health Drug Benefits 2015; 8: 448–453.
- [10] Bittner S, Ruck T, Wiendl H, et al. Targeting B cells in relapsing‑remitting multiple sclerosis: from pathophysiology to optimal clinical management. Ther Adv Neurol Disord 2017; 10: 51–66.
- [11] Baker D, Marta M, Pryce G, et al. Memory B Cells are Major Targets for Effective Immunotherapy in Relapsing Multiple Sclerosis. EBioMedicine 2017; 16: 41–50.
- [12] Lycke J. Monoclonal antibody therapies for the treatment of relapsing‑remitting multiple sclerosis: differentiating mechanisms and clinical outcomes. Ther Adv Neurol Disord 2015; 8: 274–293.
- [13] Moreno Torres I, García‑Merino A. Anti‑CD20 monoclonal antibodies in multiple sclerosis. Expert Rev Neurother 2017; 17: 359–371.
- [14] Sorensen PS. Safety concerns and risk management of multiple sclerosis therapies. Acta Neurol Scand 2017; 136: 168–186.
- [15] Sorensen PS, Blinkenberg M. The potential role for ocrelizumab in the treatment of multiple sclerosis: current evidence and future prospects. Ther Adv Neurol Disord 2016; 9: 44–52.