Biologická léčba ankylozující spondylitidy
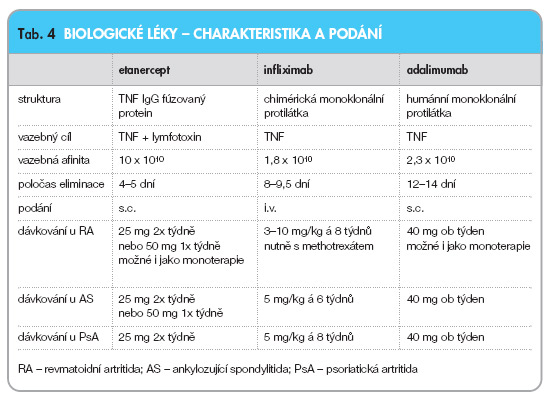
Ankylozující spondylitida (AS) patří do skupiny tzv. spondylartritid, které jsou pravděpodobně stejně četné jako revmatoidní artritida a vyvolávají i srovnatelnou míru disability a snížení kvality života. Podle medicíny založené na důkazech jsou z řady způsobů léčby AS účinná pouze cvičení, podávání nesteriodních antirevmatik a u periferních forem léčba sulfasalazinem a lokálně aplikovanými kortikoidy. Řada dalších postupů výborně účinných u RA, jako např. léčba methotrexátem či systémovým podáváním kortikoidů, u AS nefunguje. Novou kvalitu přinášejí do léčby AS látky blokující TNF (tumor necrosis factor). Do terapie AS byly zavedeny na základě nálezu RNA pro TNF- v zanícené synovii sakroiliakálních kloubů. Teoretické předpoklady byly potvrzeny nejprve v otevřených a později i dvojitě slepých kontrolovaných studiích. Infliximab se podává v dávce 5 mg/kg v infuzi po 6 týdnech, etanercept 2x týdně 25 mg s.c. a adalimumab v dávce 40 mg s.c. každý druhý týden. Příznivé terapeutické odpovědi dosahuje 60–75 % pacientů refrakterních na doposud podávanou léčbu. Odpověď na léčbu je rychlá a mohutná. Dochází k rychlému poklesu reaktantů akutní fáze. Ustupují klinické příznaky a zlepšuje se kvalita života. Předběžná data svědčí i o možném zpomalení strukturální progrese choroby (hodnocení pomocí rtg a magnetické rezonance). Mezi nežádoucí účinky léčby blokující TNF patří infekce včetně tuberkulózy, alergické a místní reakce, možný vznik myelodegenerativních onemocnění a indukce autoprotilátek a systémový lupus erythematodes. Větší výskyt lymfomů není potvrzen. Ke snížení rizika reaktivace latentní TBC se provádějí screeningová opatření dle doporučení České revmatologické společnosti. V ČR se léčba uskutečňuje v centrech biologické léčby.
Ankylozující spondylitida (AS) je chronické zánětlivé onemocnění neznámé etiologie charakterizované zánětlivou bolestí v zádech v důsledku sakroiliitidy a spondylitidy, tvorbou syndesmofytů, které vedou až k ankylóze. Rozeznáváme formu čistě axiální, dále formu s postižením ramen a kyčlí (rizomelická) a formu s artritidou a entezitidou (periferní). Výskyt AS u evropské populace kolísá v rozmezí 0,2–0,9 % [1]. Maximum výskytu AS je v pozdní adolescenci a u mladých nemocných. Ankylozující spondylitida je příčinou časté disability a invalidity svých nositelů a v tomto aspektu se neliší od následků revmatoidní artritidy [2]. V nedávno dokončené populační studii s 1008 pacienty s AS v Česku jsme zjistili, že až 60 % pacientů s AS je v invalidním důchodu.
AS je nejčastějším onemocněním ze skupiny tzv. spondylartritid, které mají řadu společných klinických rysů a společnou genetickou asociaci s antigenem HLA B27. Do této skupiny patří vedle AS ještě reaktivní artritidy, psoriatická artritida, artritida při idiopatických střevních zánětech, juvenilní AS a nediferencovaná spondylartritida (tab. 1).
Problémy při diagnostice ankylozující spondylitidy
Řada publikací i naše vlastní zkušenosti potvrzují fakt, že diagnóza AS je zpravidla stanovena se zpožděním 7–9 let od vzniku symptomů [3]. Problémy při diagnostikování časných forem AS jsou dva:
a) malé znalosti nerevmatologů o tomto onemocnění,
b) nevhodnost současně používaných klasifikačních kritérií pro časnou diagnostiku individuálních případů [4].
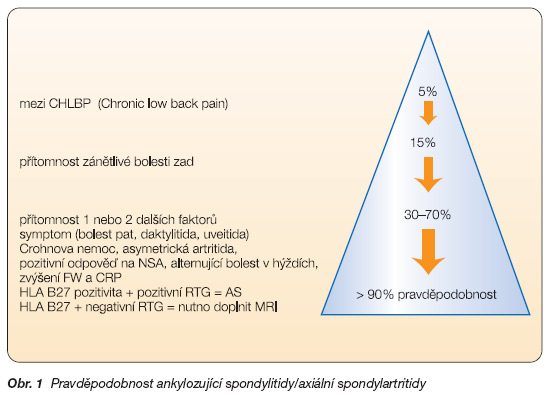
Proto jsou v současné době navrhovány diagnostické algoritmy pro vysoce pravděpodobnou diagnostiku časných forem AS v době, kdy ještě není přítomna rentgenově průkazná sakroiliitida (obr. 1). Novými prvky při této diagnostice jsou jednak nově definovaná zánětlivá bolest v zádech, přítomnost antigenu HLA B27 a nález sakroiliitidy na magnetické rezonanci (MRI) [5].
Hodnocení aktivity onemocnění a efektu léčby u ankylozující spondylitidy
Hodnocení aktivity onemocnění a terapeutické odpovědi je základem úspěšné léčby u všech chronických zánětlivých revmatických onemocnění. Je nutné odlišit hodnocení aktivity, které se soustřeďuje na hodnocení intenzity zánětu a symptomů, od hodnocení strukturální progrese, které má těžiště v zobrazovacích metodách. U AS došlo ke standardizaci metod a vytvoření validizovaných hodnotících instrumentů a „doporučení" mnohem později než u revmatoidní artritidy. Základem je hodnocení axiální i periferní bolesti na vizuální analogové škále (VAS), hodnocení délky ranní ztuhlosti (v minutách) a celkové hodnocení aktivity choroby pacientem a lékařem. Byl vyvinut speciální index – BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) [6], což je pacientem vyplněný dotazník (tab. 2).
Skupina expertů ve skupině ASAS (Assessment in AS) také navrhla definici léčebné odpovědi ve smyslu ano/ne [7]. Indikace pacientů pro biologickou léčbu a hodnocení léčebné odpovědi na tuto léčbu dle České revmatologické společnosti [8] je také založena na Doporučení ASAS [9], (tab. 3).
Pro hodnocení strukturální progrese se používají rentgenové metody a především MRI [10]. Navržené systémy však nejsou plně validizovány.
Konvenční léčba AS
Konvenční léčba AS byla systematicky vyhodnocena v přehledné práci Dougadose [9], dále především z pohledu medicíny založené na důkazech v Doporučeních pro léčbu AS Evropské ligy proti revmatismu EULAR [11].
Cílem léčby u AS je snížit bolest, ztuhlost a únavnost, udržet či zlepšit funkci a pokusit se zpomalit strukturální progresi nemoci. Jsou zde principiálně tři hlavní cíle protizánětlivé léčby:
a) zánětlivá bolest v zádech (sakroiliitida, spondylitida),
b) periferní artritida,
c) entezitida (uveitida, psoriáza).
Konvenční léčbu lze rozdělit na nefarmakologickou, farmakologickou a chirurgickou. Dle doporučení EULAR [11] je optimální nefarmakologickou a farmakologickou léčbu kombinovat. Základem léčby každého pacienta je celoživotní cvičení, které pomáhá udržovat pohyblivost páteře. Optimální je kombinace denního domácího cvičení se skupinovým cvičením pod vedením instruktora, event. doplnění o lázeňskou péči [12]. Základním prostředkem farmakoterapie AS je podávání nesteroidních antirevmatik (NSA). NSA se podávají u AS často jako monoterapie, často dlouhodobě (desetiletí). Výhodné je podávání NSA s delším biologickým poločasem. NSA mají řadu nežádoucích účinků, především gastrointestinálních, ale i kardiovaskulárních a renálních. Z COX-2 selektivních či preferenčních látek jsou indikovány k léčbě AS a byly úspěšně u této choroby zkoušeny celekoxib [13] a meloxikam [14]. Žádné z tzv. chorobu modifikujících léčiv (DMARDs – disease modifying antirheumatic drugs) používaných v léčbě revmatoidní artritidy (RA) není průkazně účinné u axiálních forem AS. U časných forem AS s periferní artritidou je účinný sulfasalazin (SAS) a může působit preventivně proti vzniku uveitidy [15]. Systémově podávané kortikoidy nejsou v terapii AS účinné [11]. Naopak je doporučována lokální léčba kortikoidy (aplikace do kloubů a k entezopatiím) [11]. Z novějších postupů se zkouší léčba bisfosfonáty [16].
Lze uzavřít, že:
a) existují důkazy o účinnosti cvičení, podávání NSA a sulfasalazinu u periferních forem AS;
b) ostatní DMARDs a systémově podávané kortikoidy jsou neúčinné;
c) chybí léčivo, které by kontrolovalo aktivitu nemoci a zpomalovalo progresi.
Biologická léčba AS
Biologická léčba revmatoidní artritidy (RA) blokádou tumor nekrotizujícího faktoru TNF-a byla zavedena do klinické praxe zhruba před 10 lety. Bylo prokázáno, že tato léčba významně a rychle snižuje aktivitu RA, potlačuje reaktanty akutní fáze, zlepšuje funkci a kvalitu života pacientů s RA. Navíc zpomaluje až zastavuje rentgenovou progresi onemocnění [17–19]. Především při aplikaci u časných forem RA také až v polovině případů indukuje remisi onemocnění [20].
Jaký je význam TNF-a u ankylozující spondylitidy? Je nutné zopakovat, že zásadní strukturou, ve které probíhá zánět u AS, jsou sakroiliakální klouby a šlachové úpony (enthesis). Existují 3 základní argumenty pro využití blokády TNF v léčbě AS.
1. TNF-a mRNA byla detekována v zanícených sakroiliakálních kloubech u pacientů s AS [21].
2. Spondylartritidy jsou jasně asociovány s idiopatickými střevními záněty (IBD – inflammatory bowel disease) [22]. TNF-a je silně exprimován ve sliznici gastrointestinálního traktu u nemocných s IBD a blokáda TNF-a je účinná u Crohnovy nemoci [23].
3. Terapie léčivy blokujícími TNF-a je účinná u jiných artritid, jako je psoriatická artritida a revmatoidní artritida, i když mechanismus jejich patogeneze je odlišný [24].
Charakteristiky jednotlivých léčiv blokujících TNF viz tab. 4.
Infliximab
První pilotní otevřená studie s infliximabem v léčbě AS byla provedena v Berlíně [25]. Podaná dávka 5 mg/kg infliximabu vedla k nejméně 50% zlepšení BASDAI u devíti z deseti pacientů. Další infuze byla podávána až v době relapsu, k němuž u většiny pacientů došlo po 6 týdnech. Tento interval pak byl zvolen jako nejvhodnější pro dvojitě slepé studie.
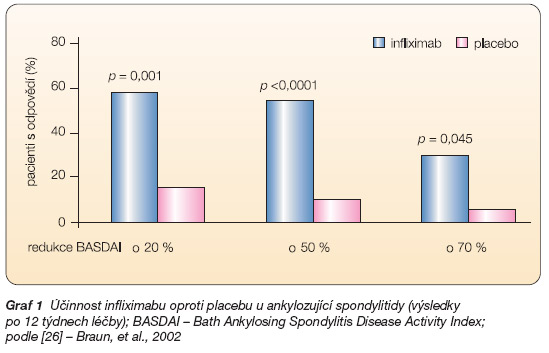
Základem pro registraci infliximabu u AS se pak staly dvojitě slepé randomizované studie. První z nich publikoval Braun a kol. [26]. Do studie bylo zařazeno 70 pacientů a primárním ukazatelem účinnosti byla redukce BASDAI o 50 % po 12 týdnech léčby. Tohoto kritéria bylo dosaženo u 53 % pacientů ve skupině léčené infliximabem a u 9 % pacientů po podávání placeba (p < 0,001), (graf 1). Rovněž funkce a kvalita života byly signifikantně zlepšeny po léčbě infliximabem, ale nikoliv po podávání placeba (p < 0,0001). Po ukončení 3měsíční dvojitě slepé fáze studie přešli pacienti do otevřené fáze, kdy byli léčeni stejnou dávkou po dobu 5 let. Po jednom roce pokračovalo v léčbě stále 54 (78 %) pacientů, z nichž u více než 50 % přetrvávalo 50% zlepšení [27]. Po 2 letech pokračovalo v léčbě 49 z původních 70 pacientů, po 3 letech pak 46 pacientů. Po 3 letech léčby bylo 50% zlepšení BASDAI stále přítomno u 47,1 % pacientů (analýza ITT – intention to treat) a při analýze tzv. completerů pak u 61 % pacientů. Snížení BASDAI o 70 % (což je téměř remise) bylo dosaženo u 39 % pacientů [28]. Původní hodnota CRP poklesla z 21,5 mg/l (0,9–74) na 1,5 mg/l (0–41,2) po 3 letech.
Do studie Bosche a kol. [29] byli zařazováni pacienti splňující širší kritéria pro stanovení diagnózy spondylartritidy. V porovnání se studií Brauna měli tito pacienti častěji periferní artritidy. Celkem bylo do studie zařazeno 40 pacientů. Primárním kritériem bylo BASDAI ve 12. týdnu. K jeho redukci o 50 % došlo po léčbě infliximabem u 53 % pacientů, oproti 9 % pacientů, jimž bylo podáváno placebo. Efekt léčby byl výraznější u pacientů s vyšším CRP při zahájení léčby. Příznivě byla léčbou infliximabem ve srovnání s podáváním placeba ovlivněna i funkční schopnost a kvalita života. Pomocí magnetické rezonance (MRI) byla hodnocena intenzita zánětu, která byla snížena u pacientů léčených infliximabem ve srovnání s těmi, jimž bylo podáváno placebo, o 46 % v oblasti páteře. Redukci intenzity zánětu páteřních struktur po léčbě infliximabem oproti placebu potvrdily i další studie za použití MRI [30].
Účinnost a bezpečnost infliximabu byla dále ověřena v randomizované kontrolované 24týdenní studii (studie ASSERT). Léčba pacientů s ankylozující spondylitidou infliximabem v dávce 5 mg/kg v týdnech 0, 2, 6, 12, 18 a 24 se ukázala jako efektivní a bezpečná ve srovnání s placebovou skupinou. Na podkladě kritérií ASAS 20 (20% zlepšení v terapeutické odpovědi) byla terapie infliximabem efektivní u 61,2 % pacientů (oproti 19,2 % u placebové skupiny; p < 0,001). Kritérií částečné remise podle ASAS dosáhlo 22,4 % pacientů léčených infliximabem (1,3 %; p < 0,001).
Signifikantní zlepšení u pacientů léčených infliximabem bylo také zaznamenáno na podkladě dalších ukazatelů (BASDAI, BASFI – Bath Ankylosing Spondylitis Functional Index, BASMI – Bath Ankylosing Spondylitis Metrology Index). Výskyt závažných nežádoucích účinků – 3,5 % u pacientů léčených infliximabem oproti 2,7 % u placebové skupiny – prokázal bezpečnost terapie infliximabem. Žádný z nežádoucích účinků nevedl k přerušení terapie, nebyl zaznamenán žádný výskyt malignit, tuberkulózy ani úmrtí v souvislosti s léčbou [31]. V rámci studie ASSERT byl prokázán pozitivní efekt terapie infliximabem na kvalitu života (hodnocené pomocí dotazníku SF 36) [32].
Etanercept
První randomizovaná dvojitě slepá placebem kontrolovaná studie u AS sledovala 40 nemocných, kteří byli léčeni buď etanerceptem v dávce 25 mg 2x týdně, nebo jim bylo podáváno placebo po dobu 4 měsíců, s 6měsíční otevřenou extenzí [33]. Primárním cílem bylo dosažení 20% zlepšení u 3 z 5 kritérií odpovědi (subjektivní celkový stav, noční bolest páteře, trvání ranní ztuhlosti, BASFI index a skóre oteklých kloubů). Ve 24. týdnu dosáhlo tohoto zlepšení 80 % nemocných z etanerceptové a 30 % nemocných z placebové skupiny (p = 0,004). V retrospektivní analýze bylo dodatečně hodnoceno skóre ASAS 20, 50, 70 (Assessment of Ankylosing Spondylitis – kritéria odpovědi – 20%, 50% a 70% zlepšení), jehož dosáhlo 85, 50 a 25 % nemocných z etanerceptové skupiny oproti 30, 15 a 10 % pacientů z placebové skupiny. Na základě těchto výsledků byly v rámci III. fáze klinického hodnocení provedeny další randomizované dvojitě slepé placebem kontrolované studie. Rozsáhlá studie sledovala 277 nemocných s AS, jimž byl podáván etanercept 25 mg 2x týdně, nebo placebo po dobu 24 týdnů [34]. Ve 12. týdnu bylo skóre ASAS 20, 50 a 70 dosaženo u 83, 62 a 40 % nemocných ve skupině léčené etanerceptem a u 27, 13 a 7 % pacientů, jimž bylo podáváno placebo. Ve 24. týdnu dosáhlo skóre ASAS 20, 50 a 70 ve skupině léčené etanerceptem 80, 58 a 39 % pacientů. 277 nemocných z předchozí 24týdenní studie, kteří dostávali 25 mg etanerceptu s.c. 2x týdně po dobu 72 týdnů, bylo zařazeno do otevřené extenze [35]. Z výsledků vyplývá, že nemocní léčení od počátku etanerceptem (tedy 96 týdnů) měli setrvalou odpověď po dva roky, ASAS 20 dosáhlo 74 % pacientů, nemocní, kteří dostávali v první fázi placebo a ve druhé fázi aktivní léčbu (72 týdnů), měli odpověď obdobnou (ASAS 20 dosáhlo 78 % nemocných). Byla pozorována i zlepšená mobilita v obou skupinách. Snášenlivost byla dobrá po celou dobu terapie.
Tyto studie prokazují účinnost etanerceptu u ankylozující spondylitidy. Bylo otázkou, jestli potlačení zánětlivé aktivity má vliv i na regresi zánětlivých změn v oblasti axiálního skeletu. Proto se uskutečnila studie s 25 nemocnými s AS, kteří užívali etanercept [36]. Vyšetření MRI bylo provedeno před zahájením léčby, po 6 týdnech a po 24 týdnech léčby etanerceptem. Hodnocena byla páteř i sakroiliakální (SI) klouby, vyhodnocovalo se skóre akutních a chronických změn. Z výsledků tohoto sledování vyplynulo, že signifikantně poklesl výskyt akutních zánětlivých změn po 24 týdnech léčby v oblasti SI kloubů i páteře. Toto sledování naznačuje možnost zpomalení rtg progrese tohoto onemocnění, což však musí být ještě prokázáno.
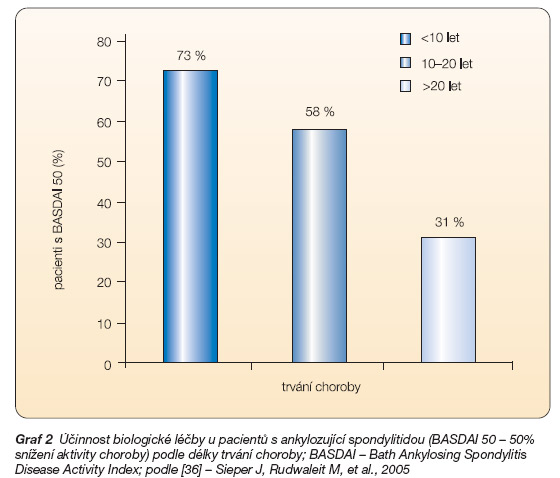
V poslední době je hodně pozornosti věnováno diagnostice a léčbě časné AS a objevují se studie hodnotící účinnost biologické léčby u časnějších i pokročilejších forem AS [36]. V prospektivní studii bylo hodnoceno 120 nemocných s ankylozující spondylitidou (rtg průkazem sakroiliitidy) s trváním onemocnění 5–10 let, 105 pacientů s AS s trváním < 5 let a 200 nemocných trpících spondylartritidou (SpA) bez rtg nálezu. Z hodnocení indexu aktivity (BASDAI) i bolesti bylo zjištěno, že příznaky jsou shodné u všech skupin nezávisle na rtg změnách. U 99 pacientů s AS, kteří dostávali biologickou léčbu, bylo dokázáno, že 50% snížení aktivity choroby bylo dosaženo u 73 % nemocných s trváním choroby po dobu kratší než 10 let, u 58 % pacientů s trváním choroby 10–20 let a pouze u 31 % nemocných s trváním AS více než 20 let (graf 2). Z tohoto pozorování můžeme usoudit, že u časných stadií jsou příznaky způsobeny ponejvíce zánětem, později se k němu přidávají strukturální a sekundární změny. Z toho plyne, že časná terapie AS blokádou TNF může ovlivnit i rtg změny.
Nedávno byla dokončena dvojitě slepá randomizovaná studie, ve které byli pacienti rozděleni do tří skupin: první dostávala 50 mg etanerceptu 1x týdně, druhá 25 mg 2x týdně a třetí placebo. Do studie trvající 12 týdnů bylo zařazeno 356 pacientů. Oba režimy – s podáváním dávky 50 mg etanerceptu 1x týdně a 25 mg etanerceptu 2x týdně – byly účinnější než režim, při němž bylo pacientům podáváno placebo, a mezi aktivními skupinami nebyl žádný zvláštní rozdíl (skóre ASAS 20 bylo dosaženo u 74,1 v. 71,3 % léčených, NS). V určitých ukazatelích byl zaznamenán trend k vyšší účinnosti léčby dávkou 50 mg etanerceptu 1x týdně (např. častější remise) [de Vlam K, et al., předloženo k publikaci]. Ve výskytu nežádoucích účinků nebyly mezi dalšími skupinami zjištěny žádné rozdíly.
Z provedených studií vyplývá, že etanercept je účinný v léčbě ankylozující spondylitidy. Není doporučeno současné užívání methotrexátu, který je v léčbě tohoto onemocnění neúčinný.
Adalimumab
Nejvýznamnější důkaz o účinnosti adalimumabu u AS přinesla randomizovaná placebem kontrolovaná studie III. fáze klinického zkoušení nazvaná ATLAS. Pacienti dostávali buď 40 mg adalimumabu každý 2. týden, nebo placebo po 24 týdnů. Pacienti z placebové větve, u kterých nebylo dosaženo odpovědi, dostali prvně 40 mg adalimumabu 1x za 14 dní. Do studie bylo zahrnuto 315 pacientů. Po 12 týdnech dosáhlo terapeutické odpovědi podle kritéria BASDAI 50 celkem 15,9 % pacientů po placebu a 45,2 % po léčbě adalimumabem. Po 24 týdnech činil tento rozdíl 15,0 % v. 42,3 % (p = 0,001) [37]. Adalimumab oproti placebu také podstatně zlepšoval kvalitu života nemocných.
Nežádoucí účinky léčby blokující TNF
Léčba blokující TNF je nepochybně účinná a představuje pokrok v terapii revmatických onemocnění, nicméně je nutné akceptovat, že může vyvolávat nežádoucí účinky, vzácně i závažné. Po 10 letech klinického používání lze označit za zvláště zřetele hodné [10]: infekce včetně sepse a tuberkulózy [39], lymfomy [40], ostatní hematologické abnormality, jako je anémie a pancytopenie, demyelinizační onemocnění [41], městnavé srdeční selhání [42], elevace jaterních testů, vznik autoprotilátek a autoimunitních onemocnění [43] a infuzní/injekční reakce včetně hypersenzitivity [44].
Velmi diskutovanou otázkou v poslední době je především možnost reaktivace latentní tuberkulózy anti-TNF terapií. TNF-a se u myších modelů podílí na normální protizánětlivé imunitní reakci na infekci TBC, což vede k aktivaci makrofágů a vzniku granulomu. Blokádou efektu TNF-a dojde tudíž k oslabení zmíněného fyziologického a obranného účinku TNF-a a ke zvýšení rizika manifestace latentní infekce TBC.
Výskyt TBC byl v průběhu klinického zkoušení těchto léčiv minimální a většina případů TBC se objevila během klinického použití látek blokujících TNF při hodnocení v rámci běžné praxe registrů a farmakovigilance.
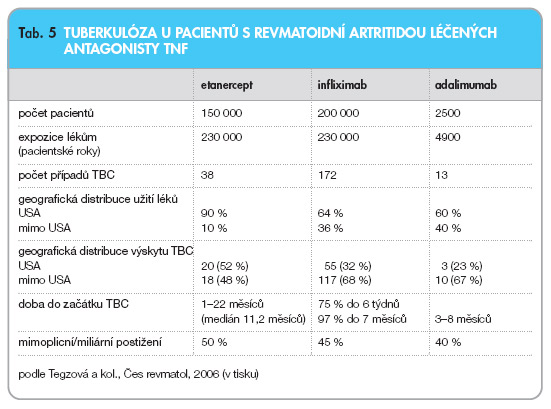
Výskyt TBC je zaznamenán po léčbě všemi třemi látkami, i když v jeho četnosti existují rozdíly (tab. 5). Zčásti jsou tyto diference způsobeny odlišností populací léčených jednotlivými léčivy, nicméně zdá se, že výskyt TBC po podávání monoklonálních protilátek je vyšší než po etanerceptu. Tuberkulóza se většinou vyskytuje v prvních měsících po zahájení léčby. Až v polovině případů jde o mimoplicní formu.
Poté co byla zjištěna zvýšená frekvence výskytu TBC po terapii léčivy blokujícími TNF, byly v řadě států přijaty Doporučené postupy k detekci latentní TBC a snížení rizika vzniku TBC. Screeningové postupy byly publikovány např. ve Francii [45] a ve Španělsku [46], ale i v dalších zemích. Např. ve Španělsku poklesl výskyt tuberkulózy po zavedení screeningových opatření řádově až 10krát.
Screeningová opatření nejsou v jednotlivých státech identická, jsou ale podobná. Jejich pilířem je správně odebraná anamnéza a klinické vyšetření, dále čerstvě provedený rentgenový snímek plic a tuberkulinový test, označovaný jako PPD test (purified protein derivative). Po 72 hodinách po provedení opichu je odečítána indurace, která nemá být větší než 10 mm. Toto je stav v České republice a např. ve Francii. V Německu se za horní hranici pozitivity považuje indurace o velikosti 5 mm. Česká revmatologická společnost publikovala svá Doporučení [47]. Při přítomnosti tzv. latentní TBC (tab. 6) je indikována profylaktická léčba isoniazidem po dobu nejméně 9 měsíců, přičemž terapii léčivy blokujícími TNF je nutné zahájit za 1 měsíc. V současné době se připravuje nový konsenzuální dokument.
Výskyt lymfomů (hodgkinských i nehodgkinských) je u RA zvýšen [48]. Mezi rizikové faktory vzniku lymfomu u RA patří délka trvání a závažnost choroby, vyšší věk, současně se vyskytující Sjögrenův syndrom a expozice imunosupresivní léčbě (cyklofosfamid, methotrexát) [49]. Ve velké kohortové studii ve Švédsku bylo sice riziko vzniku lymfomů u pacientů s RA léčených látkami blokujícími TNF zvýšeno trojnásobně v porovnání s normální populací (standardized incidence ratio = 2,9), nicméně po adjustaci k věku, pohlaví, délce trvání a aktivitě RA nebylo toto riziko u pacientů léčených anti-TNF terapií vyšší než u ostatních nemocných s RA [50]. Současná data tedy neposkytují dostatek údajů k tomu, aby bylo možné prostudovat kauzálně vztah mezi léčbou blokující TNF a vznikem lymfomů [51].
Zcela nedávno uveřejněná metaanalýza 9 studií s infliximabem a adalimumabem ukázala trojnásobné zvýšení frekvence nádorů (solidních tumorů a lymfomů) u pacientů s RA léčených anti-TNF oproti pacientům s RA léčeným konvenčními DMARDs [52]. Tato studie má však řadu metodologických nedostatků a je v současné době analyzována. Její závěry jsou navíc odlišné od švédské registrové studie, ve které vyšší výskyt solidních tumorů nalezen nebyl [50].
Bylo zaznamenáno (FDA) celkem 19 případů demyelinizačních onemocnění v možné časové koincidenci s léčbou anti-TNF [53]. Existující demyelinizační onemocnění se také v případě souběžné léčby látkami blokujícími TNF zhoršují. Ze zmíněných 19 případů nastalo onemocnění u 17 pacientů po léčbě etanerceptem a u 2 nemocných po léčbě infliximabem. Medián vzniku demyelinizačního onemocnění po zahájení léčby byl 5 měsíců. V dalším přehledu je referováno o 64 případech, které lze rozdělit na 4 skupiny: a) centrální parézy, b) syndrom Guillain-Barr `e, c) neuropatie, d) transverzální myelopatie. Vyskytly se i neuritidy optiku. Nicméně je nutné konstatovat, že incidence demyelinizačních onemocnění se nezdá být oproti pacientům s RA zvýšena. Z důvodů bezpečnosti však mají být pacienti pečlivě kontrolováni screeningem na preexistující neurologické onemocnění a důležitý je i monitoring v průběhu léčby [54].
Podávání léčiv blokujících TNF může vyvolávat vznik autoprotilátek, konkrétně antinukleárních protilátek (ANA) a protilátek proti dvojvláknové DNA (dsDNA). Tento výskyt je vyšší než po léčbě infliximabem, kde ve studii ATTRACT [18] byl výskyt ANA 62 % oproti 27% výskytu po placebu a anti-dsDNA pak v 15 %. Výskyt nových pozitivit ANA po léčbě etanerceptem během 6 měsíců trvání studií byl 11 % a po léčbě adalimumabem 12 % [55]. Byly zaznamenány také případy klinického léčbou indukovaného systémového lupusu erythematodes (SLE), které však spontánně odezněly po ukončení léčby. Je možné uzavřít, že přítomnost ANA nepredikuje možnost vzniku SLE a není kontraindikací léčby.
Po aplikaci infliximabu se mohou vyskytovat infuzní reakce. V jedné velké studii provedené ve Velké Británii byl výskyt infuzních reakcí 6,1 % a postihoval 9,7 % pacientů [56]. Většina reakcí byla mírná, ale v 1 % případů byly reakce označeny za závažné. Používání profylaktických protokolů u pacientů, kteří měli mírné reakce, podstatně snížilo výskyt reakcí závažnějších.
Reakce v místě vpichu po etanerceptu se vyskytují dle závěrů studií relativně často, až ve 37 % [57]. Většinou jsou tyto reakce mírné a pominou během měsíce i bez léčby. Klinicky se projevují jako erytém, edém a svědění.
Závěr
Léčba blokující TNF představuje významný pokrok v terapii spondylartritid. Podle principů Evidence Based Medicine bylo z konvenčních terapeutických postupů účinné pouze cvičení, podávání nesteroidních antirevmatik a u periferních forem léčba sulfasalazinem. Terapie blokující TNF je první účinnou léčbou, která kromě symptomatického účinku rychle a dramaticky snižuje koncentraci reaktantů akutní fáze a dle MRI i intenzitu zánětu (sakroiliitidy a spondylitidy).
Pravděpodobné je i zpomalení rentgenové progrese po léčbě blokující TNF. Indikace pacientů k této léčbě se opírá a) o definici selhání léčby, b) o určení aktivity AS jako vysoké, c) o periodické hodnocení úspěšnosti terapeutické odpovědi. Použití léčiv blokujících TNF v indikaci AS bylo schváleno agenturou EMEA (adalimumab – k 1. 6. 2006).
Biologická léčba je relativně bezpečná. Problémem může být reaktivace latentní TBC, a proto jsou připravovány návrhy na definování nových Návodů na léčbu látkami blokujícími TNF.
V ČR se podává léčba blokující TNF v centrech biologické léčby dle Návodů České revmatologické společnosti. Všichni pacienti jsou vedeni v registru.
Tato publikace vznikla při řešení výzkumných záměrů MZ ČR 000023728.
Obr. 1 Pravděpodobnost ankylozující spondylitidy/axiální spondylartritidy
Graf 1 Účinnost infliximabu oproti placebu u ankylozující spondylitidy (výsledky po 12 týdnech léčby); BASDAI – Bath Ankylosing Spondylitis Disease Activity Index; podle [26] – Braun, et al., 2002
Graf 2 Účinnost biologické léčby u pacientů s ankylozující spondylitidou (BASDAI 50 – 50% snížení aktivity choroby) podle délky trvání choroby; BASDAI – Bath Ankylosing Spondylitis Disease Activity Index; podle [36] – Sieper J, Rudwaleit M, et al., 2005
Seznam použité literatury
- [1] Braun J, Bollow M, Remlinger G, et al. Prevalence of spondylarthropathies in HLA B27 positive and negative blood donors. Arthritis Rheum 1998; 41: 58–67.
- [2] Boonnen A, Chorus A, Miedema H, et al. Employ¬ment, work disability and work days lost in patients with ankylosing spondylitis: cross sectional study of Dutch patients. Ann Rheum Dis 2001; 60: 353–358.
- [3] Sieper J, Braun J, Rudwaleit M, et al. Ankylosing spondylitis an overview. Ann Rheum Dis 2002; 61 (Suppl 3): 8–18.
- [4] Van der Linden S, Valkenburg HA, Cats A. Evaluation of the diagnostic criteria for AS: a proposal for modification of the New York criteria. Arthritis Rheum 1984; 27: 361–368.
- [5] Rudwaleit M, Khan MA, Sieper J. The challenge of diagnosis and classification in early ankylosing spondylitis. Do we need new criteria? Arthritis Rheum 2005; 52: 1000–1008.
- [6] Garrett S, Jenkinson T, Kennedy G, et al. A new approach to define disease status in ankylosing spondylitis: The Bath ankylosing spondylitis disea¬se activity index. J Rheumatol 1994; 21: 2286–1291.
- [7] Braun J, Pham T, Sieper J, et al. International ASAS consensus statement for the use of anti-tumor necrosis factors agents in patients with ankylosing spondylitis. Ann Rheum Dis 2003; 62: 817–824.
- [8] Pavelka K, Vencovský J, Štolfa J. Doporučení České revmatologické společnosti k biologické léčbě blokádou TNF – doplněk standardních léčebných postupů u revmatoidní artritidy. Čes Revmatol 2004; 12: 20–29.
- [9] Dougados M, Dijkmans B, Khan M, et al. Conventional treatments for ankylosing spondylitis. Ann Rheum Dis 2002; 61 (Suppl III.): 40–50.
- [10] Braun J, Sieper J. Biological therapies in spondylarthritides – the current state. Rheumatology 2004; 43: 1072–1084.
- [11] Zochling J, van der Heijde DM, Burgos-Vargas R, et al. ASAS/EULAR recommendations for the management of ankylosing spondylitis. Ann Rheum Dis 2006, in print.
- [12] Dagfinrud H, Hagen K. Physiotherapy interventions for ankylosing spondylitis (Cochrane review). Cochrane Database Syst Rev 2001; 4: CD002822.
- [13] Dougados M, Guegmen A, Nakachce JP, et al. Ankylosing spondylitis: what is the optimum duration of a clinical study? A one year versus 6 weeks nonsteroidal anti-inflammatory drug trial. Rheumatology (Oxford) 1999; 38: 235–244.
- [14] Dougados M, Behier JM, Jolchine I, et al. Efficacy of celecoxib, a COX-2 specific inhibitor in the treatment of ankylosing spondylitis: a six-week, controlled study with comparison against placebo and against a conventional NSAID. Arthritis Rheum 2001; 44: 180–185.
- [15] Dougados M, van der Linden S, Lairisalo-Depo M, et al. Sulfasalazine in the treatment of spondyl-arthropathy. Arthritis Rheum 1995; 38: 618–627
- [16] Maksymowych W, Lambert R, Jhangrii G, et al. Clinical and radiological amelioration of refractory periferal spondyloarthritis by pulse intravenouses pamidronate therapy. J Rheumatol 2001; 38: 144–155.
- [17] Klareskog L, van der Heijde DM, Jager JP, et al. Therapeutic effect of the combination of etanercept and methotrexate compared with each treatment alone in patients with rheumatoid arthritis: double-blind randomised controlled trial. Lancet 2004; 363: 675–681.
- [18] Lipsky P, van der Heijde DM, St Clair EW, et al. Infliximab and methotrexate in the treatment of rheumatoid arthritis. N Engl J Med 2000; 343: 1594–1602.
- [19] Weinblatt ME, Keystone EC, Furst DE, et al. Adalimumab, a fully human anti-tumor necrosis factor alpha monoclonal antibody, for the treatment of rheumatoid arthritis in patients taking concomitant methotrexate in the ARMADA trial. Arthritis Rheum. 2003; 48: 35–45.
- [20] Breedveld F, Weisman MH, Kavanaugh AF, et al. Adalimumab plus methotrexate versus methotrexate or adalimumab alone in methotrexate naive patients with early aggresive rheumatoid arthritis: results of the PREMIER study. Arthritis Rheum 2006; 54: 26–37.
- [21] Braun J, Sieper J. The sacroiliac joint in the spondyloarthropathies. Curr Opin Rheumatol 1996; 7: 275–283.
- [22] Mielants H, Veys EM. HLA B27 – related arthritis and bowel inflammation: Sulfasalazine in HLA B27 – related arthritis. J Rheumatol 1985; 12: 287–293.
- [23] Sandborn WJ. Anti-tumor necrosis factor therapy for inflammatory bowel disease: a review of agents, pharmacology, clinical results and safety. Inflamm Bowel Dis 1999; 5: 119–133.
- [24] Antoni C, Dechant C, Ogilvie A, et al. Successful treatment of psoriatic arthritis with infliximab in an MRI-controlled study. J Rheumatol 2000; 27 (Suppl 59): 24.
- [25] Brandt J, Haibel H, Cornely D, et al. Successful treatment of active ankylosing spondylitis with the anti-tumor necrosis factor alpha monoclonal antibody infliximab. Arthritis Rheum 2000; 43: 1346–1352.
- [26] Braun J, Brandt J, Listing J, et al. Treatment of active ankylosing spondylitis with infliximab: a randomised controlled multicentre trial. Lancet 2002; 359: 1187–1193.
- [27] Braun J, Brandt J, Listing J, et al. Long-term efficacy and safety of infliximab in the treatment of ankylosing spondylitis: an open, observational, extension study of a three-month, randomized, placebo-controlled trial. Arthritis Rheum 2003; 48: 2224–2233.
- [28] Braun J, Baraklios X, Brandt J, et al. Persistent clinical response to anti TNFĪ antibody infliximab in patients with ankylosing spondylitis over 3 years. Rheumatology 2005; 44: 670–676.
- [29] Van der Bosch F, Krenithof E, Becker D, et al. Randomised, double-blind comparison of chimeric monoclonal antibody to tumor necrosis factor Ī (infliximab) versus placebo in active spondylarthropathy. Arthritis Rheum 2002; 46: 755–765.
- [30] Baraklios X, Listing J, Brandt J, et al. Persistant reduction of spinal inflammation as assessed by MRI in patients with AS after two years of treatment with anti TNF agent infliximab. Ann Rheum Dis 2005; 323: FRI0221.
- [31] Van der Heijde DM, Dijkmans B, Geusens P, et al. Efficacy and safety of infliximab in patients with ankylosing spondylitis: results of A 24-week randomized, placebo-controlled trial (ASSERT). Ann Rheum Dis 2004; 63 (Suppl 1): 403, SAT0053.
- [32] Van der Heijde D, Dijkmans B, Guesens P, et al., and the Ankylosing Spondylitis Study for the Evaluation of Recombinant Infliximab Therapy Study Group. Efficacy and Safety of Infliximab in Patients With Ankylosing Spondylitis. Results of a Randomized, Placebo-Controlled Trial (ASSERT). Arthritis Rheum. 2005; 52: 582–591.
- [33] Gorman JD, Sack KE, Davis JC Jr. Treatment of ankylosing spondylitis by inhibition of tumor necrosis factor alpha. N Engl J Med 2002; 246 (18): 1349–1356.
- [34] Davis JC Jr, van der Heijde DM, Braun J, et al. Recombinant human tumor necrosis factor receptor (etanercept) for treating ankylosing spondylitis: a randomized, controlled trial. Arthritis Rheum 2003; 48 (11): 3230–3236.
- [35] Davis JC Jr, van der Heijde DM, Braun J, et al. Sustained durability and tolerability of etanercept in ankylosing spondylitis for 96 weeks. Ann Rheum Dis 2005; 64: 1557–1562.
- [36] Sieper J, Rudwaleit M, How early should ankylosing spondylitis be treated with tumour necrosis factor blockers? Ann Rheum Dis 2005: 64 Suppl 4: iv61–4.
- [37] Van der Heijde DM, Kivitr A, Schift M, et al. Adalimumab therapy results in significant reduction of significant symptoms in subjects with AS: The ATLAS trial. Abstract presented at ACR 2005.
- [38] Van der Heijde DM, Luo A, Matsumoto M. Adalimumab improves health-related quality of life in patients with active AS – The Atlas trial. Abstract presented at ACR 2005.
- [39] Ellerin T, Rubin RH, Weinblatt ME. Infections and anti-tumor necrosis factor alpha therapy. Arthritis Rheum 2003; 48: 3013–3022.
- [40] Brown SL, Greene MH, Gershon SK, et al. Tumor necrosis factor antagonist therapy and lymphoma development: Twenty-six cases reported to the Food and Drug Administration. Arthritis Rheum 2002; 46: 3151–3158.
- [41] Mohan N, Edwards ET, Cupps TR, et al. Demye¬lination occurring during anti-tumor necrosis factor alpha therapy for inflammatory arthritides. Arthritis Rheum 2001; 44: 2862–2869.
- [42] Wolfe F, Michaud K. Congestive heart failure in rheumatoid arthritis: rates, predictors and the effect of anti-TNF therapy. Arthritis Rheum 2003; 48: S699.
- [43] De Rycke L, Kruithof E, Van Damme N, et al. Antinuclear antibodies following infliximab treatment in patients with rheumatoid arthritis or spondylarthropathy. Arthritis Rheum 2003; 48: 1015–1023.
- [44] Bartolucci P, Ramanoelina J, Cohen P, et al. Efficacy of the anti-TNF-alpha antibody infliximab against refractory systemic vasculitides: an open pilot study on 10 patients. Rheumatology 2002; 41: 1126–1132.
- [45] Mariette X, Salmon D, Group RATIO. French guidelines for diagnosis and treating latent and active tuberculosis in patients with RA treated with TNF blockers. Ann Rheum Dis 2003; 62: 791.
- [46] Gomez-Reino JJ, Carmona L, Valverde VR, et al. Treatment of rheumatoid arthritis with tumor necrosis factor inhibitors may predispose to significant increase in tuberculosis risk. Arthritis Rheum 2003; 48: 2122–2127.
- [47] Vencovský J, Tegzová D, Pavelka K. Doplněk standardních postupů u revmatoidní artritidy. Čes revmatol 2002; 10: 31–40.
- [48] Wolfe F, Fries JF. Rate of death due to leukemia/lymphoma in patients with rheumatoid arthritis. Arthritis Rheum 2003; 48: 2694–2695.
- [49] Baecklound E, Ekbom A, Sparen P, et al. Disease activity and risk of lymphoma in patients with rheumatoid arthritis: nested case-control study. Br Med J 1998; 317: 0180–180.
- [50] Askling J, Fored CM, Baecklund E, et al. Risk of solid cancers in patients with rheumatoid arthritis and after treatment with tumor necrosis factor antagonists. Ann Rheum Dis 2005; 64: 1421–1426.
- [51] Wolfe Z, Michaud K. Lymphoma in rheumatoid arthritis. Arthritis Rheum 2004; 50: 1740–1751.
- [52] Bongartz T, Sutton AJ, Sweeting MJ, et al. Anti-TNF antipody therapy in rheumatoid arthritis and the risk of serious infections and malignancies. JAMA 2006; 295: 2275–85.
- [53] Baeten D, Kruithof E, Van den Bosch F, et al. Systematic safety follow up in a cohort of 107 patients with spondyloarthropathy treated with infliximab: a new perspective on the role of host defence in the pathogenesis of the disea¬se? Ann Rheum Dis 2003; 62: 829–834.
- [54] FDA Briefing document. Safety update on TNF antogonists: infliximab and etanercept. FDA. 8–1–2001.
- [55] Khanna D, Mc Mahon M, Frust D. Safety of tumor necrosis factor antagonists. Drug Saf 2004; 27: 307–324.
- [56] Cheifetz A, Swedley M, Martin S, et al. The incidence and management of infusion reactions to infliximab: a large cohort experience. Am J Gastroenterol 2003; 98: 1315–1324.
- [57] Keystone E, Schiff M, Kremer J, et al. Once weekly administration of 50 mg of etanercept in patients with active rheumatoid arthritis. Arthritis Rheum 2004; 50: 353–363.