Biologická léčba bronchiálního astmatu
Souhrn:
Současná léčba středně těžkého až těžkého perzistujícího astmatu se opírá zejména o inhalační kortikosteroidy v kombinaci s dlouhodobě působícími bronchodilatancii a antagonisty leukotrienů. Některé fenotypy astmatu však nejsou ani při kombinované antiastmatické léčbě pod kontrolou. V posledních dvou desetiletích se dramaticky zvýšil počet studií s užitím biologické terapie. V klinické praxi máme nyní dostupné tři molekuly se selektivními přístupy k alergickému a eozinofilnímu zánětu dýchacích cest. Užití biologické léčby, která cílí na dráhu interleukinu 5 nebo na imunoglobulin E, u těžkých astmatiků s častými exacerbacemi významně zlepšuje kontrolu nad astmatem. Přidání nových molekul do léčby pacienta s těžkým astmatickým onemocněním vyžaduje zkušený klinický úsudek, neboť molekuly se v některých účincích překrývají. Tento přehled shrnuje současné a budoucí možnosti biologické terapie ve stupňovité léčbě astmatu.
Key words: bronchial asthma – biological treatment – biomarkers.
Summary:
Current inhaled treatment of moderate to severe persistent asthma is mainly based on inhaled corticosteroids combined with long‑acting bronchodilator agents and leukotriene antagonists. Some asthma phenotypes, however, are not well controlled even by this combined antiasthmatic therapy. In the past two decades, the number of trials evaluating biological treatment has increased dramatically. Three molecules selectively influencing allergic and eosinophil inflammation of the airways are now available in clinical practice. Biological therapy targeting interleukin 5 or immunoglobulin E does improve asthma control in severe asthmatics with frequent exacerbations. Adding new molecules to treatment requires an experienced clinical judgment concerning the life of the asthmatic patient and dealing with his or her complex illness since many molecules have overlapping effects. This overview summarizes the current and future options offered by biological therapy in the cascade treatment of asthma.
Úvod
Bronchiální astma je heterogenní onemocnění dýchacích cest vyznačující se chronickým zánětem a remodelací průdušek doprovázenými jejich hyperreaktivitou a rovněž variabilní a často reverzibilní obstrukcí. Typické jsou opakující se symptomy kašle, hvízdavého dýchání, dušnosti a svírání na hrudi [1]. Diagnóza astmatu bývá celoživotní a v průběhu chronické léčby je často nezbytné přehodnocovat odpověď astmatika na terapii dle progrese choroby. Odhaduje se, že až 300 milionů lidí na celém světě trpí astmatem a výskyt onemocnění narůstá v průběhu posledních 40 let [2,3]. Současné možnosti léčby poskytují dobrou kontrolu nad astmatem u většiny pacientů, ale 5–10 % nemocných není schopno dosáhnout stabilizace onemocnění i přes komplexní terapii a vyloučení všech příčin zhoršujících astma. Tato část astmatické populace s refrakterním těžkým typem choroby je ve zvýšeném riziku morbidity a mortality na astma a léčba těchto nemocných představuje většinu ekonomických nákladů na tuto nelehkou diagnózu [4–6]. Na počátku 21. století je zřetelná snaha o přesné zařazení konkrétních fenotypů a endotypů astmatu. Výzkum astmatického zánětu se zapojením zánětlivých mediátorů a hledání biomarkerů vede k vývoji a zavádění nových molekul do léčby těžkých astmatiků s cílem poskytnout pacientovi terapii na míru [7].
Fenotypy a endotypy astmatu
S narůstajícími terapeutickými možnostmi cílené léčby se množí snahy o fenotypizaci astmatu, jež zahrnují nejrůznější pohledy od molekulárně biologické úrovně až po vnější klinické charakteristiky, často na základě clusterových analýz. V českém Doporučeném postupu diagnostiky a léčby bronchiálního astmatu je upřednostněno používání jednoduché multifunkční klinické klasifikace.
Základní snahou je dosažení kontroly nad chorobou. Lékař posuzuje tíži astmatu odvozenou od minimálního stupně farmakoterapie, jež je potřebná k dosažení plné kontroly. Tíže astmatu se však může v čase měnit, a proto je s ohledem na narůstající možnosti specifické léčby nezbytné určovat základní fenotyp, který vychází z alergologického vyšetření a z přítomnosti eozinofilie. Pokud propojíme tyto jednoduché parametry s klinickým hodnocením (doba vzniku astmatu, přítomnost alergického terénu), můžeme eozinofilní astma rozdělit na dva základní fenotypy – eozinofilní alergické astma a eozinofilní astma nealergické. Dominujícím znakem alergického eozinofilního astmatu je přítomnost klinicky významné alergie, eozinofilie v průduškách ustupuje po zavedení preventivní léčby. Astma začíná často v dětství a nezřídka mu předcházejí jiná alergická onemocnění (tzv. atopický pochod). Hlavním symptomem eozinofilního nealergického astmatu je přítomnost výrazné eozinofilie, astma začíná často až ve středním věku, alergologické vyšetření bývá negativní nebo je alergie bez kauzální vazby na průběh astmatu. Nejzávažnější formy bývají při intoleranci nesteroidních antirevmatik, prognosticky se jedná o těžší astmatiky [1,2]. Tyto dva fenotypy do určité míry evokují historické termíny extrinsic a intrinsic asthma bronchiale založené na rozlišení patogenetických mechanismů, které byly užívány už v polovině předchozího století.
Třetí fenotyp non eozinofilního, nealergického astmatu bývá spojen s nadváhou, s jinými komorbiditami a s ženským pohlavím. U těchto astmatiků chybí jak přítomnost eozinofilie, tak klinicky významné alergie, onemocnění je však doprovázeno bronchiální hyperreaktivitou a typickými příznaky astmatu, začíná s převahou v dospělosti [2].
Z vývoje biologických léčiv v terapii středně těžkého až těžkého bronchiálního astmatu je zřejmé, že příznivý účinek je dokladován zejména u pacientů, kteří mají vyšší koncentraci eozinofilů v krvi a prokazatelné další biomarkery eozinofilního zánětu ‒ eozinofily ve sputu, oxid dusnatý ve vydechovaném vzduchu (FeNO), periostin. Podle různých přehledových analýz se však udává, že těžcí astmatici vykazují eozinofilní typ pouze zhruba v 55 %, u ostatních astmatiků je buněčný profil neutrofilní či paucigranulocytární [8]. V současné době probíhají rozsáhlé populační studie u astmatiků, které se snaží definovat fenotypy astmatu s vazbou na personalizovanou léčbu [9]. Studie U BIOPRED (Unbiased BIOmarkers for the PREDiction of respiratory disease outcomes) definovala čtyři fenotypy astmatiků:
- Fenotyp T1 – astma středně těžké až těžké, dobře kontrolované, léčené středními až vysokými dávkami inhalačních kortikosteroidů (IKS), mírná nebo žádná obstrukční ventilační porucha, nízká koncentrace eozinofilů ve sputu.
- Fenotyp T2 ‒ astma těžké, s pozdním začátkem, postihující kuřáky nebo ex kuřáky, těžká obstrukční ventilační porucha, vysoká koncentrace eozinofilů v krvi a ve sputu.
- Fenotyp T3 ‒ astma těžké, léčené perorálními kortikosteroidy, střední až těžká obstrukční ventilační porucha.
- Fenotyp T4 ‒ astma těžké, postihující častěji ženy, žádná až mírná obstrukční ventilační porucha, časté exacerbace.
Fenotypizace astmatu je nezbytným vodítkem při individualizaci léčby, především u těžkých forem nemoci. Při zahajování biologické léčby musíme mít jednoznačně určen fenotyp astmatu. Z pohledu klinika je však velmi obtížné odhadnout, který fenotyp by měl v případě biologické léčby zaměřené na eozinofilní astma největší přínos. Určitě bude nutné i uvedené čtyři základní fenotypy rozdělit do dalších podskupin s ohledem na ostatní biomarkery.
Patogeneze bronchiálního astmatu
Alergické bronchiální astma může být široce charakterizováno jako T helper 2 (Th2) buňkami zprostředkovaná choroba. Cytokiny produkované Th2 lymfocyty zahrnují interleukin 4 (IL 4), interleukin 5 (IL 5) a interleukin 13 (IL 13). Dnes víme, že uvedené cytokiny jsou úzce spojeny s etiopatogenezí astmatu. Během složitého procesu interakce mezi faktory životního prostředí a imunitním zánětlivým terénem astmatika se jeví Th2 cytokiny (IL 4, IL 5 a IL 13) jako vhodné terče k terapeutické intervenci [7,10].
V etiopatogenezi eozinofilního astmatu byl popsán další typ buněk, tzv. innate lymphoid cells (přirozené lymfoidní buňky, ILC), které jsou velmi podobné Th lymfocytům, ale nenesou na svém povrchu receptory B či T a nepotřebují ke své aktivaci antigenní podnět. Jsou schopny se aktivovat a diferencovat do subtypů ILC pod vlivem cytokinů tvořených respiračním epitelem, jako jsou IL 33, IL 25 a thymový stromální lymfopoetin (TSLP). Z hlediska rozvoje eozinofilního astmatu je nejvíce diskutovanou skupina ILC 2. Tato množina lymfoidních buněk je schopna obdobné produkce prozánětlivých cytokinů včetně IL 4, IL 5, IL 9 a IL 13, jako jsou Th2 lymfocyty, ale bez přítomnosti kontaktu s alergenem. Ve zvýšené míře byla nalezena v respirační sliznici astmatiků s nosními polypy [11–13].
Klíčovou rolí IL 4 je diferenciace Th0 lymfocytů k Th2 buňkám a indukce tvorby imunoglobulinu E (IgE) v B lymfocytech. Imunoglobulin E se váže na vysokoafinní receptory (FceRI) žírných buněk a bazofilů. Navázáním alergenu na molekuly IgE dochází k přemostění FceRI a k uvolňování zánětlivých mediátorů, včetně histaminu, prostaglandinů, leukotrienů a prozánětlivých cytokinů (IL 4, IL 5, IL 13). V dolních cestách dýchacích tento proces vede ke zvýšené produkci hlenu, zvýšené svalové kontraktilitě a k buněčné, zejména eozinofilní infiltraci. S IL 4 je úzce spojen IL 13, neboť pro oba cytokiny je společná dráha přenosu signálu přes heterodimerické receptory IL 4RA/IL 13Ra1. Blokování IL 4RA proto inhibuje účinky obou cytokinů IL 4 a IL 13. Interleukin 13 způsobuje hyperplazii pohárkových buněk se zvýšenou produkcí, hyperreaktivitu dýchacích cest a může taktéž zprostředkovat isotypové přepnutí aktivovaných B buněk k produkci IgE [14].
Interleukin 5 je klíčovým cytokinem pro růst, diferenciaci a vycestování eozinofilů z kostní dřeně a rovněž pro nábor, aktivaci a přežívání eozinofilů v tkáních [6,7,15–18]. Interleukin 5 ve spojení s IL 9 je schopen podnítit tkáňovou migraci mastocytů a eozinofilů.
Pacienti s tzv. Th2 high astmatem mají typický eozinofilní zánět zprostředkovaný IL 4, IL 5 a IL 13 a mohou mít zvýšené hodnoty IgE. Nemocní s tímto fenotypem obvykle dobře reagují na inhalační kortikosteroidy. Imunoglobulin E, IL 4/IL 13 a IL 5 byly určeny jako vhodné cíle pro další vývoj biologických molekul [19–21]. Nicméně existuje podskupina pacientů se závažným onemocněním, kteří nejsou schopni dobře odpovídat na inhalační kortikosteroidy. Jedná se o takzvané Th2 low astma, jež se vyznačuje především neutrofilní až paucigranulocytární infiltrací. Proces zánětu etiopatogeneticky zahrnuje subpopulaci lymfocytů Th1 a Th17. Lymfocyty Th17 jsou CD4 lymfocyty, které produkují celou řadu cytokinů, z nichž 17A a 17F stimulují buňky dýchacích cest k vylučování chemoatraktantů (např. IL 8). Chemoatraktanty zprostředkovávají neutrofilní infiltrace se zesílením zánětlivého procesu v dýchacích cestách. Lymfocyty Th1 také produkují tumor nekrotizující faktor alfa (tumor necrosis factor alpha, TNFα), významný mediátor u těžkého astmatu, neboť vyvolává v dýchacích cestách aktivaci makrofágů s rozvojem zánětu. Pro non eozinofilní astma je významné zejména zvýšení koncentrace IL 8 v dýchacích cestách, IL 5 a IL 13 jsou sice též exprimovány, ale na nízké úrovni. Je důležité si uvědomit, že významný (přibližně 30‒50%) podíl nemocných s těžkým astmatem nemá tzv. Th2 high onemocnění. V současné době nemáme žádné spolehlivé biomarkery k přesné identifikaci non eozinofilního (Th2 low) astmatu [15,22,23].
Heterogenita těžkého bronchiálního astmatu tak může limitovat účinnost biologické léčby. Narůstá proto potřeba přesných biomarkerů k určení vhodných respondérů na drahou biologickou terapii.
Vhodné biomarkery pro určení fenotypu astmatu s ohledem na biologickou léčbu
Ve studiích jsou vyhledávány odpovídající biomarkery, které by odlišily skupinu respondérů vhodných pro konkrétní léčebnou molekulu. Byly sledovány eozinofily ve sputu, v němž jejich hodnota ≥ 3 % svědčila pro eozinofilní slizniční zánět. Bohužel je však uvedené vyšetření mimo výzkumná centra jen obtížně proveditelné [24]. Zjištění eozinofilů v periferní krvi je naopak rutinním vyšetřením, jako hranice ve většině studií s biologickou léčbou zaměřenou na eozinofilní astma byla určena hodnota ≥ 300–400 buněk/µl. V některých studiích bylo prokázáno, že koncentrace eozinofilů v krvi koreluje s eozinofily ve sputu dokonce významněji než FeNO či periostin [25,26].
Z dalších biomarkerů užívaných ve studiích s biologickou léčbou byly zaznamenány koncentrace vydechovaného oxidu dusnatého. Hodnota FeNO > 50 ppb u dospělých odráží eozinofilní zánět dýchacích cest a pravděpodobnou odpověď na IKS u symptomatických astmatiků. Lze dedukovat, že pacienti s trvale zvýšenou hodnotou FeNO i přes adherenci ke kortikosteroidní léčbě mohou mít kortikorezistentní astma. Ukazatel FeNO však nikdy nelze hodnotit osamoceně, je nutné s ním pracovat jako s komponentou integrovaného řízení astmatu [27,28].
Ve studiích byla sledována hodnota IgE jako biomarker Th2 zánětu. Při senzitivitě 95 % a vyšší měly ukazatele FeNO, eozinofily v krvi a IgE srovnatelnou specificitu. Avšak IgE byl hodnocen jako méně prediktivní u eozinofilů ve sputu u atopických a obézních pacientů [29].
V bronchiálních epiteliálních buňkách astmatiků je zvýšená exprese periostinu, pokud jsou epiteliální buňky stimulovány IL 13. Recentní studie s lebrikizumabem (anti IL 13) prokázaly signifikantní zlepšení u pacientů s vyšší koncentrací periostinu v séru. Nesmíme však zapomínat, že periostin je sekretován osteoblasty při kostní patologii (metastázy, zlomeniny, osteoporóza), což někdy může být obtížné při interpretaci jeho hodnot [30,31].
Fenotypizace astmatu je nezbytným vodítkem při individualizaci léčby především u těžkých forem nemoci. Při zahajování biologické terapie musíme mít jednoznačně určen fenotyp astmatu.
Monoklonální protilátky u eozinofilního astmatu (Th2 high asthma)
Imunoglobulin E a léčba anti IgE
Protilátky IgE jsou základním spouštěcím faktorem pro rozvoj časné fáze alergické reakce, jejich imunomodulační účinek je však uváděn jako širší, neboť buněčné receptory pro molekuly IgE jsou v různé hustotě přítomny téměř na všech imunokompetentních buňkách.
V časné fázi alergické reakce je úloha mastocytů a bazofilních granulocytů klíčová. Imunoglobulin E je vázán doménou Cε3 na odpovídající buněčný receptor. Antigen/alergen se po průniku povrchovými bariérami do podslizničního prostoru naváže na IgE. Po vazbě alergenu na komplex IgE–buněčný receptor FcεRI je uskutečněn přenos signálu do buňky, což vede k okamžité degranulaci mastocytů a bazofilů s uvolněním preformovaných mediátorů a cytokinů do tkání (u bazofilů s převahou do krevního oběhu). Přemostění IgE na povrchu mastocytů vede k aktivaci fosfolipázy A2, která se soustřeďuje na jaderné membráně. Fosfolipáza A2 je schopna uvolnit z mebránových fosfolipidů kyselinu arachidonovou, která je dále metabolizována cyklooxygenázovou a 5 lipoxygenázovou cestou. Při metabolizaci cyklooxygenázou je hlavním produktem u mastocytů prostaglandin D2 (PGD2), který působí bronchokonstrikčně, podílí se na cévní permeabilitě a vazodilataci, je schopen přímé aktivace eozinofilů. Produkty metabolizace kyseliny arachidonové 5 lipoxygenázovou cestou jsou u mastocytů a eozinofilů leukotrieny. Leukotrien B4 zvyšuje expresi adhezních molekul na leukocytech. Cysteinyl leukotrieny LTC4, LTD4 a LTE4 odpovídají za prolongovanou bronchokonstrikci, nárůst kapilární permeability, působí chemotakticky pro eozinofily a neutrofily. Dalším produktem, který vzniká při metabolizaci kyseliny arachidonové, je faktor aktivující destičky (platelet activating factor, PAF) s účinky obdobnými jako u předchozích metabolitů. V pozdní fázi alergické reakce dochází prostřednictvím exprimovaných adhezních molekul v mikrovaskulárním řečišti k vycestování eozinofilů, neutrofilů a T lymfocytů do tkání a k dalšímu rozvoji zánětu s prohloubením jeho příznaků [11,32].
V současné době přibývá důkazů o nespecifické úloze IgE u perzistujících forem zánětu dýchacích cest. Je známo, že přímá stimulace T lymfocytů superantigeny, většinou bakteriálního původu, vede k lokální polyklonální odpovědi IgE a k uvolnění cytokinů, které podporují a udržují zánět. Tak může monoklonální protilátka zaměřená proti IgE nejen inhibovat alergický zánět u astmatu a rýmy, ale mohla by také hrát roli u nealergických perzistujících forem zánětu, jak bylo nedávno prokázáno u jiných onemocnění (např. u chronické autoimunitní kopřivky) [13,33].
Anti IgE protilátky – omalizumab
Dokument Globální iniciativy pro astma (Global Initiative for Asthma, GINA) je významným mezinárodním doporučením v péči o astma. Ve verzi z roku 2007 nastal významný posun, kdy byla do farmakoterapie u pacientů s těžkým perzistujícím alergickým astmatem nově zařazena biologická léčba humanizovanými anti IgE protilátkami (omalizumab). Omalizumab (Xolair) je určen pro léčbu těžkého perzistujícího alergického bronchiálního astmatu, u kterého nejsme schopni dosáhnout kontroly nad onemocněním ani při vysokých dávkách IKS a při terapii dlouhodobě působícími inhalačními ß2 agonisty nebo u něhož je třeba k uvedení nemoci pod kontrolu (včetně předcházení exacerbacím) dlouhodobá léčba systémovou kortikoterapií. Terapii omalizumabem je možné použít pouze u pacientů s IgE zprostředkovaným typem astmatu, kteří mají prokázanou alergickou vazbu na celoroční aeroalergeny buď prick testem, nebo reaktivitou in vitro. Léčba směřuje k pacientům s častými denními a nočními symptomy, popřípadě s těžkými exacerbacemi astmatu navzdory uvedené terapii. Omalizumab je aplikován podkožně v pravidelných dvou až čtyřtýdenních intervalech. Dávka a frekvence podání jsou individuální a jsou určeny hodnotou výchozího celkového IgE a hmotností pacienta. Lék je indikován u pacientů s koncentrací IgE v rozmezí 30‒1 500 IU/ml. Omalizumab jako nekortikoidní terapie s protizánětlivým působením u alergického typu těžkého perzistujícího astmatu je z hlediska dlouhodobé prognózy lékem první volby před zahájením léčby perorálními kortikosteroidy [2,33].
V České republice je tato léčba
dostupná od 1. července 2008 a je vázána na léková
centra. Indikace vychází ze společného konsensu pneumologa
a alergologa, neboť se jedná o ekonomicky náročnou
terapii. Anti IgE protilátka omalizumab se selektivně váže
na konstant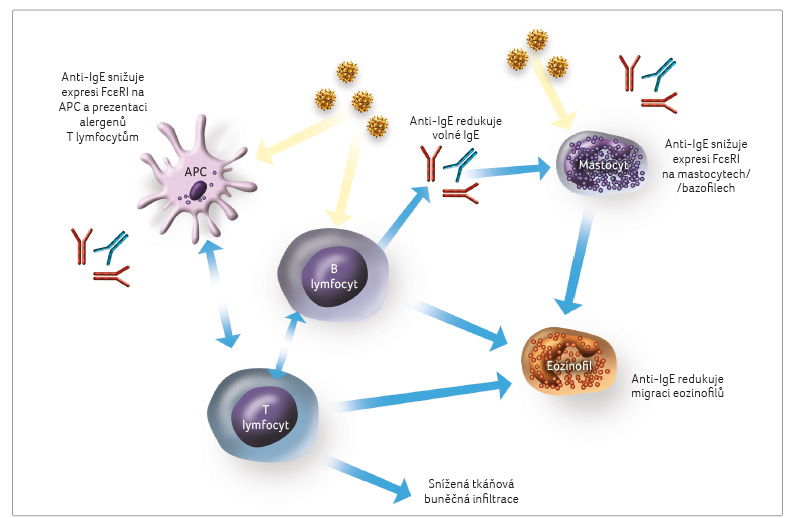 ní doménu Fce3 lidského
IgE, tedy v místě vazby IgE s vysoko
a nízkoafinními buněčnými receptory. Vazbou na cirkulující
IgE dochází ke snížení jejich sérové koncentrace až
o 96‒99 % původní hodnoty. Omezení vazby IgE
na vysokoafinní receptory zamezuje degranulaci efektorových
buněk, což vede ke snížení aktivace buněk zánětu
a k následné redukci receptorů FcεRI na mastocytech
a bazofilech. Duální mechanismus účinku je velice podstatný,
protože bez tzv. down regulace receptoru na efektorových
buňkách by bylo nutno vyvázat takřka veškerý volný IgE
k dostatečně účinné blokádě dalších dějů
zprostředkovaných bazofily a žírnými buňkami. Role
omalizumabu je však širší ‒ je schopen vazby s molekulami
IgE exprimovanými na B lymfocytech, čímž inhibuje tvorbu
nových IgE protilátek. Omalizumab ovlivňuje expresi receptorů
na antigen prezentujících buňkách a zasahuje
do mechanismu aktivace T lymfocytů (obr. 1).
ní doménu Fce3 lidského
IgE, tedy v místě vazby IgE s vysoko
a nízkoafinními buněčnými receptory. Vazbou na cirkulující
IgE dochází ke snížení jejich sérové koncentrace až
o 96‒99 % původní hodnoty. Omezení vazby IgE
na vysokoafinní receptory zamezuje degranulaci efektorových
buněk, což vede ke snížení aktivace buněk zánětu
a k následné redukci receptorů FcεRI na mastocytech
a bazofilech. Duální mechanismus účinku je velice podstatný,
protože bez tzv. down regulace receptoru na efektorových
buňkách by bylo nutno vyvázat takřka veškerý volný IgE
k dostatečně účinné blokádě dalších dějů
zprostředkovaných bazofily a žírnými buňkami. Role
omalizumabu je však širší ‒ je schopen vazby s molekulami
IgE exprimovanými na B lymfocytech, čímž inhibuje tvorbu
nových IgE protilátek. Omalizumab ovlivňuje expresi receptorů
na antigen prezentujících buňkách a zasahuje
do mechanismu aktivace T lymfocytů (obr. 1).
Cochranův přehled v roce 2014 zkoumal 25 studií a potvrdil, že omalizumab je účinný při snížení počtu exacerbací u středně těžkých až těžkých astmatiků. Léčba omalizumabem prokazuje rovněž pokles počtu hospitalizací a u pacientů došlo ke snížení dávky IKS [34]. V analýzách studií byli zkoumáni pacienti s nekontrolovaným těžkým astmatem, kteří byli léčeni placebem nebo omalizumabem. V prospektivní multicentrické, dvojitě zaslepené, placebem kontrolované studii EXTRA byli nemocní rozděleni podle biomarkerů. Bylo potvrzeno, že u astmatiků s hodnotou FeNO více než 24 ppb, s koncentrací eozinofilů více než 260 buněk/µl a s koncentrací periostinu vyšší než 50 ng/ml došlo k vysoce signifikantnímu poklesu počtu exacerbací po 48 týdnech léčby [34].
V současnosti jsou dostupné výsledky tzv. real life studií z hlediska účinnosti léčby. Tyto studie ukázaly, že po prvním roce léčby došlo ke zlepšení skóre dotazníku kvality života AQLQ (Asthma Quality of Life Questionnaire) o 84 % s poklesem závažných exacerbací astmatu o 65 %. Příznivě lze hodnotit fakt, že účinek dlouhodobě podávaného omalizumabu narůstá s časem. Mezinárodní registr pacientů léčených omalizumabem (registr eXpeRience) prokázal pokles exacerbací astmatu o 54 % po 12 měsících a o 67 % po 24 měsících terapie [35,36]. Uvedené studie rovněž potvrdily, že pacienti léčení omalizumabem podstoupili méně hospitalizací a méně návštěv v rámci akutní péče [37].
Po ukončení terapie se koncentrace IgE vrátí k původní hodnotě do 18‒20 týdnů. Tento ukazatel však nemusí vždy souviset s relapsem choroby [37]. Multicentrická retrospektivní studie provedená ve Francii prokázala, že vysazení omalizumabu nebylo spojeno s žádným rebound účinkem a kontrola nad astmatem trvala ještě šest měsíců u téměř poloviny všech pacientů [38]. V další práci uskutečněné formou pilotního sledování bylo pozorováno signifikantní snížení dávek IKS, zmírnění pozitivity kožních prick testů a pokles skóre Testu kontroly astmatu (TKA). Signifikantní účinek ukončené léčby omalizumabem přetrvával ještě 12 měsíců v podobě redukovaných dávek IKS a nízkého skóre TKA [39].
Omalizumab je obecně velmi dobře snášen a celkový výskyt nežádoucích účinků je obdobný jako u kontrolní skupiny. K nejčastějším nežádoucím účinkům u dospělých i dětí patřily nazofaryngitidy, bolest hlavy, infekce horních cest dýchacích a zánět vedlejších nosních dutin. Anafylaxe se vyskytuje u 0,14 % pacientů ve srovnání s 0,07 % u nemocných ve skupině s placebem a může k ní dojít kdykoliv v průběhu léčby. Byl též zaznamenán zvýšený zájem ohledně možnosti rizika vzniku maligního onemocnění při léčbě omalizumabem. Počáteční data z fáze I‒III klinických studií ukázala nerovnováhu v počtu výskytu malignity mezi placebovou skupinou (0,18 %) a skupinou s omalizumabem (0,5 %), avšak míra výskytu ve skupině s omalizumabem je srovnatelná s výskytem v obecné populaci [31,40].
Interleukin 5 a léčba anti IL 5
Léčebný postup vůči signální dráze IL 5 prošel zevrubným zkoumáním a molekuly nyní přecházejí od fáze klinických studií do klinické praxe. Tyto monoklonální protilátky působí buď inhibicí endogenních ligand pro IL 5 (mepolizumab, reslizumab), nebo se vážou přímo na receptor pro IL 5 (benralizumab).
Mepolizumab
Mepolizumab je humanizovaná monoklonální protilátka třídy imunoglobulinu G1, která má vysoce specifickou afinitu k IL 5. Blokuje vazbu IL 5 na řetězci α receptoru pro IL 5, jenž je lokalizován na povrchu eozinofilů. Tato vazba inhibuje aktivity IL 5, dochází ke snížení tvorby a k přežívání eozinofilů. Mepolizumab byl povolen Úřadem pro schvalování terapeutických prostředků (Therapeutic Goods Administration, TGA) v Austrálii, Evropskou lékovou agenturou (European Medicines Agency, EMA) a americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) jako přídatná léčba pro těžké refrakterní eozinofilní astma u pacientů ve věku nad 12 let [41,42]. Studie u astmatiků s eozinofilním zánětem prokázaly snížení počtu exacerbací astmatu a redukci užívání perorálních kortikosteroidů. DREAM byla rozsáhlá multicentrická studie, která vyšetřovala intravenózní aplikaci mepolizumabu v dávkách 75 mg, 250 mg a 750 mg oproti placebu. Léčba redukovala výskyt ataky astmatu přibližně o 50 % a prokázala, že nižší dávky mepolizumabu mají obdobnou účinnost jako dávky vysoké. Následné analýzy studie DREAM prokázaly, že mepolizumab měl nejvyšší účinek u astmatiků s počtem eozinofilů ≥ 150 buněk/µl [43]. Studie SIRIUS byla zaměřena na tzv. kortikosteroid šetřící (steroid sparing) účinek přípravku. Mepolizumab ve srovnání s placebem u pacientů s těžkým astmatem prokázal procentuální snížení dávky kortikosteroidů o polovinu. Kromě toho došlo u pacientů k signifikantnímu snížení počtu exacerbací. Je důležité si uvědomit, že po ukončení léčby mepolizumabem dochází k návratu koncentrace eozinofilů k původním hodnotám do tří měsíců a k návratu do původního klinického stavu do 3‒6 měsíců [16]. Přípravek je velmi dobře snášen a v klinické praxi je povolen pouze pro subkutánní aplikaci.
Reslizumab
Reslizumab je taktéž humanizovaná monoklonální protilátka proti IL 5 s regulací jeho aktivity. V březnu 2016 byl povolen agenturami EMA a FDA jako přídatná terapie u těžkých eozinofilních astmatiků ve věku nad 18 let, přípravek je podáván intravenózně. Reslizumab prokázal zlepšení v různých parametrech kontroly nad astmatem u pacientů s nedostatečnou kontrolou nad chorobou a s hodnotou eozinofilů ≥ 400 buněk/µl. Do studií fáze III byli taktéž randomizováni astmatici, u nichž byla hodnota eozinofilů < 400 buněk/µl. U této skupiny pacientů nenastalo signifikantní zlepšení v případě jednovteřinového usilovného výdechu (FEV1) ve srovnání s placebem. Subanalýza u pacientů s koncentrací eozinofilů ≥ 400 buněk/µl prokázala příznivý účinek se zlepšením hodnoty FEV1 a skóre dotazníku kvality života ve srovnání s placebem [44–46].
Benralizumab
Benralizumab je humanizovaná monoklonální protilátka zaměřená proti řetězci α receptoru pro IL 5 (anti IL 5RαIgG1) na eozinofilech a bazofilech. Blokádou tohoto receptoru je indukována apoptóza eozinofilů a bazofilů zprostředkovaná buněčnou cytotoxicitou závislou na protilátkách, v důsledku toho dochází ke snížení koncentrace eozinofilů v cirkulaci i tkáňově. Byly provedeny placebem kontrolované studie u těžkých astmatiků. K určení eozinofilního fenotypu byl stanoven index eozinofily/lymfocyty a eozinofily/neutrofily (tzv. index ELEN) nebo FeNO > 50 ppb. Index ELEN byl doporučen jako matematický algoritmus predikující zvýšenou koncentraci eozinofilů ve sputu > 2 %. V analýzách po ukončení studie bylo dokladováno, že pacienti v aktivní větvi s hodnotou eozinofilů ≥ 300 buněk/µl prokázali signifikantní zlepšení FEV1 a skóre dotazníku kontroly astmatu ACQ 6 (Asthma Control Questionnaire). Taktéž další studie (SIROCCO) fáze III u těžkých astmatiků užívajících vysoké dávky IKS a dlouhodobě působících agonistů dokladovaly signifikantní zlepšení pouze u astmatiků s hodnotou eozinofilů ≥ 300 buněk/µl. Přípravek byl velmi dobře snášen [47–49].
Léčba anti IL 4/anti IL 13
Lebrikizumab
Lebrikizumab je IgG4 humanizovaná monoklonální protilátka, která se váže na IL 13 a znemožňuje tím vazbu uvedeného interleukinu na receptor IL 4/IL 13. Úvodní studie v neselektovaných souborech pacientů byly zklamáním [31,50,51]. Avšak při selekci astmatiků založené na biomarkerech byla identifikována podskupina pacientů, pro niž může mít léčba přínos. Za vhodný biomarker byl zvolen periostin jako ukazatel aktivace IL 13. Ve fázi II studie MILLY byli zahrnuti astmatici s nedostatečně kontrolovaným astmatem. Účastníci dostávali subkutánně lebrikizumab jednou měsíčně po dobu půl roku nebo placebo. Nemocní byli na počátku rozděleni podle reaktivity Th2, která byla definována jako celková hodnota IgE > 100 IU/µl nebo počet eozinofilů > 140 buněk/µl. Analýzy byly později zaměřeny ke koncentraci periostinu. Ve skupině s lebrikizumabem bylo prokázáno zlepšení v prebronchodilatační hodnotě FEV1 u pacientů s vysokou koncentrací periostinu, avšak skóre testu ACQ 5 nebo počet exacerbací byly bez statistické významnosti při porovnání obou skupin. V dalších studiích fáze IIB byl sledován účinek lebrikizumabu u pacientů se středně těžkým až těžkým astmatem (studie LUTE a VERSE) [51]. Analýza byla založena na vysokých koncentracích periostinu (≥ 50 ng/ml) nebo na jeho nízkých koncentracích (< 50 ng/ml). Pacienti s vysokou koncentrací periostinu měli o 60 % nižší výskyt exacerbací, u astmatiků s nízkou koncentrací periostinu nastalo pouze 5% snížení počtu exacerbací. Zvýšené hodnoty FeNO (≥ 21 ppb) a počet eozinofilů (≥ 240 buněk/µl) byly taktéž vhodným prediktivním ukazatelem pro léčebnou odpověď. Ačkoliv měl lebrikizumab příznivý vliv na počet exacerbací, nebyl tento ukazatel následován signifikantním zmírněním příznaků astmatu nebo zlepšením kvality života. Dvě nedávné studie fáze III (LAVOLTA I, LAVOLTA II) prokázaly, že u astmatiků s vysokou koncentrací periostinu nebo s eozinofilií nastal signifikantní pokles počtu exacerbací astmatu (periostin ≥ 50 ng/ml nebo eozinofily ≥ 300 buněk/µl) [17,18].
Tralokinumab
Tralokinumab je monoklonální protilátka vůči IL 13, která neutralizuje uvedený interleukin bez účinku na aktivitu IL 4. Ve studii fáze IIB byl těžkým astmatikům podáván tralokinumab každé dva nebo čtyři týdny. V aktivní větvi nebyly prokázány redukce počtu exacerbací ani vliv na kvalitu života. Ve srovnání s placebem však byl zaznamenán signifikantní nárůst v hodnotě FEV1. Jako potenciální biomarker byla v této studii určena dipeptidylpeptidáza 4 (DPP 4) jako produkt genu, který je indukován IL 13 v epiteliálních buňkách dýchacích cest. Tento marker bude nadále užíván ke stratifikaci pacientů v následných studiích s tralokinumabem [52].
Dupilumab
Dupilumab je plně humánní monoklonální protilátka vůči podjednotce α receptoru pro IL 4, čímž inhibuje signální dráhu jak pro IL 4, tak pro IL 13. Studie fáze II sledovala účinek léčby subkutánně aplikovaným dupilumabem v dávce 300 mg jednou týdně po dobu 12 týdnů vůči placebu. Zařazeni byli astmatici se středně těžkým až těžkým perzistujícím astmatem a zvýšeným počtem eozinofilů (≥ 300 buněk/µl) nebo s počtem eozinofilů ve sputu ≥ 3 %. V průběhu studie byla u pacientů ukončena léčba dlouhodobě působícími β2 agonisty a posléze inhalačními kortikosteroidy. Ve skupině aktivní byl počet exacerbací redukován o 87 %, nebylo dokladováno zlepšení v případě FEV1 ani ve skóre ACQ 5. V následných studiích fáze IIB byl pacientům aplikován subkutánně dupilumab 200 mg nebo 300 mg každé dva nebo čtyři týdny po dobu 24 týdnů. Ve skupině, kde byl dupilumab aplikován každé dva týdny, byl dokumentován pokles počtu těžkých exacerbací astmatu a zlepšení hodnoty FEV1. Hlavními nežádoucími účinky byly infekce dýchacích cest, zarudnutí v místě aplikace injekce a bolesti hlavy. V současné době probíhají studie fáze III [53,54].
Pitrakinra
Pitrakinra je rekombinantní humánní varianta IL 4, která kompetitivně inhibuje komplex receptoru IL 4Rα, a tím narušuje signální dráhu jak pro IL 4, tak pro IL 13. Při užití pitrakinry u pacientů s atopickým astmatem bylo prokázáno, že dochází k nižšímu poklesu v hodnotě FEV1 po bronchoprovokačním testu alergenem v průběhu následné pozdní astmatické odpovědi ve srovnání s placebem [55]. Ve farmakogenetické studii u nemocných se středně těžkým až těžkým astmatem bylo zjištěno, že signifikantně nižší počet exacerbací nastal u pacientů se specifickým jednonukleotidovým polymorfismem v netranslatované oblasti 3 pro receptor α IL 4. To naznačuje, že tato podskupina pacientů může mít větší přínos z léčby pitrakinrou [56].
Monoklonální protilátky u non eozinofilního astmatu (Th2 low asthma)
Brodalumab, secukinumab, blokátory pro receptory TNFα
Brodalumab je humánní monoklonální anti IL 17RA protilátka třídy imunoglobulinu G2, která se váže s vysokou afinitou na receptor pro IL 17 a blokuje biologickou aktivitu IL 17A, IL 17F, IL 17AF heterodimeru a IL 25. Studie s brodalumabem u středně těžkého až těžkého astmatu při léčbě IKS prokázaly zlepšení ve skóre ACQ, v hodnotě FEV1 a v navýšení počtu dnů bez příznaků astmatu.
Secukinumab je monoklonální protilátka zaměřená proti cytokinu IL 17A, která prokázala zmírnění klinických příznaků u jiných onemocnění s převahou lymfocytů Th17, jako jsou psoriáza a revmatoidní artritida. Fáze II klinických studií se soubory pacientů s nekontrolovaným astmatem již byly dokončeny, nyní se výsledky vyhodnocují a nejsou zatím k dispozici.
Blokátory pro receptory TNFα, jako
jsou etanercept a golimumab, bohužel nepůsobily příznivě
na průběh astmatu. U studií s golimumabem bylo
dokonce prokázáno zvýšené riziko zhoubných onemocnění
a vážných infekcí a sledování byla následně
přerušena [57,58]. Výrazný účinek oproti biologické léčbě
prokázala u non eozinofilního astmatu terapie
makrolidovými antibiotiky. Ve studii AZISAST (Azithromycin for
Prevention of Exacerbations in Severe Asthma) bylo zjištěno, že
užívání azithromycinu vedlo k redukci výskytu těžkých
exacerbací u astmatiků s koncentrací eozinofilů ≤ 200
buněk/µl ve srovnání s placebem [59].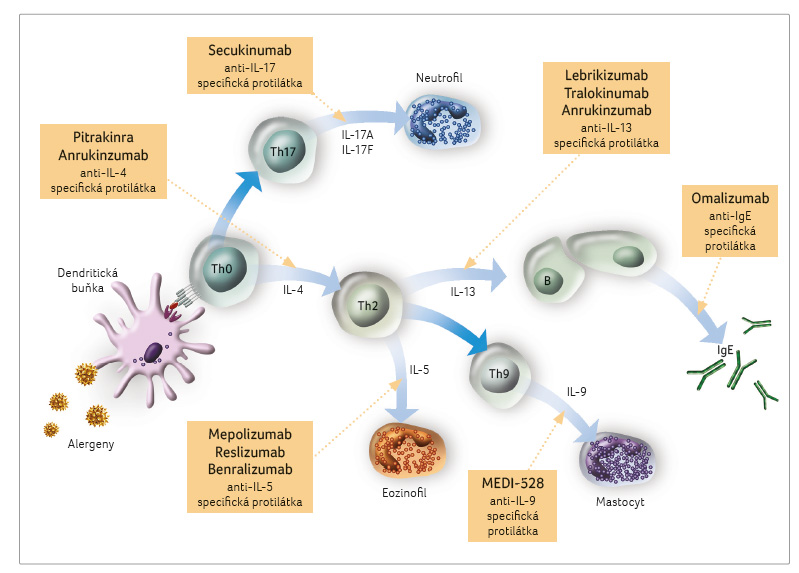
Závěr
Z vývoje biologických léčiv v terapii středně těžkého až těžkého bronchiálního astmatu je zřejmé, že příznivý účinek je dokladován zejména u pacientů, kteří mají vyšší koncentraci eozinofilů v krvi a prokazatelné další biomarkery eozinofilního zánětu (eozinofily ve sputu, FeNO, periostin). Různé přehledové analýzy však udávají, že těžcí astmatici vykazují fenotyp Th2 pouze ve zhruba 55 %, u ostatních astmatiků je buněčný profil neutrofilní či paucigranulocytární. Taktéž jiné faktory mohou oslabovat odpověď na biologickou léčbu. V klinickém obraze těžkého astmatu se uplatňuje remodelace dýchacích cest a zlepšení hodnoty FEV1 při uvedené terapii nemusí být signifikantní. Účinek biologické léčby zaměřené na tzv. Th2 zánět může být redukován chronickou nebo též akutní endobronchiální infekcí a dalšími faktory, jako jsou gastroezofageální reflux nebo dysfunkce hlasivkových vazů. Před zahájením finančně náročné biologické léčby je třeba vyloučit či pojmenovat veškeré komorbidity, které ztěžují terapii astmatu.
Acknowledgment: This work was
supported
by Charles University in Prague, Faculty of
Medicine in Hradec Kralove, Czech Republic,
project “PRVOUK”
P37/10 and PROGRES.
Seznam použité literatury
- [2] Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2016. http://www.ginaasthma.org. Accessed 16 Aug 2016.
- [3] Global Asthma Network. Global Asthma Report 2014. http://www.globalasthmareport.org/priority/ncd.php. Accessed 16 Aug 2016.
- [4] Bahadori K, Doyle‑Waters MM, Marra C, et al. Economic burden of asthma: a systematic review. BMC Pulm Med 2009; 9: 24. doi:10.1186/1471‑2466‑9‑24
- [5] Braman SS. The global burden of asthma. Chest 2006; 130(Suppl 1): 4–12.
- [6] Chung KF, Wenzel SE, Brozek JL, et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J 2014; 43: 343–373.
- [7] Chung KF. Targeting the interleukin pathway in the treatment of asthma. Lancet 2015; 386: 1086–1096.
- [8] Denlinger LC, Philips BR, Ramratnam S, et al. Inflammatory and co‑morbid features of patients with severe asthma and frequent exacerbations. Am J Respir Crit Care Med (Epub 24 Aug 2016).
- [9] Lefaudeux D, De Meulder B, Loza MJ, et al.; U‑BIOPRED Study Group. U‑BIOPRED clinical adult asthma clusters linked to a subset of sputum omics. J Allergy Clin Immunol. doi:10.1016/j. jaci.2016.08.048 (Epub 20 October 2016).
- [10] Woodruff PG, Modrek B, Choy DF, et al. T‑helper type 2‑driven inflammation defines major subphenotypes of asthma. Am J Respir Crit Care Med 2009; 180: 388–395.
- [11] Trevor JL, Deshane JS. Refractory asthma: mechanisms, targets, and therapy. Allergy 2014; 69: 817–827.
- [12] Van Rijt L, von Richthofen H, van Ree R. Type 2 innate lymphoid cells: at the cross‑roads in allergic asthma. Semin Immunopathol 2016; 38: 483–496.
- [13] Wenzel SE. Asthma phenotypes: the evolution from clinical to molecular approaches. Nat Med 2012; 18: 716–725.
- [14] Gandhi A, Bennett BL, Graham NM, et al. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov 2016; 15: 35–50.
- [15] Green RH, Brightling CE, Woltmann G, et al. Analysis of induced sputum in adults with asthma: identification of subgroup with isolated sputum neutrophilia and poor response to inhaled corticosteroids. Thorax 2002; 57: 875–879.
- [16] Haldar P, Brightling CE, Singapuri A, et al. Outcomes after cessation of mepolizumab therapy in severe eosinophilic asthma: a 12‑month follow‑up analysis. J Allergy Clin Immunol 2014; 133: 921–923.
- [17] Hanania NA, Korenblat P, Chapman KR, et al. Efficacy and safety of lebrikizumab in patients with uncontrolled asthma (LAVOLTA I and LAVOLTA II): replicate, phase 3, randomised, double‑blind, placebo‑controlled trials. Lancet Respir Med 2016; 4: 781–796. doi:10.1016/S2213‑2600(16)30265‑X
- [18] Fowler SJ, Tavernier G, Niven R. High blood eosinophil counts predict sputum eosinophilia in patients with severe asthma. J Allerg Clin Immunol 2015; 135: 822–824.
- [19] Maes T, Joos GF, Brusselle GG. Targeting interleukin‑4 in asthma: lost in translation? Am J Respir Cell Mol Biol 2012; 47: 261–270.
- [20] Walter DM, McIntire JJ, Berry G, et al. Critical role for IL‑13 in the development of allergen‑induced airway hyperreactivity. J Immunol 2001; 167: 4668–4675.
- [21] Webb DC, McKenzie AN, Koskinen AM, et al. Integrated signals between IL‑13, IL‑4, and IL‑5 regulate airways hyperreactivity. J Immunol 2000; 165: 108–113.
- [22] Moore WC, Hastie AT, Li X, et al. Sputum neutrophil counts are associated with more severe asthma phenotypes using cluster analysis. J Allergy Clin Immunol 2014; 133: 1557–1563.
- [23] Schleich F, Brusselle G, Louis R, et al. Heterogeneity of phenotypes in severe asthmatics. The Belgian Severe Asthma Registry (BSAR). Respir Med 2014; 108: 1723–1732.
- [24] Petsky HL, Cates CJ, Lasserson TJ, et al. A systematic review and meta‑analysis: tailoring asthma treatment on eosinophilic markers (exhaled nitric oxide or sputum eosinophils). Thorax 2012; 67: 199–208.
- [25] Hanania NA, Noonan M, Corren J, et al. Lebrikizumab in moderate‑to‑severe asthma: pooled data from two randomised placebo‑controlled studies. Thorax 2015; 70: 748–756.
- [26] Wagener AH, de Nijs SB, Lutter R, et al. External validation of blood eosinophils, FE(NO) and serum periostin as surrogates for sputum eosinophils in asthma. Thorax 2015; 70: 115–120.
- [27] Parulekar AD, Diamant Z, Hanania NA. Role of T2 inflammation biomarkers in severe asthma. Curr Opin Pulm Med 2016; 22: 59–68.
- [28] Petsky HL, Kew KM, Turner C, Chang AB. Exhaled nitric oxide levels to guide treatment for adults with asthma. Cochrane Database Syst Rev 2016; (9): CD011440.
- [29] Westerhof GA, Korevaar DA, Amelink M, et al. Biomarkers to identify sputum eosinophilia in different adult asthma phenotypes. Eur Respir J 2015; 46: 688–696.
- [30] Conway SJ, Izuhara K, Kudo Y, et al. The role of periostin in tissue remodeling across health and disease. Cell Mol Life Sci 2014; 71: 1279–1288.
- [31] Corren J, Lemanske RF, Hanania NA, et al. Lebrikizumab treatment in adults with asthma. N Engl J Med 2011; 365: 1088–1098.
- [32] Corren J, Casale TB, Lanier B, et al. Safety and tolerability of omalizumab. Clin Exp Allergy 2009; 39: 788–797.
- [33] Kuhl K, Hanania NA. Targeting IgE in asthma. Curr Opin Pulm Med 2012; 18: 1–5.
- [34] Normasell R, Walker S, Milan SJ, et al. Omalizumab for asthma in adults and children. Cochrane Database Syst Rev 2014; CD003559.
- [35] Braunstahl GJ, Chen CW, Maykut R, et al. The eXpeRience registry: the “realworld” effectiveness of omalizumab in allergic asthma. Respir Med 2013; 107: 1141–1151.
- [36] Brusselle G, Michils A, Louis R, et al. “Real‑life” effectiveness of omalizumab in patients with severe persistent allergic asthma: the PERSIST study. Respir Med 2009; 103: 1633–1642.
- [37] Slavin RG, Ferioli C, Tannenbaum SJ, et al. Asthma symptom re‑emergence after omalizumab withdrawal correlates well with increasing IgE and decreasing pharmacokinetic concentrations. J Allergy Clin Immunol 2009; 123: 107–113.
- [38] Molimard M, Mala L, Bourdeix I, Le Gros V. Observational study in severe asthmatic patients after discontinuation of omalizumab for good asthma control. Respir Med 2014; 108: 571–576.
- [39] Krcmova I, Novosad J. One year follow‑up of patients after omalizumab treatment withdrawal, ISAF /2017, Manchester.
- [40] Long A, Rahmaoui A, Rothman KJ, et al. Incidence of malignancy in patients with moderate‑to‑severe asthma treated with or without omalizumab. J Allergy Clin Immunol 2014; 134: 560–567.
- [41] Ortega HG, Liu MC, Pavord ID, et al. Mepolizumab treatment in patients with severe eosinophilic asthma. N Engl J Med 2014; 371: 1198–1207.
- [42] Therapeutic Goods Administration. Mepolizumab (Nucala) product information, 2016. https://www.ebs.tga.gov.au/ebs/picmi/picmirepository.nsf/pdf?OpenAgent&id=CP‑2016‑PI01215‑1&d=2016090916114622483. Accessed 16 Aug 2016.
- [43] Pavord ID, Korn S, Howarth P, et el. Mepolizumab for severe eosinophilic asthma (DREAM): a multi‑centre, double blind, placebo‑controlled trial. Lancet 2012; 380: 651–659.
- [44] Bjermer L, Lemiere C, Maspero J, et al. Reslizumab for inadequately controlled asthma with elevated blood eosinophil levels: a randomized phase 3 study. Chest 2016; 150: 789–798. doi:10.1016/j.chest.2016.03.032
- [45] Castro M, Zangrilli J, Wechsler ME, et al. Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: results from two multicenter, parallel, double‑blind, randomized, placebo controlled, phase 3 trials. Lancet Respir Med 2015; 3: 355–366.
- [46] Corren J, Weinstein S, Janka L, Zangrilli J, Garin M. Phase 3 study of reslizumab in patients with poorly controlled asthma: effects across a broad range of eosinophil counts. Chest 2016; 150: 799–810.
- [47] leecker ER, FitzGerald JM, Chanez P, et al. Efficacy and safety of benralizumab for patients with severe asthma uncontrolled with high‑dosage inhaled corticosteroids and long‑acting beta2agonists (SIROCCO): a randomised, multicentre, placebo‑controlled phase 3 trial. Lancet 2016; 388: 2115–2127. doi:10. 1016/S0140‑6736(16)31324‑1
- [48] Busse WW, Katial R, Gossage D, et al. Safety profile, pharmacokinetics, and biologic activity of MEDI‑563, an anti‑IL‑5 receptor alpha antibody, in a phase I study of subjects with mild asthma. J Allergy Clin Immunol 2010; 125: 1237–1244.
- [49] Fitzgerald JM, Bleecker ER, Nair P, et al. Benralizumab, an antiinterleukin‑5 receptor alpha monoclonal antibody, as add‑on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomised, double‑blind, placebo‑controlled phase 3 trial. Lancet 2016; 388: 2128–2141. doi:10. 1016/S0140‑6736(16)31322
- [50] De Boever EH, Ashman C, Cahn AP, et al. Efficacy and safety of an anti‑IL‑13 mAb in patients with severe asthma: a randomized trial. J Allergy Clin Immunol 2014; 133: 989–996.
- [51] Noonan M, Korenblat P, Mosesova S, et al. Dose‑ranging study of lebrikizumab in asthmatic patients not receiving inhaled steroids. J Allergy Clin Immunol 2013; 132: 567–574.
- [52] Brightling CE, Chanez P, Leigh R, et al. Efficacy and safety of tralokinumab in patients with severe uncontrolled asthma: a randomised, double‑blind, placebo‑controlled, phase 2b trial. Lancet Respir Med 2015; 3: 692–701.
- [53] Wenzel S, Castro M, Corren J, et al. Dupilumab efficacy and safety in adults with uncontrolled persistent asthma despite use of medium‑to‑high‑dose inhaled corticosteroids plus a long‑acting beta2 agonist: a randomised double‑blind placebo‑controlled pivotal phase 2b dose‑ranging trial. Lancet 2016; 388: 31–44.
- [54] Wenzel S, Ford L, Pearlman D, et al. Dupilumab in persistent asthma with elevated eosinophil levels. N Engl J Med 2013; 368: 2455–2466.
- [55] Wenzel S, Wilbraham D, Fuller R, et al. Effect of an interleukin‑4 variant on late phase asthmatic response to allergen challenge in asthmatic patients: results of two phase 2a studies. Lancet 2007; 370: 1422–1431.
- [56] Slager RE, Otulana BA, Hawkins GA, et al. IL‑4 receptor polymorphisms predict reduction in asthma exacerbations during response to an anti‑IL‑4 receptor alpha antagonist. J Allergy Clin Immunol 2012; 130: 516–522.
- [57] Busse WW, Holgate S, Kerwin E, et al. Randomized, double‑blind, placebo‑controlled study of brodalumab, a human anti‑IL‑17 receptor monoclonal antibody, in moderate to severe asthma. Am J Respir Crit Care Med 2013; 188: 1294–1302.
- [58] Morishima Y, Ano S, Ishii Y, et al. Th17‑associated cytokines as a therapeutic target for steroid‑insensitive asthma. Clin Dev Immunol 2013; 2013: 609395.
- [59] Brusselle GG, Vanderstichele C, Jordens P, et al. Azithromycin for prevention of exacerbations in severe asthma (AZISAST): a multicentre randomised double‑blind placebo controlled trial. Thorax 2013; 68: 322–329.