Biologická léčba psoriatické artritidy
Psoriatická artritida (PsA) je chronické zánětlivé kloubní onemocnění charakterizované přítomností artritidy a psoriázy. Psoriáza zpravidla předchází manifestaci kloubního syndromu (asi v 85 %), méně často se oba syndromy manifestují současně (asi v 15 %), u části pacientů předchází artritida manifestaci kožního syndromu (asi v 5 %). V roce 1964 byla psoriatická artritida vyčleněna jako samostatná jednotka odlišná od revmatoidní artritidy [1]. Léčebné možnosti psoriatické artritidy představují nesteroidní antiflogistika, chorobu modifikující léky (DMARDs – disease modifying antirheumatic drugs), kortikoidy a v poslední době tzv. biologická léčba. Nesteroidní antiflogistikum by mělo být v období aktivity onemocnění podáváno v plné dávce odpovídající příslušnému preparátu až do dosažení remise. Při neúspěchu léčby nesteroidními antiflogistiky je nezbytné zahájit léčbu některým z preparátů ze skupiny chorobu modifikujících farmak. Mezi farmaka s dokumentovaným účinkem u psoriatické artritidy patří sulfasalazin, methotrexat, leflunomid a ciclosporin v monoterapii nebo v kombinacích. U ostatních farmak pocházejí doklady o účinnosti jen z ojedinělých, zpravidla nekontrolovaných studií a jejich účinek není jednoznačný nebo je spojen s nežádoucími vedlejšími účinky na kožní syndrom.
Biologická léčba
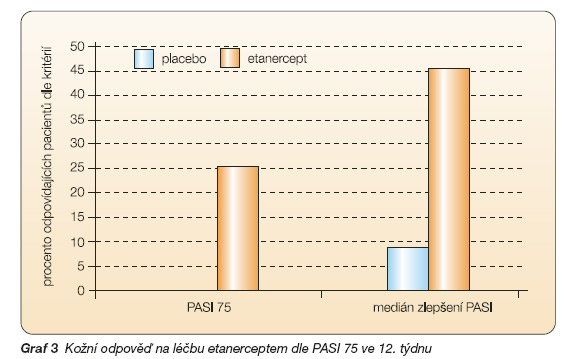
Neúčinnost chorobu modifikujících farmak u části pacientů s psoriatickou artritidou a nepřesvědčivé výsledky studií sledujících radiologickou progresi urychlily snahu o vývoj nových účinnějších farmak s cílem ovlivnit nejen klinickou aktivitu, ale i radiologickou progresi. Vývoj těchto nových farmak vychází ze znalostí klíčové role T lymfocytů a cytokinů produkovaných aktivovanými imunokompetentními buňkami v patogenezi psoriatické artritidy. Mezi nejvýznamnější cytokiny patří faktor nekrotizující tumory (TNF-a – tumor necrosis factor-a) a interleukin-1 (IL-1). Tyto poznatky vedly k vývoji látek specificky zaměřených na neutralizaci těchto cytokinů, v prvé řadě TNF-a. Léčba těmito farmaky se ukázala být vysoce účinná u revmatoidní artritidy rezistentní na léčbu standardními chorobu modifikujícími farmaky, a to při sledování prakticky všech dostupných parametrů. Méně zkušeností s touto léčbou je u spondylartritid včetně psoriatické artritidy. Zájem o tuto léčbu právě u spondylartritid byl podnícen průkazem přítomnosti TNF-a nejen v psoriatických kožních lézích [2], ale i v synovii kloubu postiženého artritidou [3] a zejména v místě zánětlivě změněných úponů šlach a kloubního pouzdra do kosti (entezitis) [4]. Právě entezitida je v současné době pokládána za primární zánětlivou afekci v patogenezi jak periferních artritid, tak sakroiliitidy a spondylitidy u spondylartritid. Léčba zaměřená proti TNF-a by tedy mohla příznivě ovlivnit jak periferní kloubní, tak axiální syndrom u spondylartritid, což se nepodařilo žádnému z tradičních chorobu modifikujících farmak. Tento předpoklad byl později potvrzen v řadě otevřených i randomizovaných kontrolovaných studií. Jiný přístup k biologické léčbě představuje snaha ovlivnit aktivaci T buněk na úrovni receptoru na T lymfocytu (TCR), na úrovni kostimulačních molekul, inhibicí proliferace T buněk, resp. jejich destrukcí, nebo tzv. imunomodulátory. Některé z těchto látek jsou již pro léčbu PsA registrované, studie s jinými probíhají. Mimoto existují látky zkoušené zatím u jiných onemocnění, které by se mohly v blízké budoucnosti stát předmětem výzkumu i u psoriatické artritidy. Přehled biologických léků pro léčbu PsA viz tab. 1.
V současné době je nejvíce zkušeností s anticytokinovou léčbou zaměřenou proti TNF-a, s infliximabem, s etanerceptem a s adalimumabem. Všechny tyto látky vykazují intenzivní protizánětlivý účinek tím, že vážou a inaktivují volný, resp. vázaný TNF-a [5]. Infliximab a etanercept jsou v ČR registrovány pro léčbu PsA, registrace adalimumabu v ČR se připravuje.
Preparáty pro biologickou léčbu PsA
Infliximab
Infliximab je chimérická monoklonální protilátka proti tumor nekrotizujícímu faktoru-a. Molekula infliximabu je tvořena ze 75 % humánní a z 25 % myší komponentou (variabilní část imunoglobulinové molekuly – Fab). Váže se jak na solubilní, tak na transmembránovou formu TNF-a v pikomolárních koncentracích. Tento komplex váže komplement a vede k lýze buňky [6]. Infliximab (na rozdíl od etanerceptu) neváže TNF-b (lymfotoxin).
Farmakodynamika
Klinického účinku infliximabu je kromě blokády TNF-a dosaženo několika dalšími mechanismy:
1. Ovlivněním některých působků angažovaných v genezi zánětu
a) snížením plazmatických hladin cytokinů: interleukinu-1b (IL-1b) a interleukinu-6 (IL-6);
b) snížením exprese chemokinů: interleukinu-8 (IL-8) a proteinu přitahujícího monocyty (monocyte chemoattractant protein-1 – MCP-1) v synoviální tkáni;
c) snížením plazmatické koncentrace metaloproteinázy-3;
d) snížením aktivity syntázy oxidu dusnatého (NOS).
2. Ovlivněním migrace lymfocytů
Infliximab snižuje expresi adhezivních molekul na endotelu synoviálních cév a tím migraci lymfocytů do kloubu s následným zvýšením počtu lymfocytů v periferní krvi. Snížená migrace lymfocytů do kloubu snižuje možnost interakce lymfocytů s makrofágy v kloubu.
3. Ovlivněním neoangiogeneze
Infliximab snižuje plazmatické koncentrace vaskulárního endoteliálního růstového faktoru (vascular endothelial growth factor – VEGF) s následným snížením neoangiogeneze v kloubu.
Mimo vzestup počtu lymfocytů v periferní krvi vede léčba infliximabem k přechodnému poklesu počtu monocytů a neutrofilních granulocytů v periferní krvi a k vzestupu hodnot hemoglobinu. Vzhledem k tomu, že počty monocytů a neutrofilních granulocytů mohou být zvýšeny v rámci základního onemocnění, může dojít po podání infliximabu k normalizaci jejich počtu [7].
Farmakokinetika
Farmakokinetika infliximabu je závislá na dávce v rozsahu dávek od 1 do 20 mg/kg. Nebyla pozorována žádná akumulace infliximabu při podávání 1 mg/kg, resp. 10 mg/kg v 8týdenních intervalech.
Farmakokinetika infliximabu se významně nemění po opakovaném podání. Průměrné sérové koncentrace infliximabu po každé ze tří dávek 10 mg/kg podávaných v 8týdenních intervalech kolísaly mezi 7,9–9,9 mg/l. Při podávání dávky 3 mg/kg (obvyklé u RA) v týdnech 0, 2, 6 a dále po 8 týdnech se průměrné sérové koncentrace infliximabu na konci 8týdenního intervalu pohybovaly okolo 1,5 mg/l [8].
Sérové koncentrace infliximabu nezávisí na současném podávání MTX, ale pomaleji klesají. Osm týdnů po poslední z 5 dávek infliximabu 3 mg/kg byly sérové koncentrace 2 mg/l při současném podávání MTX a < 0,1 mg/l bez současného podávání MTX [9].
Klinická odpověď na infliximab se přitom signifikantně zmenšuje při poklesu sérové koncentrace infliximabu pod 1,0 mg/l [10]. Je možné, že současné podávání MTX snižuje imunogenní potenciál infliximabu a tím jeho clearance. Je totiž známo, že v průběhu léčby infliximabem může docházet k tvorbě protilátek proti myší komponentě Fab části imunoglobulinové molekuly infliximabu (HACA).
Distribuční volum (Vd) infliximabu v ustáleném stavu nezávisí na dávce, což naznačuje jeho intravaskulární distribuci. Tkáňová distribuce infliximabu (včetně intraartikulární) není známa. Průměrná hodnota Vd je mezi 3 a 5 litry.
Infliximab není metabolizován prostřednictvím cytochromu P-450. V důsledku toho je menší pravděpodobnost lékových interakcí a změn metabolismu následkem genetického polymorfismu P-450 [11].
Eliminační poločas infliximabu je 8–9,5 dne při dávce 3 mg/kg [12]. Při vyšších dávkách (5–20 mg/kg) se pohybuje mezi 8,9 až 12,3 dne [13].
Vliv závažné hepatopatie, resp. nefropatie na distribuční volum a clearance infliximabu není v současné době znám [12].
Etanercept
Etanercept je solubilní dimerický fúzovaný protein sestávající ze dvou extracelulárních částí humánního receptoru pro TNF-a p75 a konstantní části humánního imunoglobulinu IgG1.
Po parenterálním podání váže volný TNF-a, a tím blokuje jeho interakci s membránovým receptorem, a oslabuje tak jeho prozánětlivý účinek [14]. Komplex TNF-a– etanercept neváže komplement, nevede proto k lýze buňky [6].
Farmakodynamika
V myším modelu kolagenem indukované artritidy snižoval etanercept tíži artritidy, při preventivním podání snižoval i incidenci artritidy [14].
U pacientů s revmatoidní artritidou léčba etanerceptem
– snižuje plazmatické hladiny interleukinu-6 (IL-6), interleukinu-1b (IL-1b), metaloproteinázy-1 (MMP-1) a metaloproteinázy-3 (MMP-3),
– snižuje počet CD3+ T buněk (zralé T lymfocyty), CD38 B lymfocytů (plazmatické buňky),
– snižuje počet periferních mononukleárních buněk produkujících TNF-a a IL-1 (pouze při dlouhodobé léčbě),
– snižuje expresi vaskulární adhezivní molekuly-1 (VCAM-1).
Tyto změny jsou asociovány s klinickým zlepšením artritidy.
Nevýznamně snižuje počet CD68+ makrofágů a koncentraci intercelulární adhezivní molekuly-1 (ICAM-1) [14].
Farmakokinetika
Střední hodnota maximální plazmatické koncentrace (cmax) etanerceptu po subkutánním podání jednotlivé dávky 25 mg etanerceptu pacientům s revmatoidní artritidou je 1,1 mg/l a je jí dosaženo v průměru po 69 hod. U pacientů dlouhodobě léčených etanerceptem 2x týdně 25 mg s.c. je dosaženo vyšších hodnot cmax (2,4 mg/l po 6 měsících léčby).
Biologická dostupnost etanerceptu po s.c. podání 25 mg je 58 %.
Etanercept je v organismu široce distribuován včetně kloubní synovie. Jeho distribuční objem u zdravých dobrovolníků byl 17,5 l.
Eliminační poločas etanerceptu je 102 hod. a clearance 0,16 l/hod. po podání jedné subkutánní injekce etanerceptu 25 mg.
Po vazbě na TNF-a je komplex TNF-a– etanercept metabolizován proteolytickými enzymy stejným způsobem jako jiné proteiny a je buď recyklován, nebo vyloučen do žluče a/nebo moče.
Farmakokinetika etanerceptu je obdobná i u starších pacientů (≥ 65 let) i u dětí (4–17 let), i když výrobce udává lehce sníženou clearance u dětí ve věku 4–8 let [14]. Rovněž srdeční selhání neovlivňuje farmakokinetiku etanerceptu. Vliv funkční poruchy ledvin a jater na farmakokinetiku etan-erceptu není v současné době znám.
U zdravých dobrovolníků nebyly prokázány interakce mezi etanerceptem a warfarinem či digoxinem [14].
Adalimumab
Adalimumab je rekombinantní humánní monoklonální protilátka IgG1 specifická proti TNF-a. Váže se na TNF-a s vysokou afinitou a specificitou, a tím neutralizuje biologickou funkci solubilního i membránově vázaného TNF-a blokádou interakce s oběma buněčnými receptory p55 a p75. Neváže se na TNF-b (lymfotoxin).
Farmakodynamika
Po léčbě adalimumabem dochází u pacientů s revmatoidní artritidou k rychlému poklesu reaktantů akutní fáze-RAF (C-reaktivní protein – CRP – a sedimentace erytrocytů – FW) a cytokinu IL-6 proti výchozím hodnotám. Rovněž byly pozorovány snížené hodnoty matrixových metaloproteináz (MMP-1 a MMP-3). Pokud je v rámci aktivity onemocnění přítomna anémie typu chronických onemocnění, relativní neutrofilie a lymfopenie, dochází při léčbě adalimumabem k normalizaci těchto hodnot [15].
Farmakokinetika
Absorpce a distribuce po subkutánní injekci 40 mg adalimumabu je relativně pomalá a maximální plazmatické koncentrace dosahuje po 5 dnech. Biologický poločas adalimumabu je obdobný jako u přirozeně se vyskytujícího imunoglobulinu IgG1, tj. 10–20 dnů, průměrně 14 dnů. Koncentrace adalimumabu v synoviální tekutině se pohybuje v rozmezí 31–96 % sérové koncentrace.
Tvorba protilátek proti adalimumabu byla u pacientů s RA užívajících současně methotrexat (MTX) nízká (< 1%). Podávání adalimubabu v monoterapii (bez MTX) vedlo k vyšší tvorbě protilátek a ke zvýšené clearance [15].
Klinické studie s anti TNF-a
Infliximab
U PsA byly provedeny dvě randomizované kontrolované studie, tři otevřené studie a jedna studie u pacientů se spondyl-artritidou, mezi kterými byla i část pacientů s PsA.
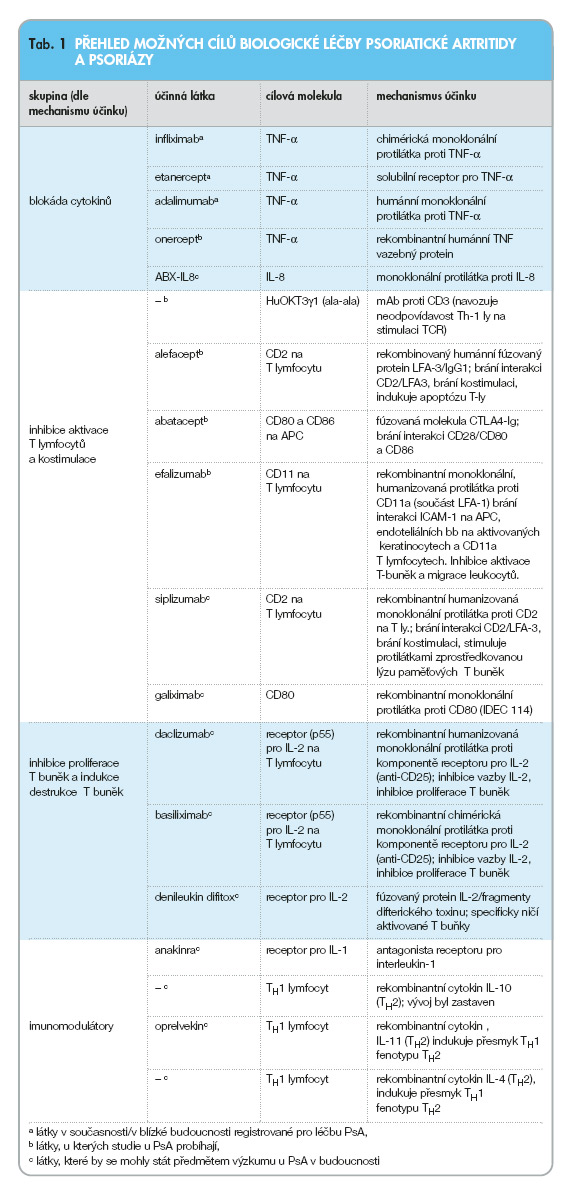
Ve dvojitě slepé studii kontrolované placebem (IMPACT) participovalo 102 pacientů s aktivní PsA (≥ 5 aktivních kloubů), infliximab se podával v dávce 5 mg/kg v týdnu 0, 2, 6 a dále po 8 týdnech po dobu 16 týdnů a pak v otevřeném uspořádání po dobu celkem 50 týdnů. Pacienti užívali NSA dle potřeby, steroidy byly povoleny v dávce < 10 mg/den, MTX užívalo současně 55 % pacientů. V 16. týdnu studie odpovědělo dle kritérií ACR 20 celkem 69 % pacientů (vs 8 % v placebové skupině), dle ACR 50 to bylo 49 % (vs 0 %) a dle ACR 70 pak 29 % (vs 0 %) pacientů. Dle PsARC odpovědělo 78 % pacientů na léčbu (vs 18 % v placebové skupině). V 50. týdnu studie odpovědělo takto 72 %, 54 %, resp. 35 % pacientů. Poklesem indexu rozsahu a tíže psoriázy (PASI) o > 75 % odpovědělo v 16. týdnu v aktivní skupině 67 % pacientů a hodnota PASI se snížila v průměru o 82 %. Rentgenová progrese se v aktivní skupině zpomalila z 5,8 Sharpových jednotek/rok na -1,52 jednotek/rok. Placebo bylo podáváno pouze 14 týdnů, pak byla tato skupina léčena infliximabem v otevřeném uspořádání do 50 týdnů [16, 17]. I zde došlo ke zpomalení rentgenové progrese (z 5,8 na 0,05 Sharpových jednotek/rok). Vyšetření pomocí magnetické rezonance (MRI) ukázalo snížení vychytávání gadolinia v průměru o 82 % [18]. Větší studie fáze III, IMPACT II (graf 1) měla podobné výsledky [19]. V obou studiích došlo i k příznivému ovlivnění entezitid. Infliximab byl dobře tolerován a bezpečnostní profil byl podobný jako v jiných indikacích. FDA upozorňuje na možnost zhoršení u pacientů se středně těžkým a těžkým srdečním selháváním a u pacientů s oportunními infekcemi, jako jsou mj. histoplazmóza, listerióza a pneumocystóza [20].
Antoni a spol. provedli otevřenou studii u 10 pacientů s polyartikulární formou PsA, kteří pokračovali v léčbě stabilní dávkou NSA, DMARDs (7 pacientů MTX) a kortikosteroidy. Bylo podáno 5 mg/kg infliximabu i.v. v týdnech 0, 2 a 6 a dále 3 mg po 8 týdnech, celkem 54 týdnů s možností úpravy dávky dle odpovědi. Všichni pacienti měli v 54. týdnu odpověď dle ACR 50 i PsARC. Osm pacientů nemělo v 54. týdnu žádný oteklý či bolestivý kloub. Vyšetření pomocí MRI u 8 pacientů ukázalo snížení vychytávání gadolinia v průměru o 82 %. Rovněž psoriáza se významně zlepšila. Nevyskytly se žádné vážné NÚ, jeden pacient odstoupil ze studie pro mírnou infuzní reakci [18].
Cauza a spol. léčili 9 pacientů s PsA v otevřené monocentrické nekontrolované 22týdenní studii. Léčba DMARDs byla vysazena. Bylo podáno celkem 5 infuzí infliximabu v dávce 3 mg/kg v týdnech 0, 2, 6, 14 a 22. Odpovědi dle ACR 20/50/70 bylo dosaženo u 89/56/22 % pacientů [21].
Feletar a spol. léčili 16 pacientů s refrakterní PsA infliximabem v dávce 5 mg/kg ve 3 základních infuzích (0., 2. a 6. týden) a dále po 6–8 týdnech dle odpovědi, po dobu 54 týdnů. Konkomitantní léčba methotrexatem byla ponechána u 11 pacientů. Odpověď na léčbu byla definována jako snížení počtu aktivních kloubů (kloub bolestivý v krajní flexi a/nebo oteklý) o 30 % a více a pokles hodnoty indexu rozsahu a tíže psoriázy (PASI) o 30 % a více. Hodnocení bylo prováděno ve 14., 30. a 54. týdnu. Odpověď na léčbu dle počtu „aktivních" kloubů nebyla signifikantní, počet oteklých kloubů v 54. týdnu ale poklesl signifikantně (p = 0,01). Hodnota indexu PASI se signifikantně snížila v týdnu 14 (p = 0,001) a v týdnu 30 (p = 0,002), hodnota CRP klesla signifikantně v týdnu 30 (p = 0,02). Signifikantně se snížila i hodnota funkčního indexu HAQ (p = 0,02 v týdnu 30). Celkem 6 pacientů studii nedokončilo (2 pacienti pro nedostatečnou účinnost, 5 pacientů pro komplikace – alergická reakce, hepatopatie) [22].
Van den Bosch a spol. léčili 21 pacientů se spondyloartropatií v otevřené monocentrické 12týdenní studii, z nichž 9 mělo PsA. DMARDs byly vysazeny, steroidy byly ponechány v dávce do 10 mg denně. Infliximab byl podáván v dávce 5 mg/kg v týdnech 0, 2, 6. Statisticky významného rozdílu proti výchozí hodnotě bylo dosaženo v krátké době (cca 3 dny) ve všech sledovaných parametrech (globální hodnocení lékařem – GHL, globální hodnocení pacientem– GHP, počet oteklých kloubů – SJC, počet bolestivých kloubů – TJC, ranní ztuhlost – RZ, axiální ukazatele i intenzita a rozsah psoriázy – PASI) a přetrvával až do 14. dne, kdy byla podána 2. infuze. Tento efekt přetrvával ještě 6. týden od podání poslední infuze [23].
Závěr
Infliximab je perspektivním vysoce účinným lékem psoriatické artritidy, který příznivě ovlivňuje kloubní syndrom, kožní syndrom i entezitidy a zpomaluje rentgenovou progresi. Podává se ve 3 základních infuzích v dávce 5 mg/kg/den v týdnech 0, 2 a 6 a dále v 8týdenních intervalech. I když v provedených studiích byla jen část pacientů současně léčena methotrexatem, doporučuje se, podobně jako u revmatoidní artritidy, podávat infliximab spolu s methotrexatem k zabránění vývoje humánních antichimérických protilátek proti infliximabu [24, 25]. V ČR je pro tuto diagnózu registrován, kategorizace probíhá.
Etanercept
Účinnost etanerceptu jak na kloubní, tak na kožní syndrom u psoriatické artritidy byla předběžně ověřena v nekontrolovaných studiích.
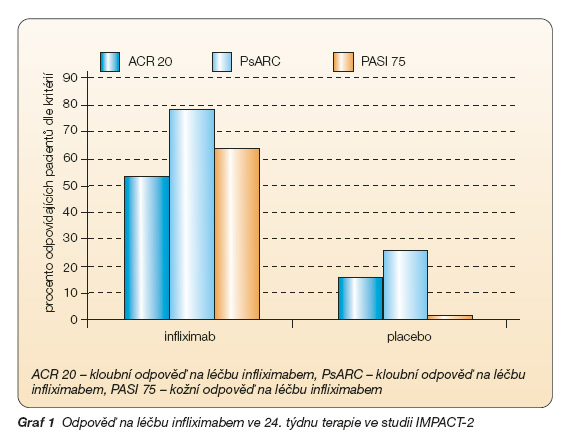
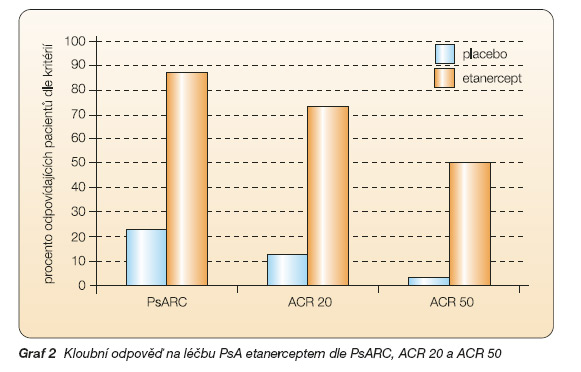
V první placebem kontrolované studii (fáze II) s 60 pacienty (47 % pacientů v obou skupinách užívalo současně MTX) s aktivní PsA (> 3 aktivní klouby) trvající 12 týdnů odpovědělo na léčbu etanerceptem v dávce 25 mg s.c. 2x týdně dle indexu PsARC 87 % pacientů ve srovnání s 23 % pacientů ve skupině placebové, dle indexu ACR 20 odpovědělo 73 % pacientů ve srovnání s 13 % ve skupině placebové. Pokud jde o kožní syndrom, 66 % pacientů odpovědělo snížením indexu PASI o 75 % ve srovnání s žádným pacientem ve skupině placebové, průměrné snížení PASI ve skupině etanerceptové bylo 46 %, ve skupině placebové 9 % (graf 2, 3). Nejčastějšími nežádoucími účinky byly infekce horních cest dýchacích, jejichž frekvence se nelišila mezi oběma skupinami a nebyly příčinou přerušení studie. Mírné reakce v místě injekce byly častější v aktivní skupině [26].
V 6měsíčním otevřeném prodloužení této studie došlo ve skupině placebové k rychlému zlepšení podobně jako v aktivní skupině, u pacientů v původní aktivní skupině došlo k dalšímu zlepšení. Tolerance léčby byla nadále dobrá [27].
Ve studii III. fáze [28] byla odpověď na léčbu dle ACR 20 v aktivní skupině u 59 % pacientů (vs 15 % v placebové skupině), dle ACR 50 u 38 % (vs 4 %) a dle ACR 70 u 11 % (vs 0 %). Dle PsARC odpovědělo 71 % pacientů (vs 31 % v placebové skupině). Pokles klinické aktivity byl doprovázen ústupem edému kostní dřeně. V aktivní skupině došlo po 1 roce rovněž k zastavení rentgenové progrese hodnocené dle Sharpova skóre (-0,03 jednotek vs + 1 jednotka v placebové skupině) [29]. V léčené skupině došlo i k poklesu počtu cirkulujících prekurzorů osteoklastů [30]. To naznačuje mechanismus, kterým etanercept inhibuje kostní destrukci u zánětlivých artropatií. Klinické zlepšení bylo doprovázeno i významným zlepšením funkčních ukazatelů, jako jsou HAQ, SF-36 a EuroQol. V uvedené studii došlo ke zlepšení HAQ skóre o 53,6 %. Nežádoucí účinky jsou obdobné jako ve studiích u revmatoidní artritidy (RA). Závažné nežádoucí účinky (NÚ) nebyly v klinických studiích častější než u placeba. V postmarketingovém sledování se ale vyskytly závažné NÚ neurologické a infekční včetně tuberkulózy. Incidence malignit se neliší od výskytu u pacientů bez biologické léčby [31].
Závěr
Etanercept je perspektivním vysoce účinným lékem psoriatické artritidy a psoriázy. Příznivě ovlivňuje kloubní i kožní syndrom a zpomaluje rentgenovou progresi. Dávkování je 25 mg s.c. 2x týdně. Lze ho podávat v monoterapii i v kombinaci s methotrexatem. V ČR je pro tuto diagnózu registrován, kategorizace probíhá.
Adalimumab
U psoriatické artritidy je v současné době k dispozici jedna pilotní nekontrolovaná studie a jedna randomizovaná dvojitě slepá placebem kontrolovaná studie.
V první studii bylo léčeno 15 pacientů s PsA s průměrným věkem 51 roků po dobu 12 týdnů v dávce 40 mg po 2 týdnech. Kritériem aktivity byla přítomnost > 3 bolestivých a > 3 oteklých kloubů při vstupu do studie. Primárním cílem sledování byl počet pacientů odpovídajících na léčbu ve 2. a 12. týdnu dle kritérií ACR 20, 50, 70 a PsARC. Sekundárním ukazatelem byl rentgenový obraz a obraz při vyšetření MRI. Byl sledován vývoj funkčního dotazníku HAQ.
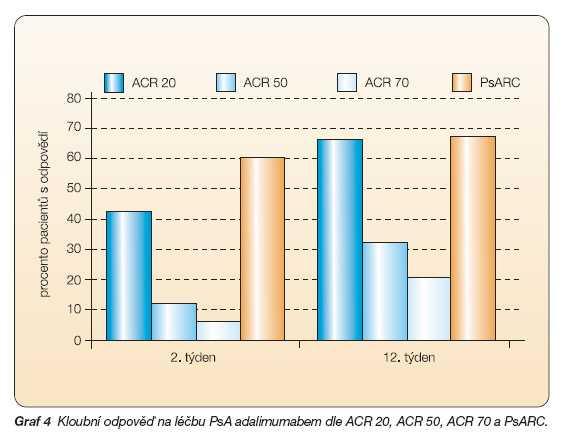
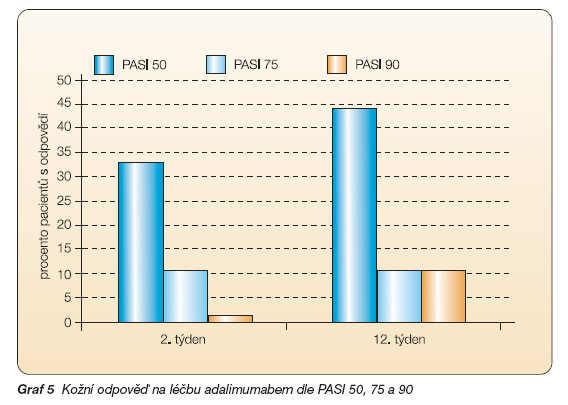
Dle ACR 20 odpovědělo ve 2. týdnu, resp.12. týdnu 42 %, resp. 66 % pacientů, dle ACR 50 to bylo 12 %, resp. 32 %, dle ACR 70 odpovědělo na léčbu 6 %, resp. 20 % pacientů, dle PsARC 60 %, resp. 67 % pacientů. Počet oteklých kloubů na začátku sledování byl 32, ve 2. týdnu 13, ve 12. týdnu 10, počet bolestivých kloubů byl 27, resp. 16, resp. 15 kloubů, sedimentace erytrocytů poklesla z 24 na 18, resp. 12 mm Hg/hod. Globální hodnocení psoriázy pokleslo z původních 3,0 na 2,0, resp. 0,1. Poklesem indexu PASI o 50 % odpovědělo ve 2., resp. 12. týdnu 33 %, resp. 44 % pacientů, pokles o 75 % byl zaznamenán u 11 %, resp. 11% a pokles o 90 % byl zaznamenán u 0 %, resp. 11 % pacientů. Výchozí hodnota indexu HAQ poklesla z původních 1,6 % o 38 %, resp. 55 % (graf 4, 5) [32].
Ve dvojitě slepé placebem kontrolované studii fáze III v trvání 24 týdnů odpovědělo na léčbu v aktivní skupině dle ACR 20 celkem 57 % pacientů (vs 15 % v placebové skupině), dle ACR 50 39 % (vs 6 %) a dle ACR 70 pak 23 % (vs 1 %). Zlepšením kožního syndromu o 75 % > dle PASI odpovědělo v aktivní skupině 59 % pacientů (vs 1 % v placebové skupině), zlepšením o 90 % odpověděl 42 % (vs 0 %) [33].
Závěr
Adalimumab je vysoce účinný v léčbě psoriatické artritidy i psoriázy v dávce 40 mg po 2 týdnech. Podávání je možné v monoterapii i v kombinaci s MTX. V současné době není pro léčbu PsA registrován.
Další biologické léky ve fázi klinického zkoušení
Onercept
Rekombinantní humánní protein vázající TNF, jehož účinnost u PsA byla prokázána ve dvojitě slepé placebem kontrolované studii fáze II při podávání 100 mg v podkožních injekcích 3x týdně [34]. Jeho účinnost je třeba ověřit v dalších studiích.
Efalizumab
Protilátka, která se váže na CD11a podjednotku adhezivní molekuly LFA-1 na T lymfocytu, a interaguje tak s jeho vazbou na ICAM-1 na antigen prezentující buňce, endoteliální buňce, resp. na keratinocytu. Důsledkem je zábrana aktivace T lymfocytů, případně keratinocytů a migrace leukocytů.
Byla provedena jedna klinická studie s efalizumabem podávaným subkutánně 1x týdně u pacientů se středně těžkou a těžkou psoriázou. Ke zlepšení došlo do 2 týdnů od zahájení léčby, k relapsu došlo po 60–70 dnech po ukončení léčby u ~ 5 % pacientů se zvýšením hodnoty PASI > 125 % výchozí hodnoty (rebound). NÚ se vyskytly po 1. a 2. injekci, dále frekvence rychle ubývalo [35].
Alefacept
Plně humánní fúzovaný protein LFA-3 (lymphocyte function associated antigen) /IgG1, blokuje interakci LFA-3 na T lymfocytech a CD2 na antigen prezentující buňce.
Byla provedena jedna otevřená explorativní studie v trvání 12 týdnů. Klinické sledování se provádělo dle indexu aktivity DAS (disease activity index) na začátku, ve 4., 9., 12. a 16. týdnu. Současně bylo provedeno histologické hodnocení synoviální biopsie z indexového kloubu na začátku, ve 4. a 12. týdnu léčby. Na léčbu v 16. týdnu odpovědělo 55 % pacientů, v kterékoliv části studie 82 % pacientů. V histologickém obraze došlo k statisticky významnému poklesu CD4+; CD8+ T lymfocytů a makrofágů ve 12. týdnu proti výchozí hodnotě [36].
Abatacept (fúzovaná molekula CTLA4-Ig)
Blokátor kostimulačních molekul, blokuje interakci CD80/86 s CD28. Přirozený CTLA-4 (cytotoxic T-ly associated Ag-4)-CD152 na T lymfocytech inhibuje interakci mezi CD80/86 a CD28 (kostimulační signál). Hybrid CTLA4 s imunoglobulinem inhibuje tuto kostimulační vazbu. Ve zvířecím modelu příznivě ovlivňuje kolagenem indukovanou artritidu, v humánních studiích zlepšuje psoriázu o > 50 %. Probíhá studie u revmatoidní artritidy, u psoriatické artritidy je studie v plánu [37].
HuOKT3g1 (anti-CD3)
HuOKT3g1 (ala-ala) je protilátka proti CD3 (součást T buněčného receptoru – TCR), která navozuje neodpovídavost Th-1 lymfocytů na stimulaci T buněčného receptoru, zatímco odpovídavost Th-2 lymfocytů zůstává zachována (tj. proliferují a exprimují IL-4). U sedmi pacientů s PsA byla provedena jedna otevřená dávková studie fáze I/II se vzestupnou dávkou huOKT3g1 denně i.v. po dobu 12–14 týdnů. Byl sledován počet oteklých a bolestivých kloubů a bolest na VAS na začátku, resp. 30. a 90. den od začátku studie. Třicátý den mělo 6/7 pacientů ≥ 75% snížení počtu aktivních kloubů a v průměru 63 % zlepšení na škále bolesti. U 2/6 pacientů přetrvávalo zlepšení ještě 90. den. Hodnota PASI se ale významně nezměnila. Žádný pacient s dávkou ≤ 1 mg neměl nežádoucí účinky [38].
Strategie léčby psoriatické artritidy
U pacientů s axiálním postižením nebo s minimálními kloubními projevy vystačíme zpravidla s léčbou nesteroidními antiflogistiky. U pacientů s oligoartikulárním postižením s cyklickým intermitentním průběhem je vhodným doplňkem této léčby intraartikulární instilace kortikosteroidu. U polyartikulárních forem nebo u přetrvávající oligoartikulární aktivity je indikováno zavedení některého z chorobu modifikujících farmak. V případě neúspěchu je možno zkusit kombinační léčbu farmaky z této skupiny podobně jako u revmatoidní artritidy, i když pro tuto léčbu u PsA není opora v kontrolovaných studiích. Při přetrvávající aktivitě a rezistenci na dosavadní léčbu bude v dohledné době možno zvážit zahájení biologické léčby některým z preparátů blokujících cytokin TNF-a. Výsledky dosud provedených studií svědčí o vysoké účinnosti těchto preparátů, a to nejen na periferní kloubní syndrom, ale i na axiální syndrom a entezitidy, stejně jako na kožní projevy psoriázy. K ověření účinnosti těchto preparátů u různých subtypů psoriatické artritidy je ještě zapotřebí dalších randomizovaných kontrolovaných studií. Hlavním rizikem této léčby jsou infekce, zejména možná reaktivace tuberkulózy. Podobně je zapotřebí identifikace nových a valorizace známých rizikových faktorů závažného průběhu PsA, tak aby bylo možno určit pacienty, které je třeba od počátku léčit agresivněji i s použitím tak nákladných prostředků, jako je biologická léčba.
Indikace biologické léčby
Podávání biologické léčby u pacientů s PsA bude soustředěno do tzv. center biologické léčby, indikace se bude řídit standardami České revmatologické společnosti, které budou publikovány v časopise Česká revmatologie. Průběh léčby bude centrálně sledován a výsledky průběžně vyhodnocovány.
Předpokladem pro indikaci biologické léčby je (1) správná diagnóza, (2) selhání dosavadní léčby, (3) přetrvávající aktivita onemocnění, (4) nepřítomnost stavů, které obecně vylučují zavedení biologické léčby, a (5) zvážení poměru rizika a prospěchu takové léčby u konkrétního pacienta.
1. Diagnóza psoriatické artritidy
Psoriatická artritida je dle Molla a Wrightové v modifikaci z roku 1973 definována jako artritida sdružená s psoriázou, obvykle séronegativní [39]. Na rozdíl od revmatoidní artritidy (RA) neexistují dosud mezinárodně přijatá diagnostická, resp. klasifikační kritéria PsA. Dělení PsA na 5 podskupin (asymetrická oligoartikulární, polyartikulární podskupina s převažujícím postižením DIP kloubů, mutilující a axiální forma) je dosud používáno, i když bylo opakovaně podrobeno kritice. V současné době probíhají práce na přípravě validních a mezinárodně přijatelných diagnostických kritérií psoriatické artritidy [40].
2. Selhání dosavadní léčby
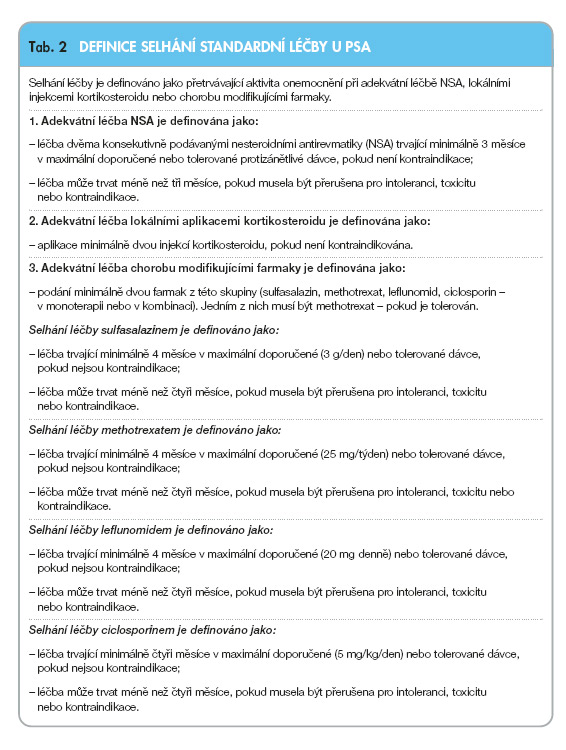
Pro všechny formy PsA je základní farmakologickou léčbou podávání NSA v plné doporučené a tolerované dávce. Tuto léčbu lze kombinovat s intraartikulárním podáváním kortikosteroidu. U oligoartikulárních forem rezistentních na tuto léčbu a u polyartikulárních forem je základem léčby podávání chorobu modifikujících farmak – sulfasalazinu, methotrexatu nebo ciclosporinu v monoterapii nebo v kombinaci. Definice selhání léčby je uvedena v tab. 2.
3. Přetrvávající aktivita onemocnění
Zhodnocení aktivity onemocnění u PsA zahrnuje periferní kloubní syndrom, axiální syndrom (tj. sakroiliitidu a/nebo spondylitidu – jsou-li přítomny) a kožní syndrom. Indikací pro zahájení biologické léčby revmatologem bude vždy přítomnost aktivního periferního kloubního nebo axiálního syndromu. Kritéria aktivity pro periferní kloubní syndrom jsou rozvedena dále. Pokud v klinickém obrazu PsA bude dominovat aktivní axiální syndrom (podobný ankylozující spondylitidě – AS), bude se indikace biologické léčby řídit doporučeními pro léčbu a sledování ankylozující spondylitidy [41]. Ostatně přítomnost HLA B27 pozitivní sakroiliitidy a spondylitidy podobné AS bez periferní artritidy u pacienta s psoriázou je spíše projevem asociace dvou nezávislých onemocnění (psoriázy a ankylozující spondylitidy) než projevem čistě axiální formy psoriatické artritidy [42]. Indikace biologické léčby v přítomnosti aktivního kožního syndromu při málo aktivním nebo neaktivním periferním kloubním syndromu bude pak záležitostí dermatologa.
Kritéria aktivity periferního kloubního syndromu pro indikaci biologické léčby jsou uvedena v tab. 3. Pro indikaci biologické léčby musí být tato kritéria splněna při dvou konsekutivních vizitách v rozmezí minimálně 4 týdny.
Indikace léčby anti TNF může vycházet kromě posouzení aktivity onemocnění i z výsledků zobrazovacích metod jako rtg (prokazující rychlou progresi) nebo MRI (ukazující známky zánětu) a z přítomnosti klinických markerů progrese kloubního poškození.
4. Nepřítomnost stavů, které obecně vylučují zavedení biologické léčby
Každý lékař indikující léčbu anti TNF u pacienta s PsA by měl vyloučit přítomnost stavů a onemocnění uvedených v tab. 4.
Monitorace biologické léčby
Pro sledování účinku léčby je zapotřebí stanovit (1) kritéria odpovědi na léčbu, (2) důvody pro ukončení léčby, (3) další sledované parametry a (4) jednotný systém monitorace nežádoucích účinků.
1. Kritéria odpovědi na léčbu
Léčba farmaky blokujícími TNF-a by měla vést k významnému klinickému zlepšení. To by mělo být dokumentováno odpovědí na léčbu dle definovaných kritérií. Tato odpověď by měla být udržována i při kontrolách v průběhu další léčby. Léčba pacientů, kteří neodpovídají na léčbu, by měla být ukončena.
Pro hodnocení odpovědi kloubního syndromu na léčbu jsou k dispozici jednak kritéria dle ACR (tab. 5) [43],
jednak kritéria speciálně vyvinutá Cleggem v roce 1996 pro hodnocení odpovědi na léčbu u psoriatické artritidy – PsARC (Psoriatic arthritis Response Criteria) – tab. 6 [44].
Kritéria odpovědi dle ACR (American College of Rheumatology, dříve American Rheumatism Association) byla vyvinuta v roce 1949 původně pro hodnocení revmatoidní artritidy. Kloubní index dle těchto kritérií dokumentuje počet kloubů s palpační bolestí kloubní štěrbiny, s napínací bolestí (stress pain) a/nebo s kloubním otokem.
Kritéria odpovědi dle PsARC byla vyvinuta Cleggem a kol. v roce 1996 [44]. Byla vyvinuta pro potřebu hodnocení odpovědi v klinických farmakologických studiích spondylartritid ještě před zavedením biologické léčby. Byla použita pro hodnocení účinku sulfasalazinu u psoriatické artritidy [44], ankylozující spondylitidy [45] a reaktivních artritid [46]. Hodnotí se zde 68 kloubů pro bolestivost a 66 kloubů pro otok. Obě kvality se gradují stupněm 1–3. Do hodnocení jsou zahrnuty distální interfalangeální klouby na horních i dolních končetinách. Výsledek se hodnotí jako kloubní skóre bolestivosti (součet všech skóre jednotlivých kloubů, max. 204) a kloubní skóre otoku (součet všech skóre jednotlivých kloubů, max. 198). Globální hodnocení onemocnění pacientem a lékařem se provádí na verbální Likertově škále (tab. 6).
Je nevyřešenou otázkou, který z obou systémů hodnocení odpovědi na léčbu psoriatické artritidy je vhodnější. Oba obsahují stejný počet hodnocených kloubů, jejich struktura se však poněkud liší. V systému hodnocení dle ACR jsou navíc (proti PsARC) hodnoceny klouby temporomandibulární (TM), akromioklavikulární (ACl) a sternoklavikulární (SCl). V systému PsARC jsou na rozdíl od ACR hodnoceny separátně PIP a DIP klouby na dolních končetinách – DK (v systému ACR jsou na DK hodnoceny pouze interfalangeální klouby – IP, tj. PIP a DIP jako jeden kloub). Oba systémy se liší dále ve způsobu globálního hodnocení onemocnění pacientem a lékařem. ACR používá hodnocení na vizuální analogové škále 100 mm, navíc takto hodnotí separátně kloubní bolest. PsARC používá ke globálnímu hodnocení Likertovu verbální škálu (0–4) ACR navíc do hodnocení odpovědi zahrnuje i funkční dotazník HAQ (Health Assessment Questionnaire) – tab. 5, 6.
Hodnocení funkčního poškození a disability
Health assessment questionnaire (HAQ) byl vyvinut Friesem a kol. pro hodnocení disability pacientů s revmatoidní artritidou [47]. Hodnotí dvě dimenze zdravotního stavu: tělesnou disabilitu (8 otázek) a bolest.
Laboratorní kritéria zánětu
Sedimentace erytrocytů (FW) je zvýšena pouze u cca 50 % pacientů s PsA [48]. Na druhé straně ale byla zvýšená sedimentace erytrocytů při vstupním vyšetření asociována s rychlejší progresí kloubního postižení a s časnou mortalitou ve studii Gladmanové a kol. [49]. U axiálního postižení nekoreluje výše sedimentace ani hodnota CRP s aktivitou onemocnění hodnocenou dle indexu BASDAI [50]. Hodnota CRP je zahrnuta do hodnocení odpovědi dle ACR – tab. 5 (nikoliv dle PsARC – tab. 6). Hodnoty CRP nebo sedimentace erytrocytů jsou zahrnuty do kritérií aktivity pro indikaci biologické léčby (tab. 3).
2. Důvody pro ukončení léčby
I. absence odpovědi na léčbu při dvou konsekutivních kontrolách (tj. ve 12. a 24. týdnu soustavné léčby);
II. ztráta odpovědi kdykoliv v průběhu léčby při dvou konsekutivních kontrolách (tj. po 12 týdnech );
III. přítomnost kontraindikací;
IV. intolerance.
Závěr
Biologická léčba psoriatické artritidy přináší zásadní obrat v léčbě tohoto onemocnění tím spíše, že všechny preparáty, které příznivě ovlivňují kloubní syndrom, zároveň příznivě ovlivňují i kožní syndrom, entezitidy a zejména zpomalují, nebo dokonce zastavují rentgenovou progresi. Na druhé straně je i u této léčby nutno počítat s potenciálně závažnými nežádoucími účinky, kterými jsou zejména infekce včetně specifické, otevřená zůstává otázka vývoje lymfomu. Těmito nežádoucími vedlejšími účinky jsme se podrobně zabývali v předchozím čísle tohoto časopisu [51]. Současně je nutno si uvědomit, že ani biologická léčba není účinná u všech pacientů a že ani biologická léčba neodstraní příčinu onemocnění, která navíc není do všech podrobností dosud známa. V blízké budoucnosti lze očekávat vývoj nových biologických léků, které zasahují o etáž výše v imunopatogenetickém řetězci, tj. na úrovně interakce antigen prezentující buňky s T lymfocytem (tab. 1).
Seznam použité literatury
- [1] BS, Bunim JJ, Calkins E, et al. ARA nomenclature and classification of arthritis and rheumatism (tentative). Arthritis Rheum 1964; 7: 93–97.
- [2] Ettehadi P, Greaves MW, Wallach D, et al. Elevated tumour necrosis factor-alpha (TNF-alpha) biological activity in psoriatic skin lesions. Clin Exp Immunol 1994; 96: 146–151.
- [3] Ritchlin C, Haas-Smith SA, Hicks D, et al. Patterns of cytokine production in psoriatic synovium. J Rheumatol 1998; 25: 1544–1552.
- [4] Marzo-Ortega H, McGonagle D, O´Connor P, Emery P. Efficacy of etanercept in the treatment of the enthesial pathology in resistant spondyl-arthropathy: a clinical and magnetic resonance imaging study. Arthritis Rheum 2001; 44: 2112–2117.
- [5] Braun J, Sieper J. anti TNF-alpha: a new dimension in the pharmacotherapy of the spondyloarthropathies? Ann Rheum Dis 2000; 59: 404–407.
- [6] Braun J, Sieper J. Role of novel biological therapies in psoriatic arthritis. Therapy review. Bio-drugs 2003; 17 (3): 187–199.
- [7] Haraoui B. Differentiating the efficacy of the tumour necrosis factor inhibitors. Semin Arthritis Rheum 2005; 34 (Suppl.1): 7–11.
- [8] Nestotov I. Clinical pharmacocinetics of TNF antagonists: How do they differ? Semin Arthritis Rheum 2005; 34 (Suppl.1): 12–18.
- [9] Thu YW, Graham MA, Menter A, Gottlieb AB. Pharmacokinetics of infliximab (REMICADE‚) in patients with severe, plaque-type psoriasis. 62nd. AAD Annual meeting; February 6–11, 2004. Washington DC Poster abstracts. J Am Acad Dermatol 2004; 50: poster P.
- [10] DiNoto D, Mace K, de Ritta R, et al. Pharmacokinetics of infliximab, a chimeric monoclonal antibody specific to tumour necrosis factor: clinical studies in rheumatoid arthritis patients. AAPS annual meeting; November 1999. Abstract 4733.
- [11] St. Clair EW, Wagner C, Wang B, Schaible T, Fasanmade A, Kavanaugh AF. Pharmacokinetics of infliximab therapy for rheumatoid arthritis. ACR Annual meeting; November 2001. Abstract 970.
- [12] Gottlieb AB, Masud S, Ramamurthi R, Abdul-ghani A, Romano P, Chaudhari U, et al. Pharmacodynamic and pharmacokinetic response to anti-tumour necrosis factor d monoclonal antibody (infliximab) treatment of moderate to severe psoriasis vulgaris. J Am Acad Dermatol 2003; 48: 68–75.
- [13] Markham A, Lamb HM. Infliximab: A review of its use in the management of rheumatoid arthritis. Drugs 2000; 59:1342–1359.
- [14] Culy ChR, Keating MG. Etanercept. An updated review of its use in Rheumatoid arthritis, psoriatic arthritis and juvenile arthritis. Drugs 2002; 62 (17): 2493–2537.
- [15] Baker DE. Adalimumab: Human recombinant imunoglobulin G1 anti-tumour necrosis factor monoclonal antibody. Rev Gastroenterol Disord 2004; 4 (4): 196–210.
- [16] Antoni C, Kavanaugh A, Kirkham B, Burmester G, Weisman M, Keystone E, et al. The infliximab multinational psoriatic arthritis controlled trial (IMPACT) [abstract]. Arthritis Rheum 2002; 46 (suppl 9): S 985.
- [17] Antoni C, Kavanaugh A, Gladman DD, et al. The infliximab multinational psoriatic arthritis controlled trial (IMPACT): results of radiographic analyses after one year. Arthritis Rheum 2004; 50: S450.
- [18] Antoni C, Dechant C, Lorenz HM Wendler J, Olgivie A, Lueftl M, Kalden-Nemeth D, Kalden JR, Manger B. Open-label study of infliximab treatment for psoriatic arthritis: Clinical and magnetic resonance imaging measurements of reduction of inflammation. Arthritis Rheum 2002; 47 (5): 506–512.
- [19] Kavanaugh A, Krueger G, de Vlam K, et al. Infliximab improves arthritis and psoriasis in patients with active polyarticular psoriatic arthritis: results of the IMPACT II trial. Ann Rheum Dis 2004; 63 (suppl 1): 402.
- [20] Remicade [package insert]. Malvern PA. Centocor, Inc; 2002.
- [21] Cauza E, Spak M, Cauza K, Hanusch-Enserer U, Dunky A, Wagner E. Treatment of psoriatic arthritis and psoriasis vulgaris with tumour necrosis factor inhibitor infliximab. Rheumatol Int 2002; 22 (6): 227–232.
- [22] Feletar M, Brockbank JE, Schentag CE, Lapp V, Gladman DD. Treatment of refractory psoriatic arthritis with infliximab: a 12 month observational study of 16 patients. Ann Rheum Dis 2004; 63: 151–156.
- [23] Van den Bosch F, Kruithof E, Baeten D, De Keyser F, Mielants H, Veys EM. Effects of a loading dose regimen of three infusions of chimeric monoclonal antibody to tumour necrosis alfa (infliximab) in spondyloarthropathy: an open pilot study. Ann Rheum Dis 2000; 59: 428– 433.
- [24] Kremer JM. Rational use of new and existing disease-modifying agents in rheumatoid arthritis. Ann Intern Med 2001; 134: 695–706.
- [25] Maini RN, Breedveld FC, Kalden JR, et al. Therapeutic efficacy of multiple intravenous infusions of anti-tumour necrosis factor alfa monoclonal antibody combined with low dose weekly methotrexate in rheumatoid arthritis. Arthritis Rheum 1998; 41: 1552–1563.
- [26] Mease PJ, Goffe BS, Metz J, Vanderstoep P, Finck B, Burge DJ. Etanercept in the treatment of psoriatic arthritis and psoriasis: A randomized trial. Lancet 2000; 356: 385–390.
- [27] Mease PJ, Goffe BS, Metz J, Vanderstoep P, Burge DJ. Enbrel (etanercept) in patiens with psoriatic arthritis and psoriasis [poster]. Presented at: EULAR, June 13–16, 2001; Prague, Czech Republic.
- [28] Mease PJ, Kivitz A, Burch F, et al. Improvement in disease activity in patients with psoriatic arthritis receiving etanercept. Results of a phase 3 multicenter trial. Arthritis Rheum 2001; 44 (Suppl.): S90.
- [29] Ory P, Sharp JT, Salonen D, et al. Etanercept (ENBREL) inhibits radiographic progression in patients with psoriatic arthritis. Arthritis Rheum 2002; 46 (Suppl. 442): S196.
- [30] Ritchlin CT, Haas-Smith SA, Shao T, et al. Etan-ercept lowers the frequency of circulating osteo-clasts precursors (OCP) and improves bone marrow edema in patients with erosive psoriatic arthritis [abstract]. Presented at 67th. Annual Scientific Meeting of the American College of Rheumatology; October 23–28, 2003; Orlando (FL).
- [31] Enbrel (etanercept) [packege insert]. Thousand Oaks (CA): Amgen Inc. and Wyeth Pharmaceuticals; 2004.
- [32] Ritchlin C, et al. poster SAT0054; EULAR Berlin 2004.
- [33] Mease PJ, et al. Poster presentation 521 (L6), Ann Scientific Meeting ACR, San Antonio 2004.
- [34] Nikas SN, Drosos AA. Onercept Serono. Curr Opin Investig Drugs 2003; 4: 1369–76.
- [35] Gottlieb A, Kreuger JG, Bright R, et al. Effects of administration of a single dose of humanized monoclonal antibody to CD11a on the immunobiology and clinical activity of psoriasis. J Am Acad Dermatol 2000; 42: 428–433.
- [36] Kraan MC, van Kuijk AW, Dinant HJ, et al. Alefacept treatment in psoriatic arthritis: reduction of the effector T cell population in peripheral blood and synovial tissue is associated with improvement of clinical signs of arthritis. Arthritis Rheum 2002; 46: 2776–2784.
- [37] Abrams JR, Lebwohl MG, Guzzo CA, et al. CTLA4Ig-mediated blockade of T-cell co-stimulation in patients with psoriasis vulgaris. J Clin Invest 1999; 9: 1243–52.
- [38] Utset TO, Auger JA, Peace D, et al. Modified anti-CD3 therapy in psoriatic arthritis: a phase I/II clinical trial. Arthritis Rheum 2001; 44 (9S): S92.
- [39] Moll JMH, Wright V. Psoriatic arthritis. Semin Arthritis Rheum 1973; 3: 55–78.
- [40] Gladman DD, Helliwell P, Mease PJ, Nash P, Ritchlin C, Taylor W. Assessment of patients with psoriatic arthritis. A review of currently available measures. Arthritis Rheum 2004; 50: 24–35.
- [41] Pavelka K, Štolfa J, Vencovský J. Doplněk standardních léčebných postupů u ankylozující spondylitidy. Čes Revmatol 2004; 30–35.
- [42] Suarez-Almazor ME, Russel AS. Sacroiliitis in psoriasis: Relationship to peripheral arthritis and HLA-B27. J Rheumatol 1990; 17: 804–808.
- [43] Cooperating Clinics Committee of the American Rheumatism Association. A seven-day variability study of 488 patients with peripheral rheumatoid arthritis. Arthritis Rheum 1965; 8: 302–334.
- [44] Clegg DO, Reda DJ, Mejias J, et al. Comparison of sulphasalazine and placebo in the treatment of psoriatic arthritis. Arthritis Rheum 1996; 39: 2013–2020.
- [45] Clegg DO, Reda DJ, Weisman MH, et al. Comparison of sulfasalazine and placebo in the treatment of ankylosing spondylitis. Arthritis Rheum 1996; 39: 2004–2012.
- [46] Clegg DO, Reda DJ, Weisman MH, et al. Comparison of sulfasalazine and placebo in the treatment of reactive arthritis (Reiter´s syndrome) Arthritis Rheum 1996; 39: 2021–2027.
- [47] Fries JF, Spitz P, Kraines RG, Holman HH. Measurement of patient outcome in arthritis. Arthritis Rheum 1980; 23: 127–145.
- [48] Gladman DD, Cook RJ, Schentag C, Feletar M, Inman R, Hitchon C, et al. The clinical assessment of patients with psoriatic arthritis: results of a validation study of the Spondyloarthritis Research Consortium of Canada [abstract]. Arthritis Rheum 2003; 48 (Suppl. 9): S168.
- [49] Gladman DD, Farewell VT, Wong K, Husted J. Mortality studies in psoriatic arthritis: results from a single outpatient center. II. Prognostic indicators of death. Arthritis Rheum 1998; 41: 1103–1110.
- [50] Spoorenberg A, van der Heijde D, de Klerk E, Dougados M, de Vlam K, Mielants H, et al. Relative value of erythrocyte sedimentation rate and C-reactive protein in assessment of disease activity in ankylosing spondylitis. J Rheumatol 1999; 26: 980–984.
- [51] Pavelka K. Biologická léčba revmatoidní artritidy a dalších revmatických onemocnění. Remedia 2005; 1: 53–66.