Biologická léčba revmatoidní artritidy a dalších revmatických onemocnění
V posledních pěti letech se do klinické praxe rozšířily tzv. biologické léky. Jde o genetickým inženýrstvím připravené proteiny, které cíleně ovlivňují některé struktury důležité pro rozvoj autoimunitního onemocnění. V praxi se již používá blokáda TNF-α, IL-1 a před registrací je též blokáda receptoru pro IL-6, blokáda kostimulace pomocí CTLA4lg a monoklonální protilátky proti B buňkám. Článek popisuje celosvětové zkušenosti především s léčbou blokující TNF, která se vyznačuje vysokou klinickou účinností a schopností zpomalovat až zastavovat rentgenovou progresi onemocnění. V revmatologii jsou tyto léky indikovány u revmatoidní artritidy a spondylartritid. Mezi negativa této léčby patří jednak její cena, jednak možnost vzniku některých sice vzácných, ale závažných nežádoucích účinků (aktivace latentní TBC). Nebezpečí je možné eliminovat přísným screeningem pacientů na TBC. V ČR se léčba blokující TNF řídí Návody České revmatologické společnosti, je prováděna v centrech biologické léčby a každý pacient je registrován.
Úvod
Od roku 1998 se začínají používat v léčbě revmatoidní artritidy léky nové generace, které nazýváme biologickými léky. V širším slova smyslu patří do skupiny tzv. chorobu modifikujících léků (DMARDs; Disease Modifying Antirheumatic Drugs). Biologickými je nazýváme, protože jde o biologické preparáty bílkovinné povahy, připravené metodami genetického inženýrství. Cíl působení většiny zatím používaných preparátů je zaměřen proti určitému cytokinu, a proto též mluvíme o anticytokinové léčbě (anti TNF-a, anti IL-1, anti IL-6). V klinických studiích u RA byla na preparátech ověřena vysoká klinická účinnost a schopnost prakticky zastavovat rentgenovou progresi. Negativními aspekty této léčby jsou některé nežádoucí účinky a také její cena. Od roku 2003 jsou pak tyto preparáty schvalovány i pro oblast tzv. spondylartritid. První uváděnou indikací pro infliximab (INF) mimo revmatologii je Crohnova nemoc.
Biologická léčba revmatoidní artritidy (RA)
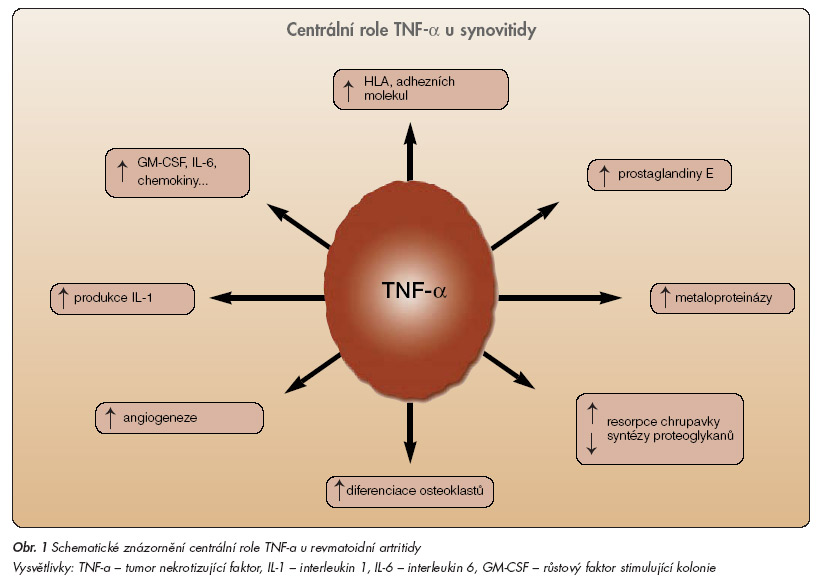
Etiopatogeneze RA není dodnes objasněna, nicméně poznatky bazální imunologie posledních 10 let přinesly mnoho nového v oblasti porozumění faktorům počáteční aktivace imunitního systému, ztráty tolerance a lokalizace zánětu v kloubních tkáních [1]. V revmatoidním kloubu dochází nejdříve k nahromadění zánětlivých buněk, které je doprovázeno novotvorbou cév v synoviální membráně. Vzniká bohatě vaskularizovaná tkáň – panus, jejíž buňky jsou zdrojem proteolytických enzymů, které se zúčastní destrukce kloubu. Zúčastní se i další buňky, jako jsou Th 1 lymfocyty a aktivované buňky monocyto-makrofágového systému. Tyto buňky produkují cytokiny, jako jsou tumor nekrotizující faktor a (TNF-a), interleukin 1 (IL-1), IL-6 a některé další, jež mají výrazně prozánětlivý charakter. Buňky nemocného s RA jsou schopny tvořit i neutralizující cytokiny a další látky (solubilní TNF receptor – sTNF-R, IL-1ra, IL-10 nebo tkáňové inhibitory metaloproteináz) s protizánětlivým působením. U aktivní RA však převažuje role prozánětlivých cytokinů. Koncepci centrální role TNF-a vypracoval kolektiv vedený sirem R. Mainim v roce 1992 [2]. TNF-a stimuluje kaskádu dalších prozánětlivých látek, tvorbu chemoatraktantů a produkci destruktivních enzymů (obr. 1).
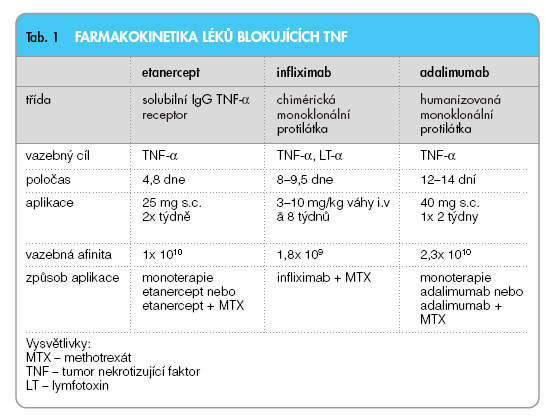
TNF-a má pravděpodobně více prozánětlivé účinky a stojí v hierarchii cytokinů nad IL-1, jehož vlastnosti spočívají spíše ve stimulaci destruktivních změn. Na základě studií in vitro byly provedeny preklinické studie na experimentálních modelech zánětu [3], které potvrdily hypotézy, že TNF-a hraje klíčovou roli v regulaci prozánětlivé sítě cytokinů, migrace buněk, adheze buněk a angiogeneze u RA. Blokáda TNF-a je v zásadě možná 2 základními způsoby. Za prvé pomocí monoklonálních protilátek proti TNF-a. Chimérická monoklonální protilátka proti TNF-a se nazývá infliximab a plně humánní monoklonální protilátka proti TNF-a pak adalimumab. Druhým způsobem blokády TNF-a je podání solubilního receptoru p75, který se nazývá etanercept. Charakteristiky jednotlivých blokátorů TNF-a viz tab. 1.
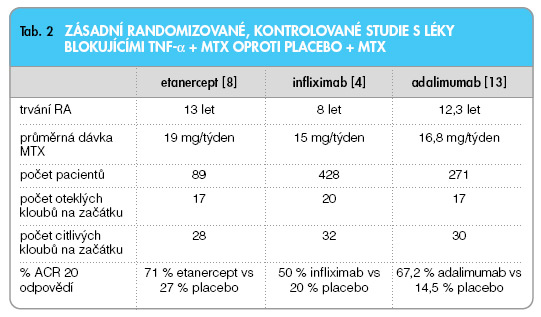
Zásadní důkaz o účinnosti infliximabu přinesly randomizované kontrolované studie (tab. 2) [4–6].
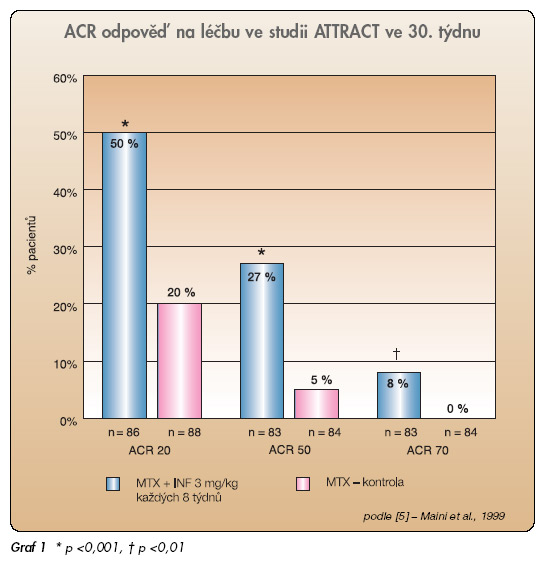
Do studie ATTRACT byli zařazováni pacienti, kteří měli velmi silně aktivní RA, a to přes stabilizovanou a relativně vysokou dávku methotrexátu (MTX). Byli randomizováni do skupin placebo (monoterapie MTX), nebo MTX + 3 mg INF/kg po 4 či 8 týdnech, nebo 10 mg INF/kg po 4 a 8 týdnech. Primární kritérium – zlepšení příznaků o 20% podle kritérií The American College of Rheumatology (ACR 20) – bylo splněno v 50 % oproti 20 % po placebu a bylo dosaženo proporcionálně vyššího počtu výraznějších odpovědí (ACR 50, 70) (graf 1).
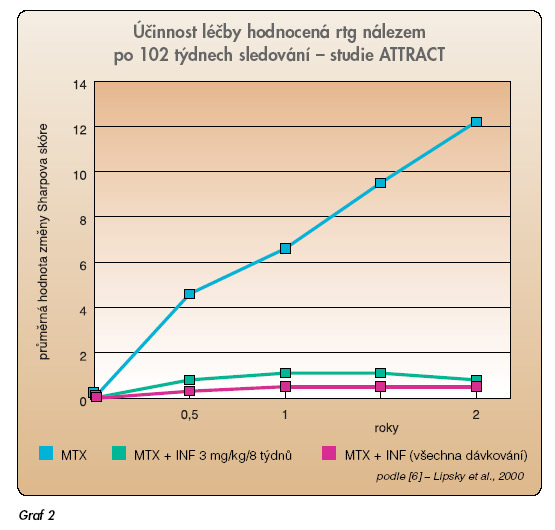
Nástup účinku je obvykle velmi rychlý a razantní. Dochází k velmi rychlému potlačení reaktantů akutní fáze, snížení počtu aktivních kloubů a zlepšení funkce a kvality života. Velice zásadní je, že dochází ke zpomalení až prakticky k zastavení rentgenové progrese onemocnění (graf 2).
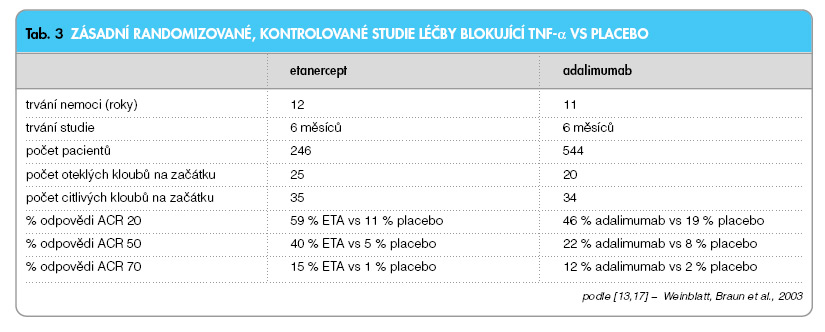
Toto je velmi důležité, protože je známo, že paralelně se zvyšujícím se strukturálním postižením se zhoršuje i funkce pacienta. Infliximab se aplikuje současně s methotrexátem. Infliximab je totiž chimérická molekula a obsahuje myší Fab část imunoglobulinu a může vyvolávat vznik antimyších protilátek (HACA). Výskyt HACA protilátek je podstatně nižší u pacientů léčených současně methotrexátem než při monoterapii (21 % vs 7 %) [5]. Oficiální indikace infliximabu u RA v současné době zní: v kombinaci s MTX je indikován pro redukci příznaků a projevů, inhibici progrese strukturálního poškození a zlepšení funkční schopnosti pacientů se střední až těžkou RA, kteří neměli adekvátní odpověď na methotrexát. Oficiální doporučená dávka je 3 mg/kg váhy. Doporučené intervaly jsou v týdnech: 0, 2, 6, a dále po 8 týdnech. Je doporučeno hodnotit účinek léčby pomocí standardizovaných ukazatelů aktivity RA, jako je např. DAS (Disease activity index, který obsahuje počet citlivých a oteklých kloubů, reaktant akutní fáze a pacientovo hodnocení) [7]. Účinek léčby infliximabem by měl nastoupit mezi 8.–12. týdnem. U pacientů, u nichž účinek nenastoupí, je doporučeno v léčbě nepokračovat. Účinek léčby infliximabem se dociluje v 70–80 % případů. U pacientů s ne zcela dostatečným účinkem terapie je možné buď zvýšit dávku (na 5–6 mg/kg váhy), anebo zkrátit interval aplikace (např. na 6 týdnů). Po vysazení léčby část pacientů exacerbuje (obvykle v intervalech několika měsíců) a je nutné opět zahájit léčbu. Nejdůležitější studií s etanerceptem (ETA) v kombinované léčbě s MTX je práce Weinblatta a spol. [8]. Do studie byli opět zařazeni pacienti s nedostatečným účinkem léčby methotrexátem (15–25 mg týdně). Primárního kritéria (ACR 20) bylo dosaženo u 71 % oproti 27 % po placebu a percentuálně vyšší odpovědi bylo dosaženo i u vyšších ukazatelů (ACR 50, 70) (tab. 2). Etanercept byl zkoušen i jako monoterapie oproti placebu ve studii, která potvrdila jeho vysokou účinnost [9]. Ve studii u časné RA byl rovněž zkoušen proti MTX (tab. 3) [10].
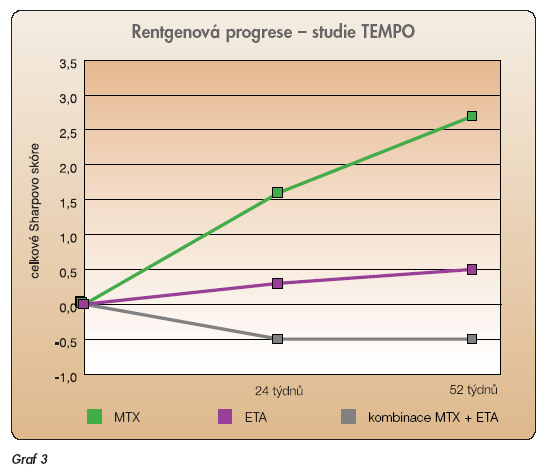
Etanercept byl účinnější než MTX u klinických ukazatelů po 6 měsících, kdy rozdíl u ACR 20 byl statisticky významný (p = 0,02). Docházelo ke statisticky významnému zpomalení rtg progrese oproti MTX. Zkušenosti s aplikací etanerceptu u RA jsou již více než pětileté [11]. Účinek léčby přetrvával u pacientů (n = 2 054) i po 5 letech (80 %). Po 5 letech zůstávalo na léčbě 71 % pacientů, což je jistě vynikající (u klasických DMARDs s výjimkou MTX se toto číslo pohybuje kolem 10–20 %). Studie TEMPO prokázala, že kombinace etanercept + MTX je účinnější než monoterapie MTX i ETA. Byly zjištěny negativní změny Sharpova skóre. Diskutuje se o tom, znamená-li to hojení erozí [12] (graf 3).
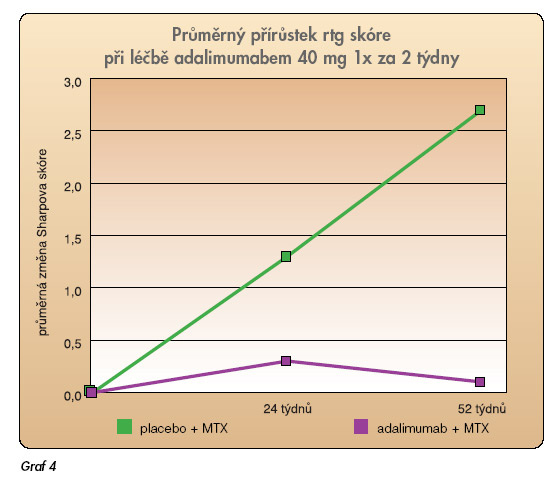
Etanercept se používá v dávkování 25 mg 2x týdně, které si pacient aplikuje sám doma subkutánně. V registraci je i dávkování 1x týdně 50 mg s.c. Nejdůležitější studie s adalimumabem se nazývá ARMADA [13]. Šlo opět o kombinovanou léčbu, do které byli zařazeni pacienti s nedostatečným účinkem methotrexátu (tab. 2). Studie trvala 24 týdnů, primárního cíle (ACR 20) dosáhlo 67,2 % pacientů oproti skupině na placebu (dávka 46 mg každý druhý týden). Kritéria ACR 50 docílilo 55 % pacientů na adalimumabu oproti 8,1 % na placebu (resp. MTX + placebo). Odpověď na léčbu byla rychlá a u většiny pacientů nastala již po 1. injekci. Adalimumab byl zkoušen paralelně v kombinacích s methotrexátem, nebo jako monoterapie. Ve studii Burmestra byl adalimumab podáván bez MTX a odpovědi ACR 20 bylo dosaženo ve 46 % oproti 19 % po placebu (p <0,001) (tab. 3) [14]. Rentgenová progrese byla prakticky úplně zastavena (graf 4).
Ve studii PREMIER u časné RA byl adalimumab v kombinaci s MTX účinnější než obě monoterapie. Po 2 letech bylo dosaženo remise téměř u 50 % pacientů [15]. Přetrvání účinku adalimumabu po více než 4 letech prokázal Burmester [14]. Mezinárodní skupina, která připravuje každý rok konsenzus jako dokument, v oficiálním časopise Evropské ligy proti revmatismu (EULAR) konstatovala: Přestože zatím neexistují žádné přímé srovnávací studie, je nutné považovat všechny tři léky blokující TNF-a za rovnocenné. Význam přechodu z jednoho typu preparátu na druhý zatím není znám. Je pravděpodobné, že současné podávání MTX zvyšuje účinnost všech těchto preparátů. Česká revmatologická společnost publikovala svoje návody na léčbu revmatoidní artritidy léky blokujícími TNF (tab. 4).
Léky blokující TNF
Indikace u revmatoidní artritidy v České republice
1) Léky blokující TNF jsou indikovány u pacientů s RA, kteří nedostatečně odpovídají na léčbu minimálně 2 léky modifikujícími průběh choroby. Jedním z těchto léků by měl být methotrexát. DMARDs musí být podávány po dostatečně dlouhou dobu (6 měsíců) a v dostatečné dávce, pokud jsou tolerovány (např. u dospělých sulfasalazin 3 g denně, methotrexát 20–25 mg týdně, leflunomid 20 mg denně; u dětí ekvivalentní dávky). Indikace se týká i polyartikulární juvenilní idiopatické artritidy (JIA) po 18. roce věku. Pro dětské pacienty (4–17 let) s polyartikulární JIA je indikován zatím pouze etanercept. 2) Aktivita choroby musí být hodnocena jako vysoká (skóre aktivity nemoci DAS28 ≥5,1) [7]. 3) Látky blokující TNF mohou být přidány k methotrexátu, případně k léku modifikujícímu průběh choroby (DMARDs), či použity samostatně. V tomto aspektu existují však určité rozdíly (podrobnosti viz tab. 1). 4) Nebylo zatím prokázáno, že by některý z léků blokujících TNF byl účinnější než jiný preparát z této skupiny, a neexistuje tedy důvod k doporučení látky, která by měla být používána prioritně. Byly však popsány individuální rozdíly mezi pacienty v reaktivitě na různé inhibitory TNF, takže není vyloučeno, že pacient nereagující na jeden lék blokující TNF bude mít dobrou odpověď na léčbu jiným preparátem. 5) Pacienti s relapsem, u kterých bylo v minulosti ukončeno podávání preparátu, které vedlo k remisi, by nejdříve měli být léčeni tímto lékem.
Použití
Léčba preparáty blokujícími TNF by měla vést k významnému zlepšení. To by mělo být dokumentováno poklesem aktivity (pokles DAS28 alespoň o ≥1,2) během 8 až 12 týdnů léčby a toto zlepšení by mělo být udržováno během následující terapie s kontrolami v intervalu 8 týdnů. Pokud je odpověď na léčbu jen částečná, je možné, že zvýšení dávky či zkrácení intervalu přinese další zlepšení. To se týká především infliximabu. Údaje o použití látek blokujících TNF v těhotenství nejsou dostatečné, aby bylo možné výslovně doporučovat pokračování této léčby. U pacientek, které otěhotněly a pokračovaly v podávání látek blokujících TNF, nebyly nalezeny odchylky v počtu porodů, spontánních či terapeutických potratů proti normální populaci. U několika pacientů s RA léčených léky blokujícími TNF bylo popsáno onemocnění podobné systémovému lupus erythematodes. Všichni tito nemocní měli anti-dsDNA protilátky. Léčba by měla být u takovýchto nemocných přerušena. Neexistuje však důkaz, že by nemocní, kteří mají před začátkem terapie či se u nich objeví během léčby antinukleární protilátky, antikardiolipinové protilátky nebo anti-dsDNA protilátky, měli zvýšené riziko léky indukovaného SLE. Léčba u takovýchto nemocných může být zahájena nebo může pokračovat. Postup v případě chirurgického výkonu u pacienta s anti TNF léčbou není jasný pro absenci dostatečného množství prospektivně sbíraných údajů. Podle ústního doporučení lékařů s největší zkušeností s touto terapií je vhodné směřovat plánovaný chirurgický zákrok do období mezi infuzemi infliximabu, tedy asi měsíc po poslední infuzi, či v případě etanerceptu a adalimumabu vynechat po krátkou dobu léčbu před zákrokem a započít znovu v odstupu 1–2 týdnů.
Ukončení léčby
Pacienti nereagující na léčbu léky blokujícími TNF by měli léčbu ukončit. Kritériem je pokles DAS alespoň o 1,2 během 3 měsíců léčby. Většina pacientů by měla odpovědět na terapii během tohoto období, i když občas se vyskytnou nemocní, kteří se významně zlepší až po delším časovém intervalu. Braun navrhuje interval alespoň 2 měsíce [17], nicméně křivky ukazující počet nemocných splňujících kritéria zlepšení většinou jasně stoupají do 3. měsíce podávání a oplošťují se až po tomto intervalu. Proto volíme tento interval. Zlepšení by mělo být udržováno i v následujícím období, a pokud pacient nesplní kritérium zlepšení ve dvou po sobě následujících návštěvách v odstupu 1–2 měsíců, léčba by měla být ukončena. Samozřejmě by měla být léčba ukončena v případě netolerovatelných vedlejších nežádoucích účinků.
Vyšetření
Všichni pacienti by měli být před začátkem léčby kompletně klinicky vyšetřeni, měli by mít provedeno rtg vyšetření plic a rtg rukou a nohou. Mělo by být provedeno základní laboratorní vyšetření. Nemocní s akutní či chronickou infekcí, zvláště TBC, by neměli být těmito preparáty léčeni, pokud není infekce potlačena (postup u TBC určuje speciální oddíl textu). Podobně pacienti s demyelinizačním onemocněním, případně s malignitou jsou kontraindikováni. Opatrnost je nutná u pacientů se sklonem k cytopeniím. Léky by neměly být podávány nemocným s městnavou srdeční nedostatečností NYHA III, IV. Všechny tyto stavy by měly být před podáváním léčby blokující TNF vyšetřeny a posouzeny.
Další sledování
Zařazení pacientů do registru léčených léky blokujícími TNF je nedílnou součástí terapie. Sledování krátkodobých i dlouhodobých účinků léčby a jejích případných toxických dopadů je jednoznačně doporučeno revmatologickými asociacemi v evropských zemích i v USA včetně American College of Rheumatology, EULAR, FDA i EMEA. Formují se celoevropské registry a registr v USA. Jen tak bude možné z dlouhodobého hlediska ohodnotit přínos a rizika této nákladné léčby. Česká revmatologická společnost (ČRS) reagovala na tyto pochopitelné požadavky a iniciovala vytvoření registru pacientů léčených léky blokujícími TNF. Registr je nazván ATTRA (anti TNF terapie revmatoidní artritidy) a je spravován Centrem biostatistiky a analýz Masarykovy univerzity v Brně, pod dohledem ČRS. Zařazení do registru a dlouhodobé sledování je povinnou administrativní součástí použití léků blokujících TNF. Sledování v registru poskytuje jistotu, že budou provedeny všechny laboratorní a další testy, včetně jejich pravidelných kontrol.
Léčba blokující TNF u spondylartritid
V posledních několika letech byly infliximab, etanercept a adalimumab zkoušeny u séronegativních spondylartritid, a především pak u ankylozující spondylitidy (AS). V roce 2003 pak byl infliximab schválen pro indikace AS a etanercept kromě AS ještě pro psoriatickou artritidu [18]. Pilotní studii o účinnosti infliximabu publikoval Braun [19]. Celkem 11 pacientům aplikoval v intervalech 0, 2, 6 týdnů 5 mg/kg váhy infliximabu. Pokles BASDAI (Bath Ankylosing Spondylitis Activity Index) o >50 % byl evidentní u 9/10 pacientů a došlo k normalizaci CRP. Zásadní důkaz o účinnosti infliximabu u AS přinesla dvojitě slepá randomizovaná studie, do níž bylo zařazeno celkem 70 pacientů [20]. Primárním kritériem byla hodnota BASDAI ve 12. týdnu a jeho redukci o 50 % splnilo 53 % pacientů po infliximabu oproti 9 % po placebu. Účinek léčby byl výraznější u pacientů s elevací CRP nad normu. Příznivě byla oproti placebu ovlivněna i funkce a kvalita života. Data z MRI vyšetření ukazují redukci zánětu v oblasti páteře až o 46 % oproti placebu. Druhá randomizovaná kontrolovaná slepá studie byla provedena u nemocných, kteří splňovali kritéria pro spondylartritidy [21]. Proto také indikační kritéria zahrnovala kromě zánětlivé bolesti v zádech i 1 oteklý kloub a 1 aktivní entezitidu. Dávkování bylo stejné jako u Braunovy studie. Zařazeno bylo 40 pacientů a primárním kritériem bylo hodnocení pacientem a lékařem v týdnu 12. Medián zlepšení obou kritérií oproti placebu byl 73 %, resp. 76 %. Statisticky vysoce výrazné rozdíly se objevily i v sekundárních ukazatelích (ranní ztuhlost, citlivé a oteklé klouby, index aktivity nemoci BASDAI). Účinnost etanerceptu u AS byla ověřena ve studii Gormana [22]. Zařazoval nemocné s aktivní AS, kteří pokračovali v zavedené léčbě DMARDs. Dávkování bylo 25 mg etanerceptu s.c. 2x týdně. Do studie bylo zařazeno 40 pacientů a trvala 4 měsíce. Primárním kritériem bylo hodnocení odpovědi ASAS. Bylo dosaženo u 80 % léčených etanerceptem oproti 30 % pacientů po placebu.
Vlastní indikační kritéria
Indikační kritéria České revmatologické společnosti viz tab. 5.
Indikováni jsou pacienti, kteří splňují tyto podmínky: Mají definitivní diagnózu AS. Aktivita nemoci je vysoká a při 2 následujících návštěvách (nejméně v 1měsíčním intervalu) je BASDAI >4 [23], CRP >10 mg/l. Selhání léčby nejméně 2 nesteroidními antirevmatiky. Selhání je definováno jako nejméně 2týdenní podávání plné (maximálně tolerované) dávky NSA. Selhání i.a. léčby kortikosteroidy, pokud byla indikována. Selhání léčby sulfasalazinem u formy AS s periferní artritidou. Pacient nemá maximální rentgenové skóre (totální ankylóza, obraz bambusové páteře).
Výběr preparátu a dávkování
Pro léčbu AS dle výše uvedených kritérií lze použít etanercept nebo infliximab. Z hlediska účinnosti je nutné považovat oba preparáty za rovnocenné. Dávkování a intervaly u AS nejsou zcela jednoznačně určeny. V klinických studiích s infliximabem byly použity dávky 3 mg/kg až 5 mg/kg váhy a intervaly 3–14 týdnů. Pracovní skupina dospěla k názoru, že optimální režim je u infliximabu 5 mg/kg každých 6 týdnů. Doporučené intervaly aplikace infliximabu u AS jsou tedy v týdnech: 0, 2, 6, a dále ā 6 týdnů. U etanerceptu jde pak o 25 mg subkutánně 2x týdně. Je možné, že u určitých skupin pacientů mohou být účinné i nižší dávky a delší intervaly, ale toto nebylo potvrzeno v klinických studiích. Studie s oběma preparáty byly prováděny jako monoterapie. O kombinační léčbě (preparát blokující TNF + methotrexát, azathioprin) nejsou žádná data.
Jak hodnotit odpověď na léčbu
Odpověď na léčbu se hodnotí po 6–12 týdnech, navrhujeme interval 12 týdnů. Odpověď na léčbu je definována jako 50% snížení nebo pokles o 2 jednotky (0–10 škála) BASDAI [23]. Délka léčby léky blokujícími TNF není určena. Nejdelší zkušenosti jsou dvouleté. Z dosavadních dat se zdá pravděpodobné, že většina pacientů po určité době po vysazení exacerbuje. Použití léků blokujících TNF-a se rozšiřuje i o další indikace. V tab. 6 jsou pod písmenem A indikace již schválené americkým FDA a evropskou agenturou EMEA (European Medicinal Evaluation Agency).
Léky blokující TNF-a byly užity i v řadě dalších revmatologických, ale i nerevmatologických indikací. Pod písmenem B jsou i další potenciální indikace, přičemž v současné době jsou pro tyto indikace dostupné otevřené studie nebo vyslovená kazuistická sdělení.
Bezpečnost léčby blokující TNF
Nejdůležitější potenciální rizika, která jsou asociována s terapií anti TNF-a, zahrnují infuzní reakce nebo reakce v místech vpichu, infekce, autoimunitní projevy, neurologické projevy, zejména typu demyelinizačních onemocnění, malignity, hematologické komplikace s pancytopenií a městnavé srdeční selhání. TNF-a má v organismu svou významnou fyziologickou roli a jeho chronická blokáda může mít své negativní důsledky. Množství udávaných vedlejších nežádoucích účinků je ve světle důležitosti tohoto cytokinu relativně, a možná i překvapivě, malé. Infuzní reakce a reakce v místech vpichu jsou asociovány s imunogenicitou preparátů a jsou většinou jen mírné. Vzácně se mohou vyskytnout závažné reakce, především při intravenózní aplikaci infliximabu, které vyžadují intenzivní terapii a jsou absolutní kontraindikací dalšího podávání. Tyto příhody jsou způsobeny hlavně hypersenzitivní reakcí na myší protein obsažený v imunoglobulinové molekule infliximabu. Myší část chimérické molekuly infliximabu je zodpovědná za možnou indukci tvorby protilátek (HACA – human antichimeric antibodies), která může vést ke snížení účinnosti léčby. Z toho důvodu je při léčbě infliximabem indikována současná aplikace methotrexátu, který tvorbu protilátek proti infliximabu tlumí. Toto platí pro revmatoidní artritidu. U ankylozující spondylitidy (AS) je infliximab podáván samostatně, bez methotrexátu, což reflektuje minimální použití tohoto léku u AS. Nicméně, vztah k produkci HACA u AS je nejasný a zatím nebylo možné získat žádné informace o jejich případné tvorbě a o dopadech na chronickou léčbu infliximabem u AS. U plně humánní monoklonální protilátky anti TNF-a adalimumabu je problém imunogenicity redukován, nicméně může dojít k tvorbě antiidiotypových protilátek, které mohou mít minimální vliv na snížení účinnosti (celková frekvence protilátek proti adalimumabu je 5,5 % při monoterapii a prakticky 0 % v kombinaci s methotrexátem; ACR20 byly redukovány při monoterapii na 41,9 % proti 45,3 % při kombinaci). Při terapii etanerceptem je nejčastěji udáván vznik lokální reakce v místě aplikace. Vzácně byl popsán vývoj akutní difuzní erytematózní reakce kůže s vývojem papulárních lézí po podání několika dávek etanerceptu. Histologicky byly prokázány změny typické pro akutní diskoidní lupus. Dále bylo popsáno několik případů leukocytoklastické nekrotizující vaskulitidy, která se objevila na kůži pacientů v místech, kde dosud nebyl etanercept aplikován. V několika případech byl po podávání etanerceptu popsán výskyt urtikariální reakce na extenzorové ploše horních končetin. Při blokádě TNF byl popsán vznik antinukleárních protilátek (11–62 %), pozitivita anti-dsDNA protilátek (6–15 %), zcela výjimečně s vyvoláním lupus-like syndromu. Z hlediska četnosti a závažnosti nepředstavuje vznik autoimunitní reakce větší praktický problém. Pacienti, kteří vyvinou známky lupus- -like syndromu, ukončí léčbu. U ostatních, kteří mají pouze autoimunitní laboratorní fenomén, léčba pokračuje. Z hlediska vztahu úlohy TNF a jeho role v aktivaci B lymfocytů a v tvorbě autoprotilátek jde o jev velmi zajímavý, který naznačuje možný význam TNF v mechanismu indukce tolerance. Mezi závažné neurologické komplikace terapie lze zařadit výskyt demyelinizačních chorob typu roztroušené sklerózy a záchvatovitých onemocnění. Vzácně byla popsána i neuritida optiku, retrobulbární neuritida a periferní neuropatie. Proto je doporučováno neaplikovat terapii anti TNF-a nemocným s anamnézou demyelinizačního onemocnění, zejména roztroušené sklerózy, a u rizikových pacientů je vhodné při léčbě průběžně sledovat MRI mozku. Pokud se taková komplikace vyskytne, je nutné léčbu blokující TNF ukončit. Bylo popsáno několik případů pancytopenie a aplastické anémie. Vztah k léčbě anti TNF je nejasný, nicméně dokud nebudou přesně známy souvislosti mezi těmito stavy a blokádou TNF, doporučuje se léčbu blokující TNF při výskytu cytopenie raději ukončit. Zvláštní situace se týká městnavého srdečního selhání. Při těchto stavech byly nalezeny vyšší hladiny TNF, které přispívají k celkové i srdeční kachexii, únavě, dysfunkci myocytů a změnám základních myokardiálních bílkovin. Léčba pomocí blokády TNF se však ukázala jako neúčinná a byla předčasně ukončena v případě etanerceptu, s nevýznamnou tendencí ke zhoršení. Vysoké dávky infliximabu (10 mg/kg) byly asociovány se zvýšeným rizikem zhoršení městnavého srdečního selhání a se zvýšenou mortalitou u takovýchto nemocných. Pro dávky infliximabu 5 mg/kg či etanerceptu 2x týdně 25 mg a zvýšené riziko zhoršení městnavého srdečního selhání nejsou žádné důkazy. V randomizovaných kontrolovaných studiích s blokátory TNF (infliximab, etanercept, adalimumab) nebyla nalezena zvýšená frekvence městnavého srdečního selhání ve srovnání s placebem. FDA doporučuje opatrnost při podávání látek blokujících TNF u městnavého srdečního selhání, zejména jsou-li dosahovány dávky infliximabu více než 5 mg/kg či etanerceptu 3x týdně 25 mg. Výskyt neoplasmat jiných než lymfomů nepřevyšuje u nemocných s RA léčených inhibitory TNF frekvenci u srovnatelné populace. Výskyt lymfomů je obecně asi 2–3x vyšší u nemocných s revmatoidní artritidou. Incidence se liší podle aktivity. Beacklund a spol. [24] nalezli OR (odds ratio) = 1,0 u pacientů s RA s nízkou aktivitou; OR = 5,4 u střední a OR = 25,8 u vysoké aktivity. Analýza pacientů s RA dostávajících inhibitory TNF ukazuje 2,3–6,3krát zvýšené SIR (standard incidence ratio). To je tedy více než u běžné populace, ale nejspíše stejně jako u pacientů s RA, kteří jsou kandidáty pro tuto léčbu z hlediska aktivity. To je poslední názor FDA (Food and Drug Administration), který se celou problematikou lymfomů u RA zabýval na své schůzi v březnu 2003 [25]. Stále však je na místě opatrnost a vedle patřičné anamnézy i pečlivé sledování pacientů nejen během terapie, ale i dlouhodobě po jejím ukončení. Léčba antagonisty TNF může vést k mírné až střední elevaci ALT a AST. V současné době není známa bezpečnost podávání látek blokujících TNF při chronických infekcích, jako jsou např. HIV, hepatitida B a další, v laktaci a při vakcinaci živými vakcínami. Léčbu blokátory TNF často doprovázejí infekce. Jsou většinou mírné, nicméně mohou se vyskytnout i závažné bakteriální, virové či mykotické infekce. Není však jasné, zda je jejich frekvence vyšší než u srovnatelné populace pacientů s revmatoidní artritidou, kteří jsou léčeni pouze běžnými DMARDs a/nebo glukokortikoidy. Mezi infekční komplikace se řadí hlavně infekce horních cest dýchacích a sinusitida. Jako méně častá infekční komplikace se objevuje pyelonefritida, pneumonie, celulitida a sepse. Vzácněji byla zjištěna histoplazmóza, listerióza, aspergilóza, kryptokoková infekce a kokcidiomykóza. Mezi rizikové faktory pro vznik infekce patří pobyt v endemické oblasti, chronická terapie kortikosteroidy, zejména při dávkách větších než 15 mg denně, a terapie imunosupresivy. Vyšší riziko vzniku infekce je i u nemocných s některou ze závažných chorob, které se případně vyskytují u nemocných souběžně a nezávisle s revmatickou chorobou, jako je diabetes mellitus, chronická renální insuficience, pozitivita na HIV, silikóza plic a malignita. U pacientů, kteří trpí akutní nebo chronickou infekcí (sinusitida, pyelonefritida, bronchiektazie, recidivující septické stavy, osteomyelitida, infekce endoprotézy atd.), se nedoporučuje terapii anti TNF-a zahajovat nebo je nutné terapii přerušit, dokud se nepodaří infekci eradikovat. Nejzávažnější infekční komplikací, která je současně i nejzávažnějším nežádoucím účinkem terapie anti TNF-a, a to zejména terapie infliximabem, je výskyt tuberkulózy [27]. TNF-a se u myších modelů podílí na normální protizánětlivé imunitní reakci na infekci TBC, což vede k aktivaci makrofágů a vzniku granulomu. Blokádou účinku TNF-a při léčbě infliximabem dojde tudíž i k blokádě zmíněného fyziologického obranného účinku TNF-a, a tím i ke zvýšení rizika manifestace latentní infekce TBC. Obecný výskyt TBC je udáván v různých zemích různě. Často se cituje 15 případů na 100 000 obyvatel, což platí v některých evropských zemích (v ČR to bylo v roce 2001 13,1/100 000). V USA je menší incidence – 5,8/100 000, poslední údaje např. ze Španělska udávají 21/100 000, což je 3–5x větší incidence než v některých evropských zemích či v USA. K březnu 2003 bylo oznámeno 242 případů TBC asociovaných s podáním infliximabu, 18 s podáním adalimumabu (schůze FDA 3. března 2003). Velmi varovná byla čísla ze Španělska, kde před započetím kontroly pacientů před léčbou anti TNF byla frekvence 17 případů na 1 540 pacientů! Po zahájení přísného vyšetření na možnou latentní TBC a aplikaci příslušné léčby zde poklesl počet na 1 případ za 5 měsíců (údaj z května 2002) a za období únor–prosinec 2002 nebyl pozorován jediný případ. Situace v přístupu k léčbě anti TNF je dnes již jiná, než byla dříve. Zvýšená frekvence infekce TBC v souvislosti s léčbou anti TNF si vynutila přísnou kontrolu pacientů, kteří mají takovou léčbu dostat. Tato opatření výrazně snížila frekvenci případů TBC. Existují lokální doporučení v různých zemích, která se od sebe více či méně liší. V USA není zavedeno očkování proti TBC, a tudíž každý pozitivní tuberkulinový test znamená nějaký kontakt. V evropských zemích při proočkované populaci je situace jiná a celá řada jedinců v populaci má nějakou reakci na tuberkulinový test (PPD). Nicméně nemocní s RA jsou většinou léčeni imunosupresivními léky, které potlačují projevy opožděné přecitlivělosti a mohou snižovat reakci na tuberkulin, tedy vést k falešně negativnímu výsledku. Prvním problémem je tuberkulinový test, označovaný jako PPD (purified protein derivative), při kterém je přísně intradermálně (ne subkutánně) do kůže na volární straně předloktí aplikováno množství 0,1 ml PPD. Po 48–72 hodinách je odečtena indurace, nikoliv erytém (!). Z hlediska pozitivity záleží na několika okolnostech a interpretaci nutno podřídit okolnostem, za kterých je PPD test prováděn. Pokud se test bude týkat zdravé očkované osoby, bez známé expozice TBC, bez klinických projevů a bez imunosupresivních vlivů, pak je za pozitivní výsledek považována indurace alespoň 15 mm. U pacientů s AIDS je indurace 5 mm a výše považována za pozitivní. Jak je tomu u revmatoidní artritidy? Lze předpokládat u pacienta s RA léčeného methotrexátem a malou dávkou kortikoidů takovou imunosupresi, že dojde k potlačení reakce směrem k negativitě? Je vlastní průběh onemocnění sám o sobě imunosupresivní vzhledem k reakci opožděné přecitlivělosti? Jaká dávka léků je imunosupresivní a jaká ještě ne? Existují individuální rozdíly mezi pacienty v tomto smyslu? Mají pacienti, kteří budou dostávat imunosupresivní léčbu methotrexátem a glukokortikoidy zároveň s léčbou anti TNF, větší riziko rozvoje TBC? To jsou otázky, na které dosud nemáme jednoznačnou odpověď. Testování jiných antigenů opožděné přecitlivělosti, jako je např. Candida albicans, se údajně neosvědčilo (doporučení CDC [22]). Španělské návody doporučují PPD test opakovat v případě negativity po týdnu s tím, že dalších 10–15 % nemocných původně negativních vyvine pozitivitu PPD testu. Dalším problémem je fakt, že řada TBC spojená s terapií blokující TNF je mimoplicní. Tedy rtg vyšetření plic v rámci preventivních opatření před léčbou blokující TNF přináší jen částečnou eliminaci rizika. Jak bude uvedeno dále, nemocní s latentní TBC by měli být léčeni před zahájením terapie blokující TNF antituberkulotiky. Jsou navrhována různá schémata; nejčastěji devítiměsíční podávání isoniazidu (INH) v dávce 5 mg/kg, maximálně 300 mg denně. Léčbu blokující TNF lze zahájit 1 měsíc po zavedení INH, především pro zjištění tolerance léku a zjištění případné toxicity. Je pravděpodobné, že po dokončení podávání INH není nutno protahovat tuto léčbu, i když podávání léků blokujících TNF pokračuje. Podávání INH je asociováno s 10% výskytem léky indukované hepatitidy. Riziko jaterního poškození je větší u alkoholiků nebo u pacientů s virovou hepatitidou a ve vyšším věku. Pravděpodobně se zvyšuje riziko při současném podávání methotrexátu, ale situace není jasná, není vyloučeno, že současná imunosupresivní léčba toto riziko může snižovat. Jsou navrhovány i jiné režimy pro chemoprofylaxi, jako např. kombinace rifampicinu a pyrazinamidu či rifampicinu a isoniazidu [28]. Důvodem je častější přítomnost rezistentních kmenů BK u imigrantů z Asie a Afriky v některých zemích.
Postup preventivního vyšetření a opatření zamezující vzniku tuberkulózní infekce u pacientů léčených léky blokujícími TNF v České republice
Používané termíny – definice
Normální nález
Negativní tuberkulinový test, negativní rtg vyšetření plic, negativní anamnéza infekce TBC.
Aktivní infekce TBC
Jasně prokázaná infekce TBC na podkladě pozitivního tuberkulinového testu, rtg vyšetření změn v případě plicní formy, pozitivního nálezu mikroskopického, kultivačního nebo LCR atd.
Latentní infekce TBC
Latentní TBC diagnostikujeme v případě přítomnosti některého z následujících bodů: 1. Pacienti s pozitivitou tuberkulinového testu. 2. Pacienti, kteří nemají jasné známky infekce TBC, ale mají rtg změny suspektní z možné prodělané infekce TBC (např. primární komplex, kalcifikace v uzlinách, fibrotické změny hlavně v oblasti plicích vrcholů).
Vyšetření před zahájením terapie
Podrobná anamnéza
- zaměření na přítomnost tuberkulózy včetně možnosti onemocnění v minulosti, typu léčby, kontaktu s TBC v nedávné době či minulosti; - datum BCG vakcinace, výsledky případných předcházejících vyšetření tuberkulinovým testem; - zjištění imunosupresivní terapie; - zjištění přídatných rizikových faktorů (infekce HIV, diabetes mellitus, závažnější renální onemocnění, silikóza, závažné střevní onemocnění, maligní onemocnění, malnutrice, profesionální expozice, jaterní cirhóza, osoba pocházející z endemické oblasti).
Podrobné objektivní vyšetření
Základní laboratorní vyšetření
Při podezření na TBC indikovat podrobné vyšetření: barvení na acidorezistentní tyčinky, kultivace ze sputa nebo materiálu z podezřelé lokalizace, molekulárněbiologické metody. V případě potřeby vyšetření z forsírovaného sputa. Provedení rtg vyšetření plic v předozadní projekci. Snímek nemá být starší než tři měsíce.
Provedení tuberkulinového kožního testu.
Postup v jednotlivých situacích
Normální nález
Terapie anti-TNF alfa je možná.
Aktivní TBC
Zahájení terapie anti TNF-a je kontraindikováno. Pacienti s podezřením na aktivní TBC musí být bez odkladu vyšetřeni specialistou a léčeni adekvátní terapií antituberkulotiky, kterou indikuje a vede specialista TRN. Po plném vyléčení infekce TBC je možno znovu zvážit nasazení terapie anti TNF-a. Přístup je individuální a je možné zvážit současné podání profylaktické terapie.
Latentní TBC
Profylaktická terapie INH, 9 měsíců v dávce 5 mg/kg (maximálně 300 mg denně). Tato terapie je indikována: tuberkulinový test ≥0 mm a negativní nález na plicním snímku; tuberkulinový test ≥5 mm a negativní nález na plicním snímku; při současné přítomnosti nedávného styku s aktivní TBC, anamnéze nedostatečně léčené tuberkulózy v minulosti nebo některého z přídatných rizikových faktorů (infekce HIV, diabetes mellitus, závažnější renální onemocnění, silikóza, závažné střevní onemocnění, maligní onemocnění, malnutrice, profesionální expozice BK, jaterní cirhóza, osoba pocházející z endemické oblasti); tuberkulinový test <5 mm a suspektní nález na plicním snímku. V tomto případě je nevyhnutelná konzultace se specialistou TRN. Terapie antagonistou TNF může být započata 1 měsíc po zahájení profylaktické terapie antituberkulotiky. Důvodem odkladu o 1 měsíc je zjištění případných vedlejších nežádoucích účinků léčby antituberkulotikem. Z analýzy nežádoucích účinků léků blokujících TNF-a vyplývají vylučovací kritéria uvedená v tab. 7.
Závěr
Blokáda TNF-a znamená zcela novou kvalitu v léčbě RA. Nová generace biologických léků vznikla na rozdíl od starší generace DMARDs již na základě částečného pochopení etiopatogeneze RA a jejich aplikace zpětně přinesla nové poznatky pro pochopení některých složitých vztahů mezi různými buňkami, cytokiny a dalšími mediátory u autoimunit obecně. Léčba biologickými léky je mnohem účinnější a výrazně zpomaluje strukturální poškození u RA. I přes některé vzácné závažné nežádoucí účinky zůstává poměr přínos/riziko vysoce kladný a nejvyšší ze všech DMARDs.
Další biologické léky
Anakinra, antagonista receptoru pro interleukin 1 v léčbě RA
Interleukin 1 je velmi důležitý mediátor imunitní a zánětlivé reakce u RA a má důležitou roli v její patogenezi [29]. IL-1 modifikuje zánět tím, že rekrutuje neutrofily, aktivuje makrofágy a stimuluje diferenciaci T i B buněk. Navíc IL-1 indukuje proteolytické enzymy a degraduje extracelulární matrix, což vyústí v destrukci tkání [30]. Antagonista pro IL-1 receptor (IL-1 Ra) se vyskytuje přirozeně jako specifický inhibitor pro IL-1. Endogenní produkce IL-1 Ra má důležitou protizánětlivou úlohu. Anakinra je rekombinantní neglykosylovaná forma nativního IL-1 Ra. Je vyráběna rekombinantní DNA technologií při použití Escherichia coli. K její účinnosti je nutné blokovat 95 % receptorů pro IL-1. Vzhledem ke krátkému poločasu (4–6 hod.) je nutná denní subkutánní aplikace, přičemž FDA schválil dávku 100 mg s.c. denně. Klinická účinnost anakinry byla potvrzena v několika velkých randomizovaných studiích, a to jak ve formě monoterapie [31], tak v kombinaci s methotrexátem [32] i s ostatními DMARDs [33]. Kombinace anakinry s etanerceptem se neosvědčila, protože docházelo k vyššímu výskytu závažných infekcí [34]. Anakinra ve studiích významně zpomalovala rentgenovou progresi [31,32]. Tolerance léčby anakinrou byla dobrá. Nejčastějším nežádoucím účinkem byly lokální kožní reakce po vpichu, které ale vedly k přerušení léčby jen u 2 % [31,32]. Infekce byly jen mírně častější než po placebu. Nevýhodu denní aplikace však z anakinry udělal lék 2. volby u pacientů se selháním DMARDs a anti TNF terapie.
Další biologické léky, těsně před registrací
Inhibice interleukinu 6 – MRA
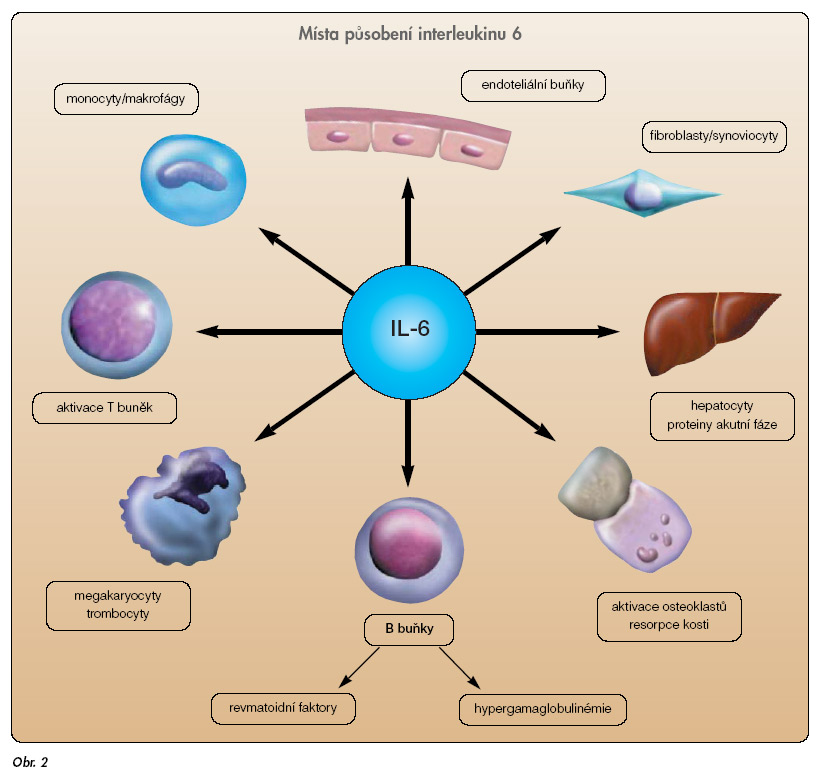
Interleukin 6 je pleiotropní cytokin s různými biologickými účinky (obr. 2).
IL-6 se nachází u nemocných s aktivní revmatoidní artritidou [35]. IL-6 se účastní při destrukci kloubu, synovitidě a systémových projevech RA. Účinek blokády IL-6 monoklonální protilátkou byl testován na experimentálním modelu artritidy [36]. Později byla vyvinuta humanizovaná protilátka proti receptoru IL-6, která byla označena MRA [37]. MRA byla testována v randomizované dvojitě slepé kontrolované studii oproti placebu. Byla podávána 1 infuze různé dávky MRA (0,1–10 mg/kg váhy). Studie ukázala účinnost dávek 5 a 10 mg/kg při intravenózním podání [37]. Biologický poločas vyšších dávek byl určen na 1 týden. Bezpečnost byla dobrá, nejčastějším nežádoucím účinkem byl průjem, který se vyskytoval v 17 % případů. V další studii byly použity dávky 4 mg/kg a 8 mg/kg v měsíčních intervalech. Odpovědi ACR 20 bylo dosaženo u 78 % pacientů ve větvi s 8 mg/kg oproti 11 % pacientů ve větvi s placebem [38]. V další velké studii byla MRA testována jako monoterapie nebo v kombinaci s methotrexátem. Byly použity 3 dávkovací režimy (2, 4 a 8 mg/kg) 1 x 4 týdny i.v. Komparátorem byl MTX v dávce 10–25 mg týdně. V monoterapii byla MRA účinnější než placebo. Kombinované režimy MRA + MTX v dávce 4 a 8 mg/kg byly účinnější než monoterapie MTX [39]. Mezi závažnými nežádoucími účinky bylo ve skupině s MRA 5 pacientů se závažnými infekcemi a 5 s reakcemi hypersenzitivity. Bylo registrováno i několik pacientů se zvýšením hladiny cholesterolu. MRA je účinná v potlačení synovitidy u RA, nyní je testována ve fázi III klinického zkoušení a má potenciál být zaregistrována v léčbě RA.
Depleční terapie B buněk pomocí rituximabu v léčbě RA
Úvahy o úloze B buněk v patogenezi RA historicky spadají až do 19. století, kdy byla identifikována germinální centra v synovii pacientů s RA. V polovině 20. století pak byl Waalerem popsán revmatoidní faktor a později Kunkelem i imunoglobuliny. Nicméně v dalších letech byl v patogenezi RA více zdůrazňován účinek T buněk a buněčné imunity obecně. B buňky byly považovány za pasivní element a produkce RF za sekundární záležitost po příslušné aktivaci T lymfocyty. Až nové poznatky 90. let obnovily zájem o B buňky jako potenciální terapeutickou cílovou strukturu. Byly vyvinuty protilátky proti B buňkám, anti CD20. Jejich prvotní indikací byly non-hodgkinské lymfomy. První otevřené studie u RA prováděl prof. Edwards v letech 1997–1999 [40,41]. Používal rituximab v kombinaci s cyclophosphamidem a methylprednisolonem ve dvou infuzích, přičemž účinek přetrvával 6–12 měsíců. Fáze II klinického zkoušení byla dokončena v roce 2003 [42]. Srovnávala účinek monoterapie rituximabem, kombinace s cyclophosphamidem a s methotrexátem. Do studie bylo zařazeno 161 pacientů, kteří dostávali v jedné z větví buď samotný MTX, samotný rituximab, rituximab + cyclophosphamid, nebo rituximab + methotrexát. Všechny skupiny měly na začátku léčby v průběhu 17 dní steroidy v celkové dávce 910 mg. Nejlepší odpovědi po 6 měsících bylo dosaženo v ukazateli ACR 50 u kombinace rituximab + MTX (41 %) a rituximab + cyclophosphamid (43 %). Účinnost je tedy v relaci s účinností léků blokujících TNF. Potenciální výhodou je fakt, že není nutné podávat kontinuálně léky jako u léčby blokující TNF. Tolerance byla dobrá a nežádoucí účinky mírné a reverzibilní. V současné době probíhají klinické studie fáze III. Používají prakticky pouze kombinace s MTX. Zkoumá se mimo jiné i optimální steroidový režim na začátku terapie a vliv léčby rituximabem na rentgenovou progresi.
Kostimulační blokáda pomocí CTLA4lg u RA
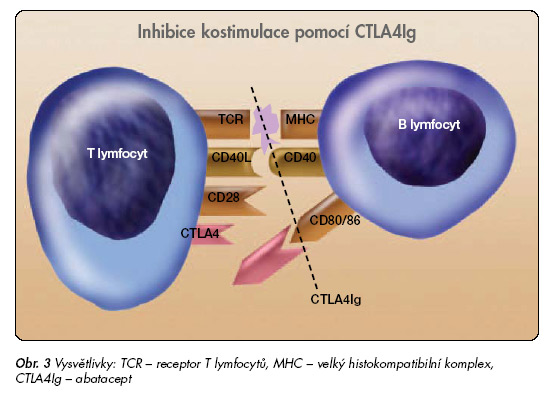
Díky poznatku, že aktivované T buňky příspívají podstatně k rozvoji RA, se zvýšil zájem o látky, které potenciálně blokují aktivaci T buněk. CTLA4lg (abatacept) je fúzovaný protein, který se skládá z extracelulární části lidského CTLA4 a fragmentu Fc domény lidského IgG1. Klidová T buňka vyžaduje pro svoji aktivaci minimálně 2 signály pro buněčnou proliferaci a genovou expresi cytokinů [42]. První signál (antigen specifický) je dodán antigen prezentujícími buňkami (APC). Při spoluúčasti MHC molekul dochází k vazbě na receptor na T buňce. Druhý signál (kostimulační) vzniká po spojení kostimulačního ligandu na APC buňce a koreceptoru na T buňce (obr. 3).
Na preklinických modelech byl CTLA4lg zkoušen u autoimunního diabetu, lupusu, lupus nefritidy, v klinických studiích pak u psoriatické a revmatoidní artritidy [43]. U revmatoidní artritidy byla ukončena fáze II klinického zkoušení a v současné době probíhá III. fáze klinického zkoušení. Ve fázi II bylo provedeno několik studií [44–46]. Ve studii s monoterapií CTLA4lg při dávce 5 mg/kg bylo dosaženo ACR 20 u 53 % pacientů [44]. V další studii byl abatacept, nebo placebo přidáván k nedostatečně účinnému methotrexátu. Obě dávky (2 mg/kg a 10 mg/kg) byly účinnější než placebo a dávka 10 mg byla účinnější než 2 mg [45]. V další studii byl abatacept přidán k nedostatečně účinnému etanerceptu. Procento pacientů s odpovědí ACR 20, 50 a 70 bylo vyšší než u placeba [46]. Kombinace abataceptu s léky blokujícími TNF však bude muset být dále zkoumána. Aplikace CTLA4lg se zatím zdá být poměrně velmi bezpečná. Postinfuzní reakce nejsou častější než po placebu. Nejsou žádné známky imunogenecity preparátu. Nebyl zaznamenán výskyt TBC ani oportunních infekcí.
Závěr
Cílená léčba (tzv. targeted therapy) RA představuje obrovský pokrok v léčbě RA v posledních 5 letech. Velikost klinického účinku, rychlost ústupu účinku, vliv na kvalitu života a vliv na strukturální progresi nemoci však tuto skupinu kvalitativně zcela odlišuje od starších DMARDs. Problémy přináší cena této léčby a některé sice řídké, ale potenciálně závažné nežádoucí účinky. Na léčbu blokující TNF příznivě odpoví 70–75 % pacientů, a proto je logické hledání dalších cíleně působících léků u RA, z nichž některé jsou již ve III. fázi klinického zkoušení.
Seznam použité literatury
- [1] Vencovský J: Revmatoidní artritída a biologická terapie. Trendy ve farmakoterapii. 2003;2: 7–9.
- [2] Maini RN, Taylor PC, Paleolog E, et al. Anti-tumor necrosis factor specific antibody (infliximab) treatment provides insights into the pathophysiology of rheumatoid arthritis. Ann Rheum Dis 1999;58:(Suppl 1) 156–60.
- [3] Williams RO, Feldmann M, Maini RN, et al. Anti-tumor necrosis factor ameliorates joint disease in murine collagen – induced arthritis. Proc Nat Acad Sci 1992;89:9784–89.
- [4] Maini RN, Breedweld FC, Kalden JR, et al. Therapeutic efficacy of multiple intravenous infusions of antitumor necrosis factor alpha monoclonal antibody combined with low-dose weekly methotrexate in rheumatoid arthritis. Arthritis Rheum 1998;41:1552–63.
- [5] Maini R, St. Clair EW, Breedweld F, et al. Infliximab versus placebo in rheumatoid arthritis patients receiving concomitant methotrexate: a randomized phase III. trial. ATTRACT Study Group Lancet 1999;354:1932–9.
- [6] Lipsky PF, van der Heide, St. Clain EW, et al. Infliximab and methotrexate in the treatment of rheumatoid arthritis Anti-Tumor Necrosis Factor Trial in RA with concomitant Therapy Study Group. N. Engl J Med 2000;343: 1594–602.
- [7] Prevo ML, van_t Hof MA, Kuper HH, et al. Modified disease activity scores that include twenty-eight-joint counts. Development and validation in a prospective longitudinal study of patients with rheumatoid arthritis. Arthritis Rheum 1995;38:440–8.
- [8] Weinblatt ME, Kremer JM, Bankhurst AD, et al. A trial of etanercept, a recombinant tumor necrosis factor receptor: Fc fusion protein, in patients with rheumatoid arthritis receiving methotrexate. New Engl J Med 1999;340:253–9.
- [9] Moreland LW, Schiff MH, Baumgartner SW, et al. Etanercept therapy in rheumatoid arthritis: a randomized, controlled trial. Ann Intern Med 1999;130:478–486.
- [10] Bathon JM, Martin RW, Fleischmann RM, et al. A comparison of etanercept and methotrexate in patients with early rheumatoid arthritis. New Engl J Med. 2000;343:1586–593.
- [11] Klareskog L, Moreland LM, Cohen SR, et al. Global safety efficacy of up to five years of etanercept (Enbrel®) therapy in rheumatoid arthritis. Arthritis Rheum 2001;44 (Suppl):577 (Abstract).
- [12] Klareskog L, van Der Heide D, Jager JP et al. Therapeutic effect of combination of etanercept and MTX compared with each treatment alone in patients with rheumatoid arthritis: double blind randomised trial. Lancet 2004; 363:675–85.
- [13] Weinblatt ME, Keystone EC, Furst D, et al. Adalimumab, a fully human anti-tumor necrosis factors monoclonal antibody, for the treatment of rheumatoid arthritis in patients taking concomitant methotrexate. The ARMADA trial. Arthritis Rheum 2003;48:35–45.
- [14] Burmester GR, van der Gutte LBA, Rau R, et al. Sustained efficacy of adalimumab monotherapy for more than four years in DMARDrefractory RA. EULAR 2003, Lisbon, Abstract.
- [15] Breedveld FC, Kavanaugh AF, Cohen SB, et al. Early treatment of RA with adalimumab (Humira) plus MTX vs adalimumab alone or TMX alone: The Premier study Arthritis. Rheum. 2004; ACR, Abstract.
- [16] St. Clair EW, Wagner CL, Fasanmade AA, et al. The relationship of serum infliximab concentrations to clinical improvement in rheumatoid arthritis. Arthritis Rheum 2002;46:1451–9.
- [17] Braun J, Sieper J, van der Heijde D. Definition of discontinuation of anti-tumor necrosis factor therapy in rheumatoid arthritis: a preliminary proposal. Ann Rheum Dis 2003;62:1023–4.
- [18] Mease J, Goffe BS, Merz J, et al. Etanercept in the treatment of psoriatic arthritis: a randomised trial. Lancet 2000;356 (9227):385–90.
- [19] Braun J, Heikel H, Cornely D, et al. Successful treatment of active ankylosing spondylitis with anti-tumor necrosis factor monoclonal antibody infliximab. Arthritis Rheum 2000;43: 1346–352.
- [20] Braun J, Brandt J, Listing J, et al. Treatment of active ankylosing spondylitis with infliximab: A randomised, controlled multicentre study, Lancet 2002;359:1187–93.
- [21] Van der Bosh F, Kruithof E, Beeter D, et al. Randomised, double-blind comparison of chimeric monoclonal antibody to tumor necrosis factor _ (infliximab) versus placebo in active spondylarthropathy. Arthritis Rheum. 2002; 46:755–765.
- [22] Gorman JO, Sasch KE, Davis JE, et al. Treatment of AS by inhibition of TNF-. New Engl J Med 2002;346:1349–355.
- [23] Garett S, Jenkinson TR, Kennedy LG a spol: A new approach to defining disease status in ankylosing spondylitis. The BATH ankylosing spondylitis disease activity index. J Rheumatol 1994;21:2286–91.
- [24] Beacklund E, Ekbom A, Sparen P, Feltelius N, KLareskog L. Disease activity and risk of lymphoma in patients with rheumatoid arthritis: nested case-control study. BMJ 1998;317: 180–1.
- [25] Hotline American College of Rheumatology, březen 2003, http://www.rheumatology.org/research/ hotline/ index.asp a http://www.fda.gov/ /ohrms/dockets/ac/acmenu.htp
- [26] Hamilton CD. Tuberculosis in the cytokine era: What rheumatologists need to know. Arthritis Rheum 2003;48:2085–91.
- [27] Gómez-Reino JJ, Carmona L, Valverde VR, Mola EM, Montero MD. Treatment of rheumatoid arthritis with tumor necrosis factor inhibitors may predispose to significant increase in tuberculosis risk. Arthritis Rheum 2003;48: 2122–7.
- [28] Mariette X, Salmon D. French guidelines for diagnosis and treating latent and active tuberculosis in patients with RA treated with TNF blockers. Ann Rheum Dis 2003;62:791.
- [29] Dayer JM, Feige U, Edwards III CK, Burger D. Anti-interleukin-1 therapy in rheumatic diseases. Curr Opin Rheumatol 2001;13 (3):170–6.
- [30] van der Berg WB,. Uncoupling of inflammatory and destructive mechanisms in arthritis. Semin Arthritis Rheum 2001;30 (5 Suppl 2): 7–16.
- [31] Bresniham B. Alvaro-Gracia JM, Cobby M, Doherty M, Domljan Z, Emery P, et al. Treatment of rheumatoid arthritis with recombinant human interleukin-1 receptor antagonist. Arthritis Rheum 1998;41 (12):2196–204.
- [32] Cohen S, Hurd E, Cush J, Schiff M, Weinblatt ME, Moreland LW, et al. Treatment of rheumatoid arthritis with anakinra, a recombinant human interleukin-1 receptor antagonist, in combination with methotrexate: results of a twenty-four-week, multicenter, randomized, double-blind, placebo-controlled trial. Arthritis Rheum 2002;46 (3):614–24.
- [33] Fleischmann RM, Schechtman J, Bennett R, Handel ML, Burmester GR, Tesser J, et al. Anakinra, a recombinant human interleukin-1 receptor antagonist (r-metHuIL–1 ra), in patients with rheumatoid arthritis: a large, international, multicenter, placebo-controlled trial. Arthritis Rheum 2003;48 (4):927–34.
- [34] Genovese M, Cohen S, Moreland L, Lium D, Liu T, Newmark R, et al. A randomized double blind controlled study evaluating the safety and efficacy of etanercept vs. etanercept plus anakinra in patients with rheumatoid arthritis. Ann Rheum Dis 2003;62 (Suppl 1):66.
- [35] Akira S, Hirano T, Taga T, Kishimoto T. Biology of multifunctional cytokines: IL 6 and related molecules (IL 1 and TNF). FASEB J 1990;4:2860–7.
- [36] Mihara M, Kotoh M, Nishimoto N, Oda Y, Kumagai E, Takagi N, et al. Humanized antibody to human interleukin–6 receptor inhibits the development of collagen arthritis in cynomolgus monkeys. Clin Immunol 2001;98:319–26.
- [37] Wending D, Racadot E, Wijdenes J. Treatment of severe rheumatoid arthritis by anti-interleukin 6 monoclonal antibody. J Rheumatol 1993; 20:259–62.
- [38] Choy EH, Isenberg DA, Garrood T, Farrow S, Ioannou Y, Bird H, et al. Therapeutic benefit of blocking interleukin–6 activity with an anti-interleukin– 6 receptor monoclonal antibody in rheumatoid arthritis: a randomized, doubleblind, placebo-controlled, dose-escalation trial. Arthritis Rheum 2002;46:3143–50.
- [39] Nishimoto N, Yoshizaki K, Miyasaka N, Yamamoto K, Takeuchi T, Hashimoto F, et al. A multicenter, randomized, double-blind, placebo- controlled trial of humanized anti-interleukin– 6 (IL–6) receptor monoclonal antibody (MRA) in rheumatoid arthritis. Arthritis Rheum 2002;46(Suppl): S559.
- [40] Edwards JCW, Cambridge G. Sustained improvement in rheumatoid arthritis following a protocol designed to deplete B lymphocytes. Rheumatology 2001;40:205–11.
- [41] Leandro MJ, Edwards JCW, Cambridge G. Clinical outcome in 22 patients with RA treated with B lymphocyte depletion. Ann Rheum Dis 2002;61:1–5.
- [42] Stahl HD., Szepanski, Szechinski J., et al. Rituximab in rheumatoid arthritis: efficacy and safety from a randomised, controlled trial. Ann. Rheum. Di 2003;62 (Suppl):09004.
- [43] Emery P. The therapeutic potential of costimulatory blockade with CTLA4lg in rheumatoid arthritis. Expert Opin. Investig. Drugs 2003;12: 673–81.
- [44] Moreland Lw, Alten R, van den Bosch F., et al. Costimulatory blockade in patients with rheumatoid arthritis. Arthritis Rheum 2002;46: 1470–9.
- [45] Kremer J, Westhovens R, Leon M, et al. A Phase IIb multi-center, randomized, doubleblind, placebo controlled study to evaluate the safety and efficacy of two different doses of CTLA4lg administered intravenously to subjects with active rheumatoid arthritis while receiving methotrexate. Arthritis Rheum (2002)46 (9 Suppl.): S203 (Abstract 463).
- [46] Weinblatt M, Schiff M, Goldmann M et al. A pilot, multicenter, randomized, double-blind, placebo- controlled study of a co-stimulation blocker CTLA41g (2 mg/kg) given monthly in combination with etanercept in active rheumatoid arthritis. Arthritis Rheum (2002); 46(9, Suppl.): S204 (Abstract 464).