Biologická terapie idiopatických střevních zánětů
Biologická terapie představuje jeden z největších pokroků současné klinické gastroenterologie. Její podání je cíleno především na neutralizaci klíčového prozánětlivého cytokinu TNF- (tumor nekrotizující faktor ). Cílem biologické léčby je dosažení remise onemocnění, zabránění vzniku komplikací, snížení nutnosti chirurgických výkonů a zlepšení kvality života pacientů s Crohnovou chorobou a ulcerózní kolitidou. V klinické praxi se využívají dvě molekuly s podobným mechanismem účinku (infliximab a adalimumab), před branami klinické praxe je třetí látka (certolizumab). Kontrolované klinické zkoušky ukázaly, že všechny tři látky jsou velmi účinné v léčbě středně a vysoce aktivní Crohnovy nemoci. Jejich nepřímé srovnání vykazuje podobnou efektivitu. Asi 30 % nemocných přejde do remise po zahájení biologické terapie, takže je možné ukončit léčbu kortikoidy a významně zlepšit kvalitu života. U 30 % nemocných dojde ke zlepšení stavu a je nutné trvalé podávání léčiva, u 30 % pacientů terapie od počátku nebo v průběhu opakovaného podávání postupně ztratí efekt. Novější látky (adalimumab, certolizumab) se podávají subkutánně a mají výhodu minimálních alergických reakcí. Infliximab je používán v klinické praxi již devět let, a proto jsou s léčbou tímto přípravkem nejrozsáhlejší zkušenosti. Je velmi účinný také u nemocných s ulcerózní kolitidou, navíc ho lze využít jako záchrannou léčbu u pacientů s hrozícím chirurgickým výkonem pro velmi těžký průběh nemoci. Indikace k zahájení biologické terapie je založena na znalosti předcházejícího průběhu nemoci a selhání konvenčních léčebných schémat. V budoucnosti je možné uvažovat o využití genetických nebo proteomických parametrů, které by umožnily zahájit léčbu v časných fázích onemocnění.
Idiopatické střevní záněty (ISZ) – Crohnova nemoc (CN) a ulcerózní kolitida (UC) – se staly v posledních deseti letech jednou z nejvýznamnějších oblastí současné klinické gastroenterologie. Hlavním důvodem zvýšeného zájmu kliniků jsou explozivně se rozvíjející nové možnosti medikamentózní terapie, kterou představuje především tzv. biologická léčba.
Crohnova nemoc je granulomatózní a transmurální zánět postihující segmentárně nebo plurisegmentárně kteroukoliv část trávicí trubice. Choroba probíhá chronicky s obdobími zhoršení (relapsů) a zklidnění (remisí) zánětu a je medikamentózně i chirurgicky nevyléčitelná.
Ulcerózní kolitida, v českém písemnictví označovaná také jako idiopatická proktokolitida, je hemoragicko-katarální zánět sliznice tlustého střeva postihující vždy rektum a šířící se kontinuálně na různě rozsáhlou část nebo do celého tlustého střeva. Průběh onemocnění je charakterizován relapsy a remisemi. Jedná se o chorobu, kterou nelze medikamentózně definitivně vyléčit, jen chirurgická léčba (proktokolektomie) vede k definitivnímu odstranění choroby. Obě onemocnění mají zcela neznámou etiologii a jen částečně prozkoumanou patogenezi.
Současné představy o patogenezi ISZ jsou založeny na poznatcích získaných z experimentálních zvířecích modelů, na nichž byla pozorována tato onemocnění. Nový přístup ke studiu ISZ přinesl v průběhu posledního desetiletí řadu zásadních objevů a relativně rychle získané poznatky byly vzápětí využity v klinické praxi.
Modely experimentálních kolitid je možné rozdělit do dvou velkých skupin. První představují záněty, které jsou indukovány podáním toxických chemických látek přímo na sliznici tlustého střeva pokusného zvířete (myší nebo potkanů) nebo přenesením určité subpopulace lymfocytů z nemocného člověka na imunologicky defektní laboratorní zvíře. Druhou skupinu tvoří spontánně vzniklé chronické záněty tlustého střeva u speciálně vyšlechtěných geneticky defektních myší („knockout" kmeny). Tyto modely umožnily studium faktorů, které jsou při rozvoji zánětu nejdůležitější.
Zcela zásadní pro klinickou práci bylo zjištění, že po podání neutralizačních protilátek proti určitým cytokinům dochází ke zmenšení nebo vyhojení zánětu u experimentálního zvířete. Zvláště významné se ukázalo podávání protilátek proti TNF-a (tumor nekrotizující faktor a) a proti IL-12 (interleukin-12), které jsou syntetizovány a uvolňovány aktivovanými makrofágy, monocyty a T lymfocyty. Z poznatků získaných u experimentálních modelů vyplynulo, že ke vzniku chronického střevního zánětu dochází pouze tehdy, dojde-li k narušení přirozené rovnováhy mezi prozánětlivými (Th1) a protizánětlivými (Th2) cytokiny. Jaký je však prvotní mechanismus, který celou kaskádu zánětlivých reakcí spouští, není v současné době stále ještě uspokojivě vysvětleno [1].
Změny v medikamentózní terapii ISZ v posledních třiceti letech
Koncem sedmdesátých let minulého století se začaly v léčbě pacientů s Crohnovou nemocí více využívat kortikoidy a sulfasalazin. To souvisí především s publikovanými výsledky tzv. Národní kooperativní studie u Crohnovy nemoci (NCCDS) v USA v roce 1976 a podobně koncipované studie na evropském kontinentu (ECCDS) v roce 1984. Tyto stěžejní publikace ukázaly, že v léčbě Crohnovy nemoci na tlustém střevě (podobně jako u UC) se jako vysoce efektivní osvědčuje podávání kortikoidů a sulfasalazinu. Počátkem osmdesátých let se do terapie více rozšířila antibiotika (metronidazol) a začala se také více využívat léčba imunosupresivními thiopuriny. Počátkem devadesátých let byla do léčebných schémat u CN i UC zavedena 5-aminosalicylová kyselina (mesalazin) s cílem bezpečného podávání vysokých dávek účinné látky s řízeným uvolňováním v celé trávicí trubici. V polovině devadesátých let se objevil budesonid – topický kortikoid, jehož podávání se ukázalo jako velmi přínosné u mírně až středně aktivní CN na terminálním ileu. Ve druhé polovině devadesátých let se rozšířila paleta imunosu-presiv, přibyly methotrexát u CN a cyklosporin A u vysoce aktivních forem UC.
V roce 1998 byla nejprve v USA a o rok později v Evropě zavedena do klinické praxe biologická terapie CN představovaná infliximabem [2]. Po sedmi letech došlo k dalšímu rozšíření indikace biologické terapie, a to na ulcerózní kolitidu, a v letošním roce byla u CN zavedena do klinické praxe nová generace antiTNF-a léčiv představovaná adalimumabem. Další preparát certolizumab stojí těsně před branami klinické praxe.
Tumor nekrotizující faktor a – klíčový mediátor zánětu
Tumor nekrotizující faktor a má v patogenezi obou nemocí klíčovou roli. Jeho koncentrace je zvýšená v krvi, ve střevní tkáni i ve stolici v průběhu aktivity ISZ, v době remise střevního zánětu se hladiny tohoto působku neliší od zdravých kontrol. Účinky TNF-a zasahují vzdálené cílové tkáně (endokrinní efekt – kosti, mozek, játra), ale také se významnou měrou podílejí na rozšíření a zintenzivnění zánětu lokálně ve střevní sliznici (parakrinní efekt). TNF-a ovlivňuje a zvyšuje tvorbu prozánětlivých cytokinů a chemokinů makrofágy, zvyšuje expresi adhezních molekul na povrchu endoteliálních buněk, a tím napomáhá prostupu leukocytů do tkáně, stimuluje tvorbu reaktantů akutní fáze (CRP, C-reaktivní protein) v séru, stimuluje syntézu metaloproteináz a zvyšuje tvorbu kolagenu. Tímto efektem se podílí na remodelaci celé střevní stěny a má vliv na vznik chronických a irreparabilních změn, jako jsou striktury lumen střeva, rozšíření stěny střeva a zmnožení perienterického tuku. TNF-a také ovlivňuje epiteliální buňky a zvyšuje prostupnost střevní bariéry pro ionty a bakteriální a potravinové alergeny [3].
Klinické studie s antiTNF-a protilátkami a jejich design
V klinických studiích publikovaných v posledních několika letech byly v léčbě pacientů s CN užity tři modely, a to se všemi antiTNF-a molekulami (infliximab, adalimumab a certolizumab) [3].
Prvním typem léčby je krátkodobý indukční režim, ve kterém se využily buď vysoké dávky léčiva (adalimumab), nebo častější frekvence podávání (infliximab, certolizumab). Tato krátkodobá indukční terapie sledovala efektivitu podávaného léčiva po dobu 4–12 týdnů. Patří sem studie Targanova s infliximabem, studie CLASSIC-I monitorující efektivitu adalimumabu a studie Schreiberova zaměřená na účinnost certolizumabu. Tyto studie používaly k posouzení efektivity terapie symptomový index aktivity CDAI (Crohn´s disease activity index), pozitivní odpověď byla hodnocena snížením hodnoty CDAI o více než 70 nebo 100 bodů, jako remise byla hodnocena situace, kdy CDAI kleslo na méně než 150 bodů. Cílem těchto zkoušek bylo nalézt optimální dávku léčiva.
Druhý model léčby představovaly rozsáhlé zkoušky, které se skládaly z indukční fáze a následného přechodu do fáze udržovací. Pro tyto studie bylo společné, že se zahajovaly jako „open label", tj. účinná látka byla podána všem nemocným a dále byli randomizováni ti nemocní, kteří odpověděli na úvodní aplikaci léčiva. Indukce formou „open label" byla provedena jednorázově u studií ACCENT I a ACCENT II (testujících infliximab), nebo v plné indukci, jako tomu bylo u hodnocení adalimumabu ve studii CHARM nebo při testování certolizumabu ve studii PRECiSE 2. Jako hodnotící kritérium bylo užito opět symptomové skóre CDAI. Podobný model byl využit také u pacientů s UC ve studiích ACT-1 a ACT-2, které monitorovaly efektivitu infliximabu. Délka léčby byla většinou jeden rok. Při interpretaci výsledků je třeba mít na zřeteli, že tyto studie pracují s pacienty, kteří jsou vůči terapii antiTNF-a vnímaví. Nemocní, kteří nereagovali na úvodní aplikaci léčiva, nebyli do hodnocení zahrnuti. Cílem těchto studií bylo poskytnout robustní data příslušným orgánům (FDA, EMEA) k získání povolení pro použití v klinické praxi.
Třetí typ zkoušek představuje program PRECiSE 1, kde od počátku byla indukce dvojitě slepá a placebem kontrolovaná a stejně se postupovalo i v udržovacím režimu. Všichni nemocní s CN zařazení do studie byli následně randomizováni, bez ohledu na to, zda indukční fáze přinesla pozitivní odpověď či nikoliv. Je to model nejbližší běžné klinické praxi. Jedná se o zkoušku probíhající po dobu několika let.
Infliximab v léčbě pacientů se středně a vysoce aktivní CN
Infliximab je chimérická monoklonální protilátka IgG1, která obsahuje ze 75 % lidskou a z 25 % myší bílkovinu. Na vazebném místě CDR (Complementarity Determining Region) v molekule imunoglobulinu je umístěna proteinová kombinace pocházející z imunizované myši a zbytek molekuly je povahy lidské.
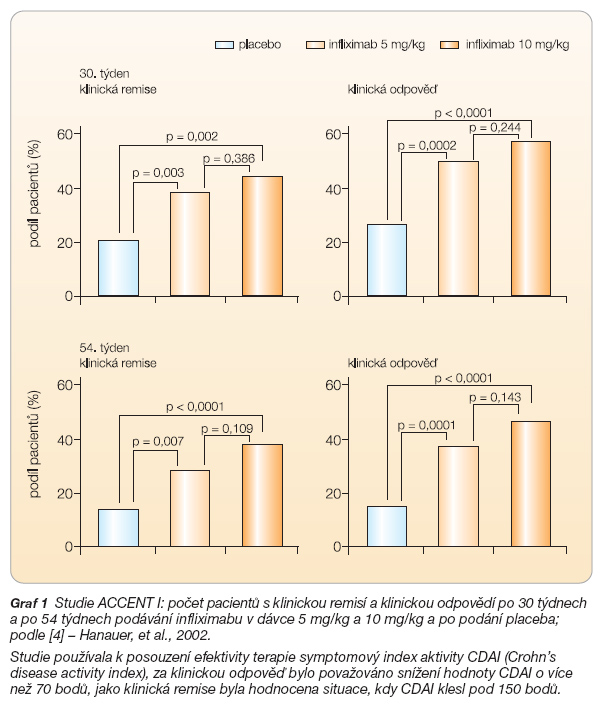
Ve studii ACCENT I byla v úvodu provedena otevřená indukční fáze s podáváním infliximabu v dávce 5 mg/kg. Pouze nemocní, kteří odpověděli, přešli do další fáze studie a do udržovacího režimu, během něhož jim byl podáván infliximab v dávce 5 mg/kg, 10 mg/kg nebo dostávali placebo (aplikace v týdnu 0, 2 a 6, a dále pak každých 8 týdnů, celkem po dobu 46 týdnů). Počet remisí ve 30. týdnu byl 39 % (5 mg/kg), resp. 45 % (10 mg/kg) a v 54. týdnu představoval počet remisí 28 % (5 mg/kg), resp. 38 % (10 mg/kg). Pozitivní setrvalá odpověď při opakovaném podávání byla ve 30. týdnu u 47 % (5 mg/kg) a 60 % (10 mg/kg) pacientů. Na konci sledování v 54. týdnu bylo zaznamenáno 36 % odpovědí jako reakce na léčbu dávkou 5 mg/kg, podávání dávky 10 mg/kg vyvolalo 46 % odpovědí. Rozdíly ve všech sledovaných parametrech mezi pacienty s dávkou 5 mg/kg a 10 mg/kg proti placebu byly statisticky významné. Nebyly zjištěny významné rozdíly mezi jednotlivými skupinami v aktivních ramenech [4] (graf 1).
Studie ACCENT II posuzovala účinnost a bezpečnost infliximabu v léčbě nemocných s fistulujícím typem CN. Po indukci tří infuzí „open label" následovala udržovací terapie po dobu 46 týdnů. Ve 14. týdnu léčby byli nemocní, kteří odpověděli pozitivně na indukci, randomizováni k terapii infliximabem v dávce 5 mg/kg nebo k podávání placeba. Ve 30. týdnu bylo v remisi 48 % nemocných v aktivním ramenu a 28 % nemocných dostávajících placebo, na konci sledování v 54. týdnu byla zaznamenána remise u 36 % nemocných léčených infliximabem a u 25 % pacientů, kteří dostávali placebo. Počet pozitivních odpovědí u pacientů léčených infliximabem byl ve 30. týdnu 72 % v porovnání se 40 % u pacientů dostávajících placebo. Na konci sledování byl počet pozitivních odpovědí v 54. týdnu 58 % v aktivním rameni proti 32 % ve skupině s placebem. Kumulativní počet chirurgických výkonů u pacientů s udržovací léčbou infliximabem byl 50 proti 125 výkonům u pacientů, kteří dostávali placebo. Další rozbory potvrdily pozitivní vliv udržovací léčby infliximabem na zhojení střevní sliznice.
Infliximab v léčbě pacientů se středně a vysoce aktivní UC
Multicentrická studie ACT-1 hodnotila efektivitu infliximabu v léčbě nemocných s UC se střední a vysokou aktivitou nemoci (Mayo index 6–12; endoskopický index aktivity 2). Nemocní byli randomizováni do tří skupin, první skupině byl podáván infliximab v dávce 5 mg/kg, druhé v dávce 10 mg/kg, ve třetí skupině dostávali nemocní placebo. Infuze byly podány v týdnu 0, 2 a 6 a pak po 8 týdnech do 46. týdne. V 8. týdnu byly zaznamenány pozitivní klinické odpovědi charakterizované snížením Mayo indexu > 30 % nebo ≥ 3 body, ve 30. týdnu sledování byly odpovědi procentuálně vyjádřeny takto: 69,4 % (5 mg/kg) vs. 61,5 % (10 mg/kg) vs. 37,2 % (placebo). Rozdíly ve skupinách s aktivní léčbou proti placebu byly vysoce signifikantní (p < 0,001; p = 0,002). Remise v 8. týdnu byla zaznamenána u 38,8 % pacientů (5 mg/kg) vs. 32,0 % pacientů (10 mg/kg) vs. 14,9 % pacientů (placebo); opět se signifikantním rozdílem mezi aktivní léčbou a placebem (p < 0,001; p = 0,002). Významný rozdíl v udržení remise setrval i ve 30. týdnu sledování: 33,9 % (5 mg/kg) vs. 36,9 % (10 mg/kg) vs. 15,7 % (placebo) (p = 0,001; p < 0,001) [6].
Multicentrická, randomizovaná a placebem kontrolovaná zkouška ACT-2 zahrnovala celkem 364 nemocných s UC, kteří neodpovídali na terapii kortikoidy, imunosupresivy a aminosalicyláty. Nemocní byli randomizováni do tří ramen: pacienti v prvním rameni dostávali infliximab v dávce 5 mg/kg, ve druhém rameni byli léčeni dávkou 10 mg/kg, třetí skupina pacientů dostávala placebo. Léčba byla podávána v týdnu 0, 2, 6, 14 a 22. Primárním cílem byla klinická odpověď ve 30. týdnu. Pozitivní odpověď byla definována snížením Mayo indexu o více než 3 body, za remisi bylo považováno, jestliže celkové skóre bylo ≤≤ 2. Ve 30. týdnu pozitivně odpovědělo 47,1 % (5 mg/kg) vs. 60 % (10 mg/kg) vs. 26 % pacientů (placebo) a remise byla zjištěna u 25,6 % (5 mg/kg) vs. 35,8 % (10 mg/kg) vs. 10,6 % pacientů (placebo). Rozdíly ve skupinách s aktivní léčbou byly proti skupině s placebem statisticky významné (p < 0,001). Kompletní slizniční hojení bylo detekováno u 46,3 %, resp. u 56,3 % nemocných v rameni s aktivní léčbou proti 30,1 % pacientů, kterým bylo podáváno placebo (p = 0,009) [7].
Jarnerot využil aplikaci jedné infuze infliximabu jako záchrannou léčbu u nemocných s vysoce až fulminantně probíhající ulcerózní kolitidou. Za tři měsíce hodnotil počet vynucených kolektomií. Ve skupině léčené infliximabem bylo operováno 29 % nemocných, ve skupině dostávající placebo byl počet chirurgických výkonů signifikantně vyšší (67 %), (p = 0,017; OR 4,9; 95% CI 1,4–17) [8]. Výsledky této jedinečné studie změnily dosavadní strategii v tom směru, že u těžce (fulminantně) probíhající ulcerózní kolitidy nahradil infliximab postavení cyklosporinu A jako záchranné terapie. Výhodou je rychlý nástup účinku, minimální vedlejší a nežádoucí účinky a také to, že infliximab nemá žádný nepříznivý vliv na průběh a komplikace urgentního operačního výkonu.
Infliximab v léčbě dětských pacientů
V letošním roce publikovaná studie Reach, která se zabývala účinností infliximabu v léčbě dětí se středně a vysoce aktivní Crohnovou nemocí, přinesla velmi zajímavé výsledky. Ukázala, že účinnost infliximabu u dětských pacientů je ještě vyšší než u dospělých s Crohnovou chorobou. Po indukci třemi infuzemi byla klinická odpověď zaznamenána u 88,4 % dětí, z nichž 58,9 % dosáhlo remise. Pouze děti odpovídající na indukční léčbu třemi infuzemi v dávce 5 mg/kg byly dále randomizovány k udržovací terapii po 8 nebo 12 týdnech. Na konci sledování, tj. v 54. týdnu, byly výsledky dětských pacientů léčených v osmitýdenních intervalech významně lepší proti dětem, které dostávaly udržovací léčbu ve dvanáctitýdenních intervalech (přetrvávající remise 55,8 % vs. 23,5 %) (p < 0,001) [9]. Publikované výsledky vedly k tomu, že v letošním roce bylo oficiálně schváleno použití infliximabu v léčbě dětských pacientů s Crohnovou chorobou.
Nová generace antiTNF-a léčiv
Adalimumab
Adalimumab je rekombinantní monoklonální protilátka IgG1 s vysokou vazebnou aktivitou k solubilní i membránově vázané molekule TNF-a. Mechanismus protizánětlivého účinku spočívá pravděpodobně v indukci apoptózy aktivovaných slizničních T lymfocytů.
Studie CLASSIC-I prokázala nejvyšší účinnost indukční léčby adalimumabem při podávání dávky 160 mg s.c. v nultém týdnu sledování a 80 mg s.c. ve druhém týdnu. V udržovací fázi studie CLASSIC-II se potvrdilo, že opakované podávání 40 mg adalimumabu 1krát za dva týdny nebo 1krát týdně je významně lepší pro udržení remise než podávání placeba. U nemocných, kteří odpověděli, avšak nepřešli do remise v indukci, bylo opakované podávání léčiva spojeno s nárůstem počtu remisí v průběhu jednoho roku udržovací léčby [10].
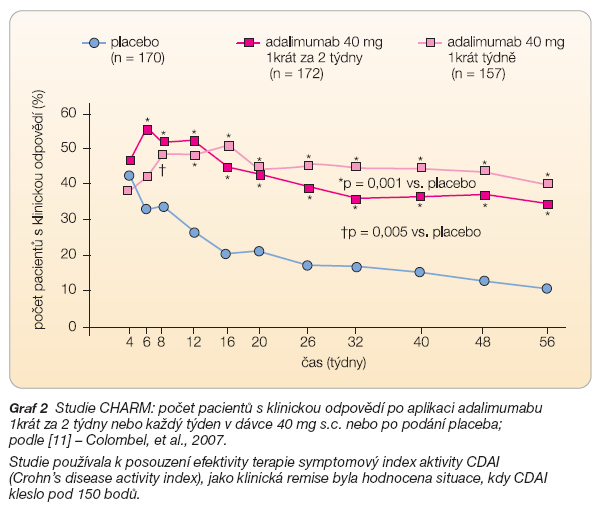
Studie CHARM pracovala (podobně jako ACCENT) se skupinou nemocných odpovídajících na indukční léčbu. Kohorta zahrnovala celkem 499 nemocných, po indukční fázi 80 mg adalimumabu s.c. v nultém a 40 mg s.c. ve druhém týdnu následovala udržovací fáze aplikací adalimumabu 1krát za 2 týdny nebo každý týden v dávce 40 mg s.c. Ve 26. týdnu bylo 40 % a 47 % pacientů v aktivních ramenech v remisi v porovnání s placebem, kde bylo zaznamenáno pouze 17 % dosažených remisí. Pozitivní odpověď byla zaznamenána u 54 %, resp. u 56 % nemocných v aktivních ramenech v porovnání s 26 % nemocných dostávajících placebo. Na konci sledování v 56. týdnu byl počet remisí 36 %, resp. 41 % v porovnání s placebem, kde bylo pouze 12 % remisí (graf 2).
Pozitivní odpověď na terapii byla zaznamenána u 41 %, resp. u 48 % nemocných léčených adalimumabem v porovnání se 16 % u pacientů dostávajících placebo [11]. V osmém týdnu trvání studie CHARM bylo možné u nemocných s příznivou odpovědí začít s ukončováním léčby kortikoidy. Počet nemocných, kteří neužívali steroidy, byl následující: ve 26. týdnu pouze 3 % nemocných dostávajících placebo, 19 % nemocných léčených v režimu 1krát za 2 týdny a 15 % nemocných léčených 1krát týdně. Na konci sledování bylo 29 % nemocných léčených adalimumabem bez kortikoidů. Efektivita léčby adalimumabem byla potvrzena také při hojení píštělí. Na konci sledování mělo 30 %, resp. 33 % pacientů v aktivních ramenech zhojené píštěle. V porovnání s placem (13 % nemocných) byl rozdíl statisticky významný (p = 0,016). Protilátky proti adalimumabu byly detekovány jen v malém počtu případů (3,7 %). Studie GAIN ukázala, že 20 % nemocných, kteří ztratili odpověď na předcházející podávání infliximabu nebo se stali intolerantními k této léčbě, přejde po zahájení terapie adalimumabem do remise [12].
Pro léčbu Crohnovy choroby je adalimumab od konce února 2007 povolen k užívání v klinické praxi v USA, od června 2007 v Evropě a také v České republice. Výhodná může být u některých nemocných subkutánní aplikace léčiva a možnost samostatného podávání. Hlavní indikací zahájení terapie adalimumabem v současné době je selhání terapie infliximabem nebo vznik závažných alergických reakcí na infliximab. V této indikaci je ve vybraných centrech biologické léčby v ČR povoleno kompletní hrazení léčiva.
Předpokládá se také využití adalimumabu u nemocných s ulcerózní kolitidou. Zatím ještě nebyly zveřejněny výsledky probíhajících klinických zkoušek v této indikaci.
Certolizumab pegol
Certolizumab pegol (CDP 870) je humanizovaný Fab fragment monoklonální protilátky antiTNF-a, který je navázán na dvě molekuly polyethylenglykolu. Vazba na nosič významně prodlužuje biologický poločas molekuly, který je delší než 2 týdny. Aplikuje se subkutánně jedenkrát za 4 týdny.
První studie (Schreiberova) ukázala, že významně vyšší efektivita léčby certolizumabem byla zjištěna, pokud byl aplikován nemocným s vyšší koncentrací CRP (> 10 mg/l), a že nejúčinnější dávkou je 400 mg podaných s.c. [3].
Další studie PRECiSE 1 potvrdila, že remise byla dosažena ve 4. týdnu (po dvou aplikacích certolizumabu) u 19,5 % nemocných v porovnání s 11,3 % pacientů dostávajících placebo, ve 26. týdnu dosáhlo remise 29,5 % pacientů léčených certolizumabem proti 18,3 % nemocných ve skupině s placebem (statisticky významný rozdíl p < 0,05). Pozitivní klinická odpověď byla zaznamenána u 28,7 % pacientů ve 4. týdnu a 37,2 % pacientů ve 26. týdnu (p < 0,05). Nebyla potvrzena závislost na výchozí koncentraci CRP a na přítomnosti či nepřítomnosti klinické odpovědi [13].
Program PRECiSE 2 pracoval podobně jako CHARM nebo ACCENT pouze s pacienty, kteří odpověděli na útočnou dávku certolizumabu, proto počty pacientů odpovídajících na léčbu vyjádřené v procentech a procentuálně vyčíslené počty pacientů s remisí jsou významně vyšší, než je tomu ve studii PRECiSE 1. Pozitivní odpověď na terapii byla zaznamenána u 62,8 % všech nemocných ve 26. týdnu sledování, v porovnání s 36,2 % odpovědí u nemocných dostávajících placebo a nebyl zjištěn rozdíl mezi pacienty s nízkou a vyšší koncentrací CRP. K remisi došlo u 47,9 % nemocných léčených certolizumabem v porovnání s 28,6 % pacientů, jimž bylo podáváno placebo (p < 0,05) [3]. Nebyl také zjištěn rozdíl ve vlivu konkomitantní imunosupresivní terapie na dosažení příznivého výsledku.
Studie PRECiSE 3 se zabývá dlouhodobým monitorováním efektivity opakovaného podávání certolizumabu nemocným, kteří příznivě reagovali na terapii certolizumabem ve 26. týdnu ve studii PRECiSE 2. V 80. týdnu sledování příznivě reagovalo na aplikaci certolizumabu (snížení aktivity podle Harweyova-Bradshowova indexu o 3 a více bodů) 44,2 % nemocných a 37,2 % nemocných zůstávalo stále v remisi [14].
PRECiSE 4 je pokračující studie monitorující efekt reindukce a udržení efektu léčby certolizumabem u nemocných, kteří neodpověděli nebo ztratili odpověď na léčbu ve studii PRECiSE 1 ve druhém týdnu nebo ve studii PRECiSE 2 po 6. týdnu léčby. Reindukce zahrnovala podávání certolizumabu v týdnu 0, 2 a 4 a poté udržovací terapii 1krát měsíčně. Remise byla hodnocena podle Harweyova-Bradshowova indexu (HB < 4) a v 52. týdnu byla dosažena u 11,4 % pacientů přeřazených z PRECiSE 1 a u 34,7 % nemocných z PRECiSE 2. Protilátky proti certolizumabu se vyskytly ve studiích zřídka a četnost jejich výskytu se pohybovala od 8 % do 12 % [14].
Nevyřešené problémy s biologickou léčbou
Publikované výsledky klinických studií i klinické zkušenosti ukazují, že 15–20 % nemocných primárně neodpovídá na terapii antiTNF-a. V průběhu jednoho roku dochází ke ztrátě odpovědi u dalších 20–30 % pacientů (tzv. sekundární non-respondéři). Shrneme-li dohromady primární a sekundární selhání léčby, pak musíme počítat, že u 30–50 % nemocných tato terapie nebude mít očekávaný efekt.
Imunogenicita léčiva (infliximab) je odpovědná za druhotnou ztrátu odpovědi, za infuzní reakce a nutnost dlouhodobého podávání a rovněž za nutnost současné terapie imunomodulátory.
Nežádoucí účinky spočívají v možnosti indukce infekce, ať již intracelulární bakteriální (tuberkulóza, histoplazmóza) nebo generalizace latentních virových infekcí (herpes zoster, cytomegalovirová nákaza). V současné době, po zavedení screeningu na latentní tuberkulózu a při respektování kontraindikací terapie (sepse), je riziko závažných infekcí minimální.
Lymfoproliferativní choroby představují z hlediska dlouhodobé bezpečnosti zatím nevyřešený problém. Siegel na základě publikovaných výsledků různých studií sestavil hypotetický model a vypočítal, že riziko indukce lymfomu by mohlo být jeden případ na 500 pacientů léčených infliximabem [16]. Data z TREAT Registru, který v současné době zahrnuje cca 6000 nemocných s Crohnovou chorobou, však vykazují vysokou bezpečnost léčby infliximabem. Lichtensteinova data ukazují, že není rozdíl mezi rizikem při podávání placeba a aplikací infliximabu (HR 1,05 pro infliximab). Pro srovnání, riziko závažných infekcí po léčbě kortikoidy je 2,01. Faktem je, že TREAT Registr reprezentuje cca 10 % nemocných, kteří jsou v USA léčeni infliximabem [B.C. Sands, osobní sdělení]. V této souvislosti je nutné také se zmínit o T-buněčném hepatosplenickém lymfomu. Do současnosti bylo prezentováno celkem 11 nemocných s touto komplikací. Jde o zvláště maligní typ lymfomu, který je formován g- a d-lymfocyty a byl poprvé popsán teprve v roce 1990. Klinickou prezentací lymfomu je hepatosplenomegalie, progredující cytopenie a nepřítomnost koincidující lymfadenopatie. Diagnóza byla provedena na základě jaterní biopsie a vyšetření kostní dřeně. Choroba je téměř vždy fatální, terapie (byť agresivní) je pouze paliativní a průměrná doba přežití se pohybuje kolem 16 měsíců od stanovení diagnózy. Všichni nemocní byli léčeni nejen infliximabem, ale především dlouhodobou imunosupresivní terapií thiopuriny [17].
Alergické reakce – ať již anafylaktické (12–20 %) nebo opožděného typu (4–6 %) – jsou způsobeny vznikem ATI (anti-infliximab-antibodies), které vznikají z důvodů přítomnosti cizorodé myší bílkoviny v této molekule. Vhodná léčebná strategie a pre- medikace před podáním infuze jejich výskyt významně snižují. Stanovení protilátek proti infliximabu nemá větší klinický význam.
Terapie infliximabem v klinické praxi
Před zahájením terapie musí být nemocný podrobně vyšetřen a u fistulujícího typu CN musí být vyloučena přítomnost abscesu. Podání léčby by mohlo totiž indukovat rozvoj nezvládnutelné sepse.
Přítomnost symptomatické stenózy trávicí trubice je relativní kontraindikací k podání léčby. Důvodem je rychlé hojení a indukce fibrózy ve stěně střeva, která může vést ke vzniku střevní neprůchodnosti.
Provedení skiagrafického vyšetření hrudníku a PPD test (tuberkulinový test) je žádoucí k vyloučení latentní tuberkulózy. Jako vhodnější test v naší očkované populaci se jeví Quantiferon Elisa Gold TB test, který má vysokou specificitu a senzitivitu. Pokročilá srdeční insuficience (NYHA III–IV) je kontraindikací léčby pro možnost prudkého zhoršení oběhové situace.
Začátek podávání infliximabu by měl být spojen s konkomitantní imunosupresivní terapií (thiopuriny, methotrexát), a to pro vzájemné potencování příznivého efektu a minimalizaci vedlejších účinků léčby. Opakované podávání infliximabu v intervalu kratším než 6 měsíců je výhodnější vzhledem k nižší frekvenci vzniku neutralizačních protilátek (ATI). Při podávání infliximabu v intervalech delších než 6 měsíců je vhodné před každou infuzí podat 200 mg hydrokortisonu i.v. nebo 40 mg prednisonu p.o. V případě infuzní reakce je nutné dočasně přerušit nebo výrazně zpomalit rychlost aplikace a podat parenterálně antihistaminika a kortikoidy. Tři infuze infliximabu v úvodu terapie následované opakovaným podáváním léčiva v osmitýdenních intervalech jsou mnohem méně imunogenní než jednorázové podávání v úvodu terapie anebo léčba epizodická.
Léčebná strategie při podávání infliximabu
Všeobecně doporučované léčebné strategie s aplikací infliximabu u Crohnovy nemoci vycházejí v Evropě ze zkušeností IBD kliniky v Leuven, která představuje centrum s největším souborem takto léčených pacientů na světě. Rozhodnutí o typu léčebné strategie je založeno na předcházejícím průběhu nemoci a způsobu podávané léčby. Epizodická terapie, tj. podání jedné infuze infliximabu při zhoršení nemoci, byla na většině pracovišť již opuštěna.
Indukční a dlouhodobá udržovací terapie je považována za optimální volbu. Vhodná je především u nemocných s píštělovým typem nemoci. Po indukci remise, která se provádí třemi infuzemi v nultém, druhém a šestém týdnu, následuje terapie udržovací, při které se podávají infuze v dávce 5 mg/kg po 8 týdnech. Předpokladem pro zahájení udržovací fáze je pozitivní odpověď v indukční fázi, která je hodnocena klinicky (zmenšení sekrece z píštělí nebo úplné uzavření píštěle) a dokumentována také zobrazovacím vyšetřením (magnetická rezonance, endosonografie). Udržovací terapie se provádí v aplikaci po 8 týdnech. V případě, že došlo ke ztrátě efektivity léčby, je možné zkrátit interval mezi jednotlivými infuzemi na 6 týdnů, resp. 4 týdny nebo zvýšit dávku na 10 mg/kg. Celková délka udržovací terapie není určena. U nemocných, kteří optimálně odpověděli a jsou kompletně zhojeni, je možné po jednom roce léčbu ukončit. U pacientů, kteří po ukončení léčby relabují, je nutné podávat udržovací léčbu trvale.
U nemocných s luminálním typem Crohnovy nemoci je indukční fáze dána buďto třemi infuzemi v nultém, druhém a šestém týdnu, anebo lze podat dvě infuze s odstupem jednoho měsíce. Po indukční fázi je nutné zhodnotit efektivitu terapie. Dojde-li ke klinickému a objektivnímu zlepšení stavu, pak se přechází na terapii udržovací ve stejném režimu jako u předchozího typu nemoci. Nedojde-li k odpovědi, nemá větší smysl podávat udržovací terapii.
U nemocných s luminálním typem CN, kteří dosud neužívali imunosupresiva, je možné podat pouze indukční fázi – a to ve třech infuzích – a pokračovat v léčbě pouze imunosupresivy. Tato přemosťující „bridging" léčba umožňuje rychlý nástup protizánětlivého efektu infliximabu, který překrývá dobu latence nutnou k nástupu protizánětlivého vlivu thiopurinů nebo methotrexátu.
Zvláštní formou této přemosťující léčby je tzv. top down strategie, která je založena na aplikaci indukční léčby s následným podáváním imunosuprese. Na rozdíl od předchozí „bridging" strategie se podává nemocnému ihned od stanovení diagnózy Crohnovy nemoci a nikoliv až po neúspěchu klasické léčby. I když předběžné výsledky jsou velmi slibné, je potřeba ověřit jejich platnost u většího počtu pacientů. V současné době jde o experimentální model, který ještě nelze využít v klinické praxi. Hlavním problémem je, že zatím nemáme žádné spolehlivé laboratorní nebo genetické prediktory nepříznivého průběhu střevního zánětu. Indikace k zahájení biologické terapie vychází ze zhodnocení dosavadního nepříznivého průběhu nemoci a odpovědi na aplikovanou medikamentózní terapii, a proto zahájení nejúčinnější, ale také potenciálně nebezpečné léčby u každého nově diagnostikovaného pacienta s CN není zatím opodstatněné.
Jak bylo výše uvedeno, trvalé používání infliximabu a imunosupresiv může být spojeno s významnými nežádoucími účinky (lymfoproliferace). Z tohoto hlediska je velmi cenná studie IMID, jež hodnotila efektivitu současného podávání azathioprinu nemocným s CN, kteří byli léčeni infliximabem v udržovacím režimu, a to nejméně po dobu dvou let. Celkem 40 nemocných dostávalo azathioprin a po šesti měsících byla terapie ukončena, dále pak bylo pokračováno pouze v terapii infliximabem. Druhá skupina 40 nemocných dostávala trvale azathioprin a infliximab po dobu dvou let. Ukázalo se, že v obou skupinách nebyl rozdíl v počtu relapsů, ve stejném procentu došlo ke ztrátě účinnosti infliximabu. Na konci sledování měl stejný počet nemocných endoskopické známky aktivity CN. Studie IMID prokázala, že současné podávání azathioprinu a infliximabu po dobu delší než šest měsíců nemá větší léčebný efekt [18].
Inhibitory adhezivních molekul
Natalizumab je humanizovaná monoklonální protilátka IgG4 proti adhezivní molekule a4b1 integrinu, která je nutná k migraci leukocytů z kapilárního řečiště do tkáně. Čtyři velké randomizované studie potvrdily příznivý vliv natalizumabu podávaného ve formě infuze v dávce 3–4 mg/kg na snížení zánětlivé aktivity středně a vysoce aktivní Crohnovy nemoci. Bylo potvrzeno, že léčebný efekt má určitou latenci a s opakovanými infuzemi natalizumabu se zvyšuje (studie ENACT-2, ENCORE). Bohužel, u dvou pacientů léčených natalizumabem pro roztroušenou sklerózu a u jednoho pacienta léčeného pro Crohnovu nemoc v kombinaci s interferonem beta a azathioprinem došlo ke vzniku progresivní multifokální leukoencefalopatie s následným úmrtím dvou z nich. Následné pečlivé vyšetření 3500 pacientů léčených tímto léčivem podobné změny neprokázalo u žádného dalšího pacienta. Natalizumab byl po bezpečnostním šetření FDA i EMEA schválen k podání pacientům s roztroušenou sklerózou. Podání u pacientů s Crohnovou nemocí doposud schváleno nebylo a je předmětem dalšího klinického hodnocení [19].
Seznam použité literatury
- [1] Lukáš M. Biologická terapie střevních zánětů. Současný stav. In: Novinky v gastroenterologii. Editor: Julius Špičák, Maxdorf (v tisku).
- [2] Lukáš M. Idiopatické střevní záněty. Nejistoty, současné znalosti a klinický přístup. Praha, Galen 1998.
- [3] Sandborn WJ. Extending the therapeutic choices in Crohn´s disease: The next generation of anti-TNF- therapies. Symposium: New generation anti-TNF-therapy for Crohn´s disease. Practice paradigms for the future. DDW, Washington 2007.
- [4] Hanauer SB, Feagan BG, Lichtenstein GR, et al. Maintenance infliximab for Crohn´s disease. The ACCENT I randomised trial. Lancet 2002; 359: 1541–1549.
- [5] Sands BE, Anderson FH, Bernstein CN, et al. Infliximab maintenance therapy for fistulizing Crohn´s disease. N Engl J Med 2004; 350: 876–885.
- [6] Rutgeerts P, Feagan BG, Olson A, et al. A randomised placebo controlled trial of infliximab for active ulcerative colitis: the ACT-1 trial. DDW, Chicago 2005, ID 689.
- [7] Sandborn WJ, Rachmilewitz D, Hanauer SB, et al. Infliximab induction and maintenance therapy for ulcerative colitis: the ACT-2 trial. DDW, Chicago 2005, ID 688.
- [8] Jarnerot G, Hertervig E, Friis-Liby I, et al. Infliximab as rescue therapy in severe to moderately severe ulcerative colitis: a randomized, placebo-controlled study. Gastroenterology 2005; 128: 1805–1811.
- [9] Hyams J, Crandall W, Kugathasan S, et al. Induction and maintenance infliximab therapy for the treatment of moderate to severe Crohn´s disease in children. Gastroenterology 2007; 132: 863–873.
- [10] Hanauer SB, Sandborn WJ, Rutgeerts P, et al. Human anti-tumor necrosis factor monoclonal antibody (Adalimumab) for the treatment of moderately to severely active Crohn´s disease: the CLASSIC trial. Gastroenterology 2006; 130: 323–329.
- [11] Colombel JF, Sandborn WJ, Rutgeerts P, et al. Adalimumab for maintenance of clinical response and remission in patients with Crohn´s disease: The CHARM trial. Gastroenterology 2007; 132: 52–65.
- [12] Sandborn WJ. Gauging adalimumab efficacy in infliximab non-responders GAIN trial. ACG meeting, Las Vegas 2006.
- [13] Sandborn WJ. Certolizumab pegol administered subcutaneously is effective and well tolerated in patients with active Crohn´s disease. Results of PRECiSE trial. Gastroenterology 2006; 130: A 107.
- [14] Sandborn WJ. Poster T1274, DDW 2007, Washington DC.
- [15] Lichtenstein G. Poster T1264, DDW 2007, Washington DC.
- [16] Siegel CA, Hur C, Korzenik JR, et al. Risks and benefits of infliximab for the treatment of Crohn´s disease. Clin Gastroenterol Hepatol 2006; 4: 1017–1024.
- [17] Mackey AC, Green L, Liang LC, et al. Hepatosplenic T cell lymphoma associated with infliximab use in young patients treated for inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2007; 44: 265–267.
- [18] van Assche G, Paintoud G, Magdelaine C, et al. Concomitant immunosuppression does not impact on the outcome of maintenance infliximab therapy. Final results of IMID trial. DDW, Washington 2007, DC.
- [19] MacDonald JK, McDonald JWD. Natalizumab for induction of remission in Crohn´s disease. Art. No.: CD006097. DOI: 10.1002/14651858. CD006097.pub2.
- [4] – Hanauer, et al., 2002.