Blokátory systému renin-angiotenzin-aldosteron u fibrilace síní
Fibrilace síní (FIS) je nejčastější setrvalou arytmií. Je spojena se zvýšenou morbiditou, mortalitou a se sníženou kvalitou života. Inhibitory angiotenzin konvertujícího enzymu a sartany redukují morbiditu a mortalitu u pacientů se srdečním selháním, cévním onemocněním a hypertenzí. Ve studii TRACE u nemocných s chronickým srdečním selháním snížila léčba trandolaprilem výskyt FIS o 55 %. Studie u nemocných s hypertenzí ukazují snížení výskytu nové FIS asi o třetinu. Tento fakt byl jasně demonstrován ve studii LIFE s poklesem o 33 %. Naopak studie HOPE či TRANSCEND efekt ramiprilu a/nebo telmisartanu na výskyt FIS u nemocných s ischemickou chorobou srdeční neprokázaly.
Studie ACTIVE I hodnotila léčbu irbesartanem oproti placebu u 9016 pacientů s FIS. V primárním cíli, který zahrnoval infarkt myokardu, cévní mozkovou příhodu a vaskulární úmrtí, nebyl nalezen rozdíl. Podobně studie GISSI-AF neprokázala efekt valsartanu na udržení sinusového rytmu po kardioverzi u 1442 pacientů.
Uvádíme doporučení Evropské kardiologické společnosti pro tzv. upstream terapii u pacientů s FIS.
Úvod
Fibrilace síní (FIS) je nejčastější setrvalou tachyarytmií u člověka [1] a rozhodně nepatří k benigním arytmiím. Její incidence a prevalence stále narůstá. Prevalence FIS exponenciálně roste s věkem a ve věku nad 70 let může dosáhnout až 10 % [2]. Nedávno publikované studie ukázaly (po úpravě na věk, pohlaví a přidružená onemocnění) trojnásobné zvýšení prevalence FIS v posledních třech dekádách. Její nárůst nelze tedy vysvětlit pouze stárnutím populace. Tyto údaje navíc mohou být podhodnocené, protože až 70 % paroxysmů FIS u jednotlivce může být asymptomatických. Předpokládá se, že v následujících padesáti letech se zvýší počet pacientů s FIS 2,5–5krát [3–6], což se stává velkým problémem nejen ve zdravotnictví, ale i v sociální a ekonomické oblasti. U pacientů s FIS se nejen snižuje kvalita života, ale je zvýšená morbidita i mortalita. Na dvojnásobné mortalitě u pacientů s FIS se podílejí převážně tromboembolické mozkové příhody a částečně i progrese srdečního selhání. Riziko mozkové příhody je u pacientů s FIS 5krát vyšší než u zdravé populace. FIS zhoršuje srdeční selhání u pacientů s již přítomným organickým postižením srdce. U pacientů s funkční skupinou NYHA IV dosahuje prevalence FIS až 50 %. Ale i sama FIS může být příčinou srdečního selhání z důvodu elektrické, strukturální a mechanické remodelace myokardu [7]. Úspěšná léčba FIS a obnovení sinusového rytmu potom mohou vést k částečnému zlepšení nebo k úplné normalizaci funkce levé komory.
Dle nových evropských doporučení [1] dělíme FIS na:
- paroxysmální (většinou ≤ 48 hodin),
- perzistentní (vyžaduje kardioverzi),
- dlouhodobě perzistentní (většinou > 1 rok),
- permanentní.
Léčba FIS zahrnuje farmakologická a nefarmakologická opatření. Farmakologická léčba se opírá o 3 základní pilíře. Jsou to:
- antikoagulační léčba,
- antiarytmická léčba – kontrola rytmu nebo frekvence,
- tzv. upstream léčba.
Upstream léčba fibrilace síní
Upstream léčba (léčba „proti proudu“) může zabránit remodelaci levé komory u nemocných s hypertenzí, po infarktu myokardu či se srdečním selháním. Z pohledu FIS může zabránit jejímu vzniku (primární prevence) nebo její rekurenci či progresi do permanentní FIS (sekundární prevence) [8]. Pod pojem upstream léčba je zahrnuta léčba inhibitory angiotenzin konvertujícího enzymu (inhibitory ACE), blokátory receptoru AT1 pro angiotenzin II (sartany), blokátory aldosteronu, statiny a s-3 vícenenasycenými mastnými kyselinami (PUFAs) [1, 7].
U jedinců s velkým rizikem vzniku FIS by se měla zahájit určitá preventivní strategie. Ta by měla zabránit především vzniku nové FIS, ale také by se měla podílet na vyšší účinnosti zavedené antiarytmické terapie ke kontrole rytmu.
Upstream léčba vede k prevenci a také k léčbě remodelace síní, která se podílí na vzniku a udržení FIS. Stupeň remodelace je také důležitý pro odhad účinnosti léčby FIS. Při pokročilejší remodelaci síní je nižší pravděpodobnost obnovení a udržení sinusového rytmu (SR), vznikají častější a delší ataky FIS a následně přechází paroxysmální FIS v chronické formy. Zabráněním remodelace síní se zvýší pravděpodobnost udržení SR, což také ukazují studie se síňovými defibrilátory, kdy časná léčba atak FIS vedla ke snížení četnosti paroxysmů FIS. V menších studiích byly v rámci upstream léčby podávány statiny, kortikoidy, rybí olej a s-3 vícenenasycené mastné kyseliny. V jedné studii byly podávány statiny vs. placebo u pacientů s ischemickou chorobou srdeční (ICHS); podávání statinů vedlo ke statisticky významnému snížení rekurence FIS, což bylo zřejmě důsledkem protizánětlivého účinku [9]. Ve studii Dernellise byly podávány kortikoidy u perzistentní FIS jako léčba zánětu a ve srovnání s placebem došlo ke snížení hladiny CRP i rekurence FIS [10]. Další autoři podávali pacientům před provedením aortokoronárního bypassu a po zákroku rybí olej [11]. U pacientů, kterým byl podán rybí olej, došlo k redukci vzniku FIS o 54 % ve srovnání s placebem. Pozitivní účinek této neantiarytmické léčby v rekurenci FIS je však ještě nutné prokázat v klinických studiích s větším souborem pacientů.
V upstream léčbě se nejvíce uplatňuje blokáda renin-angiotenzin-aldosteronového systému (RAAS), a to především inhibitory ACE a sartany. U pacientů s kardiovaskulárním onemocněním a zvláště s přítomnou dysfunkcí levé komory se zvyšuje aktivace RAAS, který se podílí na regulaci rovnováhy vodního prostředí, minerálů a dále reguluje cévní odpověď na poškození a zánět. V poslední době bylo prokázáno v řadě mezinárodních multicentrických studií, že inhibitory ACE a sartany snižují kardiovaskulární morbiditu, mortalitu a zabraňují vzniku nové FIS u pacientů se srdečním selháním, dysfunkcí levé komory a po infarktu myokardu, po mozkové příhodě a s přítomnou arteriální hypertenzí [12]. Obě skupiny léků ovlivňují negativní působení angiotenzinu II na buňky.
V populaci je nejčastějším rizikovým faktorem vzniku FIS arteriální hypertenze. V klinických studiích, které sledovaly pouze hospitalizované pacienty, byla hlavním etiologickým faktorem vzniku FIS ischemická choroba srdeční. FIS a hypertenze jsou samostatnými rizikovými faktory vzniku mozkové příhody. Ještě vyššímu riziku jsou vystaveni pacienti s kombinací těchto faktorů a riziko se dále zvyšuje v přítomnosti diabetu mellitu a/nebo v přítomnosti srdečního selhání. Přítomnost hypertenze u pacientů s FIS zvyšuje riziko mozkové příhody dvakrát. Hypertenze může vést k FIS prostřednictvím dilatace levé síně, ischemie a/nebo zvýšeného tlaku v levé síni, který vyplývá ze snížené poddajnosti levé komory, obzvláště pokud je přítomna hypertrofie levé komory na podkladě hypertenze. Hypertenze může vést ke vzniku a k progresi aterosklerózy koronárních tepen, jejímž důsledkem je vznik akutního infarktu myokardu s různým stupněm dysfunkce levé komory, který je velmi často provázen vznikem FIS [13].
Primární prevence
Chronické srdeční selhání
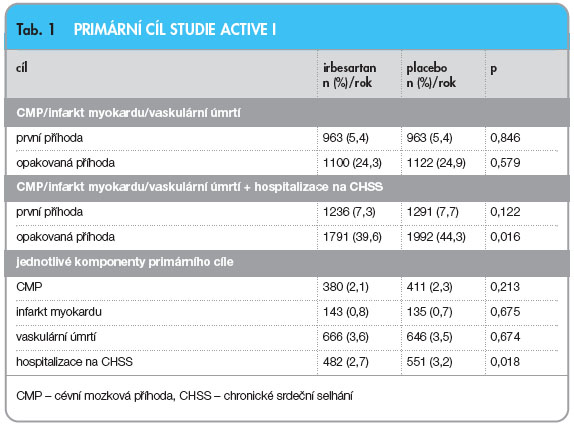
Několik retrospektivních analýz prokázalo snížení výskytu FIS při léčbě inhibitory ACE u pacientů s dysfunkcí levé komory [14]. Např. ve studii TRACE snížila léčba trandolaprilem výskyt FIS o 55 % (graf 1) [15]. Podle metaanalýzy je toto riziko sníženo léčbou inhibitory ACE či sartany o 30–48 % [15–18] a je o něco méně vyjádřeno u nemocných se srdečním selháním bez systolické ![Graf 1 Ovlivnění rizika vzniku fibrilace síní léčbou trandolaprilem ve studii TRACE (snížení o 55 %); podle [15] – Jibrini, et al., 2008.](https://www.remedia.cz/photo-a-28411---.jpg) dysfunkce [8]. V roce 2005 byla publikována metaanalýza 11 randomizovaných klinických studií s 56 308 pacienty, v níž se sledoval účinek blokády RAAS na výskyt FIS [19]. Čtyři studie byly provedeny u pacientů s přítomným srdečním selháním, tři studie u hypertoniků, dvě u pacientů po elektrické kardioverzi a dvě u pacientů po prodělaném infarktu myokardu. Inhibitory ACE a sartany redukovaly celkové relativní riziko vzniku FIS o 28 %. Nebyl zjištěn statisticky významný rozdíl v účinku obou skupin, inhibitorů ACE (28 %) a sartanů (29 %).
dysfunkce [8]. V roce 2005 byla publikována metaanalýza 11 randomizovaných klinických studií s 56 308 pacienty, v níž se sledoval účinek blokády RAAS na výskyt FIS [19]. Čtyři studie byly provedeny u pacientů s přítomným srdečním selháním, tři studie u hypertoniků, dvě u pacientů po elektrické kardioverzi a dvě u pacientů po prodělaném infarktu myokardu. Inhibitory ACE a sartany redukovaly celkové relativní riziko vzniku FIS o 28 %. Nebyl zjištěn statisticky významný rozdíl v účinku obou skupin, inhibitorů ACE (28 %) a sartanů (29 %).
Hypertenze
![Graf 2 Ovlivnění rizika vzniku fibrilace síní léčbou losartanem ve studii LIFE (snížení o 33 %); podle [21] – Wachtell, et al., 2005.](https://www.remedia.cz/photo-a-28412---.jpg) V metaanalýze klinických studií s inhibitory ACE a sartany u nemocných s hypertenzí došlo ke snížení výskytu FIS asi o 25 % [15]. Tento trend byl ještě zvýrazněn ve studii LIFE u nemocných s hypertenzí a hypertrofií levé komory, kde při léčbě losartanem došlo k 33% snížení oproti léčbě atenololem (6,8 vs. 10,1 na 1000 pacientoroků), vizgraf 2 [20, 21].
V metaanalýze klinických studií s inhibitory ACE a sartany u nemocných s hypertenzí došlo ke snížení výskytu FIS asi o 25 % [15]. Tento trend byl ještě zvýrazněn ve studii LIFE u nemocných s hypertenzí a hypertrofií levé komory, kde při léčbě losartanem došlo k 33% snížení oproti léčbě atenololem (6,8 vs. 10,1 na 1000 pacientoroků), vizgraf 2 [20, 21].
Kardiovaskulární riziko
Je třeba zmínit studie Heart Outcomes Prevention Evaluation (HOPE) a Telmisartan Randomised Assessment Study in ACE intolerant Subjects with Cardiovascular Disease (TRANSCEND), kde léčba ramiprilem ani telmisartanem neměla žádný vliv na výskyt FIS u nemocných s ICHS či s vysokým rizikem ICHS [8].
V roce 2009 byla ukončena irbesartanová větev klinické studie ACTIVE I (AF Clopidogrel Trial with Irbesartan for prevention of Vascular Events), jíž se aktivně účastnila i centra v České republice [22].
Projekt studie ACTIVE měl dvojí randomizaci. V první části byli nemocní zařazeni buď do programu ACTIVE W – clopidogrel/ ASA versus warfarin (6507 nemocných), nebo do programu ACTIVE A – clopidogrel/ASA versus ASA (7554 nemocných). Pokud nemocní z ACTIVE W i A splnili i kritéria pro další randomizaci, byli zařazeni do části ACTIVE I.
Studie ACTIVE I zahrnula 9016 pacientů, kteří byli randomizováni k léčbě irbesartanem nebo k podávání placeba. Vstupním kritériem byla dokumentovaná FIS (jakákoliv forma), systolický krevní tlak vyšší než 110 mm Hg a některý z dalších rizikových parametrů, jako věk 75 let nebo více, hypertenze, anamnéza cévní mozkové příhody, ejekční frakce méně než 45 % a další.
 K léčbě irbesartanem bylo randomizováno 4518 nemocných průměrného věku 69,5 roku; 39,2 % byly ženy a v 66,0 % trpěli nemocní permanentní FIS. K podávání placeba bylo randomizováno 4498 nemocných průměrného věku 69,6 roku; 39,3 % byly ženy a v 64,4 % měli nemocní permanentní formu FIS. Srdeční selhání mělo 32,3 % pacientů v irbesartanové větvi a 31,6 % ve větvi placebové. Krevní tlak byl v obou větvích obdobný – 138/83 mm Hg
K léčbě irbesartanem bylo randomizováno 4518 nemocných průměrného věku 69,5 roku; 39,2 % byly ženy a v 66,0 % trpěli nemocní permanentní FIS. K podávání placeba bylo randomizováno 4498 nemocných průměrného věku 69,6 roku; 39,3 % byly ženy a v 64,4 % měli nemocní permanentní formu FIS. Srdeční selhání mělo 32,3 % pacientů v irbesartanové větvi a 31,6 % ve větvi placebové. Krevní tlak byl v obou větvích obdobný – 138/83 mm Hg 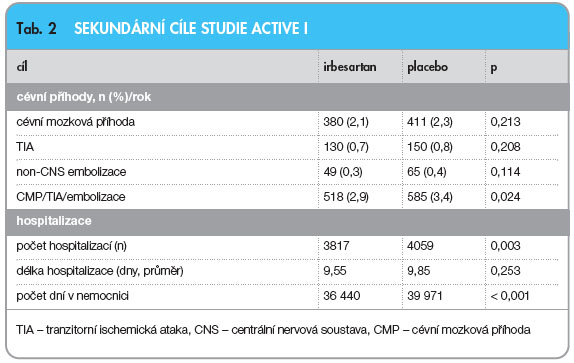 a 138/82 mm Hg; tepová frekvence dosahovala 75,3 vs. 74,9 tepu za minutu. Téměř dvě třetiny nemocných v obou větvích byly léčeny inhibitory ACE (60,2 % vs. 60,6 %) a v nadpoloviční většině betablokátory (54,4 % vs. 54,6 %). Skupiny se nelišily v léčbě blokátory kalciových kanálů, a-blo-kátory, antiarytmiky a digoxinem. Krevní tlak poklesl v irbesartanové větvi o 6,84/ 4,51 mm Hg a ve větvi s placebem o 3,93/ 2,63 mm Hg, rozdíl v poklesu tedy činil 2,91/1,88 mm Hg ve prospěch irbesartanu. Primární cíl studie ukazuje tab. 1, sekundární cíle tab. 2.
a 138/82 mm Hg; tepová frekvence dosahovala 75,3 vs. 74,9 tepu za minutu. Téměř dvě třetiny nemocných v obou větvích byly léčeny inhibitory ACE (60,2 % vs. 60,6 %) a v nadpoloviční většině betablokátory (54,4 % vs. 54,6 %). Skupiny se nelišily v léčbě blokátory kalciových kanálů, a-blo-kátory, antiarytmiky a digoxinem. Krevní tlak poklesl v irbesartanové větvi o 6,84/ 4,51 mm Hg a ve větvi s placebem o 3,93/ 2,63 mm Hg, rozdíl v poklesu tedy činil 2,91/1,88 mm Hg ve prospěch irbesartanu. Primární cíl studie ukazuje tab. 1, sekundární cíle tab. 2.
Studie ACTIVE neprokázala snížení výskytu cévních mozkových příhod, infarktů myokardu a vaskulárních úmrtí po léčbě irbesartanem, prokázala však signifikantní snížení výskytu srdečního selhání o 14 %. Významné snížení výskytu opakovaných příhod vedlo ke statisticky významnému snížení počtů dní hospitalizace. Analýza podskupin ukázala, že větší prospěch z léčby měli nemocní, kteří neužívali betablokátor.
Sekundární prevence
Poměrně velké množství menších klinických studií potvrdilo význam podávání inhibitorů ACE či sartanů po kardioverzi na udržení sinusového rytmu, především když byly blokátory RAAS podávány společně s antiarytmikem, nejčastěji s amiodaronem, ve srovnání s podáváním samotného antiarytmika [23, 24]. Randomizovaná studie s kandesartanem CAPRAF (Candesartan in the Prevention of Relapsing Atrial Fibrillation) bohužel žádný efekt na snížení rekurencí FIS neprokázala [25]. Podobně ani největší sekundárně preventivní studie GISSI-AF (Gruppo Italiano per lo Studio della Sopravvivenza nell Insufficienza cardiaca Atrial Fibrillation) u 1442 pacientů s vysokým kardiovaskulárním rizikem a po kardioverzi pro perzistentní FIS neprokázala žádný vliv léčby valsartanem na výskyt recidiv FIS [26].
Závěr
 Upstream terapie inhibitory ACE a/nebo sartany má pravděpodobně velký význam v prevenci vzniku fibrilace síní např. u hypertoniků či u pacientů po infarktu myokardu. V případě permanentní fibrilace síní je již tento význam pochybný. Doporučení Evropské kardiologické společnosti pro použití blokátorů RAAS v upstream léčbě můžeme shrnout do tab. 3 [1].
Upstream terapie inhibitory ACE a/nebo sartany má pravděpodobně velký význam v prevenci vzniku fibrilace síní např. u hypertoniků či u pacientů po infarktu myokardu. V případě permanentní fibrilace síní je již tento význam pochybný. Doporučení Evropské kardiologické společnosti pro použití blokátorů RAAS v upstream léčbě můžeme shrnout do tab. 3 [1].
Ani tato doporučení ale nezpochybňují indikaci pro podání inhibitorů ACE (při intoleranci sartanů) všem nemocným s ICHS, srdečním selháním či s dysfunkcí levé komory, bez ohledu na přítomnost či nepřítomnost FIS (síla důkazu IA). Stejně tak každý hypertonik s FIS má jako lék první volby dostat inhibitor ACE, resp. sartan při intoleranci léčby inhibitorem ACE [27].
Seznam použité literatury
- [1] Camm AJ, Kirchhof P, Lip GYH, et al. Guidelines for the management of atrial fibrillation. EHJ 2010; 31: 2369–2429.
- [2] Go AS, Hylek EM, Phillips KA, et al. Prevalence of diagnosed atrial fibrillation in adults. National implications for rthythm management and stroke prevention: The Anticoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA 2001; 285: 2370–2375.
- [3] Gage BF, Waterman AD, Shannon W, et al. Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation. JAMA 2001; 285: 2864–2870.
- [4] Lábrová R. Epidemiologie fibrilace síní. Kardiofórum 2007; 5: 6–10.
- [5] Tsang TS, Petty GW, Barnes ME, et al. The prevalence of atrial fibrillation in incident stroke cases and matched population controls in Rochester, Minnesota: changes over three decades. J Am Coll Cardiol 2003; 42: 93–100.
- [6] Wolf PA, Benjamin EJ, Belanger AJ, et al. Secular trends in the prevalence of atrial fibrillation: the Framingham Study. Am Heart J 1996; 131: 790–795.
- [7] Lábrová R, Špinar J. Srdeční selhání a fibrilace síní. Cor Vasa 2008; 50: 385–392.
- [8] Savelieva I, Camm AJ. Is there any hope for angiotensin-converting enzym inhibitors in atrial fibrillation? Am Heart J 2007; 154: 403–406.
- [9] Young-Xu Y, Jabbour S, Goldberg R, et al. Usefulness of statin drugs in protecting against atrial fibrillation in patients with coronary artery disease. Am J Cardiol 2003; 92: 1379–1383.
- [10] Dernellis J, Panaretou M. Relationship between C-reactive protein concentrations during glucocorticoid therapy and recurrent atrial fibrillation. Eur Heart J 2004; 25: 1100–1107.
- [11] Calo L, Bianconi L, Colivicchi F, et al. N-3 fatty acids for the prevention of atrial fibrillation after coronary artery bypass surgery. J Am Coll Cardiol 2005; 45: 1723–1728.
- [12] Freestone B, Beevers DG, Lip GY. The renin-angiotensin-aldosterone system in atrial fibrillation: a new therapeutic target? J Hum Hypertens 2004; 18: 461–465.
- [13] Bautista LE. Inflammation, endothelial dysfunction, and the risk of high blood pressure: epidemiologic and biological evidence. J Hum Hypertens 2003; 17: 223–230.
- [14] Yusuf S. Prevention of atrial fibrillation in patients with symptomatic chronic heart failure by candesartan in the Candesartan in Heart failure: Assessment of Reduction in Mortality and morbidity (CHARM) program. Am Heart J 2006; 151: 985–991.
- [15] Jibrini MB, Molnar J, Arora RR. Prevention of atrial fibrillation by way of abrogation of the renin-angiotensin system: a systematic review and meta-analysis. Am J Ther 2008; 15: 36–43.
- [16] Anand K, Mooss AN, Hee TT, Mohiuddin SM. Meta-analysis: inhibition of renin-angiotensin system prevents new-onset atrial fibrillation. Am Heart J 2006; 152: 217–222.
- [17] Schneider MP, Hua TA, Bohm M, et al. Prevention of atrial fibrillation by renin-angiotensin system inhibition a meta-analysis. J Am Coll Cardiol 2010; 55: 2299–2307.
- [18] Ducharme A, Swedberg K, Pfeffer MA, et al. Atrial fibrilation and congestive heart failure: specific considerations at the intersection of two common and important cardiac disease sets. J Cardiovasc Electrophysiol 2002; 13: 339–405.
- [19] Healey JS, Baranchuk A, Crystal E, et al. Prevention of atrial fibrillation with angiotensin converting enzyme inhibitors and angiotensin receptor blockers: a meta-analysis. J Am Coll Cardiol 2005; 45: 1832–1839.
- [20] Špinar J, Vítovec J. Losartan – víc než pokles krevního tlaku. Kardiol Rev 2006; 8: 115–120.
- [21] Wachtell K, Lehto M, Gerdts E, et al. Angiotensin II receptor blockade reduces new-onset atrial fibrillation and subsequent stroke compared to atenolol: the Losartan Intervention For End Point Reduction in Hypertension (LIFE) study. J Am Coll Cardiol 2005; 45: 712–719.
- [22] Špinar J, Lábrová R. ACTIVE I a upstream terapie. Interv Akut Kardiol 2009; 8: 325–327.
- [23] Madrid AH, Bueno MG, Rebollo JM, et al. Use of irbesartan to maintain sinus rhythm in patients with long-lasting persistent atrial fibrillation: a prospective and randomized study. Circulation 2002; 106: 331–336.
- [24] Ueng KC, Tsai TP, Yu WC, et al. Use of enalapril to facilitate sinus rhythm maintenance after external cardioversion of long-standing persistent atrial fibrillation. Results of a prospective and controlled study. Eur Heart J 2003; 24: 2090–2098.
- [25] Tveit A, Seljeflot I, Grundvold I, et al. Effect of candesartan and various inflammatory markers on maintenance of sinus rhythm after electrical cardioversion for atrial fibrillation. Am J Cardiol 2007; 99: 1544–1548.
- [26] Belluzzi F, Sernesi L, Preti P, et al. Prevention of recurrent lone atrial fibrillation by the angiotensin-II converting enzyme inhibitor ramipril in normotensive patients. J Am Coll Cardiol 2009; 53: 24–29.
- [27] Mancia G, Laurent S, Agabiti-Rosei L, et al. Reappraisal of European guidelines on hypertension management: a European Society of hypertension Task Force document. J Hypertens 2009; 27: 2121–2158.