Blokátory systému renin-angiotenzin-aldosteron v sekundární prevenci cévních mozkových příhod
V etiopatogenezi cévních mozkových příhod hrají důležitou úlohu vedle faktorů neovlivnitelných (např. věk či genetická výbava) též faktory ovlivnitelné, zejména přítomnost hypertenze, dyslipidémie, kuřáckého návyku, diabetu či fibrilace síní. V etiopatogenezi řady těchto jednotek, zvláště však hypertenze, diabetu či fibrilace síní, má velký význam hyperaktivace systému renin-angiotenzin-aldosteron (RAAS). Nepřekvapí proto, že blokáda systému RAAS patří k účinným zbraním nejen v primární, ale ještě více v sekundární prevenci tranzitorních či proběhlých mozkových příhod. Po překonané příhodě – je-li přítomna hypertenze – vede léčba inhibitory ACE, konkrétně ramiprilem či perindoprilem, k významnému poklesu výskytu recidiv téměř o třetinu, léčba sartany, zejména telmisartanem, o pětinu. Též u normotenzních nemocných po mozkové příhodě byla doložena účinnost inhibitorů ACE (zvláště perindoprilu v kombinaci s diuretikem indapamidem) ve snížení výskytu recidiv cerebro- či kardiovaskulárních příhod o více než třetinu. U sartanů zatím přesvědčivý doklad o příznivém efektu u normotenzních nemocných po mozkové příhodě podán nebyl. Shrneme-li, pak nemocní po proběhlém iktu či tranzitorní ischémii jsou indikováni nejen k léčbě hypolipidemické a antitrombotické, ale též k inhibici systému RAAS, optimálně s použitím inhibitorů ACE.
Cerebrovaskulární příhody patří, spolu s kardiovaskulárními a onkologickými chorobami, do „silné trojky“ nemocí decimujících populaci našeho socioekonomického regionu. Prvé atace mozkové příhody podlehne téměř polovina postižených; ti, kteří iktus překonají, mají až 20% pravděpodobnost recidivy příhody již během prvého roku, do pěti let pak můžeme očekávat další ataku u více než třetiny nemocných. Z těchto chmurných dat vyplývá důležitost účinné prevence recidivy mozkových příhod. V současné době je sekundární prevence ischemických mozkových příhod založena na účinné léčbě antitrombotické (reprezentované zejména kyselinou acetylsalicylovou, klopidogrelem či tiklopidinem, eventuálně kombinací kyseliny acetylsalicylové s dipyridamolem). V sekundární prevenci ischemických mozkových příhod se dále zásadním způsobem uplatňuje léčba antiaterogenní, zde vévodí postupy upravující dyslipidémii (zvláště podávání statinů), ukončení kuřáctví (i pasivního), a důsledná léčba hypertenze či diabetu. U příhod hemoragických, které jsou příčinou asi 10 % iktů, klademe na prvém místě důraz na optimální kontrolu krevního tlaku, hypolipidemickou léčbu, protikuřáckou intervenci a opět na důslednou prevenci a léčbu diabetu.
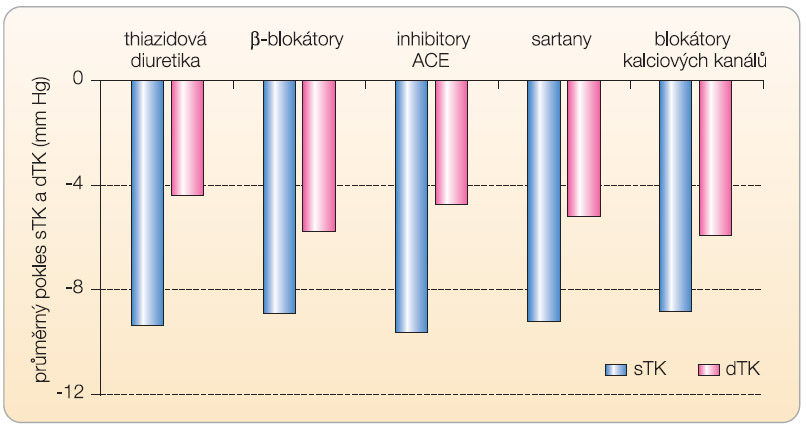 Jak v léčbě příhod ischemických, tak hemoragických hraje klíčovou úlohu účinná léčba hypertenze. Cílem není jen snížení krevního tlaku na optimální hodnoty, ale i výběr antihypertenziva s největším vlivem na snížení rizika mozkových i jiných kardiovaskulárních příhod. Řada studií dokumentovala srovnatelný efekt základní řady antihypertenziv (tj. inhibitorů ACE, sartanů, blokátorů kalciových kanálů, β-blokátorů či thiazidových diuretik a indapamidu) na pokles krevního tlaku (graf 1), nicméně snížení výskytu mozkových příhod bylo závislé na výběru antihypertenziva. Na jedné straně je patrný nejvýraznější
Jak v léčbě příhod ischemických, tak hemoragických hraje klíčovou úlohu účinná léčba hypertenze. Cílem není jen snížení krevního tlaku na optimální hodnoty, ale i výběr antihypertenziva s největším vlivem na snížení rizika mozkových i jiných kardiovaskulárních příhod. Řada studií dokumentovala srovnatelný efekt základní řady antihypertenziv (tj. inhibitorů ACE, sartanů, blokátorů kalciových kanálů, β-blokátorů či thiazidových diuretik a indapamidu) na pokles krevního tlaku (graf 1), nicméně snížení výskytu mozkových příhod bylo závislé na výběru antihypertenziva. Na jedné straně je patrný nejvýraznější 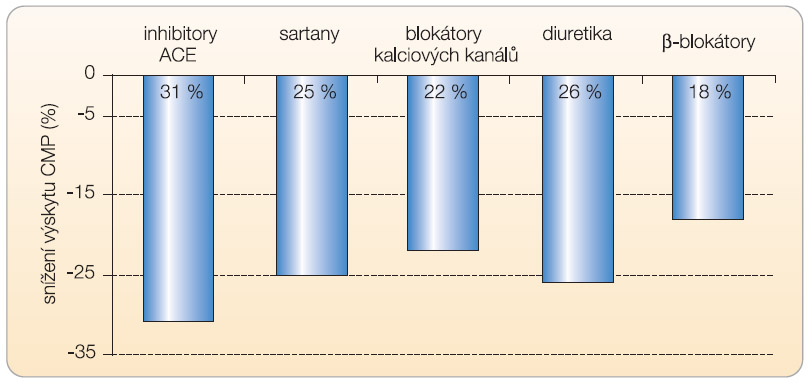 účinek inhibitorů ACE, na straně druhé nejnižší efekt β-blokátorů (graf 2). Nutno zdůraznit, že tento rozdíl je patrný pouze při hodnocení mozkových příhod, v prevenci kardiovaskulárních onemocnění naopak β-blokátory patří k nejvýznamnějším. Máme-li tak významné rozdíly mezi antihypertenzivy v prevenci výskytu a recidivy iktu, podívejme se na pravděpodobné příčiny, proč inhibice systému renin-angiotenzin-aldosteron (RAAS) patří k nejúčinnějším terapeutickým postupům.
účinek inhibitorů ACE, na straně druhé nejnižší efekt β-blokátorů (graf 2). Nutno zdůraznit, že tento rozdíl je patrný pouze při hodnocení mozkových příhod, v prevenci kardiovaskulárních onemocnění naopak β-blokátory patří k nejvýznamnějším. Máme-li tak významné rozdíly mezi antihypertenzivy v prevenci výskytu a recidivy iktu, podívejme se na pravděpodobné příčiny, proč inhibice systému renin-angiotenzin-aldosteron (RAAS) patří k nejúčinnějším terapeutickým postupům.
Jaká je úloha systému RAAS?
Fylogeneticky je RAAS jedním z nejstarších defenzivních systémů. V době, kdy se první obratlovci stěhovali na souš, bylo nutno zajistit optimální homeostázu i ve změněném prostředí, tedy zabránit ztrátám iontů i soli a udržet dostatečný krevní tlak. Z řady systémů kontrolujících základní funkce – obranu a zánět či integritu cév a cirkulaci – se u obojživelníků vydělil systém RAAS, který pak u suchozemců výrazně posílil. Skutečnost, že primární mechanismy umožňující přežití živočichů měly komplexní funkci, si s sebou tento systém nese i po další miliony let a nepřekvapí nás velmi úzký vztah regulace hemostázy k regulaci zánětlivých i hemostatických pochodů. Vývojem se tento systém stal robustním a k zajištění optimální rovnováhy bylo nutno zapojit i plejádu mechanismů kontrolních. Páteří celého systému je osa RAAS vedoucí k uvolnění angiotenzinu II (AII) a aldosteronu [1 – obr. 1a]. Pro AII je klíčovým receptor AT1, který udržuje dostatečný cirkulující volum, zvyšuje krevní tlak a aktivuje reparační (zánětlivé) a trombotické pochody. Aldosteron potencuje působení AII svým mineralokortikoidním efektem, kdy dominuje retence sodíku. Mineralokortikoidní receptory však jsou přítomny též v myokardu a v cévní stěně, kde navodí proliferaci vaziva s následným poklesem kontraktility a poddajnosti myokardu či fixují zvýšenou rezistenci remodelací cévní stěny.
Jak již bylo zmíněno, v posledních letech víme daleko více i o systémech kontrolních, tj. vazodilatačních, natriuretických a antiproliferačních. Tak například v cévě postižené zánětem (např. v rámci aterogeneze) jsou exprimovány i receptory AT2 a AT4 , jež naopak, zvýšením nabídky oxidu dusnatého (NO), výše uvedené účinky stimulace receptoru AT1 tlumí. I tyto receptory jsou stimulovány AII, nicméně nejsou blokovány sartany. Druhým kontrolním mechanismem je systém kininový, jehož klíčový působek – bradykinin – svým diuretickým a vazodilatačním efektem (zvýšením nabídky NO) snižuje výsledný dopad stimulace receptorů AT1 či aldosteronu. Společným jmenovatelem u obou systémů je ACE, enzym konvertující angiotenzin I (AI) na AII a současně štěpící bradykinin na degradační produkty. Dalším hráčem, opět s vazodilatačním, natriuretickým a diuretickým efektem, je komplex natriuretických peptidů typu A, B či C či angiotenzin 1-7. Natriuretické peptidy jsou uvolňovány například při akutní dilataci srdečních síní či komor, angiotenzin 1-7 se tvoří při zvýšené nabídce AI či AII (tedy jak při podávání inhibitorů ACE, tak sartanů). K dokreslení komplexnosti je nutné zmínit účinek reninu – nejen jako enzymu, ale též jako mitotického působku stimulujícího proliferaci elementů cévní stěny [1 – obr. 1b].
Jsou rozdíly ve způsobu inhibice systému RAAS?
V současnosti máme řadu možností tlumení aktivity systému RAAS: inhibovat uvolnění reninu po fyziologických podnětech (např. β-blokátory), zamezit působení reninu jako enzymu i jako promitotického hormonu (inhibitory reninu – aliskiren), blokovat konverzi AI na AII (inhibitory ACE), zamezit působení AII na receptory AT1 (sartany) či inhibovat působení aldosteronu na mineralokortikoidní receptory (inhibitory aldosteronu – spironolakton či eplerenon). Efekt jednotlivých lékových skupin se významně liší. Ovlivnění výdeje reninu β-blokátory je relativně slabé a v praxi se uplatní pouze v antihypertenzním působení. Podobný, ale daleko intenzivnější je útlum osy RAAS inhibitory reninu, blokována je nejen základní osa, ale též aktivita (pro)reninového receptoru a angiotenzinu 1-7 [1 – obr. 1b]. Naopak inhibitory ACE vedle snížení nabídky AII zvyšují nabídku reninu a tak i stimulaci (pro)reninového receptoru a významně zvyšují dostupnost bradykininu (snížením jeho degradace) [1 – obr. 1c]. ACE se navíc účastní též biokonverze řady dalších látek, zejména neurohormonů typu neuropeptidu Y, takže blokáda jejich degradace může vést k dráždění centra pro kašel. Konečně sartany selektivně inhibují receptor AT1 a zvýšením hladiny AI a AII stimulují i nabídku angiotenzinu 1-7 a aktivují receptory AT2 a AT4. Bradykinin je naopak ovlivněn minimálně [1 – obr. 1d].
Shrneme-li, pak různé způsoby blokády osy RAAS mají odlišný dopad na aktivitu obdobně důležitých systémů paralelních, často s opačným fyziologickým působením. Proto nelze pokládat jednotlivé skupiny léčiv užívané k inhibici systému RAAS za rovnocenné. Existují rozdíly ve farmakodynamickém působení – díky aktivitě bradykininu mají inhibitory ACE silnější antihypertenzní efekt a větší efekt na úpravu endoteliální dysfunkce, na druhé straně sartany jsou lépe snášeny, neobjevuje se kašel.
Jak působí inhibice systému RAAS v profylaxi cerebrovaskulárních příhod?
Blokáda osy RAAS se příznivě projeví na několika úrovních. Zřejmě nejvýznamnější je přímý antihypertenzní účinek, nicméně jistě se uplatní též metabolický efekt (zvýšení nabídky NO s úpravou endoteliální dysfunkce a zvýšení senzitivity k inzulinu). V profylaxi mozkových příhod je významné i zabránění remodelace srdečních oddílů – zejména síní, což sníží riziko vzniku a recidivy fibrilace síní, významného faktoru příhod vznikajících na tromboembolickém podkladě. Jak významný je podíl jednotlivých složek, můžeme jen odhadovat, u různých klinických stavů se bude lišit.
Je rozdíl mezi inhibitory ACE a sartany? Je rozdíl mezi hypertoniky a normotoniky?
Prvé doklady o příznivém efektu blokády systému RAAS na incidenci cerebrovaskulárních příhod byly podány pro inhibitory ACE a posléze též pro sartany. Řada studií u hypertoniků dokumentovala pokles rizika mozkových příhod řádově o třetinu v rámci primární prevence i u nemocných s různými typy kardiovaskulárního postižení. Srovnat efekt inhibitorů ACE se sartany je obtížné, nejsou dostupné prognostické studie s oběma skupinami v primární, natož v sekundární profylaxi cerebrovaskulárních příhod. Pouze nepřímé srovnání obou skupin proti placebu hovoří ve prospěch inhibitorů ACE, nicméně pokud není dostupná analýza typu „head to head“, nejsou závěry konkluzivní. Podobně jsme na tom i při srovnání inhibitorů ACE či sartanů s jinými skupinami antihypertenziv. Na základě výsledků studie ASCOT-BPLA můžeme jen říci, že antihypertenzní kombinace inhibitoru ACE (perindoprilu) a blokátoru kalciového kanálu (amlodipinu) byla výrazně výhodnější nežli kombinace β-blokátoru s diuretikem – dokumentován byl významný pokles výskytu mozkových příhod o 23 % a pokles mortality o 11 % [2]. Studie ovšem nebyla směřována na sekundární prevenci mozkových příhod. V této indikaci však máme výsledky studie se sartany. Ve studii MOSES je vzájemně porovnáván eprosartan s blokátorem kalciového kanálu nitrendipinem u hypertoniků po iktu [3]. Mortalita a vaskulární morbidita poklesla při léčbě sartanem o 21 % více nežli ve větvi blokátoru kalciového kanálu. Metaanalýza účinnosti různých sartanů proti amlodipinu u hypertoniků s různými typy kardio- a cerebrovaskulárních příhod však superioritu sartanů nepotvrdila, naopak v prevenci mozkových příhod byl účinnější amlodipin [4]. Shrneme-li, pak optimálním přístupem k profylaxi mozkových příhod u hypertoniků je pravděpodobně kombinační léčba založená na blokádě RAAS inhibitorem ACE či sartanem spolu s blokátorem kalciového kanálu, optimálně s amlodipinem.
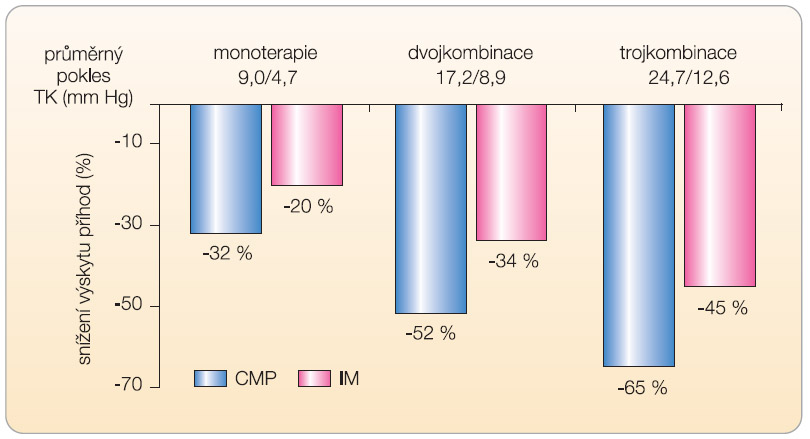
Údaje o výhodnosti inhibice RAAS v prevenci iktů u hypertenzní populace jsou dávno lékařské veřejnosti známy a využití těchto poznatků se stalo součástí každodenní praxe. Daleko zajímavější jsou proto výsledky preventivní blokády osy RAAS u normotoniků. Odpověď na otázku, zda i v rizikové populaci normotoniků či u nemocných s mírnou hypertenzí je indikována blokáda RAAS inhibitorem ACE, podaly hned dvě studie – HOPE a EUROPA [5, 6]. Výskyt iktů klesl ve studii HOPE s ramiprilem o 32 %, efekt u normotenzních pacientů byl přitom plně vyjádřen a nelišil se významně od hypertoniků. Efekt iniciální léčby inhibitorem ACE přetrvával přitom ještě řadu let po ukončení vlastní studie [7]. Zatímco uvedené klíčové studie HOPE a EUROPA se zabývaly převážně nemocnými s kardiovaskulárním postižením, studie PROGRESS byla určena k tomu, aby přinesla odpověď na otázku, jaký je přínos inhibitorů ACE u nemocných po ischemické či hemoragické mozkové příhodě [8]. V této studii byl při kombinační léčbě perindoprilem s diuretikem indapamidem dokumentován pokles výskytu recidiv mozkové příhody o 43 %! V celé skupině, tj. při léčbě perindoprilem 6 indapamidem, klesl počet recidiv cerebrovaskulárních příhod o 28 % a výskyt kardiovaskulárních příhod o 26 %. Při sledování
účinnosti vzhledem k etiologii příhody byl pozorován největší přínos u krvácení do CNS (graf 3). Efekt u hypertoniků a normotoniků byl zcela srovnatelný (graf 4a). Shrneme-li, pak efekt inhibitorů ACE, konkrétně perindoprilu a ramiprilu, je dokumentován u rizikových nemocných v prevenci výskytu mozkové příhody i její recidivy u hypertoniků, stejně jako u normotoniků. Přidání diuretika tento efekt potencuje.
Jak je tomu však u sartanů? Obdobnou studií, jako byla PROGRESS s perindoprilem, byla studie PRoFESS s telmisartanem [9]. I v této studii byl pozorován významný pokles výskytu recidiv mozkových příhod. Na rozdíl od inhibitoru ACE byla však účinnost telmisartanu prokazatelná pouze u hypertoniků. Rozdíl mezi oběma skupinami byl významný (graf 4b). Zdá se tak, že u inhibitorů ACE se vedle antihypertenzního efektu uplatňuje protektivní efekt na endoteliální dysfunkci, zatímco u sartanů je přítomen převážně efekt antihypertenzní. Proto byla účinnost inhibitorů ACE prokázána i u normotoniků. Pro efekt inhibitorů reninu v profylaxi mozkových příhod nemáme v současné době žádné doklady, bohužel ani není registrována žádná prospektivní studie v této indikaci. Obdobně není k dispozici, není uskutečňována ani plánována žádná studie v této indikaci s antagonisty mineralokortikoidních receptorů, tj. s eplerenonem či se spironolaktonem [10].
Je výhodná duální inhibice systému RAAS?
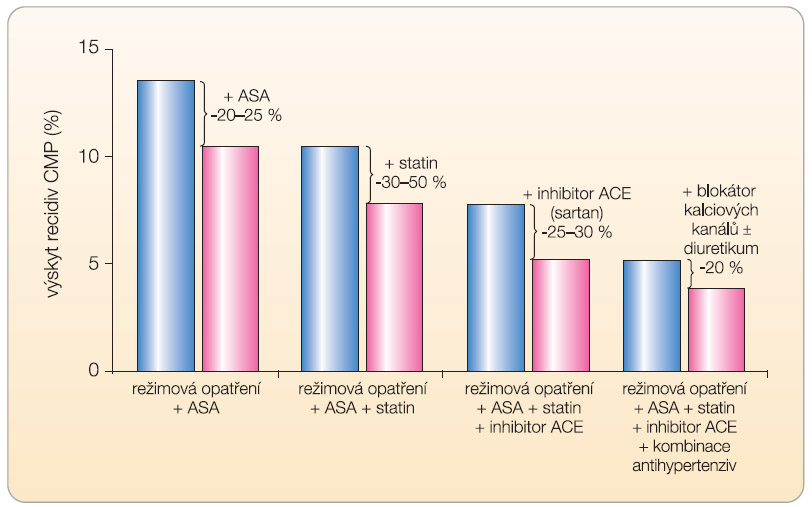
 V léčbě hypertenze je velmi výhodná kombinace antihypertenziv, též v profylaxi recidivy mozkových příhod byl dokumentován příznivý efekt inhibitorů ACE či sartanů s jinými antihypertenzivy (graf 5). Je však výhodná také duální inhibice systému RAAS podáváním kombinace inhibitoru ACE a sartanu? Nejprve se podívejme, jaký efekt má podávání této kombinace na samotný pokles krevního tlaku. Nejrozsáhlejší analýza 14 antihypertenzních studií dokumentovala relativně malý efekt na pokles krevního tlaku [11]. Zatímco kombinace inhibitorů ACE s diuretiky vedla k poklesu sytolického tlaku téměř o 10 mm Hg, kombinací inhibitoru ACE se sartanem bylo dosaženo poklesu pouze o 2 mm Hg, tedy výrazně menšího než aditivního účinku. Ani v prevenci kardiovaskulárních příhod není kombinace přínosná. Ve studii ONTARGET nevedla kombinovaná léčba ramiprilem a telmisartanem k poklesu morbidity a mortality, navíc se zvýšil výskyt nežádoucích účinků [12]. K podobnému závěru, tj. neracionálnosti kombinace inhibitorů ACE se sartany, dospěli po komplexní analýze efektu duální léčby i v dalších indikacích též jiní autoři [13].
V léčbě hypertenze je velmi výhodná kombinace antihypertenziv, též v profylaxi recidivy mozkových příhod byl dokumentován příznivý efekt inhibitorů ACE či sartanů s jinými antihypertenzivy (graf 5). Je však výhodná také duální inhibice systému RAAS podáváním kombinace inhibitoru ACE a sartanu? Nejprve se podívejme, jaký efekt má podávání této kombinace na samotný pokles krevního tlaku. Nejrozsáhlejší analýza 14 antihypertenzních studií dokumentovala relativně malý efekt na pokles krevního tlaku [11]. Zatímco kombinace inhibitorů ACE s diuretiky vedla k poklesu sytolického tlaku téměř o 10 mm Hg, kombinací inhibitoru ACE se sartanem bylo dosaženo poklesu pouze o 2 mm Hg, tedy výrazně menšího než aditivního účinku. Ani v prevenci kardiovaskulárních příhod není kombinace přínosná. Ve studii ONTARGET nevedla kombinovaná léčba ramiprilem a telmisartanem k poklesu morbidity a mortality, navíc se zvýšil výskyt nežádoucích účinků [12]. K podobnému závěru, tj. neracionálnosti kombinace inhibitorů ACE se sartany, dospěli po komplexní analýze efektu duální léčby i v dalších indikacích též jiní autoři [13].
Jaký je závěr pro klinickou praxi?
Shrneme-li, pak blokáda osy RAAS vede nejen k úpravě krevního tlaku, k úpravě endoteliální dysfunkce a ke zlepšení regulace homeostázy, ale máme doklady o příznivém vlivu inhibice systému i v prevenci cévních mozkových příhod – u nemocných s hypertenzí, u normotoniků či hypertoniků se zvýšeným cerebro- či kardiovaskulárním rizikem či v prevenci recidivy cerebrovaskulárních příhod u nemocných s hypertenzí. V těchto indikacích byla u hypertoniků prokázána účinnost jak inhibitorů ACE, tak sartanů. Ve výskytu mozkových příhod či jejich recidivy je možno očekávat pokles asi o třetinu. Naproti tomu u nemocných normotenzních po proběhlé příhodě je dokumentován příznivý vliv inhibitorů ACE, zejména jsou-li kombinovány s diuretikem. Pro skupinu sartanů zatím efekt doložen nebyl.
 Při výběru optimálního léčiva nutno vzít v úvahu, že většina studií byla provedena s perindoprilem či s ramiprilem, je proto racionální při intervenci vybrat přednostně z těchto dvou látek. Též ve dvou velkých retrospektivních analýzách vycházejících z reálné praxe se ukázalo, že dopad na mortalitu a morbiditu v sekundární prevenci kardiovaskulárních onemocnění byl u těchto dvou inhibitorů ACE významně nejpříznivější [14, 15]. Rozhodování o optimálním sartanu je z pohledu medicíny založené na důkazech obtížnější. Nicméně při omezení dostupnosti sartanů v ČR na telmisartan, valsartan a losartan by mohl být při výběru léčby upřednostněn telmisartan. Jeho výhodou jsou příznivé farmakokinetické vlastnosti s dlouhým účinkem a s nízkým potenciálem k lékovým interakcím, navíc i výsledky studie ONTARGET u rizikové populace podporují tento výběr. Závěrem nutno zdůraznit, že problémem současnosti nejsou málo účinná léčiva (graf 6), ale nedostatečný počet indikovaných nemocných, kterým není léčba poskytnuta, a skutečnost, že zdaleka ne všichni nemocní jsou léčeni optimální kombinací léčebných postupů.
Při výběru optimálního léčiva nutno vzít v úvahu, že většina studií byla provedena s perindoprilem či s ramiprilem, je proto racionální při intervenci vybrat přednostně z těchto dvou látek. Též ve dvou velkých retrospektivních analýzách vycházejících z reálné praxe se ukázalo, že dopad na mortalitu a morbiditu v sekundární prevenci kardiovaskulárních onemocnění byl u těchto dvou inhibitorů ACE významně nejpříznivější [14, 15]. Rozhodování o optimálním sartanu je z pohledu medicíny založené na důkazech obtížnější. Nicméně při omezení dostupnosti sartanů v ČR na telmisartan, valsartan a losartan by mohl být při výběru léčby upřednostněn telmisartan. Jeho výhodou jsou příznivé farmakokinetické vlastnosti s dlouhým účinkem a s nízkým potenciálem k lékovým interakcím, navíc i výsledky studie ONTARGET u rizikové populace podporují tento výběr. Závěrem nutno zdůraznit, že problémem současnosti nejsou málo účinná léčiva (graf 6), ale nedostatečný počet indikovaných nemocných, kterým není léčba poskytnuta, a skutečnost, že zdaleka ne všichni nemocní jsou léčeni optimální kombinací léčebných postupů.
Seznam použité literatury
- [1] Bultas J. Osa renin-angiotenzin-aldosteron – půl století od objasnění funkce a stále nová překvapení. Remedia 2008; 18: 120–129.
- [2] Dahlöf B, Sever PS, Poulter NR, et al. Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a multicentre randomised controlled trial. Lancet 2005; 366: 895–906.
- [3] Schrader J, Lüders S, Kulschewski A, et al. Morbidity and Mortality After Stroke, Eprosartan Compared with Nitrendipine for Secondary Prevention: principal results of a prospective randomized controlled study (MOSES). Stroke 2005; 36: 1218–1226.
- [4] Wang JG, Li Y, Franklin SS, Safar M. Prevention of stroke and myocardial infarction by amlodipine and Angiotensin receptor blockers: a quantitative overview. Hypertension 2007; 50: 181–188.
- [5] Yusuf S, Sleight P, Pogue J, et al. Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. The Heart Outcomes Prevention Evaluation Study Investigators. N Engl J Med 2000; 342: 145–153.
- [6] Fox KM. EURopean trial On reduction of cardiac events with Perindopril in stable coronary Artery disease Investigators. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double-blind, placebo-controlled, multicentre trial (the EUROPA study). Lancet 2003; 362: 782–788.
- [7] Bosch J, et al. Long-term effects of ramipril on cardiovascular events and on diabetes: results of the HOPE study extension. Circulation 2005; 112: 1339–1346.
- [8] PROGRESS Collaborative Group. Randomised trial of a perindopril-based blood-pressure-lower-ing regimen among 6,105 individuals with previous stroke or transient ischaemic attack. Lancet 2001; 358: 1033–1041.
- [9] Yusuf S and PRoFESS Study Group. Telmisartan to prevent recurrent stroke and cardiovascular events. N Engl J Med 2008; 359: 1225–1237.
- [10] www.clinicaltrials.gov (navštíveno 15. 4. 2009)
- [11] Doulton TW, He FJ, MacGregor GA. Systematic review of combined angiotensin-converting enzyme inhibition and angiotensin receptor blockade in hypertension. Hypertension 2005; 45: 880–886.
- [12] ONTARGET Investigators, Yusuf S, et al. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med 2008; 358: 1547–1559.
- [13] Messerli FH. The sudden demise of dual renin-angiotensin system blockade or the soft science of the surrogate end point. J Am Coll Cardiol 2009; 53: 468–470.
- [14] Pilote L, Abrahamowicz M, Eisenberg M, et al. Effect of different angiotensin-converting-enzyme inhibitors on mortality among elderly patients with congestive heart failure. CMAJ 2008;178: 1303–1311.
- [15] Pilote L, Abrahamowicz M, Rodrigues E, et al. Mortality rates in elderly patients who take different angiotensin-converting enzyme inhibitors after acute myocardial infarction: a class effect? Ann Intern Med 2004; 141: 102–112.