Celková a lokální léčba bolesti při sportovních poúrazových stavech pohybového aparátu
Úrazy patří mezi nejčastější příčinu vzniku akutní nociceptivní muskuloskeletální bolesti. Terapie bolesti je proto nedílnou součástí terapie úrazů. Její charakter a intenzita vnímání souvisí nejen s rozsahem vlastního poranění, ale také s etnickými a kulturními faktory, osobnostními rysy, emocemi, prostředím, věkem a socializací pacienta. Pro zahájení farmakoterapie je důležité objektivizovat intenzitu vnímání bolesti a na jejím základě zvolit správný algoritmus farmakoterapie, eventuálně kombinaci farmakologické a nefarmakologické léčby. V terapii postupujeme efektivně, ale bezpečně, s ohledem na možné nežádoucí účinky.
Úvod
Podle WHO je bolest definována jako nepříjemná vjemová a emocionální zkušenost související se skutečným nebo potenciálním poškozením tkáně, případně jako takové poškození popsaná [1]. Bolest je vždy subjektivní komplexní biologický a psychologický prožitek se sociální souvislostí a její vnímání je značně individuální, ovlivněno řadou faktorů (etnické a kulturní faktory, osobnostní rysy, emoce, typ bolesti, prostředí, věk, socializace). Podstatné je, jaký význam pacient bolesti přikládá. Tento fakt vystihla ve svém sdělení Margo McCaffery [2], která bolest charakterizovala takto: „Bolest je to, co člověk cítí, když říká, že ho to bolí.“
Proto dnes převažuje chápání bolesti jako nozologické jednotky charakterizované jako objektivní fenomén, který je subjektivně odlišně vnímán, odlišně snášen, a musí být proto i různě léčen. V terapii poúrazových stavů hraje léčba bolesti zásadní roli, neboť bolest je častým jevem provázejícím poranění. Nejčastějším typem bolesti v poúrazovém období je akutní nociceptivní muskuloskeletální bolest vzniklá iritací nociceptorů mechanickými, termickými nebo chemickými inzulty při povrchovém poranění kůže, podkoží, ale také při hlubším poranění kostí, vazů, svalů, disků nebo na základě potenciální následné operace. Jde o komplexní proces, na kterém se podílí stres, rozvoj zánětu a změny vaskularizace v poškozené oblasti. V místě poškození a jeho okolí vzniká zóna zvýšené odpovědi (hyperalgezie). Poranění vede k uvolnění řady mediátorů, z nichž některé (např. bradykinin a prostaglandin) vedou ke zvýšení senzitivity nociceptorů [3]. Podle mechanismu vzniku bolesti rozlišujeme:
Nociceptivní bolest – vzniká podrážděním periferních nervových zakončení, tzv. nociceptorů:
- Somatická: dochází k iritaci nociceptorů z kůže, svalů, kloubů, bolest je povrchová – obvykle ostrá, píchavá, dobře lokalizovaná, trvá krátký čas, anebo hloubková – palčivá, úporná, difuzní, trvá delší čas.
- Viscerální: je výsledkem stimulace receptorů bolesti v břišní dutině, provázejí ji vegetativní příznaky; tento typ bolesti se svým charakterem podobá hloubkové somatické bolesti. Bolest je úporná, projevuje se pálením, pícháním, tlakem. Viscerální bolest prochází stejnými nervovými drahami jako bolest somatická, a proto se i stejně pociťuje.
Neuropatická bolest – vychází z centrálního nebo periferního nervového systému, vzniká přímým poškozením nervové tkáně, ischemií, metabolickou chorobou, nádorem. Může mít charakter konstantní nebo paroxysmální bolesti.
Důležitá je také délka bolesti:
-
Akutní bolest je velmi důležitý syndrom, má pozitivní biologický význam, protože je signálem poškození organismu. Trvá méně než 3 až 6 měsíců, je dobře lokalizovatelná, obvykle ostrá, výrazná, aktivizuje sympatoadrenergní systém. Odstraníme-li příčinu, akutní bolest rychle ustoupí. Při velké intenzitě však pro pacienta znamená velkou psychickou zátěž, která může vést až k agresivnímu jednání nebo u velice silné bolesti i k rozvoji šoku, v extrémním případě dokonce ke smrti. Akutní bolest obvykle velmi dobře reaguje na farmakoterapii. Volíme strategii „step down“ podle analgetického žebříčku WHO. Při zahájení farmakoterapie tedy volíme analgetikum podle intenzity bolesti dle VAS a s nastupujícím analgetickým efektem měníme analgetika za farmaka nižšího stupně žebříčku. Obvykle vystačí symptomatická léčba neopioidními analgetiky [4]. Výhodné je používání paracetamolu v kombinaci s NSAID či s opioidem nebo kombinace metamizolu s opioidem či s NSAID [5]. Při závažných poraněních, trvá-li bolest déle než 3–6 měsíců, se její charakter mění na bolest chronickou.
-
Chronická bolest ztrácí význam signálu, stává se samostatnou nemocí, syndromem. Její biologický význam je negativní až destruktivní, trvá déle než 6 měsíců, obtížně se určuje začátek a lokalizace bolesti, bývá obvykle tupá, difuzní. Způsobuje změny celého životního stylu pacienta, narušuje jeho pracovní i rodinný život, navozuje změny psychické a fyzické, ovlivňuje jeho chování. Analgetický efekt farmakoterapie analgetiky bývá často nevýrazný. Volíme strategii „step up“, analgetika podáváme podle časového plánu, abychom předcházeli rozvoji bolesti, doplňujeme o adjuvantní a pomocná léčiva (např. myorelaxancia, psychofarmaka), která potencují analgetický účinek nebo potlačují nežádoucí účinky analgetik.
-
CÍL: úleva od bolesti v klidu, klidný a nerušený spánek.
-
CÍL: úleva od bolesti při pohybu, zařazení do běžné denní aktivity.
Vyšetření a hodnocení bolesti
Důkladné vyšetření a správné zhodnocení bolesti je klíčovým krokem k zahájení adekvátní farmakologické či nefarmakologické léčby pacienta. Při vyšetření klademe důraz na podrobnou anamnézu, která často sama může vést ke stanovení příčiny úrazu a správného typu bolesti. Ptáme se, jak k úrazu došlo, na lokalizaci, kvalitu bolesti, její intenzitu, kdy začala, jaký má průběh v čase, co ji zhoršuje nebo co ji vyvolává, jak se mění během dne, zda ruší spánek, co ji zmírní, jaké léky pacient dosud užívá [5]. Vzhledem k možným nežádoucím účinkům (zažívací obtíže až léze žaludeční sliznice, tzv. NSA gastropatie, poruchy ledvinných funkcí až analgetická nefropatie, hepatopatie, poruchy krvetvorby, alergické reakce aj.) 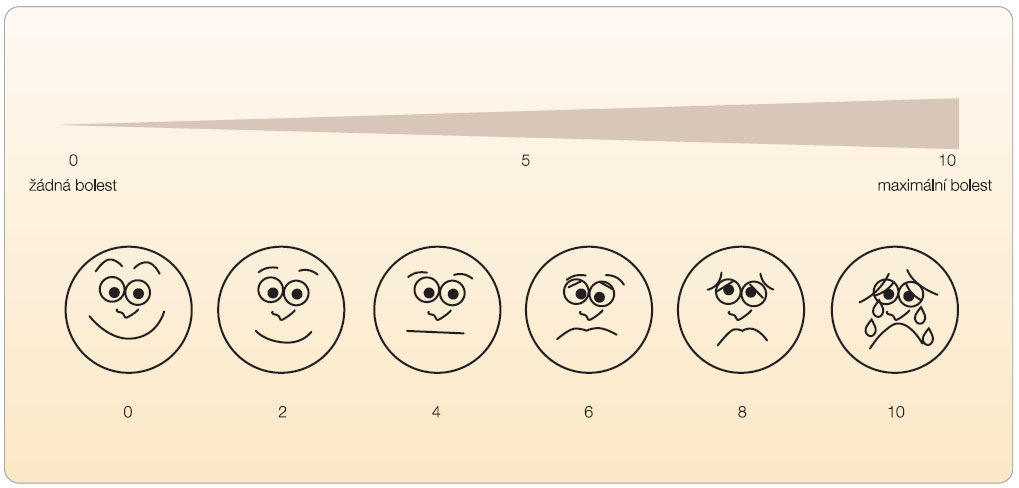 se cíleně ptáme na další přidružená onemocnění (např. onemocnění GIT, asthma bronchiale, onemocnění srdce, ledvin atd.), na intoleranci nebo alergickou reakci po předchozím podávání analgetik. Přestože bolest je velmi subjektivní pocit, snažíme se o její objektivizaci. K hodnocení bolesti používáme vizuální analogovou škálu, na které pacient vyjádří subjektivní vnímání bolesti na stupnici 0–10 cm (obr. 1).
se cíleně ptáme na další přidružená onemocnění (např. onemocnění GIT, asthma bronchiale, onemocnění srdce, ledvin atd.), na intoleranci nebo alergickou reakci po předchozím podávání analgetik. Přestože bolest je velmi subjektivní pocit, snažíme se o její objektivizaci. K hodnocení bolesti používáme vizuální analogovou škálu, na které pacient vyjádří subjektivní vnímání bolesti na stupnici 0–10 cm (obr. 1).
Management léčby poúrazové bolesti
V poúrazových stavech se obvykle jedná o akutní bolest, která zpravidla vyžaduje jen krátkodobou farmakoterapii a po odstranění příčiny rychle odezní, proto je zapotřebí vždy zahájit terapii vlastního úrazu (fixace, bandáž atd.). Při výběru analgetika vycházíme z třístupňového žebříčku WHO dle intenzity a charakteru bolesti a zohledňujeme aktuální klinický stav pacienta. Po celou dobu farmakoterapie je nutné monitorování účinnosti léčby a výskytu nežádoucích účinků (NÚ). Terapeutický přínos analgetické léčby by měl zřetelně převyšovat potencionální rizika jejích NÚ. Pro farmakologickou léčbu bolesti jsou používány tři základní skupiny léků: neopioidní analgetika (analgetika-antipyretika, NSAID), opioidní analgetika a adjuvantní léčba [6].
Třístupňový analgetický žebříček WHO
1. stupeň (VAS 0–4)
– neopioidní analgetika (event. doplněná o adjuvantní nebo nefarmakologickou terapii).Běžné drobné úrazy, např. při sportu. Při výběru neopioidního analgetika je nutné zvážit, zda je u konkrétního pacienta kontraindikace k podání NSAID, či nikoliv (dávky jsou uvedeny pro dospělé pacienty, u dětí dávku redukujeme podle hmotnosti dítěte).
ibuprofen 200 mg, diklofenak 25 mg, ASA 650–1000 mg.
2. stupeň (VAS 4–7)
– bolest přetrvává, zesiluje, nenastávají změny v objektivním nálezu– slabá opioidní analgetika (event. doplněná o neopioidní analgetika a adjuvantní terapii).Závažnější úrazy s intenzivnější bolestí. Iniciálně volíme silnější a rychleji působící farmaka a podle monitorace intenzity bolesti a analgetického efektu postupujeme podle žebříčku WHO „níže“ („step down“) [6].
3. stupeň (VAS 7–10)
– bolest přetrvává, zesiluje, není indikace pro jinou léčbu– silná opioidní analgetika (event. doplněná o neopioidní analgetika, slabá opioidní analgetika a adjuvantní terapii).
Těžká poranění (často), která vyžadují nejen analgetickou, ale i další konzervativní (antiedematózní, sedativní atd.) či chirurgickou léčbu. Farmakoterapii bolesti je nutné zahájit podle celkového klinického stavu pacienta, především podle stavu vědomí.
Silné opioidy – morfin podáván titračně po 2 mg i.v. po 5 min. do analgetického efektu; celková maximální dávka 6 mg; nebo fentanyl i.v. 1 ml titračně do utlumení bolesti 1–4 ml (50–200 mikrogramů). Volba dávky se řídí tělesnou hmotností pacienta, hodnotou krevního tlaku a intenzitou bolesti. Intravenózní terapii je možno doplnit také o analgetika podávaná per os (např. paracetamol nebo NSAID) a adjuvantní terapii např. sedativy [6, 7]. Z výše uvedené charakteristiky vyplývá, že se v praxi setkáváme v terapii poúrazových stavů s bolestí vyžadující intervenci 1. a 2. stupně. U stavů vyžadujících intervenci 3. stupně je obvykle indikována specializovaná a intenzivní terapie za hospitalizace. V terapii prvních dvou stupňů nejčastěji využíváme neopioidní analgetika nebo slabé opioidy, jejich podávání doplňujeme o metody nefarmakologické léčby. U těchto preparátů musíme mít na paměti tzv. stropový efekt, zvýšení podané dávky nad terapeutickou dávku nezvýší analgetický efekt, ale zvýší riziko nežádoucích účinků. Proto při nedostatečné analgetizaci volíme raději slabý opioid nebo kombinaci neopioidního a slabého opioidního analgetika. Kombinace neopioidních a opioidních analgetik má aditivní až synergní účinek. Možná je také kombinace analgetik s adjuvantními analgetiky a kombinace paracetamolu s NSAID [7]. Vzhledem ke zvýšení rizika nežádoucích účinků nekombinujeme jednotlivá NSAID. Velmi často ve snaze eliminovat nežádoucí účinky NSAID podávaných per os využíváme v terapii poúrazových stavů lokálně podávané preparáty, avšak jejich kombinace s NSAID podávanými současně per os může rovněž zvyšovat riziko výskytu NÚ.
Lokální léčba bolesti
Metaanalýzy četných klinických zkoušení podle zásad medicíny založené na důkazech ukazují, že lokální přípravky obsahující NSAID mohou být skutečně účinné. Účinnou látkou lokálně podávaných přípravků bývají nejčastěji NSAID (ketoprofen, ibuprofen, diklofenak, piroxikam, nimesulid atd.) [9]. Výhodou této formy podání je široká škála aplikačních forem (gely, masti, spreje), snadná aplikace, rychlý nástup účinku daný vysokou koncentrací účinné látky v místě poškození při současně výrazném omezení celkových NÚ díky nízké plazmatické koncentraci NSAID.
Účinnost daného preparátu ovlivňuje několik parametrů:
-
hloubka vstřebání (lipofilita);
-
rychlost vstřebávání – penetrace (velikost molekuly);
-
koncentrace účinné látky;
-
dosažená biologická aktivita ITAA – dosažená koncentrace/koncentrace schopná inhibovat
50 % COX 2; -
biologická inhibiční aktivita (inhibice COX 2);
-
aplikační forma (nosič).
Tyto formy jsou vhodné pro terapii především tupých poranění (kontuze, distorze atd.) povrchně uložených struktur, jako jsou svaly, šlachy, případně kloubní pouzdra apod. Postup účinné látky až do hloubky velkých kloubů (např. kyčle) je sice omezený, ale vzhledem k tomu, že i u kloubních afekcí bolest často vychází z periartikulárních struktur (např. svalového spasmu), má tato terapie své uplatnění také v těchto indikačních skupinách. Přestože výskyt NÚ po lokální aplikaci je ve srovnání se systémovým podáním výrazně nižší, je zapotřebí i při této formě aplikace pamatovat na některé vedlejší účinky:
– alergická reakce (důkladná alergologická a farmakologická anamnéza),– fototoxicita (důsledná edukace),– GIT potíže (cave: kombinace NSAID v lokální formě + podání per os, dlouhodobé podávání).
V terapii poúrazových stavů je možno efektivně využít kombinaci farmakologické a nefarmakologické terapie.
Nefarmakologická léčba bolesti
Nefarmakologická intervence v akutní fázi poúrazové terapie bolesti:
– psychoterapie (sugesce, relaxace, ...),– lokální kryoterapie,– fytoterapie (vrbová kůra, zelný list, bosvelové kyseliny, aescin, bromelain, ...),– fixace (tape, bandáže, ortézy, dlahy, ...),– akupunktura, akupresura,– homeopatie.
Nefarmakologická léčba se zaměřuje především na ovlivnění prokrvení poškozené oblasti, a tím na zmírnění rozvoje otoku (kryoterapie), na omezení hybnosti a fixaci a omezení bolesti vznikající při pohybu (taping, ortéza, bandáž). Nefarmakologická terapie zahrnuje také působení některých přírodních látek – fytoterapie (vrbová kůra, zelný list). Důležitou roli hraje ovlivnění psychického stavu pacienta (relaxace, meditace, sugesce, hypnóza). Základní kroky nefarmakologické intervence ihned po úrazu provádíme dle „pravidla“ PRICE:
Protection (ochrana),Rest (klid),Ice (ledování),Compression (bandáž),Elevation (zvýšení).
– rehabilitace (cílená fyzioterapie, diatermie, magnetoterapie, interferenční proudy, ...),– balneoterapie,– celková kryoterapie,– individuální LTV, pohybová aktivita,– sociální podpora.
Také po odeznění akutních potíží hraje nefarmakologická intervence důležitou roli v terapii poúrazového stavu. Rehabilitace se zaměřuje na odstranění poruch vzniklých v souvislosti s úrazem, následnou chirurgickou léčbou, nebo využívá metod individuálního LTV k odstranění svalových dysbalancí, protahování zkrácených, převážně posturálních svalů, posilování atrofických svalů. Na akutní fázi rehabilitace navazuje lázeňská léčba se širokou škálou terapeutických metod (vodoléčba, elektroléčba, magnetoterapie, terapie rázovou vlnou atd.). V doléčování např. sportovních úrazů se stává stále oblíbenější celková kryoterapie v poláriích. Vystavení organismu krátkodobému, ale intenzivnímu vlivu velmi nízkých teplot (od -120 °C do -130 °C) uvádí do pohybu hormonální reakci a do těla se vylučují látky, které mají za úkol zachovat lidský organismus nepoškozený. V krevním séru se tak zvyšuje hladina endorfinů vyznačujících se výrazným protibolestivým účinkem, ale taky kortikoidů a testosteronů.
Dochází k výraznému snížení subjektivního pocitu bolesti, což představuje pozitivum zejména při léčbě postižení pohybového aparátu, revmatických onemocnění i zánětlivých onemocnění kloubů, ale taky při korekci poúrazových stavů [8]. V neposlední řadě je důležitou součástí také sociální podpora navazující na psychoterapii – pomáhá pacientovi řešit eventuální následky úrazu (pracovní neschopnost, omezení sportovních aktivit, ukončení profesionální sportovní kariéry atd.).
Závěr
Bolest svým negativním emočním nábojem výrazně zhoršuje stav pacienta po úrazu. Výběr a strategie vedení analgetické léčby vychází z pacientova celkového klinického stavu, věku a přidružených onemocnění. Důležitou roli hraje charakter bolesti a především její intenzita [10, 11]. V akutní fázi preferujeme analgetika s rychlým nástupem účinku. Je třeba předcházet rozvoji možných nežádoucích účinků a efektivně využívat a kombinovat nefarmakologické i farmakologické postupy léčby, především u osob se zvýšeným gastrointestinálním a kardiovaskulárním rizikem, u starších pacientů a zejména při dlouhodobé léčbě.
Seznam zkratek:
Seznam použité literatury
- [1] Merskey H, Bogduk N. Classification of Chronic Pain: Descriptions of Chronic Pain Syndromes and Definitions of Pain Terms. Seattle: IASP Press, 1994.
- [2] McCaffery M. Patients in pain: What they say, and what they really mean. Am J Nurs 2005; 105: 30–31.
- [3] Siddall PJ, Middleton JW. A proposed algorithm for the management of pain following spinal cord injury. Spinal cord 2006; 44: 67–77.
- [4] Ragnarsson K. Management of pain in persons with spinal cord injury. J Spinal Cord Med 1997; 20: 186–199.
- [5] Opavský J. Vyšetřování osob s algickými syndromy a hodnocení bolesti. In: Rokyta R, Kršiak M, Kozák J. Bolest. Praha; TIGIS 2006: 174–175.
- [6] Kršiak M, et al. Farmakoterapie bolesti – Doporučený diagnostický a léčebný postup pro všeobecné praktické lékaře. 2004. Praha. Centrum doporučených postupů pro praktické lékaře. ISBN: 80-903573-2-6.
- [7] Votava M, Doležal T, Kozák J, Vondráčková D. Adjuvantní léčiva v terapii bolesti. In: Rokyta R, Kršiak M, Kozák J. Bolest. Praha; TIGIS 2006: 147–155.
- [8] Pastucha D. Jak ošetřit bolest nohou po sportu? Interní Med 2009; 11: 188–189.
- [9] Martínková J, Chládek J, Mičuda S, Chládková J. Farmakologie pro studenty zdravotnických oborů. Praha; Grada 2007, 145 s.
- [10] Moore A, Edwards J, Barden J, et al. Bandolier's Little book of pain. 1. vydání, Oxford; Oxford University Press 2003, 453 s.
- [11] Chang SH, Maney KM, Mehta V, Langford RM. Pain assessment and management in medical wards: an area of unmet need. Postgrad Med J 2010; 86: 279–284.