Dlouhodobý účinek okamžité versus opožděné léčby fingolimodem u mladých dospělých pacientů s RR‑RS
Souhrn:
Halúsková S, Vališ M. Dlouhodobý účinek okamžité versus opožděné léčby fingolimodem u mladých dospělých pacientů s RR‑RS. Remedia 2020; 30: 44–49.
Roztroušená skleróza (RS) je chronické zánětlivé autoimunitní onemocnění centrálního nervového systému postihující zejména mladé dospělé. Představuje nejčastější potenciálně invalidizující neurologické onemocnění vedoucí ke snížení kvality života pacientů. Léčba relabující‑remitující RS (RR‑RS) zaznamenala v posledních letech výrazný pokrok. O významu včasného zahájení terapie RS pro další prognózu nemocného vypovídají dlouhodobá data. S příchodem nových vysoce účinných léků přibývá diskusí o tom, jakou zvolit optimální léčebnou strategii. Složitá otázka preference bezpečnější eskalační či razantnější indukční léčby je v současnosti stále více probíraným tématem. Z výsledků provedených post hoc analýz a retrospektivních studií vyplývá, že u mladých dospělých je míra zánětu, aktivita na magnetické rezonanci (MR) i frekvence relapsů vyšší v porovnání se starší populací. Fingolimod byl k léčbě RR‑RS schválen jako první perorální přípravek působící v roli antagonisty sfingosin‑1‑fosfátového receptoru. Fingolimod prokázal pozitivní vliv na stabilizaci onemocnění, a to zejména u mladších věkových skupin s RR‑RS. V práci se zaměřujeme na dlouhodobý efekt fingolimodu na hodnocené klinické i MR parametry u mladých dospělých pacientů ve věku do 30 let sledovaných po dobu 96 měsíců.
Summary:
Haluskova S, Valis M. Long‑term effect of immediate versus delayed fingolimod treatment in young adult patients with RRMS. Remedia 2020; 30: 44–49.
Multiple sclerosis (MS) is a chronic inflammatory autoimmune disease of the central nervous system affecting most commonly young adults that causes significant disability resulting in poor health‑related quality of life. There has been tremendous progress in the treatment of relapsing‑remitting MS (RRMS) over recent years. The concept of early treatment to achieve better outcomes in MS has clearly emerged, fully supported by the positive results of several randomized clinical trials, but how intensively to treat at onset is not known. Whether to use moderately effective and safe medications with escalation as needed, or to use higher efficacy medications from the outset, is a key question in clinical practice. Evidence from post‑hoc analyses and retrospective studies indicates that patients with early‑onset MS tend to relapse more frequently with higher magnetic resonance imaging (MRI) activity compared with their older adult counterparts. Fingolimod is a sphingosine‑1‑phosphate receptor modulator and was the first oral therapy to be approved for RRMS. Fingolimod has demonstrated clinical and MRI benefits in young adults with RRMS. This paper focuses on long‑term effects of fingolimod on clinical and MRI outcomes in young adults aged ≤ 30 years followed up for up to 8 years.
Key words: multiple sclerosis, young adults, treatment, fingolimod, relapse, disability
Úvod
Roztroušená skleróza (RS) je chronické zánětlivé demyelinizační a neurodegenerativní onemocnění centrálního nervového systému (CNS), které postihuje především mladé dospělé ve věku od 20 do 40 let a daleko častěji se vyskytuje u žen. U lidí v produktivním věku RS představuje nejčastější potenciálně invalidizující neurologické onemocnění, jehož incidence stejně jako u jiných autoimunitních chorob neustále narůstá [1,2]. Ke zmíněnému pozorování jistě přispívají lepší přístup k neurologické péči, citlivější diagnostická kritéria a delší očekávaná doba dožití, ovšem panuje i shoda v tom, že se zároveň incidence RS skutečně zvýšila [3]. Moderní léčba RS je dlouhodobý proces vyžadující komplexní multioborový přístup a v zásadě platí, že by měl být zahájen ihned po stanovení definitivní diagnózy. Výsledky klinických studií potvrzují, že včasnou diagnostikou a zahájením adekvátní terapie v iniciální fázi nemoci lze významně zpomalit její progresi, a tím oddálit invaliditu pacientů. V současnosti jsme svědky intenzivního výzkumu a výrazné akcelerace vývoje nových léčiv používaných v terapii RS a jejich postupného zavádění do klinické praxe. S příchodem další generace vysoce efektivních imunomodulačních léků byly definovány i ambicióznější terapeutické cíle, a ačkoliv nesporné pokroky jak ve výzkumu, tak v terapii podstatně zlepšují vyhlídky nemocných s RS na zkvalitnění života a příznivější průběh nemoci, kauzální léčba stále neexistuje.
Fingolimod byl ke klinickému použití v zemích Evropské unie schválen v březnu 2011 a stal se prvním perorálním přípravkem ze skupiny léků modifikujících průběh onemocnění (disease modifying drugs, DMDs) pro léčbu relabující remitující formy RS (RR RS) a zároveň prvním lékem s potvrzeným příznivým vlivem na zpomalení procesu atrofie mozku [4‒6]. Je podáván dospělým pacientům v dávce 0,5 mg ve formě tablety 1× denně a pediatrickým pacientům s tělesnou hmotností do 40 kg v dávce 0,25 mg denně, nad 40 kg v dávce 0,5 mg denně. Z hlediska mechanismu účinku představuje kontinuální imunosupresivum. Funguje jako modulátor sfingosin 1 fosfátového receptoru na lymfocytech, kdy vazbou na uvedený receptor brání uvolňování autoagresivních lymfocytů do cirkulace a jejich následné migraci do CNS. Působení fingolimodu je plně reverzibilní, po přerušení terapie dochází k obnovení exprese cílového receptoru a tím k recirkulaci lymfocytů [4,5].
V rámci současné palety léčiv dostupných v České republice řadíme fingolimod do 1,5. linie léčby dospělých pacientů s RR RS, tj. je možné jej použít u nemocných se známkami nepříznivé prognózy nemoci, u kterých došlo navzdory léčbě nejméně jedním lékem 1. linie k rozvoji alespoň jednoho středně těžkého nebo těžkého relapsu. Lék lze však v případě vysoké aktivity choroby (dva těžké relapsy za rok a současně jedna a více gadolinium enhancujících lézí na magnetické rezonanci [MR] mozku či významný nárůst počtu T2 hypersignálních ložisek na kontrolní MR ne starší než 3–6 měsíců) indikovat i v 1. léčebné linii. Fingolimod je navíc od listopadu 2018 schválen Evropskou lékovou agenturou (EMA) vedle prvoliniových přípravků interferonu beta a glatiramer acetátu také v pediatrické indikaci jako eskalační léčba dětské RR RS u jedinců již ve věku od deseti let, přičemž indikace a kontraindikace se shodují s dospělou populací, a poskytuje nám výrazné rozšíření dosavadních možností terapie dětských pacientů s RS [7].
Fingolimod v klinických studiích
První klinické studie byly zahájeny
před více než 15 lety (graf 1).
Do studie fáze II byli zařazeni pacienti léčení
fingolimodem v dávce 5 mg a 1,25 mg, tyto dávky však
byly ve fázi extenze postupně sníženy na 0,5 mg
denně. Fingolimod byl registrován na základě výsledků tří
rozsáhlých randomizovaných paralelně uspořádaných studií fáze
III – FREEDOMS (FTY720 Research Evaluating Effects of Daily
Oral Therapy in Multiple Sclerosis; n = 1 272), FREEDOMS
II (n = 1 083) a TRANSFORMS (Trial Assessing
Injectable Interferon versus FTY720 Oral in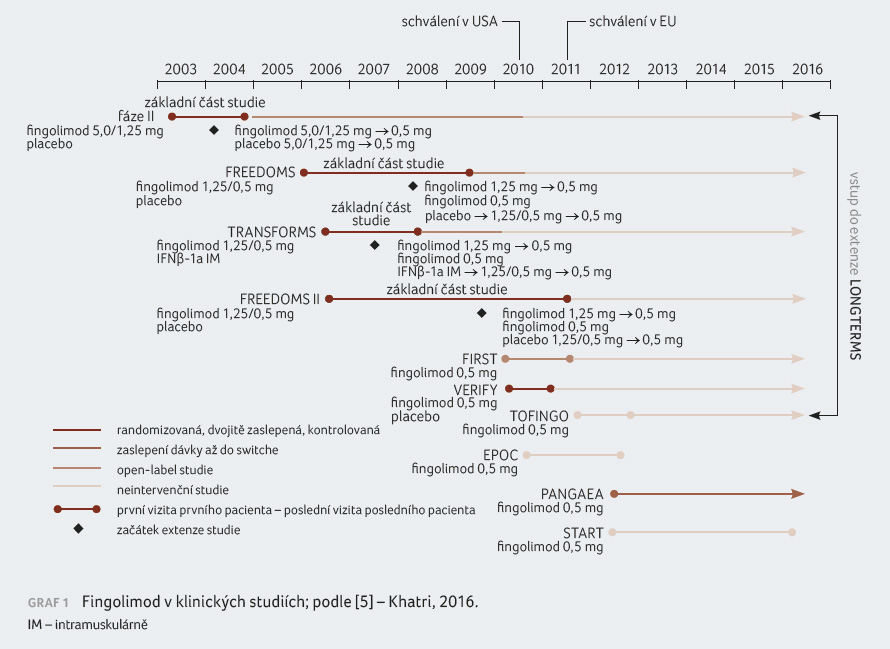 Relapsing Remitting
Multiple Sclerosis; n = 1 292), ve kterých byl
porovnáván oproti placebu, resp. interferonu beta 1a
(IFNβ 1a). Ve všech zmiňovaných
studiích byl fingolimod účinnější než komparátory, a to
jak s ohledem na ovlivnění roční četnosti relapsů či
rizika progrese neurologického postižení (ve studii FREEDOMS
II nebyla pozorována statistická významnost vlivu na zhoršení
disability), tak z hlediska působení na aktivitu
onemocnění hodnocenou na MR [5,8‒10]. Studie fáze II a III
jsou ale časově omezené a neodpovídají reálné klinické
praxi, kdy nemocní užívají léky zpravidla po mnoho let.
Proto představují velmi cenná data dlouhodobé extenzní fáze
klinických studií, jež poskytují lepší představu o klinické
účinnosti léků, jejich bezpečnostních aspektech a kvalitě
života pacientů s RS. LONGTERMS (n = 4 086) bylo
otevřené jednoramenné prodloužené sledování pacientů, kteří
se dříve účastnili fingolimodových studií fáze II/III/IIIb,
hodnotící dlouhodobou účinnost, snášenlivost a bezpečnost
přípravku. Terapie fingolimodem po dobu až 14 let byla
spojena s trvale nízkou aktivitou onemocnění měřenou
klinickými i MR parametry a dlouhodobá data rovněž
potvrdila dobrý bezpečnostní profil léku [5,11].
Relapsing Remitting
Multiple Sclerosis; n = 1 292), ve kterých byl
porovnáván oproti placebu, resp. interferonu beta 1a
(IFNβ 1a). Ve všech zmiňovaných
studiích byl fingolimod účinnější než komparátory, a to
jak s ohledem na ovlivnění roční četnosti relapsů či
rizika progrese neurologického postižení (ve studii FREEDOMS
II nebyla pozorována statistická významnost vlivu na zhoršení
disability), tak z hlediska působení na aktivitu
onemocnění hodnocenou na MR [5,8‒10]. Studie fáze II a III
jsou ale časově omezené a neodpovídají reálné klinické
praxi, kdy nemocní užívají léky zpravidla po mnoho let.
Proto představují velmi cenná data dlouhodobé extenzní fáze
klinických studií, jež poskytují lepší představu o klinické
účinnosti léků, jejich bezpečnostních aspektech a kvalitě
života pacientů s RS. LONGTERMS (n = 4 086) bylo
otevřené jednoramenné prodloužené sledování pacientů, kteří
se dříve účastnili fingolimodových studií fáze II/III/IIIb,
hodnotící dlouhodobou účinnost, snášenlivost a bezpečnost
přípravku. Terapie fingolimodem po dobu až 14 let byla
spojena s trvale nízkou aktivitou onemocnění měřenou
klinickými i MR parametry a dlouhodobá data rovněž
potvrdila dobrý bezpečnostní profil léku [5,11].
V post hoc analýze klíčových klinických studií FREEDOMS, FREEDOMS II a TRANSFORMS fingolimod signifikantně redukoval roční míru relapsů ve skupinách mladých dospělých pacientů ve věku ≤ 20 a ≤ 30 let s nejnápadnější redukcí u nejmladších jedinců (vs. placebo: 79 % ve studii FREEDOMS, p < 0,001; 59 % ve studii FREEDOMS II, p = 0,007; a vs. IFNβ 1a: 77 % ve studii TRANSFORMS, p < 0,001). Fingolimod rovněž signifikantně snížil počet nových nebo zvětšujících se ložisek na T2 vážených obrazech MR u nemocných ve všech věkových skupinách, kromě kategorie nejmladších pacientů (≤ 20 let) ve studii TRANSFORMS, kde byl výskyt nových či zvětšujících se T2 lézí obdobný u fingolimodu i IFNβ 1a. Pravděpodobnost dosažení a udržení stavu bez klinické a radiologické aktivity onemocnění (No Evidence of Disease Activity 3, NEDA 3) po dobu dvou let ve studiích FREEDOMS a jednoho roku ve studii TRANSFORMS byla největší u nejmladších pacientů léčených fingolimodem ve srovnání s nemocnými léčenými placebem nebo IFNβ 1a [2].
Jakkoliv jsme v poslední dekádě svědky nebývalého rozmachu farmakoterapeutických možností pro RS, důkazy o účinnosti inovativních přístupů se týkají dominantně dospělé populace. Jedinou globální dosud kvalitně provedenou a ukončenou lékovou studií u dětí s RR RS je klinické hodnocení PARADIGMS (n = 215), které probíhalo v letech 2013–2017 a v němž byli pediatričtí pacienti randomizováni k podávání fingolimodu v dávce 0,25 mg (u dětí s tělesnou hmotností ≤ 40 kg) či 0,5 mg denně, nebo k podávání IFNβ 1a v dávce 30 µg intramuskulárně jednou týdně. I v tomto případě výsledky ukázaly superioritu fingolimodu v signifikantní redukci roční míry výskytu potvrzených relapsů, oddálení prvního relapsu, ve statisticky významném snížení aktivity onemocnění na MR a také významném zpomalení ztráty objemu mozkové tkáně [12].
Klinické charakteristiky RS u dětí,
dospívajících a mladých dospělých
Pro predikci vývoje RS je používána řada proměnných, z nichž jednou z důležitých zůstává věk pacienta v době nástupu choroby. Kvantitativní a funkční změny vrozené i adaptivní imunity spojené s věkem označované jako imunosenescence a takto podmíněný mírně vyjádřený prozánětlivý stav neboli „inflamm aging“ mohou mít vliv nejen na průběh RS u konkrétní osoby, ale i na odpověď na léčbu a riziko nežádoucích příhod [3,13]. Z literatury je známo, že schopnost zotavit se z projevů iniciálního relapsu klesá se stoupajícím věkem, čímž dochází k akumulaci invalidizace v průběhu dalších let. Z výsledků provedených post hoc analýz a retrospektivních studií vyplývá, že u dětí a mladých dospělých je míra zánětu, aktivita na MR i frekvence relapsů vyšší (přibližně dvoj až trojnásobně) a úvodní ataky bývají závažnější s výraznějším stupněm neurologického deficitu v porovnání se starší populací. Zásadní však je, že schopnost regenerace CNS po akutním inzultu je díky neuroplasticitě mozku a dobrým kompenzačním schopnostem včetně remyelinizace u mladších věkových skupin lepší a po zaléčení je u nich úprava, nezřídka kompletní, pozorována častěji [1,2,12,14]. Některé literární zprávy naznačují, že osoby se začátkem RS v dětském věku a v adolescenci jsou do budoucna ohroženy kognitivním deficitem více než v případě rozvoje nemoci v dospělosti [14‒16]. Míra atrofie mozkové kůry se jeví jako velmi silný korelát kognitivního postižení. Časná detekce sníženého objemu mozkové tkáně u mladších ročníků pravděpodobně souvisí s preexistujícími T2 lézemi a s častějším výskytem akutních postkontrastně se sytících ložisek na MR [1,17]. Určitým specifikem, podpořeným důkazy z populačních studií, je také skutečnost, že u jedinců, kteří onemocní touto chorobou během dětství a mládí, je doba do nástupu významné disability mnohem delší, ireverzibilní deficit ale vzniká v nižším věku a přechod do sekundárně progresivní formy nastává zhruba o deset let dříve ve srovnání s pacienty se začátkem RS v dospělosti [18].
Současný přístup k léčbě RS
Protože víme, že axonální ztrátu lze prokázat již v preklinickém stadiu nemoci a pokles počtu neuronů pod určitou hranici vede k ireverzibilní ztrátě funkce, je podle odborníků nezbytné terapeuticky zasáhnout už v počáteční fázi onemocnění tak, aby došlo ke zpomalení krátkodobé i dlouhodobé progrese nemoci a k zabránění invalidizace [19,20]. Je nezpochybnitelným faktem, že pacienti, jejichž léčba je zahájena později, nemají stejný prospěch z léčby jako nemocní se zahájením terapie v iniciálním stadiu choroby [21,22]. V současné době neexistuje univerzální léčebné paradigma a nejsou schváleny jednoznačné terapeutické algoritmy odsouhlasené odbornými společnostmi [23]. V rámci volby optimální strategie léčby se s přihlédnutím k poznatkům o přirozeném průběhu nemoci a dostupnosti poměrně širokého léčebného spektra dostáváme do dvou názorových rovin. První možností je eskalační terapie (v současnosti nadále dominantní přístup), jejímž principem je zahájení léčby bezpečnějšími imunomodulačními léky, avšak s nižší účinností a s následnou ideálně časnou eskalací do jedenapůlté, resp. druhé linie při jejich nedostatečném efektu. Suboptimální kontrolu onemocnění lze rozpoznat pouze precizním monitorováním klinické a subklinické aktivity RS. Druhou variantu představuje indukční terapie (v dnešní době obhajitelná u pacientů s aktivní agresivní formou nemoci), která spočívá v zahájení podávání vysoce účinného léku již v začátku onemocnění, i s vědomím případného rizika výskytu závažnějších nežádoucích účinků, a jakmile je pacient stabilizován, lze zvážit deeskalaci k bezpečnějšímu přípravku [21‒25].
Jak ukázala metaanalýza klinických studií zahrnujících více než 28 000 nemocných s RS, účinno
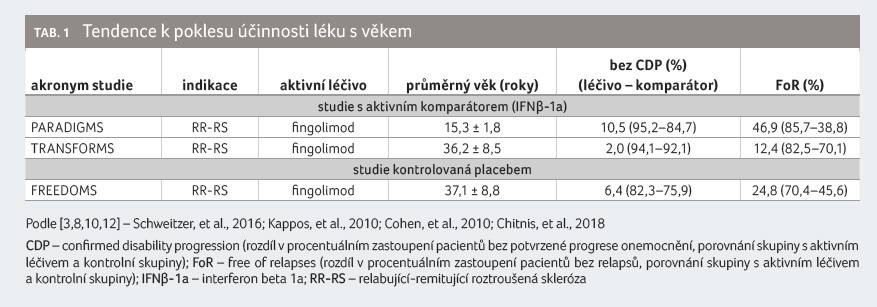
st DMDs z hlediska ovlivnění progrese neurologického deficitu významně klesá s věkem, přičemž ztrátu efektivity této léčby lze očekávat ve věku kolem 53 let. Kromě toho vysoce účinná léčiva ztrácejí svou prokázanou vyšší účinnost oproti méně účinným přípravkům dříve – u pacientů ve věku od 40,5 roku výše [3,26] (tab. 1). Údaje z poslední doby naznačují, že časná terapeutická intervence efektivnějšími DMDs může zpomalit progresi disability a zlepšit dlouhodobou prognózu zejména u mladších pacientů s jasně vyjádřenou klinickou i radiologickou aktivitou onemocnění [25].
Okamžitá
vs. opožděná léčba fingolimodem u mladých dospělých
pacientů s RR RS
Otázkou dlouhodobého efektu okamžité versus opožděné léčby fingolimodem na sledované klinické i MR parametry u mladých dospělých pacientů s RR RS se zabývala post hoc analýza poolovaných dat ze dvou placebem kontrolovaných klinických studií fáze III (FREEDOMS a FREEDOMS II). Jednalo se o osmiletý follow up pacientů ve věku ≤ 30 let, kteří se účastnili výše zmiňovaných studií a byli léčeni fingolimodem ve schválené dávce 0,5 mg denně od počátku klinického hodnocení – „okamžitá léčba“ ‒ nebo byli v úvodu zařazeni do placebové větve a po 24 měsících převedeni na fingolimod 0,5 mg denně – „opožděná léčba“ (pacienti iniciálně randomizovaní k podávání fingolimodu v dávce 1,25 mg nebyli do analýzy zařazeni). Skupiny okamžitě a opožděně léčených pacientů byly porovnávány jak mezi sebou, tak s úplnou analyzovanou populací (též rozdělenou na část nemocných s okamžitou a opožděnou léčbou fingolimodem), která zahrnovala všechny vybrané pacienty sdružených studií FREEDOMS [1].
Klíčové klinické a MR parametry byly hodnoceny po 24, 48 a 96 měsících léčby. Mezi základní klinické ukazatele patřily roční počet relapsů, šestiměsíční potvrzené zmírnění disability (Confirmed Disability Improvement, 6m CDI; snížení skóre EDSS [Expanded Disability Status Scale] o ≥ 1,0 při základním EDSS ≤ 5,5, nebo o ≥ 0,5 při vstupním EDSS ≥ 6,0), 6m CDI plus (6m CDI+; 6m CDI rozšířené o potvrzené ≥ 20% zlepšení v testu jemné motoriky horních končetin [9 Hole Peg Test] či v testu chůze [Timed 25 Foot Walk Test]), šestiměsíční potvrzená progrese disability (Confirmed Disability Progression, 6m CDP; zhoršení EDSS o ≥ 1,5 při iniciálním EDSS 0 bodů nebo o ≥ 1,0 v případě, že se základní EDSS pohybovalo v rozmezí 1,0‒5,0, nebo o ≥ 0,5 při vstupním EDSS > 5) a dosažení EDSS ≥ 4,0. Vliv fingolimodu na hodnocené MR parametry byl posuzován pomocí detekce nových nebo zvětšujících se T2 lézí, podílu nemocných bez nových či zvětšujících se ložisek na T2 vážených obrazech a roční procentuální změny objemu parenchymové frakce mozku [1].
Celkově bylo do studie zařazeno
1 556 pacientů, z nichž 20 % (310/1 556) představovali
pacienti ve věku ≤ 30 let. Ze skupiny mladých
dospělých pacientů dostalo 52,6 % (163/310) nemocných léčbu
okamžitě a 47,4 % (147/310) opožděně. Přibližně dvě
třetiny mladých dospělých tvořily ženy s průměrným
věkem 25 let. Mladí dospělí pacienti byli charakterizováni
kratším trváním nemoci, nižšími vstupními hodnotami EDSS
a větším počtem gadolinium enhancujících T1 lézí na MR
ve srovnání s úplným analyzovaným souborem. Aktivita
onemocnění vyjádřená počtem relapsů v předchozích dvou
letech byla podobná napříč všemi skupinami, což bylo
do jisté míry ovlivněno zařazovacími kritérii
do základních fází studií (minimálně jeden relaps
v posledním roce nebo dva relapsy v uplynulých dvou
letech), tabulka 2
[1].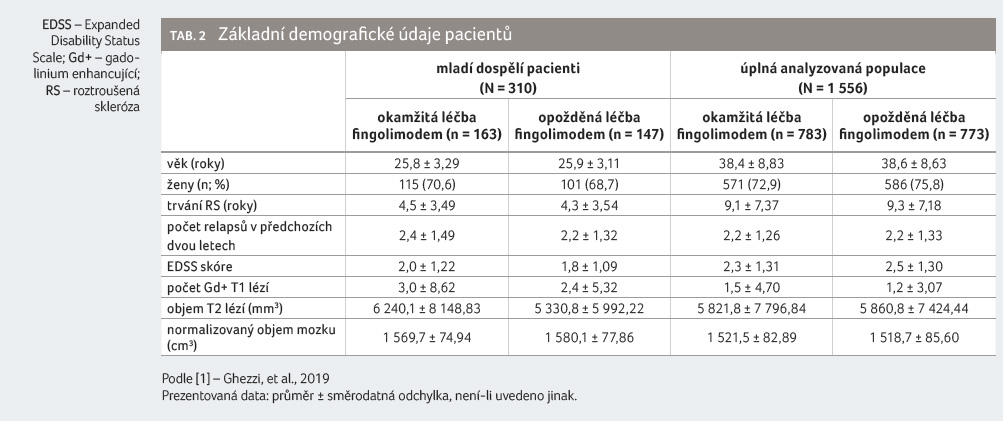
Cílové klinické parametry –
výsledky
Za období 96 měsíců dosáhlo 6m CDI a 6m CDI+ větší množství mladých dospělých pacientů s okamžitou léčbou fingolimodem než mladí nemocní převedení na fingolimod až po 24 měsících (6m CDI: 58,2 % vs. 30,5 %; 6m CDI+: 70,6 % vs. 42,3 %). Pravděpodobnost dosažení obou hodnocených parametrů ve skupinách s okamžitou léčbou oproti opožděné terapii byla vyšší u mladých dospělých pacientů (6m CDI: hazard ratio [HR] 2,00; 95% confidence interval [CI] 1,11–3,61; p = 0,0206; 6m CDI+: HR 1,92; 95% CI 1,14–3,23; p = 0,0149) ve srovnání s úplnou analyzovanou populací (6m CDI: HR 1,14; 95% CI 0,89–1,45; p = 0,3004; 6m CDI+: HR 1,06; 95% CI 0,86–1,31; p = 0,6000). Riziko 6m CDP bylo o 54 % nižší u okamžitě léčených mladých dospělých oproti mladým pacientům s opožděnou léčbou. Po 96 měsících byl efekt okamžité léčby fingolimodem na snížení rizika 6m CDP v komparaci s opožděným podáváním léku výraznější u mladých dospělých pacientů (HR 0,46; 95% CI 0,27–0,80; p = 0,0058) oproti hodnocené populaci (HR 0,76; 95% CI 0,62–0,93; p = 0,0078). Ve srovnání s oddálenou terapií fingolimodem byl podíl mladých dospělých pacientů, kteří dosáhli EDSS skóre ≥ 4,0, signifikantně nižší v kategorii okamžitě léčených. Bezprostřední zahájení terapie ve srovnání s opožděnou léčbou vedlo ke snížení rizika dosažení EDSS ≥ 4,0 během 96 měsíců u všech pacientů zařazených do studie, s markantnějším výsledkem ve skupině mladých dospělých pacientů (HR 0,48; 95% CI 0,29–0,80; p = 0,0044) než u celého posuzovaného souboru (HR 0,68; 95% CI 0,55–0,83; p = 0,0001). Pacienti s okamžitou léčbou fingolimodem měli konstantně nižší roční počet potvrzených relapsů než nemocní s pozdrženou léčbou jak ve skupině mladých dospělých, tak v úplném analyzovaném souboru. Na konci 96. měsíce činila roční míra relapsů u pacientů od počátku léčených fingolimodem 0,16 (mladí dospělí) a 0,15 (celý soubor). Rozdíl v procentuální redukci počtu relapsů mezi skupinami s okamžitou a oddálenou léčbou byl zřetelnější u pacientů ve věku do 30 let v komparaci s výchozím souborem [1].
Cílové MR parametry – výsledky
Výskyt nových nebo zvětšujících se T2 lézí v období od iniciace do 24. měsíce hodnocení (základní fáze studií FREEDOMS) byl signifikantně nižší při léčbě fingolimodem ve srovnání s placebem v úplné analyzované populaci i mladých dospělých pacientů, s relativní redukcí 74 % (p < 0,0001) a 77 % (p < 0,0001) v daném pořadí. Během celé sledované periody měli okamžitě léčení mladí dospělí pacienti signifikantně nižší kumulativní počet nových či zvětšujících se T2 lézí v porovnání se skupinou nemocných s oddáleným terapeutickým zásahem. Pacienti, kterým byl fingolimod podáván okamžitě, měli větší šanci zůstat bez nových a rozšiřujících se T2 lézí než jedinci s opožděnou léčbou. Téměř 30 % bezprostředně léčených mladých nemocných zůstalo se stabilním MR nálezem během 96 měsíců. Ztráta objemu mozkové tkáně byla obdobná ve skupině mladých dospělých pacientů i v celém souboru nemocných. Rozdíl v účinku léku na zpomalení procesu atrofie mozku mezi skupinami okamžitě a opožděně léčených pacientů byl postupně méně výrazný, ale nadále patrný i v závěrečné fázi hodnocení [1].
Shrnutí
Fingolimod splňuje moderní předpoklady léčby RS dle konceptu NEDA a patří již mezi etablované DMDs s přetrvávající vysokou účinností. Recentní data potvrzují pozitivní vliv fingolimodu na stabilizaci onemocnění, a to zejména u mladších věkových skupin s RR RS ve srovnání se starší populací [1,2]. U mladých dospělých pacientů vedlo zároveň okamžité zahájení terapie fingolimodem k signifikantně lepším dlouhodobým klinickým výsledkům v komparaci s oddálenou léčbou [1]. Časná terapeutická intervence představuje v současné době jediný správný postup, jak zabránit nevratnému poškození CNS a oddálit invaliditu, která negativně ovlivňuje kvalitu života pacientů a má i značný socioekonomický dopad. Názor, že u pacientů s RR RS by měla být včasně zahájena vysoce účinná léčba, podporují podle odborníků důkazy z klinických studií, ale i ze samotné praxe – tato strategie je nicméně v reálné klinické praxi nadále minoritní. Složitá otázka preference eskalační, či indukční léčby je v současnosti stále více diskutovaným tématem. Roztroušená skleróza je však nesmírně heterogenní onemocnění s variabilním průběhem a dosud bohužel není k dispozici jasný ukazatel či parametr, který by přesně definoval pokročilost choroby a predikoval úspěšnost zvolené léčby. Proto se v posledních letech prosazuje snaha najít takové biologické markery, které nám v budoucnu umožní personifikovat léčbu a spolehlivě diferencovat skupinu vysoce rizikových nemocných, u kterých by bylo nutné zahájit razantní terapii co nejdříve.
Práce byla částečně podpořena
granty FN HK 00179906 a výzkumným projektem PROGRES
Q40 + projektem PERSONMED (Centrum rozvoje personalizované
medicíny u věkem podmíněných onemocnění),
CZ.02.1.01/0.0/0.0/17_048/0007441, spolufinancován z prostředků
ERDF a státního rozpočtu ČR
.
Seznam použité literatury
- [1] Ghezzi A, Chitnis T, K‑Laflamme A, et al. Long‑Term Effect of Immediate Versus Delayed Fingolimod Treatment in Young Adult Patients with Relapsing‑Remitting Multiple Sclerosis: Pooled Analysis from the FREEDOMS/FREEDOMS II Trials. Neurol Ther 2019; 8: 461–475.
- [2] Gärtner J, Chitnis T, Ghezzi A, et al. Relapse Rate and MRI Activity in Young Adult Patients With Multiple Sclerosis: A Post Hoc Analysis of Phase 3 Fingolimod Trials. Mult Scler J Exp Transl Clin 2018; 4: 2055217318778610.
- [3] Schweitzer F, Laurent S, Fink GR, et al. Age and the risks of high‑efficacy disease‑modifying drugs in multiple sclerosis. Curr Opin Neurol 2019; 32: 305–312.
- [4] Ayzenberg I, Hoepner R, Kleiter I. Fingolimod for multiple sclerosis and emerging indications: appropriate patient selection, safety precautions, and special considerations. Ther Clin Risk Manag 2016; 12: 261–272.
- [5] Khatri BO. Fingolimod in the treatment of relapsing‑remitting multiple sclerosis: long‑term experience and an update on the clinical evidence. Ther Adv Neurol Disord 2016; 9: 130–147.
- [6] De Stefano N, Silva DG, Barnett MH. Effect of Fingolimod on Brain Volume Loss in Patients with Multiple Sclerosis. CNS Drugs 2017; 31: 289–305.
- [7] Feng J, Rensel M. Review Of The Safety, Efficacy And Tolerability Of Fingolimod In The Treatment Of Pediatric Patients With Relapsing‑Remitting Forms Of Multiple Sclerosis (RRMS). Pediatric Health Med Ther 2019; 10: 141–146.
- [8] Kappos L, Radue EW, OʼConnor P, et al. FREEDOMS Study Group. A placebo‑controlled trial of oral fingolimod in relapsing multiple sclerosis. N Engl J Med 2010; 362: 387–401.
- [9] Calabresi PA, Radue EW, Goodin D, et al. Safety and efficacy of fingolimod in patients with relapsing‑remitting multiple sclerosis (FREEDOMS II): a double‑blind, randomised, placebo‑controlled, phase 3 trial. Lancet Neurol 2014; 13: 545–556.
- [10] Cohen JA, Barkhof F, Comi G, et al. TRANSFORMS Study Group. Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis. N Engl J Med 2010; 362: 402–415.
- [11] Cohen JA, Tenenbaum N, Bhatt A, et al. Extended treatment with fingolimod for relapsing multiple sclerosis: the 14‑year LONGTERMS study results. Ther Adv Neurol Disord 2019; 12: 1756286419878324.
- [12] Chitnis T, Arnold DL, Banwell B, et al. Trial of Fingolimod versus Interferon Beta‑1a in Pediatric Multiple Sclerosis. N Engl J Med 2018; 379: 1017–1027.
- [13] Fulop T, Larbi A, Dupuis G, et al. Immunosenescence and Inflamm‑Aging As Two Sides of the Same Coin: Friends or Foes? Front Immunol 2018; 8: 1960.
- [14] Giorgio A, Zhang J, Stromillo ML, et al. Pronounced Structural and Functional Damage in Early Adult Pediatric‑Onset Multiple Sclerosis with No or Minimal Clinical Disability. Front Neurol 2017; 8: 608.
- [15] Ruano L, Branco M, Portaccio E, et al. Patients with paediatric‑onset multiple sclerosis are at higher risk of cognitive impairment in adulthood: An Italian collaborative study. Mult Scler 2018; 24: 1234–1242.
- [16] Baruch NF, OʼDonnell EH, Glanz BI, et al. Cognitive and patient‑reported outcomes in adults with pediatric‑onset multiple sclerosis. Mult Scler 2016; 22: 354–361.
- [17] Carotenuto A, Moccia M, Costabile T, et al. Associations between cognitive impairment at onset and disability accrual in young people with multiple sclerosis. Sci Rep 2019; 9: 18074.
- [18] Scalfari A, Lederer C, Daumer M, et al. The relationship of age with the clinical phenotype in multiple sclerosis. Mult Scler 2016; 22: 1750–1758.
- [19] Romeo MAL, Martinelli V, Dalla Costa G, et al. Assessing the role of innovative therapeutic paradigm on multiple sclerosis treatment response. Acta Neurol Scand 2018; 138: 447–453.
- [20] Fernández Ó. Is there a change of paradigm towards more effective treatment early in the course of apparent high‑risk MS? Mult Scler Relat Disord 2017; 17: 75–83.
- [21] Ontaneda D, Tallantyre E, Kalincik T, et al. Early highly effective versus escalation treatment approaches in relapsing multiple sclerosis. Lancet Neurol 2019; 18: 973–980.
- [22] Merkel B, Butzkueven H, Traboulsee AL, et al. Timing of high‑efficacy therapy in relapsing‑remitting multiple sclerosis: A systematic review. Autoimmun Rev 2017; 16: 658–665.
- [23] Cree BAC, Mares J, Hartung HP. Current therapeutic landscape in multiple sclerosis: an evolving treatment paradigm. Curr Opin Neurol 2019; 32: 365–377.
- [24] Le Page E, Edan G. Induction or escalation therapy for patients with multiple sclerosis? Rev Neurol (Paris) 2018; 174: 449–457.
- [25] Harding K, Williams O, Millis M, et al. Clinical Outcomes of Escalation vs Early Intensive Disease‑Modifying Therapy in Patients With Multiple Sclerosis. JAMA Neurol 2019; 76: 536–541.
- [26] Weideman AM, Tapia‑Maltos MA, Johnson K, et al. Meta‑analysis of the Age‑Dependent Efficacy of Multiple Sclerosis Treatments. Front Neurol 2017; 8: 577.